Морфологические особенности аутоиммунного гастрита
Автор: Гостеева Е.А., Пачуашвили Н.В., Нагорная Д.П., Юмашева В.А., Ананьева В.С., Проценко Д.Д., Тертычный А.С.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 4 т.15, 2025 года.
Бесплатный доступ
Цель: уточнение и анализ характерных морфологических критериев аутоиммунного гастрита (АИГ). Объект и методы. В исследование было включено 37 пациентов с диагнозом АИГ, проходивших лечение в клиниках ПМГМУ им. И.М. Сеченова в 2022 году. Во время проведения эндоскопического исследования выполнен забор биоптатов слизистой оболочки желудка по Сиднейскому протоколу. С целью оценки выраженности атрофии использована система OLGA. Дополнительно проведено иммуногистохимическое исследование с использованием антител к хромогранину А (5H7, RTU, LeicaBiosystems, Германия). Результаты. Средний возраст исследуемых пациентов составил 59±12,78 года. 97% пациентов (36 из 37) были женского пола, 3% (1 из 37) – мужского. В биоптатах антрального отдела желудка у 89,2% пациентов (33 случая) была выявлена 1 степень гастрита, в то время как в теле желудка в 78,4% образцов (29 случаев) отмечалась 2 степень гастрита (хи-квадрат 9.21, р=0,01). В теле желудка было отмечено преобладание метапластического типа атрофии слизистой оболочки желудка: полная кишечная метаплазия была отмечена в 59% биоптатов (22 случаев), неполная – в 2,7% (1 случай). Установлены различия по степени и стадии АИГ в зависимости от локализации гастрита – поражение 2 и более степени/стадии в теле желудка отмечаются достоверно чаще (хи-квадрат 9.21, р=0,01). Дополнительными гистологическими находками явились: наличие гиперпластических полипов тела желудка у 3 пациентов (8% случаев), а также высокодифференцированная нейроэндокринная опухоль тела желудка (G1) у 1 пациента (2,7% случаев). Заключение. При гистологическом исследовании в биоптатах фундального отдела желудка, как правило, обнаруживаются признаки атрофии желез, распространённая псевдопилорическая и/или кишечная метаплазия, а также признаки гиперплазии энтерохромафинподобных клеток, в то же время в биоптатах антрального отдела желудка могут отмечаться реактивные изменения слизистой оболочки.
Аутоиммунный гастрит [D005756], атрофия [D001284], кишечная метаплазия [D008679], морфологическое исследование [нет MeSH], иммуногистохимия [D007150], слизистая оболочка желудка [D005753], биопсия [D001706], эндоскопия [D004724], хромогранин А [D053379], энтерохромафинподобные клетки [D019858], псевдопилорическая метаплазия [нет MeSH], гиперплазия [D006965], нейроэндокринная опухоль [D018358]
Короткий адрес: https://sciup.org/143185004
IDR: 143185004 | УДК: 616.33-002.44-097:616-091 | DOI: 10.20340/vmi-rvz.2025.4.MORPH.4
Текст научной статьи Морфологические особенности аутоиммунного гастрита
В 15–20% случаев АИГ может приводить к развитию пернициозной анемии, также известной как болезнь Аддисона – Бирмера, которая характеризуется недостатком витамина B 12 . Гипергастрине-мия, вызванная разрушением париетальных клеток, гипохлоргидрия или ахлоргидрия, увеличивает риск развития эпителиальных и нейроэндокринных опухолей, в связи с чем необходима своевременная диагностика для определения персонализированной тактики ведения пациентов с АИГ [3, 4].
Целью данного исследования является уточнение и анализ характерных морфологических критериев АИГ.
Объект и методы
Обработка биопсийного материала осуществлялась по общепринятой методике. Биопсийный материал фиксировали в 10% нейтральном формалине, обрабатывали в аппарате гистологической проводки Leica ASP 30, затем материал был залит в парафин на станции Leica EG 1150. Далее гистологические срезы толщиной 3 мкм были окрашены гематоксилином и эозином в автоматической станции Leica ST 5010. Также было проведено иммуногистохимическое исследование с использованием антител к хромогранину А (5H7, RTU, LeicaBiosys-tems, Германия). Впоследствии препараты были оцифрованы с помощью сканера микропрепаратов Aperio AT2 (LeicaBiosystems, Германия). Для просмотра и анализа цифровых изображений была использована программа QuPath v.0.4.3 (University of Edinburgh, Великобритания). С целью оценки выраженности атрофии была использована система OLGA [6].
У всех пациентов наличие предшествующей или текущей инфекции H. pylori было исключено посредством проведения серологического, иммуногистохимического (ИГХ) и молекулярнобиологического тестирований.
Статистическая обработка полученных результатов проводилась с помощью программного обеспечения Jamovi (Version 1.6). Тип распределения устанавливали с помощью критерия Шапиро – Уилка. Для сравнения номинальных переменных в двух несвязанных совокупностях использовался критерий Хи-квадрат, а при наличии ограничений для его использования – точный критерий Фишера. Критический уровень статистической значимости был принят равным 0,05.
Результаты и их обсуждение
Возраст пациентов в исследуемой группе варьировал от 29 лет до 81 года, средний возраст составил 59±12,78 года. 97% пациентов (36 из 37) были женского пола, 3% (1 из 37) – мужского.
Распределение пациентов по стадии и степени гастрита в соответствии с системой OLGA представлено на рис. 1.
Активность
Выраженность (слабо)
Выраженность (умеренно)
Степень 1
Степень 2
Стадия 1
Стадия 2
КМ (полная)
КМ (нет)
КМ (неполная)
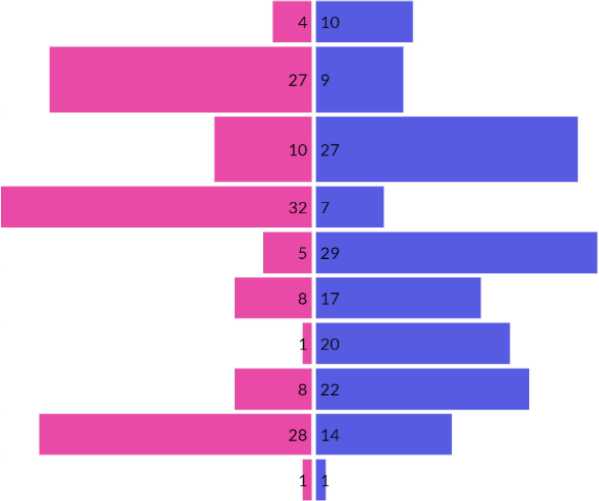
Рисунок 1. Результаты гистологического исследования биопсийного материала пациентов с АИГ
Figure 1. The results of histological examination of biopsy material of patients with AIG
На сегодняшний день данные о влиянии H. pylori на развитие АИГ противоречивы. Выдвигается предположение, что H. pylori посредством молекулярной мимикрии может играть существенную роль в патогенезе АИГ [14]. Однако в данной выборке пациентов наличие признаков предшествующей или текущей инфекции H. pylori обнаружено не было.
Figure 2. Autoimmune gastritis. The biopsy from the body of the stomach. Chronic moderately severe inactive atrophic gastritis of the body of the stomach with diffuse pseudopyloric metaplasia, the formation of small lymphoid aggregates and focal hyperplasia of the foveal layer. Degree 2. Stage 2. Staining with hematoxylin and eosin, ×20
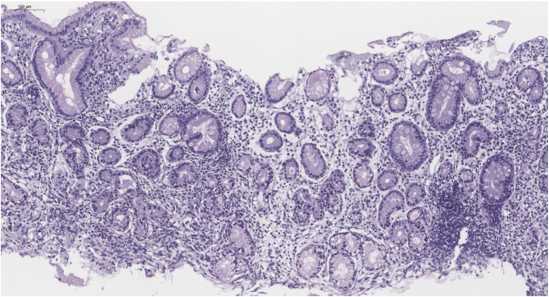
Figure 3. Autoimmune gastritis. The biopsy from the body of the stomach. Chronic moderately severe inactive atrophic gastritis of the body of the stomach with focal complete intestinal metaplasia, which does not exceed 30% of the biopsy area. Degree 2. Stage 2. Staining with hematoxylin and eosin, ×20
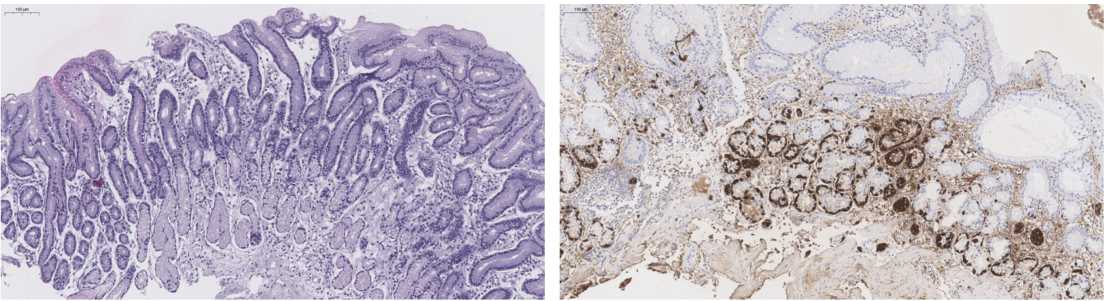
Figure 4. Autoimmune gastritis. The biopsy from the antrum of the stomach. Chronic mild inactive superficial gastritis of the antrum with focal hyperplasia of enterochromaffin-like cells and the foveal layer. Degree 1. Stage 0. Staining with hematoxylin and eosin, ×20
Figure 5. Autoimmune gastritis. The biopsy from the body of the stomach. Widespread linear and focal nodular hyperplasia of neuroendocrine cells. IHC reaction with the antibody Chromogranin A, ×20
Заключение


