Морфологические особенности брахиоцефальных артерий у пациентов с гипоплазией дуги аорты
Автор: Сойнов Илья Александрович, Синельников Ю.С., Кливер Е.Э., Корнилов И.А., Ничай Н.Р., Горбатых А.В., Кулябин Ю.Ю., Горбатых Ю.Н.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Врожденные пороки сердца
Статья в выпуске: 4 т.19, 2015 года.
Бесплатный доступ
Цель Оценить особенности морфологии и характер структурных изменений стенки левой подключичной артерии у новорожденных и младенцев с коарктацией и гипоплазией дуги аорты. Материал и методы В исследование включили 27 пациентов с гипоплазией дуги аорты в возрасте 64 (27; 89) дней, средней массой тела 3,6±1,1 (1,8-6,9) кг, оперированных в центре детской хирургии ННИИПК им. акад. Е.Н. Мешалкина в 2013-2014 гг. Всем пациентам выполняли хирургическую коррекцию гипоплазии дуги аорты без искусственного кровообращения с модифицированной реверсивной пластикой лоскутом левой подключичной артерии. Интраоперационно осуществляли забор фрагмента левой подключичной артерии с целью определения степени васкуляризации, соотношения эластина и коллагена. Сравнивали результаты с показателями контрольной группы, которую составили образцы левой подключичной артерии у пациентов (п = 27) аналогичного возраста, умерших после операции по поводу врожденных пороков сердца без гипоплазии дуги аорты. Результаты Обнаружили достоверные различия в содержании тонких коллагеновых и эластических волокон у пациентов с гипоплазией дуги и пациентов с нативной аортой. Особенностями являются достоверно большее содержание тонких коллагеновых и меньшее содержание эластических волокон в стенке подключичной артерии у пациентов с гипоплазией дуги аорты. Заключение Морфология подключичной артерии у детей с гипоплазией дуги характеризуется увеличением количества коллагеновых и уменьшением эластических волокон, что обусловлено пролиферацией гладких миоцитов, миофибробластов, фибробластов и изменением их соотношения. Данные особенности определяют изменения эластических характеристик сосудистой стенки - повышение ригидности.
Гипоплазия дуги аорты, морфология, эластичность
Короткий адрес: https://sciup.org/142140697
IDR: 142140697
Текст научной статьи Морфологические особенности брахиоцефальных артерий у пациентов с гипоплазией дуги аорты
Гистологические показатели стенки левой подключичной артерии
Цель – оценить особенности морфологии и характер структурных изменений стенки левой подключичной артерии у новорожденных и младенцев с коарктацией и гипоплазией дуги аорты.
Материал и методы
В исследование включили 27 пациентов с гипоплазией дуги аорты в возрасте 63,6±89,6 (1–281) дня, средней массой тела 3,6±1,1 (1,8–6,9) кг, оперированные в центре детской хирургии ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина» в 2013–2014 гг. Всем пациентам выполняли хирургическую коррекцию гипоплазии дуги аорты без искусственного кровообращения с модифицированной реверсивной пластикой лоскутом левой подключичной артерии. Интраоперационно осуществляли забор фрагмента левой подключичной артерии с целью определения степени васкуляризации, соотношения эластина и коллагена. Сравнивали результаты с показателями контрольной группы, которую составили образцы левой подключичной артерии у пациентов (n = 27) аналогичного возраста, умерших после операции по поводу врожденных пороков сердца без гипоплазии дуги аорты.
Фрагменты подключичных артерий, взятых интраоперационно у больных с гипоплазией дуги аорты и на аутопсии у пациентов без патологии аорты, фиксировали в 10% растворе формалина на фосфатном буфере и заливали в парафин. Подготовили срезы толщиной 4 мкм на микротоме фирмы Microm HM 550 и окрашивали гематоксилин-эозином по методу Ван Гизона с комбинированной докраской эластики орсеином, также устанавливали РAS-реакции методом импрегнации срезов серебром по Гомори и методом Пикро Маллори (Picro Mallory Trichromica). Обзорную гистологию проводили с помощью программно-микроскопного комплекса, который включал световой микроскоп Imadger M2 (ZEISS, Германия), цифровую видеокамеру AxioCam НRc и компьютер Pentium 4. Иммуногистохимическое окрашивание гистологических препаратов выполнили на автоматическом иммуногистостейнере Benchmark XT Ventana с помощью мышечного актина (Actin Muscle (HUC-1)), гладкомышечного миозина (Myosin, Smooth Muscle (SMMS-1)) и системы визуализации ultraView Universal DAB Detection Kit (Roche). При стереомор-фометрическом исследовании изучали степень васкуляризации, соотношение эластина и коллагена, а также изменение их соотношения в стенке неизмененной подключичной артерии и подключичной артерии у пациентов с гипоплазией дуги аорты.
Статистический анализ
Статистическую обработку проводили с использованием пакета прикладных программ Stata 13. Оценивали нормальность распределения признака с помощью гистограммы распределения признака, а также критериев Колмогорова – Смирнова, Лиллиефорса и Шапиро – Уилка. Для описательной статистики нормально распределенных количественных признаков использовали параметрические методы: вычисление средних значений и средних квадратических отклонений. Для количественных признаков с неправильным распределением, а также качественных (порядковых и номинальных) признаков применяли непараметрические методы – вычисления медиан и соответствующий интервал между 75-м и 25-м процентилями. При сравнении двух независимых групп использовали t-критерий Стьюдента для признаков с гауссовским распределением и U-критерий Манна – Уитни для признаков с неноминальным распределением. Значение не более 0,05 считали статистически достоверным.
Результаты
При гистологическом исследовании васкуляризации стенки подключичной артерии у детей с гипоплазией дуги аорты не обнаружили достоверной разницы по этому показателю с контрольной группой ( таблица ).
Содержание тонких коллагеновых волокон в стенке подключичной артерии у пациентов контрольной груп-
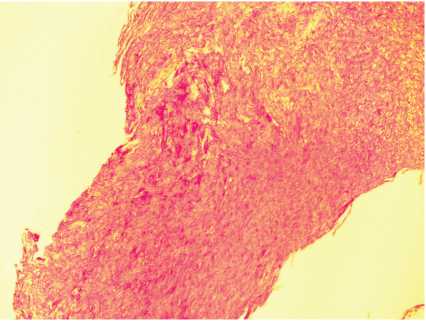
Рис. 1. Фрагмент подключичной артерии у пациентов с гипоплазией дуги аорты (гипоэластоз с образованием «плешей»). Окраска по Ван Гизону. Увеличение х 180
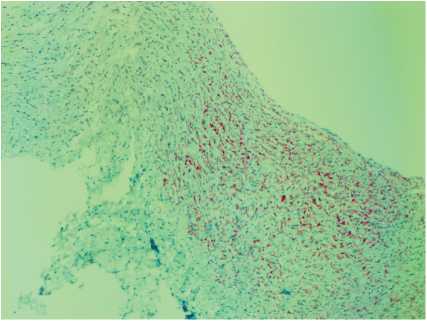
Рис. 2. Неравномерное распределение миозина в стенке подключичной артерии у пациентов с гипоплазией дуги аорты. Иммуногистохимическая окраска с использованием Myosin, Smooth Muscle (SMMS-1). Увеличение х 180
пы было достоверно ниже, чем в артерии у пациентов с гипоплазией дуги (p<0,05), а содержание эластических волокон в стенке нормальной подключичной артерии, напротив, выше (p<0,05). В то же время в обеих группах наблюдалась тенденция к уменьшению количества эластических волокон с течением времени (p<0,05). В стенке подключичной артерии у пациентов с гипоплазией аорты также отмечен гипоэластоз вплоть до развития «плешей» (рис. 1). Увеличение тонких коллагеновых волокон в образцах артерии у пациентов с гипоплазией дуги указывает на нарушение синтеза гладких миоцитов (рис. 2), фибробластов, миофибробластов на фоне текущего повреждения клеточно-волокнистых структур с развитием во внутренней и средней оболочках подключичной артерии миксоматозной мышечно-фиброзной ткани (рис. 3), представленной пролиферирующими клеточными элементами, вокруг которых развивается рыхлая соединительная ткань, содержащая тонкие коллагеновые волокна.
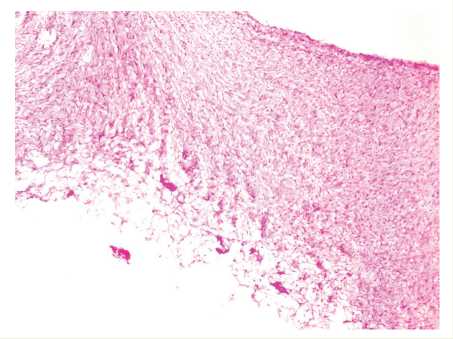
Рис. 3. Участки миксоматозной мышечно-фиброзной ткани. Окраска: гематоксилин-эозином. Увеличение х 180
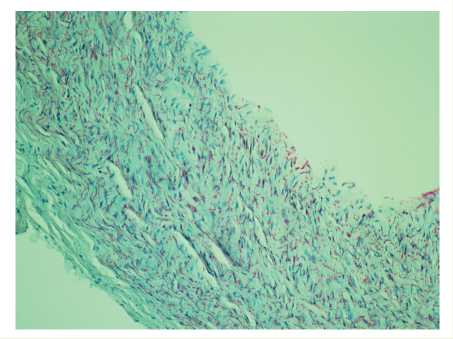
Рис. 4. Интрамуральные сосуды адвентициальной и медиальной оболочек подключичной артерии. Иммуногистохимическая окраска с использованием Аctin Muscle (HUC-1). Увеличение х 180
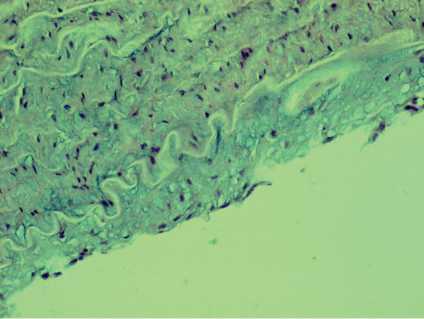
Рис. 5. Скопления липидов и пенистых клеток в интимальном слое. Окраска Picro Mallory Trichromica.
Увеличение х 280
Новообразование сосудов капиллярного типа в адвентициальной оболочке подключичной артерии у пациентов с гипоплазией дуги аорты происходит из собственных сосудов при участии эндотелиальных и гладкомышечных клеток, адвентициальных фибробластов и протекает с уменьшением количества интрамуральных сосудов (рис. 4).
В единичных случаях со стороны интимы обнаружили скопления липидов и пенистых клеток, что указывает на ранние гистологические признаки атеросклероза у данной категории больных (рис. 5).
Обсуждение
Подключичная артерия, как и любой сосуд эластического типа, имеет эластико-коллагеновый каркас, основная функция которого – передача пульсовой волны и превращение пульсирующего тока крови в более равномерный. При врожденной обструктивной патологии дуги аорты происходит нарушение эластико-коллагено-вого каркаса, что приводит к сосудистой дисфункции [9, 10], которая в свою очередь у пациентов после коррекции гипоплазии дуги аорты может влиять на долгосрочный прогноз. 30% пациентов с этой патологией имеют риск раннего возникновения артериальной гипертензии, аневризм аорты и брахиоцефальных сосудов, ишемической болезни сердца и ишемического инсульта [3]. Впервые сосудистую дисфункцию описали в 1985 г., что явилось прорывом в понимании патологического процесса [11]. Выявили патологическую сосудистую реактивность предплечья и нормальную реактивность сосудов голени у детей с обструктивной патологией аорты. Как правило, такие пациенты имеют морфофункциональные нару- шения крупных артерий. До сих пор остается неясной причина вышеуказанных осложнений: патология гладких миоцитов, волокнистых структур или их сочетание [1, 2, 5]. Многие авторы сосредотачиваются на морфологических изменениях самой аорты, не уделяя должного внимания брахиоцефальным сосудам [5, 7]. На наш взгляд, проблема носит комплексный характер. Как и в других морфологических исследованиях артерий эластического типа у пациентов с обструктивной патологией дуги аорты, мы обнаружили увеличение коллагеновых волокон и снижение эластических вплоть до их полного отсутствия. Такие изменения эластико-коллагенового состава приводят к повышенной жесткости и сниженной растяжимости артерии. Даже после устранения обструкции на уровне дуги соотношение эластических и коллагеновых волокон не изменяется, продолжая снижаться с течением времени. В норме у детей раннего возраста также имеется физиологическое снижение эластина [12], однако оно чередуется с увеличением эластических волокон, что не происходит у детей с обструктивной патологией аорты, даже если она была коррегирована в младенчестве. Такие изменения в стенке сосудов эластического типа предрасполагают к системной артериальной гипертензии [1, 4, 10].
Также мы обнаружили повреждения клеточно-волокнистых структур с развитием во внутренней и средней оболочках подключичной артерии миксоматозной мышечно-фиброзной ткани, представленной пролиферирующими клеточными элементами, а также патологию vasa vasorum. Подобные изменения описаны при аневризмах аорты [13–15], поэтому обструктивная патология дуги аорты – возможный фактор риска образования аневризм.
Как и Тодоров С.С., изучавший морфологию различных сегментов аорты [7], мы обнаружили ранние признаки атеросклероза. Meyer A.A. и соавторы показали, что дегенеративные и пролиферативные изменения в брахиоцефальных артериях и аорте приводят к ранней инвалидности больных и высокой летальности в общей популяции пациентов с обструктивной патологией дуги аорты [15].
Заключение
Морфология подключичной артерии у детей с гипоплазией дуги характеризуется увеличением коллагеновых и уменьшением эластических волокон, что обусловлено пролиферацией гладких миоцитов, миофибробластов, фибробластов и изменением их соотношения. Данные особенности определяют изменения физических характеристик сосудистой стенки (повышение ригидности). Во внутреннем и среднем слоях артерии отмечается гиперплазия гладких миоцитов, 7. миофибробластов, фибробластов с формированием мышечно-фиброзной ткани. В адвентиции уменьшается количество интрамуральных сосудов, развиваются кровоизлияния. Все вышеуказанные изменения в комплексе обусловливают снижение эластичности и приводят к развитию гемодинамических нарушений.
Список литературы Морфологические особенности брахиоцефальных артерий у пациентов с гипоплазией дуги аорты
- Сойнов И.А., Синельников Ю.С., Горбатых А.В. Ничай Н.Р., Иванцов С.М., Корнилов И.А., Кшановская М.С., Горбатых Ю.Н. Артериальная гипертензия у пациентов после коррекции коарктации и гипоплазии дуги аорты//Патология кровообращения и кардиохирургия. 2015. Т. 19. № 2. С. 102-113.
- Синельников Ю.С., Кшановская М.С., Горбатых А.В., Иванцов С.М., Прохорова Д.С. Гипоплазия дуги аорты//Патология кровообращения и кардиохирургия. 2013. № 3. С. 68-72.
- Toro-Salazar О.Н., Steinberger J., Thomas W., Rocchini A.P., Carpenter B., Moller J.H. Long-term follow-up of patients after coarctation of the aorta repair//Am. J. Cardiol. 2002. Vol. 89. P. 541-547.
- Синельников Ю.С., Кшановская M.C., Прохорова Д.С. и др. Хирургическая коррекция коарктации аорты, всегда ли оправданы ожидания?//Сибирский медицинский журнал. 2013. Т. 28. № 4. С. 55-58.
- Machii М., Becket A. Hypoplastic aortic arch morphology pertinent to growth after surgical correction of aortic coarctation//Ann. Thorac. Surg. 1997. Vol. 64. P. 516-20.
- Прохорова Д.С., Нарциссова Г.П., Горбатых Ю.Н., Синельников Ю.С., Субботин Д.В. Сравнительная оценка эластических свойств аорты у новорожденных с коарктацией аорты до и после хирургической коррекции//Патология кровообращения и кардиохирургия. 2011. № 2. С. 17-20.
- Тодоров С.С. Патоморфологическая характеристика изменений аорты при коарктации у детей первого года жизни//Вестник ВолГМу. 2009. № 3. С. 73-76.
- Синельников Ю.С., Горбатых Ю.Н., Горбатых А.В., Иванцов С.М., Стрельникова М.С., Чащин О.В., Прохорова Д.С., Литасова Е.Е. Хирургическое лечение коарктации с гипоплазией дистального отдела дуги аорты у новорожденных//Патология кровообращения и кардиохирургия. 2011. № 3. С. 9-12.
- Горбатых Ю.Н., Синельников Ю.С., Сойнов И.А. и др. Хирургическая коррекция аномалий дуги аорты у младенцев в условиях искусственного кровообращения//Хирургия. 2015. № 8. С. 18-21.
- O'Sullivan J.J. Late hypertension in patients with repaired aortic coarctation//Curr. Hypertens. Rep. 2014. Vol. 16. P. 421-26.
- Gidding S., Rocchini A., Moorehead C., Schork M., Rosenthal A. Increased forearm vascular reactivity in patients with hypertension after repair of coarctation//Circulation. 1985. Vol. 71. P. 495-9.
- Machii M., Becker A.E. Morphologic features of the normal aortic arch in neonates, infants, and children pertinent to growth//Ann. Thorac. Surg. 1997. Vol. 64. P. 511-5.
- Тодоров С.С. Клинико-морфологическая характеристика изменений аорты при синдроме Марфана у детей и взрослых//Детские болезни сердца и сосудов. 2010. № 1. С. 52-57.
- Новикова Е.Г., Титова Г.П., Таланкина И.Е. Морфологические изменения стенки аорты при расслаивающей аневризме//Архив патологии. 2013. № 6. С. 3-9.
- Новикова Е.Г., Таланкина И.Е. Морфологические особенности возрастных изменений в стенке аорты при расслаивающейся аневризме//Архив патологии. 2015. № 1. С. 18-23.
- Meyer А. A., Joharchi M.S., Kundt G., Schuff-Werner Р., Steinhoff G., Kienast W. Predicting the risk of early atherosclerotic disease development in children after repair of aortic coarctation//Eur. Heart J. 2005. Vol. 26. P. 617-22.


