Морфологические особенности фолликулов щитовидном железы и состав интратиреоидных лимфоцитов при болезни Грейвса
Автор: Дудина Маргарита Андреевна, Медведева Надежда Николаевна, Савченко Андрей Анатольевич, Мошев Антон Викторович, Жуков Евгений Леонидович, Хапилина Елена Алексеевна, Ковалева Гульмира Кажгалиевна, Догадин Сергей Анатольевич, Маньковский Владимир Анатольевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.29, 2021 года.
Бесплатный доступ
Накопление Т-лимфоцитов в паренхиме щитовидной железы при гипертиреозе аутоиммунного генеза ограничено, что может свидетельствовать о первичной роли Т-лимфоцитов в развитии болезни Грейвса. Механизмы инвазивной активности лимфоцитов в паренхиме щитовидной железы и ее морфологической перестройки при болезни Грейвса неизвестны. Цель исследования - изучение морфологических особенностей тироцитов фолликулов щитовидной железы и фенотипического состава интратиреоидных лимфоцитов при болезни Грейвса. В исследовании использованы ультразвуковые, гистологические, микро-морфометрические, иммунологические и иммуноферментный методы исследования. Материалом для исследования послужили операционные биоптаты щитовидной железы, полученные у пациентов при эпифасциальной тиреоидэктомии после достижения медикаментозного эутиреоза. В исследование было включено 58 женщин с болезнью Грейвса, средний возраст 40,4±13,2 лет, из них 18 (31,11%) с впервые верифицированным диагнозом и 40 (68,96%) с рецидивом заболевания. Результаты проведенных исследований показали, что исходом тканеспецифичного аутоиммунного воспаления и длительной тиреостатической терапии у пациентов с болезнью Грейвса является перестройка тиреоидного эпителия с гистологическими признаками хронического аутоиммунного тиреоидита, особенно выраженная при рецидиве заболевания. В группе пациентов с рецидивом болезни Грейвса повышено процентное содержание Т-лимфоцитов с фенотипом CD3+CD4+CD127LowCD25High и В1-клеток памяти (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Щитовидная железа, болезнь грейвса, тироциты, морфометрия, фенотип интратиреоидных лимфоцитов, эпифасциальная тиреоидэктомия
Короткий адрес: https://sciup.org/143177416
IDR: 143177416 | DOI: 10.20340/mv-mn.2021.29(2).556
Текст научной статьи Морфологические особенности фолликулов щитовидном железы и состав интратиреоидных лимфоцитов при болезни Грейвса
Article received 21 October 2020
Article accepted 6 July 2021
Введение. Болезнь Грейвса (далее - БГ) – органоспецифическое аутоиммунное заболевание, обусловленное выработкой ти-реоидстимулирующих иммуноглобулинов (далее - ТСИ), стимулирующих пролиферацию тиреоцитов за счет взаимодействия с рецепторами тиреотропного гормона (далее - рТТГ) на мембране фолликулярных клеток щитовидной железы (далее – ЩЖ) [1]. Наибольшее внимание уделяется антителам (далее - АТ), стимулирующим функцию ЩЖ (TSAb), поскольку они взаимодействуют с рТТГ на мембране тиреоцитов и повышают продукцию цАМФ, приводя к повышенной секреции тироксина и трийодтиро-нина. TSAb направлены против эпитопов внеклеточного домена рТТГ и являются агонистами ТТГ. Они способны усиливать функцию тиреоцитов в течение нескольких часов, тогда как сам ТТГ действует менее продолжительно [2-3]. В аутоиммунный процесс при БГ могут вовлекаться все компоненты паренхимы ЩЖ [4]. Существует предположение, что тиреоциты, экспрессируя молекулы HLA и презентируя антиген непосредственно Т-клеткам, могут инициировать аутоиммунное заболевание ЩЖ, после воздействия какого- либо внешнего стимула [5]. Было показано, что аккумуляция Т-клеток в паренхиме ЩЖ при БГ сильно ре-стриктирована, что может свидетельствовать о первичной роли Т-клеток в развитии гипертиреоза аутоиммунного генеза. В более поздних работах [6-7] было продемонстрировано, что снижение активности ТСИ, часто наблюдаемое после субтотальной тиреоидэктомии, обусловливается, вероятно, тем, что с тиреоидной паренхимой удаляется и основная масса лимфоцитов, продуцирующих АТ к рТТГ. Рецидив после операции может быть связан с сохранением достаточного объема тиреоидной паренхимы, способной реагировать на ТСИ, и достаточного количества лимфоцитов, способных поддерживать аутоиммунное воспаление. К настоящему времени доконца не ясны ме ханизмы развития лимфоидной инфильтрации ЩЖ при БГ, а также участия в этом процессе клеток иммунной системы и тире-оцитов. Очевидно, что аутоиммунное воспаление при БГ меняет морфологическую структуру ЩЖ и представляет собой результат интегрированных взаимодействий лимфоцитов, мигрировавших непосредственно в ткань железы, и инфильтрировавших ее с тиреоцитами, которые приобрели способность аберрантно экспрессировать широкийспектр молекул клеточной адгезии, HLA I и II класса [8-9]. В то же время остаются недостаточно изученными особенности структуры тиреоидного эпителия, субпопуляционного состава Т- и В-лимфоцитов паренхимы ЩЖ, у пациентов БГ в исходе длительной терапии антитиреоидными препаратами (АТП).
Цель исследования: изучить морфологические особенности фолликулов ЩЖ и фенотипический состав интрати-реоидных лимфоцитов у пациентов БГ после эпифасциальной тиреоидэктомии.
Материалы и методы исследования. В исследование было включено 58 женщин с БГ, средний возраст 40,54±13,24 лет, из них 18 (31,11%) - с впервые верифицированным диагнозом и 40 (68,96%) - с рецидивом заболевания. Диагноз БГ (шифр МКБ – Е05.0) основывался на клинико- лабораторных признаках: жалобах, клинической картине тиреотоксикоза при объективном осмотре, характерных сонографических изменениях ЩЖ, а такжеповышенном титре АТ к рТТГ в сыворотке крови и соответствующих изменениях тиореоидного статуса [10]. Подробная клинико-лабораторная характеристика обследуемых пациентов представлена в таблице 1. Инструментальные методы диагностики. Исследование ЩЖ проводилось при помощи аппарата «Philips iU22 xMatrix» (США) с линейным датчиком 7,5 МГц. Увеличенным считался объем ЩЖ у обследуемых женщин превышающий 18 мл, рассчитанный по фор- муле J. Brunn (1981). Диффузным зобом (ДТЗ) обозначалось диффузное увеличение ЩЖ без узловых образований; узловым (УТЗ) - узловые образования без увеличения объема ЩЖ, многоузловым зобом (МТЗ) - несколько узловых образований в ЩЖ. При обнаружении таких образований пациенты из исследования исключались.
Микроскопия и морфометрия гистологических срезов ЩЖ. После достижения медикаментозного эутиреоза всем пациентам проводилась эпифасциальная тиреоидэктомия. Часть удаленной ЩЖ погружалась в пластиковый контейнер с изотоническим раствором натрия хлорида для последующего проведения гистологического анализа и выделения интратирео-идных лимфоцитов. Отобранный операционный материал ЩЖ фиксировали в 10% растворе нейтрального формалина, затем образцы обезвоживали в возрастающей концентрации спирта, впоследствии заливали в парафин-воск (автоматизированный гистологический процессор Leica TP 120; станция заливки Leica EG 150H с охлаждающим модулем Leica EG 1150C, Германия). Серийные парафиновые срезы толщиной 6–8 мкм изготавливали на универсальном автоматизированном микротоме Microm НМ-360 (Microm International GmbH, Германия). После окраски гистологических срезов гематоксилином и эозином проводили обзорную микроскопию и морфометрию на микроскопе Nikon Eclipse Ni-U c цифровой камерой для фото- и видеодокументации Nikon DS-Fi2 (Nikon, Япония) и пакетом программного обеспечения NIS-Elements Document и JMicroVision. При обзорной микроскопии проводили общую оценку структуры ЩЖ и полуколичественную морфометрию. Морфометрию гистологических срезов проводили по алгоритму описания паренхимы оперативно удаленных и диффузно измененных щитовидных желез [11]. Учитывались следующие параметры: распространенность фестончатых фолликулов, степень плотности коллоида, выраженность краевой резорбции коллоида и лимфоидной инфильтрации, наличие сосочковых структур, подушек Сандерсона и лимфоидных фолликулов (таблица 2).
Для кариометрии изготавливали микрофотографии различных полей зрения и измеряли их с помощью программы JMicroVision 1.2.7. С каждого препарата паренхимы ЩЖ от каждого пациента считали по 10 ядер тиреоцитов в пяти полях зрения. Всего было произведено 2900 измерений площади ядер тиреоцитов.
Выделение лимфоцитов из паренхимы ЩЖ и цитометрический анализ. Суспензию лимфоцитов получали путем мягкого механического выдавливания клеток из фрагментированной паренхимы ЩЖ. Клетки трижды отмывали в растворе Хенк-са. Распределение антител по каналам флуоресценции проводили в соответствие с принципами формирования панелей для многоцветных цитофлуориметрических исследований [12]. Пробоподготовку осуществляли по стандартной методике [13]. Анализ окрашенных клеток проводили на проточном цитофлуориметре Navios (Beckman Coulter, USA) Центра коллективного пользования КНЦ СО РАН. В каждой пробе анализировали не менее 50000 лимфоцитов.
Иммунологические методы исследования. Исследование фенотипа интра-тиреоидных T- и В-лимфоцитов проводили методом проточной цитометрии с использованием прямой иммунофлуоресценции с применением моноклональных антител (Beckman Coulter, США), меченных FITC (fluoresceinisothiocyanate), PE или RD1 (phycoerythrin), ECD
(phycoerythrin-TexasRed-X),PC5
(phycoerythrin-cyanin 5),PC7
(phycoerythrin-cyanin 7) иAPC
(allophycocyanin) в следующих панелях: CD45-FITC/CD127-PE/CD3-ECD/CD25-PC5/CD4-PC7/CD8-APC иCD5-
FITC/CD19-ECD/CD45-PC5/CD27-PC7.
Иммунохимические методы исследования. Методом хемилюминесцентного иммуноанализа на микрочастицах (ХИАМ) на автоматическом анализаторе Architect i1000sr (Abbott Diagnostics, США) определяли уровень ТТГ и свободного тироксина (св.Т4) в сыворотке крови, указанный референсный диапазон, соответственно, 0,354,94 мМЕ/л и 9,01-19,05пмоль/л.
Таблица 1
Клинико-лабораторная характеристика обследованных пациентов (Me (Q1-Q3)
|
Показатель |
Впервые выявленная БГ n=18 |
Рецидив БГ n=40 |
P |
|
Средний возраст пациентов, лет |
44,46±14,02 |
40,86±11,06 |
- |
|
Продолжительность приема АТП (с момента выявления заболевания), мес. |
2,4 (1,3 – 4,1) |
11,4 (5,8 – 17,1) |
0,004 |
|
Объем ЩЖ, мл |
21,90 (18,8 - 48,75) |
46,65 (28,15 - 84,35) |
0,010 |
|
ТТГ, мМЕ/л |
0,15 (0,01 - 0,49) |
0,54 (0,14 - 1,4) |
0,008 |
|
Свободный Т4, пмоль/л |
15,63 (11,60 - 24,91) |
15,26 (10,80 - 27,01) |
- |
|
Свободный Т3, пг/мл, |
4,70 (3,71 - 6,30) |
5,93 (3,61 - 7,62) |
- |
|
АТ к рТТГ, мЕд/л |
10,81 (6,21 - 31,28) |
9,70 (8,51 - 13,50) |
- |
|
АТ к ТПО, мЕд/л |
223 (191 - 374) |
42 (14 - 543) |
0,003 |
Таблица 2
Критерии морфологической оценки паренхимы щитовидной железы
|
Параметр |
Степень выраженности признака |
||
|
Распространенность фестончатых фолликулов |
Низкая (менее ¼ поля зрения при объективе ×10) |
Умеренная (от ¼ до ½ поля зрения при объективе ×10) |
Высокая (более ½ поля зрения при объективе ×10) |
|
Степень плотности коллоида |
Жидкий (бледнее, чем междольковая соед. ткань) |
Средний (такая же, как междольковая соед. ткань) |
Плотный (интенсивнее, чем меж-дольковая соед. ткань) |
|
Выраженность краевой резорбции коллоида |
Низкая (наблюдается в фолликулах в менее чем ¼ поля зрения при объективе ×10) |
Средняя (наблюдается в фолликулах от ¼ до ½ поля зрения при объективе ×10) |
Высокая (наблюдается в фолликулах в более чем ½ поля зрения при объективе ×10) |
|
Сосочковые структуры |
Небольшое количество (наблюдается в фолликулах в менее чем ¼ поля зрения при объективе ×10) |
Умеренное количество (наблюдается в фолликулах от ¼ до ½ поля зрения при объективе ×10) |
Большое количество (наблюдается в фолликулах в более чем ½ поля зрения при объективе ×10) |
|
Подушки Сандерсона |
Небольшое количество (наблюдается в фолликулах в менее чем ¼ поля зрения при объективе ×10) |
Умеренное количество (наблюдается в фолликулах от ¼ до ½ поля зрения при объективе ×10) |
Большое количество (наблюдается в фолликулах в более чем ½ поля зрения при объективе ×10) |
|
Выраженность лимфоидной инфильтрации |
Небольшая (инфильтраты реже, чем в 3-х полях зрения при объективе х10) |
Умеренная (инфильтраты в 1-3-х полях зрения при объективе х10) |
Выраженная (инфильтраты в каждом поле зрения при объективе х10) |
|
Распространенность лимфоидных фолликулов |
Низкая (менее ¼ поля зрения при объективе ×10) |
Умеренная (от ¼ до ½ поля зрения при объективе ×10) |
Высокая (более ½ поля зрения при объективе ×10) |
Количественное определение свободного трийодтиронина (свободный Т3) в сыворотке крови осуществляли методом энзим-связанного иммуносорбентного анализа (ИФА) с использованием тест- систем «ДС-ИФА-ТИРОИД-Т3свободный» (ООО «НПО «Диагностические системы»), референсный интервал (1,2-4,2 пг/мл). Уровень АТ к рТТГ и антител к тиреоидной пероксидазе (АТ к ТПО) оценивался методом ИФА при помощи соответствующих наборов «Medizym T.R.A.» («Medipan Diagnostica», Германия) и «АТ-ТПОХема-Медика», (Россия), референсный интервал < 35 мЕд/л. Рекомендованная точка разделения (cut-off) для уровня АТ к рТТГ составила 1,5 мЕд/л («серая» зона 1-1,5 мЕд/л).
Статистические методы исследования. Описание выборки производили с помощью подсчета медианы (Ме) и интерквартального размаха в виде 1 и 3 квартилей (Q1–Q3)]), а также в виде средних арифметических значений и стандартных отклонений от среднего M±SD в случае нормального распределения показателей. Для определения характера распределения полученных данных использовали критерий Шапиро-Уилка. Достоверность различий между исследуемыми показателями оценивали по непараметрическому критерию Манна-Уитни (Mann-Whitney U test). Для исследования силы взаимосвязей показателей вычислялся коэффициент ранговой корреляции по Спирмену (Spearman rank R). Статистический анализ осуществляли в пакете прикладных программ Statistica 8.0 (StatSoftInc., 2007).
Согласие пациентов. Все исследования выполнены с информированного согласия испытуемых и в соответствии с Хельсинкской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2013 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266.
Результаты исследования и обсуждение. При морфологической характеристике послеоперационных препаратов ЩЖ у всех пациентов с впервые выяв- ленной БГ наблюдалась выраженная краевая резорбция коллоида, преобладание сосочковых структур, а среднее значение площади ядер составило 31,79 кв. мкм. При этом, у 12 (66,62%) пациентов отмечалась выраженная пролиферация тиреоци-тов. В 15 (83,33%) случаях впервые выявленной БГ в препаратах ЩЖ встречался коллоид высокой и средней плотности, лимфоидная инфильтрация, подушки Сандерсона и регионарные кровоизлияния. У половины пациентов этой группы отмечалось преобладание склеротических изменений, лимфоидных фолликулов и расстройства кровообращения. В единичных случаях были зафиксированы выраженная аргирофильная сеть и отсутствие коллоида. В группе пациентов с рецидивирующим течением БГ во всех препаратах ЩЖ отмечалось преобладание сосочковых структур, у 37 (93,91%) из них пре-обладалколлоид высокой и средней плотности, у 33 (81,82%) - подушки Сандерсона, а средняя площадь ядер была равна 30,30 кв.мкм. Лимфоидная инфильтрация в этой группе пациентов отмечалась в 31 (78,73%) случаев, при этом краевая резорбция коллоида и пролиферация тире-оцитов встречались одинаково часто у 29 (72,71%) пациентов. У половины пациентов с рецидивом БГ наблюдались склеротические изменения стромы ЩЖ, у 30 (75,74%) кровоизлияния и 14 (36,33%) расстройства кровообращения. Такие морфологические структуры ЩЖ, как лимфоидные фолликулы и аргирофильная сеть с отсутствием коллоида встречались, соответственно, в 18 (45,43%) и 2 (6,06%) случаев рецидивирующего течения БГ.
При проведении сравнительной полуколичественной морфометрии установлено, что характерными особенностями морфологической структуры ЩЖ пациентов с впервые выявленной БГ были высокая распространенность фестончатых фолликулов и высокая степень краевой резорбции фолликулов (рис. 1).
Большее количество коллоида высокой и средней плотности было зафиксировано у пациентов с впервые выявленной БГ, а в группе пациентов с рецидивом заболевания, напротив, коллоид был более жидкий или отсутствовал. При изучении серийных гистологических срезов послеоперационного материала ЩЖ было установлено, что структура эпителия фолликулов ЩЖ пациентов с рецидивом БГ отличается выраженной лимфоидной инфильтрацией, преобладанием сосочко- вых структур, подушек Сандерсона, а также достоверно высокой распростра- нен-ностью лимфоидных фолликулов, в сравнении с морфологической структурой ЩЖ пациентов с впервые выявленным заболеванием (рис. 2).
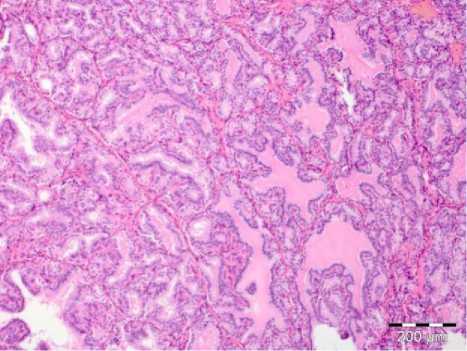
Рис. 1. Микрофото щитовидной железы пациента с впервые выявленной БГ с наличием фестончатых фолликулов и участков краевой резорбции коллоида. Окраска: гематоксилин–эозином. Ув.: х200.
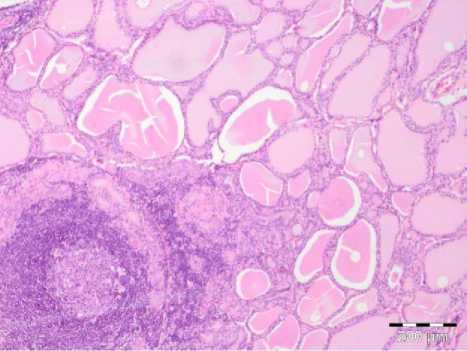
Рис. 2. Микрофото щитовидной железы пациента с рецидивом БГ с наличием лимфоидного фолликула. Окраска: ге-матоксилин-эозином. Ув.: х200.
При микроскопическом изучении послеоперационных гистологических препаратов ЩЖ медиана площади ядер тиреоцитов у пациентов БГ составила 31,96 кв. мкм (26,29-37,73). При этом обнаружено линейное изменение уровня ТТГ в зависимости от площади ядер тиреоцитов: у пациентов БГ с площадью ядер тиреоци-тов менее 31,96 кв. мкм уровень ТТГ был достоверно ниже (Ме=0,58; 0,42-2,59, p<0,01), чем у пациентов с площадью ядер тиреоцитов ≥31,96 кв. мкм. (0,2 (0,03-0,38)). В зависимости от площади ядер тиреоци-тов менялся и уровень активированных Т-лимфоцитов (CD3+CD25+) в периферической крови: достоверное увеличение
CD3+CD25+-лимфоцитов (Ме=4,22; 0,4-9,72, p < 0,05) наблюдалось у пациентов БГ с площадью ядер тиреоцитов < 31,96 кв. мкм.
Таким образом, для пациентов с впервые верифицированным диагнозомБГ характерно умеренное содержание фолликулов фестончатой формы, меньшее содержание сосочковых структур и подушек Сандерсона, незначительно выраженная лимфоидная инфильтрация и небольшое количество лимфоидных фолликулов. У пациентов с рецидивом заболевания, в отличие от пациентов с впервые выявленной БГ, отмечена достоверно большая распространенность сосочковых структур, лимфоидных фолликулов и подушек Сандерсона, а также выраженность лимфоидной инфильтрации.
Известно, что образование лимфоидных фолликулов связано с длительной антигенной стимуляцией и продукцией антитиреоидных антител плазматическими клетками [14]. Сравнительное исследование содержания интратиреоидных Т- и В-лимфоцитов в паренхиме ЩЖ, в зависимости от варианта течения заболевания, позволило установить выраженные отличия в группе пациентов с рецидивом БГ (табл. 3).
Обнаружено, что процентное количество цитотоксических Т-лимфоцитов у пациентов с рецидивом БГ значительно повышено: при рецидиве Ме=31,1% (22,341,6), у лиц с впервые выявленным заболеванием – Ме=12,6% (9,1-26,1), p<0,01. Также, в группе пациентов с рецидивом БГ в паренхиме ЩЖ повышено процентное содержание регуляторных Т-лимфоцитов (Ме=22,4%; 15,9-36,1, p<0,001) и Bl-клеток памяти (Ме=6,0%; 3,8-7,6, p<0,01), при снижении содержания Т-активированных лимфоцитов с фенотипом CD3+CD25+,цитотоксических активированных Т-клеток и популяции В1- лимфоцитов, в сравнении с уровнем, установленным у пациентов с впервые вы- явленным заболеванием. С помощью кор- реляционного анализа исследованы осо- бен-ности взаимосвязи между количеством Т-и B-лимфоцитов, и показателями, ха- рак-теризующими функцию и морфоло- гиче-скую структуру ЩЖ. Установлено, что только при рецидиве заболевания вы- являются отрицательные взаимосвязи между количеством интратиреоидных CD19+CD27+-лимфоцитов и концентрацией ТТГ (r=-0,97, р<0,001), и уровнем интра-тиреоидных CD3+CD4+-клеток и средней площадью ядер тиреоцитов (r=-0,79, р<0,001), а также одна положительная связь между содержанием интратиреоид-ных CD3+-клеток и концентрацией АТ к
ТПО (r=0,64, р < 0,001). У обследованных пациентов с впервые выявленной БГ взаимосвязей количества интратиреоидных Т-и В-лимфоцитов с другими исследуемыми показателями не обнаружено.
При исследовании особенностей фенотипического состава Т- и В- лимфоцитов в паренхиме ЩЖ пациентов с БГ было установлено, что интратирео- идный субпопуляционный состав клеток иммунной системы изменяется в зависи- мости от степени распространенности лимфоидных фолликулов. Так, в группе пациентов БГ с высокой распространенно- стью лимфоидных фолликулов в парен- химе ЩЖ наблюдалось уменьшение отно- сительно-го числа B-клеток памяти (1,81; 0,92–2,10, p<0,05), В2-лимфоцитов (8,69; 6,88-16,95, p<0,05), активированных Т- лимфоцитов (0,41; 0,15-1,1, p<0,01), а также активированных цитотоксических Т- клеток (CD3+CD8+CD25+) (0,57; 0,09–1,08, p<0,05) и Т-лимфоцитов-хелперов
(CD3 + CD4 + CD25 + ) (0,62; 0,39-0,92, p < 0,01).
Таблица 3
Содержание Т- и В-лимфоцитов (в %) в щитовидной железе у пациентов с впервые выявленной БГ и при рецидиве заболевания (Ме, Q 1 -Q 3 )
|
Показатели |
Впервые выявленная БГ; n=18 |
Рецидив БГ; n=40 |
P |
|
CD3+ |
55,3 (43,3 - 64,8) |
76,3 (57,4 - 84,6) |
< 0,001 |
|
CD3+CD4+ |
44,4 (41,7 - 58,4) |
43,9 (35,1 - 48,9) |
- |
|
CD3+CD8+ |
12,6 (9,1 - 26,1) |
31,1 (22,3 - 41,6) |
< 0,001 |
|
CD3+CD25+ |
4,0 (2,3 - 7,1) |
1,5 (0,3 - 3,9) |
< 0,001 |
|
CD3+CD4+CD25+ |
1,5 (0,9 - 3,0) |
0,5 (0,3 - 1,0) |
< 0,001 |
|
CD3+CD8+CD25+ |
1,3 (0,2 - 3,2) |
1,1 (0,4 - 2,1) |
- |
|
CD3+CD4+CD25highCD127low |
2,7 (0,6 - 3,9) |
22,4 (15,9 - 36,1) |
< 0,001 |
|
CD19+ |
14,8 (13,5 - 15,4) |
13,3 (10,4 - 19,0) |
- |
|
CD19 + CD27 - |
11,0 (8,7 - 17,0) |
7,3 (5,1 - 12,1) |
- |
|
CD19+CD27+ |
3,3 (2,3 - 3,4) |
6,0 (3,8 - 7,6) |
< 0,001 |
|
CD19 + CD5 - |
13,2 (10,6 - 16,7) |
12,8 (10,4 - 16,5) |
- |
|
CD19+CD5+ |
1,3 (1,0 - 2,6) |
0,4 (0,2 - 1,1) |
< 0,001 |
Многовариантность морфологических изменений ЩЖ при аутоиммунных тиреопатиях обуславливает сложность клинической интерпретации особенностей органоспецифического аутоиммунного процесса при БГ [11]. Проведенные ранее фундаментальные [4, 7, 9] исследования демонстрируют, что функционально-морфологическая оценка состояния тиреоцитов и выявленные гистологические изменения операционного материала ЩЖ при гипертиреозе аутоиммунного генеза должны быть интерпретированы не только с учетом неоднородности эпителиального компонента в разных участках железы и её стромы, но и проведенного консервативного лечения АТП.
Аутоиммунный характер БГ, наличие лимфоидной инфильтрации и сочетание ее с наличием клеток Аскинази позволило говорить о родстве этого заболевания с хроническим аутоиммунным тиреоидитом (АИТ) [11, 15]. Результаты нашего исследования согласуются с предположением ряда авторов о том, что при клиническом диагнозе БГ не исключается морфологическое сочетание двух аутоиммунных тиреопатий – АИТ и БГ одновременно [16-17]. Во многих работах было показано, что CD4+-клетки пациентов АИТ и БГ сенсибилизированы к интактным ти-реоцитам или отдельным тиреоидным антигенам (ТПО или рТТГ) [5, 18].
Выявленные изменения гистологической структуры ЩЖ и субпопуляционного состава интратиреоидных лимфоцитов в группе пациентов с рецидивом заболевания указывают на наличие органоспецифических нарушений иммунорегуляции при БГ, поддерживающих и усиливающих аутоиммунный процесс, независимо от длительности лечения АТП и степени компенсации гипертиреоза. В этом аспекте следует остановиться на оценке пролиферации и десквамации тиреоидного эпителия. Оба эти явления в настоящее время рассматриваются как проявление своеобразной морфодинамики или мор-фокинетики, являющейся отражением изменений функции железы [11, 14]. Высказано мнение, что основой десквамации, как клеточного деструктивного процесса, может быть механизм апоптоза [6, 15]. Причем, экспериментально подтверждено, что мигрировавшие в паренхиму ЩЖ Т-лимфоциты способны вызывать гибель клеток-мишеней не только путем некроза, но и путем индукции апоптоза [4]. Высокая распространенность лимфоидной инфильтрации существенно дополняет ранее полученные нами данные [19] о снижении содержания Т-регуляторных клеток (CD3+CD4+CD127LowCD25High) в периферической крови при БГ. Выявленное увеличение регуляторных Т-клеток в па- ренхиме ЩЖ в настоящем исследовании в группе пациентов с рецидивом заболевания с одной стороны объясняется эффекторными механизмами воздействия иммуноцитов на клетки-мишени при развитии гипертиреоза, но с другой стороны отражает тяжелый дефект специфических регуляторных Т-лимфоцитов, независимый от степени компенсации гипертиреоза и длительности антитиреоидной лекарственной терапии. Можно предположить, что тиреоидная клетка при БГ является объектом иммунологической атаки вследствие одномоментно протекающих двух процессов: снижения количества и генерализованной супрессорной функции Т-лимфоцитов, и прямой антигенспецифи-ческой цитотоксичности интратиреоид-ных лимфоцитов с фенотипом CD3+CD8+ и CD3+CD4+CD127LowCD25High на тиреоци-ты. Таким образом, миграция Т- лимфоцитов в ЩЖ может быть одним из морфологических признаков десквама- ции, как компенсаторного клеточно- деструктивного процесса перестройки ти- реоидной паренхимы.
Известно, что предоперационное применение АТП снижает уровень тиреоидных гормонов, что уже вторично уменьшает презентацию антигенов тире-оцитов интратиреоидным Т-лимфоцитам и тем самым продукцию АТ к рТТГ [14]. В то же время, увеличение количества реактивных клеток иммунной системы в паренхиме ЩЖ, в группе пациентов с низкой распространенностью лимфоидных фолликулов, может быть свидетельством регенерации сохранившегося фолликулярного эпителия и морфологическим проявлением уменьшения гормонопоэза. С другой стороны, нормализация функции ЩЖ должна была бы ослаблять сигнализацию тиреоцитов иммуноцитам и тем самым восстанавливать прежнее состояние иммунорегуляции, приводя к ремиссии. Но, выявленные закономерности морфокинетики ЩЖ в сочетании с ин-тратиреоидными иммунорегуляторными процессами, на фоне терапии АТП, свидетельствуют о деструкции патологически функционирующей тиреоидной паренхимы.
Интересно отметить, что АТП прерывают синтез тиреоидных гормонов и оказывают иммуносупрессивный эффект, избирательно накапливаясь в ЩЖ [1, 20]. Имеются сообщения о том, что АТП ингибируют образование свободных радикалов в клетках иммунной системы и, таким образом, снижают активность аутоиммунного процесса [21]. Тиамазол угнетает высвобождение простагландина E2, интерлейкина-альфа и интерлейкина-6 из тиреоци-тов [6]. Считают, что снижение содержания медиаторов воспаления уменьшает лимфатическую инфильтрацию ЩЖ ипо-следующее образование антитиреоид- ных антител, в том числе и TSAb [22]. Было показано, что выраженная лимфоцитар- ная инфильтрация и аутоиммунная деструкция тиреоидной паренхимы может приводить к развитию спонтанной ремиссии заболевания или индуцированному тиреостатической терапией гипотиреозу, что, также, может объяснять выявленные особенности кариометрии тиреоцитов и морфологические признаки АИТ при исследовании постоперационного материала ЩЖ у пациентов БГ в настоящем исследовании. Наконец, к перестройке тиреоидного эпителия, с признаками АИТ может приводить длительная терапия АТП и появление интратиреоидных АТ,
Список литературы Морфологические особенности фолликулов щитовидном железы и состав интратиреоидных лимфоцитов при болезни Грейвса
- Gallo D, Piantanida E, Gallazzi M, Bartalena L, Tanda ML, Bruno A, Mortara L. Immunological Drivers in Graves' Disease: NK Cells as a Master Switcher. Front Endocrinol (Lausanne). 2020;(32765422) Elpub. https://doi.org/10.3389/fendo.2020.00406
- Zdor VV, Tihonov YN. Immunnyeigistologicheskie izmeneniya v zhelezah vnutrennej sekrecii pri eksperimental'nom tireotoksikoze i gipotireoze. Klinicheskaya i eksperimental'naya tireoidologiya. 2015;10(1):55-60.
- Kahaly GJ, Diana T, Olivo PD. TSH receptor antibodies: relevance & utility. Endocr Pract. 2020;26(1):97-106. https://doi.org/10.4158/EP-2019-0363.
- Schlüter A, Eckstein AK, Brenzel A, Horstmann M, Lang S, Berchner-Pfannschmidt U, Banga JP, Diaz-Cano S. Noninflammatory Diffuse Follicular Hypertrophy/Hyperplasia of Graves Disease: Morphometric Evaluation in an Experimental Mouse Model. Eur Thyroid J. 2018;7(3):111-119. https://doi.org/10.1159/000488079.
- Volpé R. The immunomodulatory effects of anti-thyroid drugs are mediated via actions on thyroid cells, affecting thyrocyte-immunocytesignalling: a review. Curr Pharm Des. 2001;7(6):451-60. https://doi.org/10.2174/1381612013397898.
- Wiersinga WM. Graves' Disease: Can It Be Cured? Endocrinol Metab (Seoul). 2019;34(1):29-38. https://doi.org/10.3803/EnM.2019.34.1.29.
- De Leo S, Lee SY, Braverman LE. Hyperthyroidism. Lancet. 2016;388(10047):906-918. https://doi.org/10.1016/S0140-6736(16)00278-6.
- Rapoport B, McLachlan SM. Graves' hyperthyroidism is antibody-mediated but is predominantly a Th1-type cytokine disease. J Clin Endocrinol Metab. 2014;(25210884). Elpub. https://doi.org/10.1210/jc.2014-3011.
- Ricci D, Brancatella A, Marinò M, Rotondi M, Chiovato L, Vitti P, Latrofa F. The Detection of Serum IgMs to Thyroglobulin in Subacute Thyroiditis Suggests a Protective Role of IgMs in Thyroid Autoimmunity. J Clin Endocrinol Metab. 2020;(31996918). Elpub. https://doi.org/10.1210/clinem/dgaa038.
- Troshina EA, Sviridenko NY, Vanushko VE, Rumyancev PO, Fadeev VV, Petunina NA. Federal'nye klinicheskie rekomendacii po diagnostike i lecheniyu toksicheskogo zoba. 2014;10(3):8-19. https://doi.org/10.14341/probl201460667-77.
- Hmel'nickij OK. Gistologicheskaya diagnostika neopuholevyh zabolevanij shchitovidnoj zhelezy: Posobie dlya vrachej. SPb.: SPbMAPO, 1999. 56s.
- Kudryavcev IV, Subbotovskaya AI. Opyt izmereniya parametrov immunnogo statusa s ispol'zovaniem shesticvetnogo citofluorimericheskogo analiza. Medicinskaya immunologiya. 2015;17(1):19-26. https://doi.org/10.15789/1563-0625-2015-1-19-26.
- Maecker HT, McCoy JP, Nussenblatt R. Standardizing immunophenotyping for the Human Immunology Project. Nat Rev Immunol. 2012;12(3):191-200. https://doi.org/10.1038/nri3158.
- Yin Q, Jin Z, Zhou Y, Song D, Fu C, Huang F, Wang S. lncRNA: mRNA expression profile in CD4+ T cells from patients with Graves' disease. Endocr Connect. 2020;9(12):1202-1211. https://doi.org/10.1530/EC-20-0373.
- Skov J, Calissendorff J, Eriksson D, Magnusson P, Kämpe O, Bensing S, Kuja-Halkola R. Limited Genetic Overlap Between Overt Hashimoto's Thyroiditis and Graves' Disease in Twins: A Population-based Study. J Clin Endocrinol Metab. 2021;106(4):1101-1110. https://doi.org/10.1210/clinem/dgaa956.
- Saprina TV, Prohorenko TS, Martynova SY, Dzyuman AN, Zima AP, Popova OS, Hluzov IA, Latipova VI, Ryazanceva IV. Disbalans sistemy «ligand receptor» faktora nekroza opuholej-α i ekspressiya TNF-RI v tkani shchitovidnoj zhelezy u pacientov s bolezn'yu Grejvsa. Klinicheskaya i eksperimental'naya tireoidologiya. 2013;9(3):56-65.
- Gonzalez-Aguilera B, Betea D, Lutteri L, Cavalier E, Geenen V, Beckers A, Valdes-Socin H. Conversion to Graves disease from Hashimoto thyroiditis: a study of 24 patients. Arch Endocrinol Metab. 2018;62(6):609-614. https://doi.org/10.20945/2359-3997000000086.
- Xiaoheng C, Yizhou M, Bei H, Huilong L, Xin W, Rui H, Lu L, Zhiguo D. General and Specific Genetic Polymorphism of Cytokines-Related Gene in AITD. Mediators Inflamm. 2017;(28133421). Elpub. https://doi.org/10.1155/2017/3916395.
- Savchenko AA, Dudina MA, Borisov AG, Dogadin SA, Kudryavcev IV, Moshev AV, Man'kovskij VA. Vliyanie helpernyh i regulyatornyh T-kletok na fenotipicheskij sostav B-limfocitov krovi i tkani shchitovidnoj zhelezy pri bolezni Grejvsa. Medicinskaya immunologiya. 2018;20(3):431-438. https://doi.org/10.15789/1563-0625-2018-3-431-438.
- Žarković M, Wiersinga W, Perros P, Bartalena L, Donati S, Okosieme O, Morris D, Fichter N, Lareida J, Daumerie C, Burlacu MC, Kahaly GJ, Pitz S, Beleslin B, Ćirić J, Ayvaz G, Konuk O, Törüner FB, Salvi M, Covelli D, Curro N, Hegedüs L, Brix T; EUGOGO (European Group on Graves’ Orbitopathy). Antithyroid drugs in Graves' hyperthyroidism: differences between «block and replace» and «titration» regimes in frequency of euthyroidism and Graves' orbitopathy during treatment. J Endocrinol Invest. 2021;44(2):371-378. https://doi.org/10.1007/s40618-020-01320-7.
- Abdi H, Amouzegar A, Azizi F. Antithyroid Drugs. Iran J Pharm Res. 2019;18(1):1-12. https://doi.org/10.22037/ijpr.2020.112892.14005.
- Langenstein C, Schork D, Badenhoop K, Herrmann E. Relapse prediction in Graves´ disease: Towards mathematical modeling of clinical, immune and genetic markers. Rev Endocr Metab Disord. 2016;17(4):571-581. https://doi.org/10.1007/s11154-016-9386-8.
- Fathima N, Narne P, Ishaq M. Association and gene-gene interaction analyses for polymorphic variants in CTLA-4 and FOXP3 genes: role in susceptibility to autoimmune thyroid disease. Endocrine. 2019;64(3):591-604. https://doi.org/10.1007/s12020-019-01859-3.
- Cui Z, Wang Z, Liu X, Cai Y, Xu X, Yang T. Establishment of clinical diagnosis model of Graves' disease and Hashimoto's thyroiditis. J Transl Med. 2019;(30616573). Elpub. https://doi.org/10.1186/s12967-018-1765-3.


