Морфологические особенности грануляционной ткани, формирующейся при чрескостном остеосинтезе и воздействии лазерного излучения
Автор: Ирьянов Юрий Михайлович, Ирьянова Татьяна Юрьевна, Дюрягина Ольга Владимировна, Ирьянова Вера Николаевна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2011 года.
Бесплатный доступ
В эксперименте на половозрелых линейных крысах при помощи методов световой и электронной микроскопии и морфометрии исследовано влияние импульсного инфракрасного лазерного излучения в терапевтическом режиме на грануляционную ткань, формирующуюся в костномозговой полости при заживлении перелома большеберцовой кости в условиях чрескостного остеосинтеза. Отмечены уменьшение воспаления, увеличение объема грануляционной ткани, активизация фибриллогенеза и репаративного интрамурального ангиогенеза. Под действием лазера усиливается пролиферация эндотелиоцитов и перицитов, образуются сосудистые почки роста, эндотелиальные выросты и эндовазальные разрастания, локализующиеся в просвете сосудов и в интрамуральных каналах. Впервые выявлен характерный поверхностный микрорельеф эндовазальных разрастаний, образованный черепицеобразно расположенными перицитами. В результате интенсивного капиллярообразования количество сосудов в единице площади среза грануляционной ткани в опыте достоверно увеличивается, а диаметр просвета сосудов уменьшается по сравнению с контролем. Полученные данные являются основанием для проведения дальнейших исследований в этом направлении с целью разработки клинических рекомендаций по стимуляции ангиогенеза и использования прогениторных клеток грануляционной ткани костномозговой полости в клеточных технологиях.
Грануляционная ткань, чрескостный остеосинтез, инфракрасный лазер, интрамуральный ангиоге-нез, клеточные технологии
Короткий адрес: https://sciup.org/142121383
IDR: 142121383
Текст научной статьи Морфологические особенности грануляционной ткани, формирующейся при чрескостном остеосинтезе и воздействии лазерного излучения
Лазерные и клеточные технологии все более широко применяются в таких высокотехнологичных областях медицины, как травматология и ортопедия, сердечно-сосудистая хирургия, нейрохирургия, косметология, нефрология [1, 2, 5, 6]. Стволовые и прогениторные клетки костного мозга используются для лечения ишемии конечностей, ожоговых повреждений кожи, костнохрящевых дефектов, трофических язв, свищей, ран разной этиологии, инфаркта миокарда, почечной недостаточности, травм спинного и головного мозга [8, 9, 12]. Активно развиваются клеточные технологии, основанные на использовании в клинических целях «взрослых» стволовых клеток костного мозга, жировой ткани, пу- повинной, плацентарной и периферической крови [7, 10, 11, 13]. Грануляционная ткань, формирующаяся в костномозговой полости при заживлении костных ран, в качестве одного из возможных источников мультипотентных мезенхимальных клеток не рассматривалась, хотя она представляет особый интерес в связи с тем, что предшественниками большинства макрофагов и фибробластов в очаге воспаления и заживления ран являются прогениторные клетки костного мозга [3]. Сведения о действии лазерного излучения на структуры костного мозга единичны и касаются преимущественно влияния гелий-неонового лазера. Грануляционная ткань, формирующаяся при заживлении костных ран в условиях чреско- стного остеосинтеза и воздействия лазерного излучения, исследована недостаточно. Цель работы – анализ морфологических особенностей грануляционной ткани, формирующейся при за- живлении перелома кости в условиях чрескост-ного остеосинтеза и воздействия низкоэнергетического импульсного инфракрасного лазерного излучения.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на 10 половозрелых крысах линии Вистар в контрольной и опытной группах (по 5 животных в каждой группе). Условия содержания и кормления животных соответствовали «Санитарным правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник», утвержденным Приказом МЗ СССР № 1179 от 10.10.83 г. Экспериментальные исследования выполнялись с соблюдением правил гуманного обращения с животными (Report of the AVMA Panel on Euthanasia JAVMA, 2001).
Под общей анестезией у крыс моделировали закрытый перелом большеберцовой кости в области средней трети диафиза и проводили операцию чрескостного остеосинтеза, используя разработанное нами устройство (рис. 1). Рентгеновский контроль осуществляли аппаратом АРД-2 (рис. 2). Животных опытной группы через 1 сутки после операции подвергали воздействию импульсного инфракрасного лазерного излучения на лазерном терапевтическом аппарате «Узор-А-2К» (длина волны 0,89±0,02 мкм, частота импульсов 150 Гц, мощность - 4 Вт). На зону перелома и затылочнотеменную область накожно проводили 3 сеанса облучения по 5 минут через 1 сутки. Крысы, оперированные, но не подвергавшиеся воздействию лазерного излучения, служили контролем.
Через 7 суток после операции животных опытной и контрольной групп эвтаназировали. Оперированные большеберцовые кости фиксировали в 2 % растворе параформальдегида и глутаральдегида, декальцинировали и заливали в парафин. Продольные срезы толщиной 4-6 мкм окрашивали гематоксилином-эозином и пикрофуксином по Ван Гизону. Часть материала исследовали в сканирующем электронном микроскопе JSM-840 (Япония). Для морфофункциональной оценки сосудистого русла грануляционной ткани на сканирующих электронограммах при инструментальном увеличении 1000 в единице площади среза
0,01 мм2 определяли количество сосудов и средний диаметр их просвета. Количественные данные подвергали статистической обработке с использованием пакета статистических программ «Microsoft Office Excel 2003».

Рис. 1. Устройство для чрескостного остеосинтеза на голени крысы
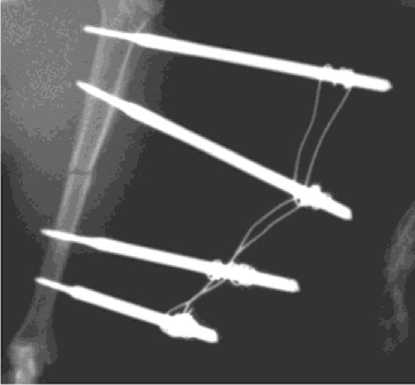
Рис. 2. Контрольная рентгенограмма голени крысы сразу после перелома большеберцовой кости и операции чрескостного остеосинтеза
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
У контрольных животных через 7 суток после операции в костной ране отмечается воспалительная реакция с формированием инфильтрата, представленного преимущественно нейтрофильными элементами, лимфоцитами и макрофагами. В ин-термедиарных зонах регенерата располагаются лейкоцитарно-некротические массы, содержащие лизированные клетки, волокна и пласты фибрина. Большинство нейтрофильных лейкоцитов в этой области находится в состоянии лейкоклазии. В просветах сосудов содержатся преимущественно эритроциты и единичные лейкоциты. Отмечается слабовыраженный лейкодиапедез. В эндостальных и центральных участках костномозговой полости, примыкающих к области перелома, формируется грануляционная ткань, в которой располагаются расширенные неправильной формы фестончатые капилляры синусоидного типа с неравномерным кровенаполнением, диаметр которых существенно превышает диаметр обычных капил- ляров. Стенка новообразованных капилляров утолщена, отечна, пропитана плазмой крови. На отдельных участках выявляются микроциркуля-торные расстройства, такие как эритростаз, лейко-стаз, микротромбоз, периваскулярный отек (рис. 3). В центральных участках костномозговой полости в зоне перелома отмечается незначительная периваскулярная пролиферация фибробластоподобных клеток, фибриллогенез и формирование тонких коллагеновых волокон и их пучков, не имеющих какой-либо преимущественной ориентации. Перифибриллярная клеточная реакция выражена слабо. В промежутках между волокнистыми структурами наблюдаются скопления свободно расположенных экстравазальных эритроцитов и выход плазмы крови вследствие повышенной проницаемости стенок сосудов. Количество сосудов в единице площади 0,01 мм2 грануляционной ткани в контроле составляет 1,65±0,07, диаметр просвета сосудов – 42,75±2,05 мкм.
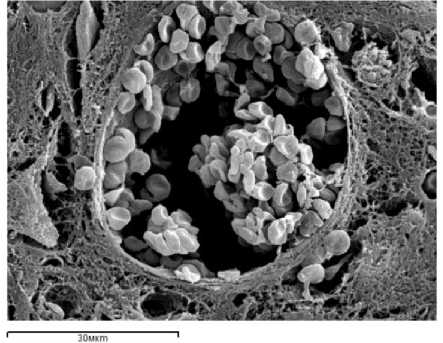
Рис. 3. Грануляционная ткань контрольного животного. Умеренная эктазия синусоида, формирование пристеночных микротромбов, отек периваскулярного пространства, выход из сосудистого русла эритроцитов и лейкоцитов. Периваскулярные клетки единичны. Сканирующая электронная микроскопия
В опытной группе животных в костной ране отмечены морфологические признаки уменьшения воспаления и начала репаративнорезорбтивных процессов. Грануляционная ткань заполняет практически полностью всю поврежденную область костного мозга и разрастается на значительном протяжении в костномозговую полость отломков. При этом в зоне перелома формируется соединительнотканное сращение. В интермедиарных и медуллярных участках регенерата некротический детрит полностью отсутствует. Несмотря на значительное уменьшение общего количества лейкоцитов, вокруг отдельных сосудов выявляются лейкоцитарные муфты, свидетельствующие о сохранении лейкоцитарной активности. В грануляционной ткани располагаются многочисленные группы малодифференцированных клеток, малые и большие круглые, эпителиоидные клетки, большое количество капилляров синусоидного типа, во- круг которых отмечается выраженная пролиферация перицитов (рис. 4).
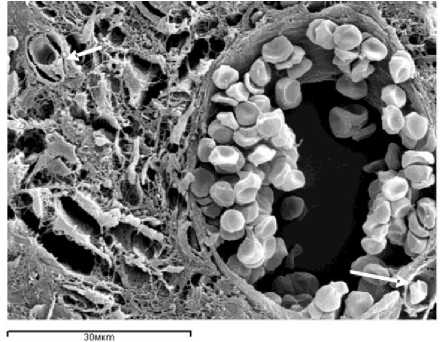
Рис. 4. Грануляционная ткань животного опытной группы. Образование капиллярных почек роста и эндовазальных разрастаний (стрелки). Появление многочисленных периваскуляроцитов. Сканирующая электронная микроскопия
В периваскулярных пространствах грануляционной ткани животных опытной группы наряду с многочисленными макрофагами выявляются фибробластоподобные элементы различной степени дифференцировки – от эпителиоидных до фибробластов и остеобластов с морфологическими признаками высокой функциональной активности, о чем свидетельствует активный фибриллогенез в перицеллюлярных пространствах. В таких участках выявляется мелкопетлистая фибриллярная сеть и извитые тонкие пучки коллагеновых волокон. Формируются и более толстые пучки волокон, входящих в состав новообразованных костных трабекул, которые разделены инфильтратами из лимфоидных клеток и экстравазальных эритроцитов. В грануляционной ткани встречаются единичные тканевые базофилы, лимфоциты и плазматические клетки. Полиморфноядерные нейтрофилы немногочисленны. Наблюдается пролиферация эндотелиальных клеток, которые формируют сосудистые почки микроциркуля-торного русла. Камбиальные клетки грануляционной ткани опытных животных метаболически высоко активны, содержат большие ядра и ядрышки; иногда в них видны фигуры митоза.
Одной из характерных особенностей воздействия инфракрасного лазерного излучения на грануляционную ткань, формирующуюся в костномозговой полости при заживлении перелома в условиях чрескостного остеосинтеза, является выраженная активизация репаративного интрамурального ангиогенеза, о чем свидетельствует интенсивное капиллярообразование и формирование многочисленных эндотелиальных выростов, образующих капиллярные почки и эндовазальные разрастания, локализующиеся в просвете сосудов и в интрамуральных каналах (рис. 5, 6). В результате количество сосудов в единице площади среза гра- нуляционной ткани в опыте увеличивается до 2,86±0,15 (р<001), а диаметр просвета сосудов, напротив, уменьшается до 32,45±1,51 мкм (р<001) по сравнению с контролем.
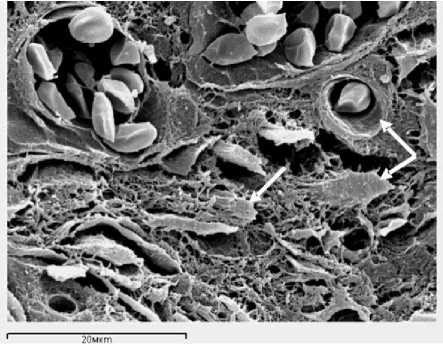
Рис. 5. Грануляционная ткань животного опытной группы. Интенсивный капиллярогенез, появление многочисленных капиллярных и эндотелиальных выростов (стрелки). Сканирующая электронная микроскопия

Рис. 6. Участок интрамурального ангиогенеза в грануляционной ткани животного опытной группы. Эндотелиальные выросты (стрелки) в интрамуральных каналах. Сканирующая электронная микроскопия
Эндовазальные разрастания имеют толщину 810 мкм и характерный микрорельеф поверхностного слоя (рис. 6, 7), который образован плоскими отростками перицитов, располагающимися по поверхности эндотелиального тяжа черепицеобразно, с ориентацией свободного края клеток к вершине разрастания, что обусловлено хемотакси- сом и хемокинезом перицитов [4]. Часть эндовазальных разрастаний канализируется и превращается в капилляры.

Рис. 7. Канализированный эндотелиальный вырост, окруженный плоскими отростками перицитов (стрелки), которые перекрывают друг друга (черепичное перекрытие) в интрамуральном канале грануляционной ткани опытного животного. Сканирующая электронная микроскопия
Таким образом, локальное воздействие инфракрасного лазерного излучения на зону перелома на ранних этапах чрескостного остеосинтеза вызывает существенные структурные изменения грануляционной ткани, формирующейся в костномозговой полости. Уменьшается воспаление, увеличивается объем регенерата, активизируется фиб-риллогенез и репаративный интрамуральный ангиогенез. Под действием лазера усиливается пролиферация эндотелиоцитов и перицитов, активизируется образование сосудистых почек, эндотелиальных выростов и эндовазальных разрастаний, формируются сосудистые интрамуральные каналы. В результате интенсивного капиллярообразо-вания количество сосудов в грануляционной ткани в опыте достоверно увеличивается, а диаметр просвета сосудов уменьшается по сравнению с контролем. Полученные данные являются основанием для проведения дальнейших исследований с целью разработки клинических рекомендаций по использованию прогениторных клеток грануляционной ткани костномозговой полости в методах клеточной трансплантологии и тканевой инженерии, в частности для стимуляции ангиогенеза.


