Морфологические особенности миокарда при экспериментальном сахарном диабете и его фармакологической коррекции мефаргином
Автор: Тюренков Иван Николаевич, Смирнов Алексей Владимирович, Бакулин Дмитрий Александрович, Великородная Юлия Ивановна
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 4 (76), 2022 года.
Бесплатный доступ
При экспериментальном моделировании сахарного диабета обнаружено развитие фиброзирования и гипертрофии миокарда левого желудочка сердца, что рассматривается как морфологическое проявление диабетической кардиомиопатии. Наблюдаемое под влиянием мефаргина снижение степени выраженности патологических изменений в миокарде левого желудочка выражается в снижении доли соединительной ткани и периваскулярного фиброза, снижению выраженности гипертрофии, что реализуется, по-видимому, благодаря протективному влиянию препарата на эндотелий кровеносных сосудов миокарда.
Сахарный диабет, кардиомипатия, мефаргин
Короткий адрес: https://sciup.org/142236027
IDR: 142236027 | УДК: 616-005.4:611.813.14:616-092.9
Текст научной статьи Морфологические особенности миокарда при экспериментальном сахарном диабете и его фармакологической коррекции мефаргином
Заболеваемость и смертность от сахарного диабета (СД) представляет собой мировую медицинскую проблему, согласно прогнозу ВОЗ и данным Международной диабетической федерации (IDF) распространенность СД достигнет 10,4% (642 миллиона) к 2040 г. Диабетические макро- и микроангиопатии играют ведущую роль в развитии диабетических кардиальных осложнениях, диабетической кардиомиопатии (ДКМП) и хронической сердечной недостаточности, в т.ч. включаясь в общий патогенез коморбидной патологии [1,4,6].
В основе связи диабета и сердечной недостаточности лежит не только осложнение СД в виде ишемии миокарда, но и метаболические нарушения, такие как токсичность глюкозы и липотоксичность на фоне инсулинорезистентности, дисфункции эндотелия сосудов, нарушения микроциркуляции, и капиллярная недостаточность [8].
Показано, что запущенное гипергликемией нарушение обмена веществ при СД может вести к эндотелиальной дисфункции, окислительному стрессу, нарушению проницаемости стенок капилляров, за счет процессов гликирования белков, что приводит к нарушению обмена веществ [5].
На более поздних стадиях диабетической кардиомиопатии обнаруживается гипертрофия ЛЖ и прогрессирующая диастолическая и систолическая дисфункция сердца, сопровождающейся снижением фракции выброса и сердечной недостаточностью. Кроме того, длительное воздействие окислительного стресс приводит к запуску механизмов хронического воспаления и фиброзированию миокарда [6].
Диабетические кардиальные осложнения приводят к острой необходимости эффективного лечения. Однако классические сахароснижающие методы лечения в целом оказывают нейтральное влияние на смертность от сердечно-сосудистых заболеваний при диабете и иногда даже усугубляют сердечную недостаточность [10].
Разработанный препарат мефаргин, проявляющий выраженные эндотелиопротективные свойства, улучшающий эндотелиальную функцию за счет повышения выработки NO эндотелием, представляет собой новый класс эндоте-лиопротективных средств, которые могут быть использованы при комплексном лечении СД на фоне применения противодиабетических препа- ратов [2].
Цель. Оценить морфологические особенности миокарда при экспериментальном сахарном диабете и его фармакологической коррекции ме-фаргином.
Методика исследования
Экспериментальное исследование проведено на 30 белых беспородных лабораторных крысах-самках, в возрасте 12 мес. Животные содержались в условиях вивария (ГОСТ Р 518492001) со свободным доступом к питьевой воде и пище (ООО «Лабораторкорм», Москва). В качестве патологии была выбрана экспериментальная модель, рекомендованная для изучения отдаленных последствий сахарного диабета, в которой с целью формирования осложнений СД используют крыс со стрептозотоциновым диабетом длительностью 6 месяцев. Стрепто-зотоцин-индуцированный СД моделировали однократным внутрибрюшинным введением растворенного в цитратном буфере (0,1 М, рН 4,5) стрептозотоцина («Sigma», США) в дозе 60 мг/ кг после 48-часовой пищевой депривации. В исследование брали животных с уровнем тощако-вой (забор корма за 4 часа до измерения) гликемии ≥ 15 ммоль/л через 3 дня и 6 месяцев после инъекции [3]. Для измерения уровня гликемии использовали глюкометр Contour TS и соответствующие тест-полоски (Bayer). Кровь для измерений забирали при пункции подъязычной вены. Лечение начинали через 6 месяцев после моделирования СД. Исследуемое производное ГАМК – мефаргин вводили перорально в течение 30 дней в дозе 20 мг/кг. Группе негативного контроля вводили физиологический раствор (крысы с СД без лечения). В качестве позитивного контроля использовали крыс без СД (интактных) той же партии животных.
После курсового лечения у наркотизированных (хлоралгидрат, 400 мг/кг, внутрибрюшинно) животных проводили забор образцов тканей левого желудочка сердца. Образцы тканей левого желудочка сердца проводили у наркотизированных (хлоралгидрат, 400 мг/кг, внутрибрюшинно) животных. Материал фиксировали в течение 24 часов в 10% растворе нейтрального забу-ференного формалина (pH 7,4), обезвоживали и заливали в парафин по общепринятой гистологической методике. На роторном микротоме изготавливали срезы толщиной 4-5 мкм. Окра- шивали парафиновые срезы гематоксилином и эозином, трихромом по Массону.
Гистологические срезы фотографировали цифровой камерой AxioCam 305 color (Carl Zeiss Microscopy GmbH, Германия) на базе микроскопа AxioImager A2 (Carl Zeiss Microscopy GmbH, Германия) с использованием объективов х10, х20, х40. Средний диаметр кардиомиоцитов (мкм) определяли помощью морфометрического метода исследования в произвольно выбранных областях левого желудочка с использованием программного обеспечения Zeiss Zen Pro 2.3 2021 (Carl Zeiss Microscopy GmbH, Германия).
Статистическую обработку данных проводили с использованием пакета программы «Statistica 10.0» (USA). Проверку выборки на нормальность проводили с помощью теста Колмогорова-Смирнова. Сравнение двух независимых выборок проводили непараметрическим методом (парный тест Манна-Уитни). Сравнение трех и более независимых выборок проводили непараметрическим методом (критерий Краске-ла-Уоллиса с посттестом Данна). Гипотезу о существовании различий между выборками принимали при уровне р<0,05.
Результаты и их обсуждение
У животных с сахарным диабетом, не получавших лечения, была выявлены дистрофические изменения в кардиомицитах и гипертрофия миокарда левого желудочка. Преобладали гипертрофированные кардиомиоциты, встречались участки с клетками, диаметр которых близок к норме, встречались отдельные мышечные клетки с признаками отека.
Было выявлено увеличение доли фиброзной соединительной ткани в миокарде. По сравнению с интактным контролем (рисунок 1) в миокарде крыс с экспериментальным сахарным диабетом отмечалось фиброзирование, увеличение доли соединительной ткани в периваскулярном и интерстициальном компартментах. Определялось очаговое выраженное капиллярное и венозное полнокровие, незначительный периваскулярный и интерстициальный отек. В некоторых случаях более выраженный очаговый фиброз миокарда наблюдался в субэндокардиальных отделах, был менее выражен в миокарде правого желудочка и сопровождался умеренно выраженной лимфоидной инфильтрацией областей фиброза (рисунок 2).
При проведении морфометрического исследования отмечалось статистически значимое увеличение среднего диаметра кардиомиоцитов на 74,1% (при p<0,001) по отношению к группе интактного контроля. Средний диаметр кардиомиоцитов левого желудочка у животных с сахарным диабетом составил 16,55±3,04 мкм (ме- диана 16,40 [14,11783; 18,42735]), аналогичный показатель у интактных крыс - 9,51±1,89 мкм (медиана 9,41 [8,32797; 10,74161]).
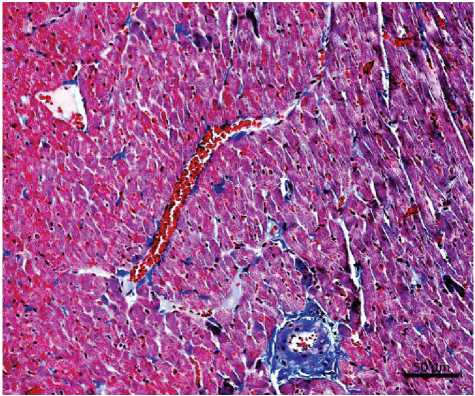
Рисунок 1. Строение миокарда левого желудочка интактной крысы.
Окраска трихромом по Массону.
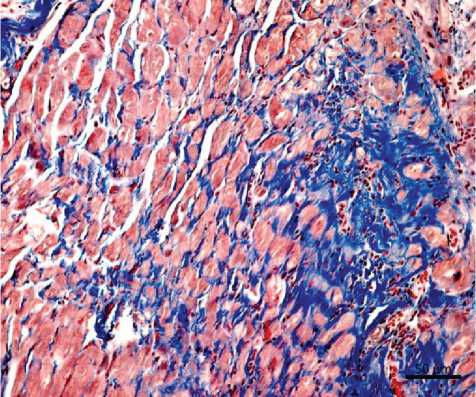
Рисунок 2. Строение миокарда левого желудочка крысы с экспериментальным сахарным диабетом.
Окраска трихромом по Массону.
У животных, получавших мефаргин, было отмечено менее выраженное фиброзирование миокарда за счет меньшего разрастания периваскулярной соединительной ткани, по сравнению с группой сахарного диабета. В кардиомиоцитах определялась хорошо выраженная поперечная исчерченность, наряду с наличием дистрофических изменений. Наблюдалось умеренное фиброзирование в периваскулярных отделах.
При проведении морфометрического исследования у животных с сахарным диабетом, получавших мефаргин, отмечалось статистически
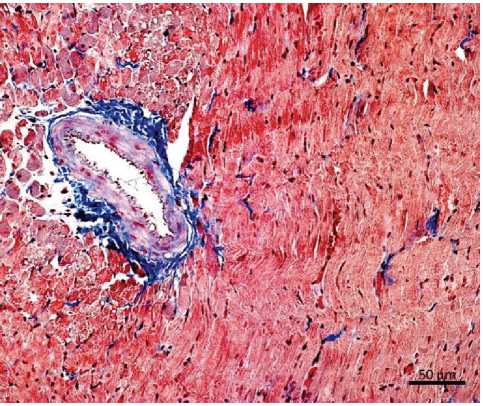
Рисунок 3. Строение миокарда левого желудочка крысы с экспериментальным сахарным диабетом, получавших мефаргин.
Окраска трихромом по Массону.
значимое снижение среднего диаметра кардиомиоцитов на 22,0% (при p<0,001) по отношению к группе животных с сахарным диабетом без лечения, однако было выявлено увеличение среднего диаметра кардиомиоцитов на 35,8% (при p<0,001) по отношению к группе интактного контроля. Средний диаметр кардиомиоцитов левого желудочка у животных с сахарным диабетом, получавших мефаргин, составил 12,91±2,39 мкм (медиана 12,73 [11,06113; 14,28153]).
Обнаруженная морфологическая картина свидетельствует о развитии очагового фиброза и гипертрофии миокарда левого желудочка сердца при экспериментальном СД. Протектив-ное влияние мефаргина на миокард левого желудочка, по нашему мнению, реализуется посредством протективного влияния препарата на эндотелий кровеносных сосудов миокарда, что способствуют снижению доли соединительной ткани и периваскулярного фиброза, снижению выраженности гипертрофии. Считается, что эндотелиальная дисфункция является ключевым фактором в развитии ДКМП и реализуется посредством влияния на эндотелий ряда патогенных факторов: гипергликемии, снижения уровня оксида азота, оксидативного стресса, ПОЛ, активации механизмов воспаления и повреждения барьерных функций [7], протекция эндотелия сосудов сердца может способствовать большей сохранности миокарда и снижению выраженности ДКМП при сахарном диабете, что подтверждает результаты нашего исследования. Однако исследования фиброза миокарда при моделировании ДКМП утверждают, что повреждение эндотелия способствует снижению степени ангиогенеза и фиброза в миокарде при СД [9].
ЗАКЛЮЧЕНИЕ
Таким образом, при экспериментальном моделировании СД обнаружено развитие фиброзирования и гипертрофии миокарда левого желудочка сердца, что рассматривается как морфологическое проявление ДКМП. Наблюдаемое под влиянием мефаргина снижение выраженности патологических изменений в миокарде левого желудочка, по нашему мнению, реализуется посредством протективного влияния препарата на эндотелий кровеносных сосудов миокарда. Изучение роли эндотелиальной дисфункции в патогенезе ДКМП требует дальнейшего углубленного анализа молекулярных механизмов.
Работа выполнена при финансовой поддержке гранта РНФ № 21-15-00192
Список литературы Морфологические особенности миокарда при экспериментальном сахарном диабете и его фармакологической коррекции мефаргином
- Патологическая анатомия коронавирусной инфекции в современных условиях /А.В. Смирнов, А.И. Бисинбекова, Н.В. Григорьева [и др.] // Волгоградский научно-медицинский журнал. 2021. № 4. С. 5-11.
- Роль NO-ергической системы в регуляции углеводного обмена и развитии сахарного диабета /Д.В. Куркин, Е.Е. Абросимова, Д.А. Бакулин [и др.] // Успехи физиологических наук. 2022. Т. 53. № 1. С. 88-104.
- Руководство по проведению доклинических исследований лекарственных средств. Часть первая /Под ред. А.Н. Миронова. - М.: Гриф и К., 2013. - 944 с.
- COVID-19 у молодых пациентов с коморбидной патологией на фоне иммуносупрессии (случай из практики) /В. В. Ермилов, А. В. Смирнов, Н. А. Дорофеев [и др.] // Вестник Волгоградского государственного медицинского университета. 2021. № 1 (77). С. 84-88.
- Hu X., Bai Т., Xu Z. Pathophysiological fundamentals of diabetic cardiomyopathy // Compr Physiol. 2017;7:693-711.
- Jia G., Hill M.A., Sowers J.R. Diabetic cardiomyopathy: an update of mechanisms contributing to this clinical entity. Circ Res. 2018;122(4):624-638.
- Knapp M., Tu X., Wu R. Vascular endothelial dysfunction, a major mediator in diabetic cardiomyopathy // Acta Pharmacol Sin. 2019 Jan;40(1):1-8.
- Pathophysiology and Treatment of Diabetic Cardiomyopathy and Heart Failure in Patients with Diabetes Mellitus /K. Nakamura, T. Miyoshi, M.Yoshida, [et al.] //Int. J. Mol. Sci. 2022, 23, 3587.
- Selective deletion of endothelial cell calpain in mice reduces diabetic cardiomyopathy by improving angiogenesis /Teng X., Ji C., Zhong H. [et al.] // Diabetologia. 2019 May;62(5):860-872.
- Udell J.A., Cavender M.A., Bhatt D.L. Glucose-lowering drugs or strategies and cardiovascular outcomes in patients with or at risk for type 2 diabetes: a meta-analysis of randomised controlled trials // Lancet Diabetes Endocrinol. 2015;3:356-366.


