Морфологические особенности регенерации поврежденного нерва в условиях дозированного растяжения
Автор: Щудло Н.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2006 года.
Бесплатный доступ
С целью исследования особенностей регенерации поврежденного нерва в условиях дозированного растяжения проведены опыты на 80 собаках. В группе "опыт 1" (n = 22) выполнена резекция седалищного нерва, сближение его концов за счет сгибания коленного сустава и микрохирургический эпиневральный или эпи-периневральный шов1; в послеоперационном периоде осуществляли компенсацию дефекта удлинением сшитого нерва путем постепенного изменения положения в суставе, фиксированном аппаратом Илизарова. В группе "опыт 2" (n=27) после остеотомии или резекции участка диафиза бедренной кости осуществлен остеосинтез спице-стержневым аппаратом, после чего выполнено пересечение или резекция участка седалищного нерва и микрохирургический шов; в послеоперационном периоде проводили дистракцию. Контрольные эксперименты включали замещение резекционного дефекта нерва аутологичным трансплантатом (n = 8) и шов "конец в конец" после нейротомии без резекции (n = 23). Морфологические исследования, выполненные в сроки от 2 недель до 2 лет после операции, показали, что эффективность разработанных на основе метода Илизарова способов возмещения дефектов нервов у собак сопоставима с результатами нейроррафии2 "конец в конец" в опытах без дефекта, а в отдельных случаях превышает и.х., что следует интерпретировать как проявление морфогенетического эффекта дозированного растяжения. Дистракционный минифасцикулярный регенерат, формирующийся при осложнениях данного метода, обеспечивает частичное морфо-функциональное3 восстановление, сравнимое с результатами аутопластики. 1, 2, 3 - Авторский вариант написания.
Нерв, регенерация, аутонейропластика, дозированное растяжение
Короткий адрес: https://sciup.org/142120911
IDR: 142120911
Текст научной статьи Морфологические особенности регенерации поврежденного нерва в условиях дозированного растяжения
Повреждения нервов вызывают серьёзные и нередко стойкие функциональные расстройства. Несмотря на высокие регенераторные потенции аксонов периферической нервной системы, при полных анатомических перерывах нервов возникают показания для оперативного вмешательства, направленного на точное сопоставление рассечённых пучков нервных волокон. Это важнейшее условие для оптимальной регенерации, но нередко и оно оказывается недостаточным для полноценного восстановления утраченных функций.
Пересечение нерва включает повреждение множества нервных клеток с ампутацией и необратимой утратой значительной части аксоплазмы, а также разрушение микроокружения нервных волокон, обеспечиваемого эндо-, пери- и эпиневральными оболочками. Чтобы восстановить исходный объём аксоплазмы, нейроны затрачивают колоссальные усилия на вторичную экстензию повреждённых периферических отростков и восстановление функциональных связей с органами-мишенями. Регуляция этого процесса заключается в сложнейших взаимодействиях между рекапитуляциями генетических программ развития, заложенных в телах нейронов, локальными клеточными реакциями и молекулярнобиологическими событиями, ориентирующими и поддерживающими аксональные выросты на протяжении всего регенерационного пути от зоны повреждения до органов-мишеней.
Одна из концепций теории морфогенеза постулирует, что направленность роста нервных волокон определяется также и механическими факторами [1]. Эта концепция подтверждена in vitro: если среду культуры нейробластов ориентировать путём растяжения, нервные волокна растут упорядоченно. Мы предположили, что применение аппарата и метода Илизарова позволяет воспроизвести указанный эффект в зрелом живом организме и оптимизировать регенерацию нерва после травматического дефекта, что определило цель исследования.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперименты выполнены на 80 собаках, которые были распределены на две опытные группы и две контрольные. Методика эксперимента в группе "опыт 1" (n=22) включала резекцию седалищного нерва, сближение его концов за счет сгибания коленного сустава и микрохирургический эпиневральный или эпи-периневральный шов; в послеоперационном периоде осуществляли компенсацию дефекта удлинением сшитого нерва путем постепенного изменения положения в суставе, фиксированном аппаратом Илизарова – его специально разработанной экспериментальной модификацией. Объём резекции седалищного нерва в этой группе опытов от 10 до 15 мм, что составляло 15 % длины бедра собак.
В группе "опыт 2" (n=27) оперативное вмешательство включало остеотомию или резекцию участка диафиза бедренной кости (от 1 до 4 см, что составляло от 10 до 25 % длины бедра), остеосинтез спице-стержневым аппаратом (костные фрагменты в аппарате сближали до контакта костных раневых поверхностей, что в опытах с резекцией приводило к укорочению бедра), после чего выполняли пересечение или резекцию участка седалищного нерва и микрохирургический шов. В опытах с остеотомией через 79, а в опытах с резекцией через 9-11 дней после операции начинали дистракцию фрагментов бедренной кости с суточным темпом 0,5 и 0,75 мм и шагом 0,25 мм, которую продолжали до удлинения бедра на 10, 12, 15, 18 и 25 %.
Контрольные эксперименты включали замещение резекционного дефекта нерва аутологичным трансплантатом (n=8) "контроль 1" и шов конец в конец после нейротомии без резекции (n=23) "контроль 2".
Все операции выполняли под внутривенным комбинированным наркозом в асептических условиях. В сроки от 2 недель до 2 лет после операции животные выведены из опыта передозировкой барбитуратов.
Для гистологического исследования участок седалищного нерва, включающий зону швов, перед иссечением фиксировали к деревянной основе так, чтобы уровень швов оказался на её середине. Большеберцовый и поверхностный малоберцовый нервы иссекали на уровне средней трети голени.
Иссеченные кусочки помещали в охлажденную смесь 2 % растворов глутарового и параформальдегидов на фосфатном буфере (pH 7,4) с добавлением 0,1 % пикриновой кислоты. На следующие сутки материал измельчали по специальной схеме. Материал, предназначенный для обзорного гистологического исследования, до-фиксировали не менее месяца в 10 % нейтральном формалине или сиропе “суза” по Гейденгайну, после чего заливали в парафин и целлоидин. Для выявления реакций соединительной ткани поперечные и продольные срезы нервов окрашивали гематоксилин-эозином, пикрофуксином по Ван-Гизону, трехцветным методом по Массону. Кусочки, предназначенные для импрегнации серебром, фиксировали не менее 8 месяцев в 10 % нейтральном формалине. Для приготовления поперечных полутонких срезов измельчённый материал вновь погружали в альдегидный фиксатор на 24 часа, постфиксировали четырехокисью осмия и по стандартной методике заливали в эпоксидные смолы. Срезы толщиной 0,5, 1 и 2 мкм выполняли с помощью стеклянных и алмазных ножей на ультратомах фирмы LKB (Швеция). Для дифференцированного выявления мякотных и безмякотных нервных волокон срезы окрашивали метиленовым синим и основным фуксином. Гистологические препараты и полутонкие срезы изучали и фотографировали, используя большие исследовательские микроскопы фирмы «Opton» (ФРГ).
В части экспериментов качественные характеристики регенераторного процесса дополнили морфометрическими исследованиями полутон-ких срезов. Используя исследовательские микроскопы фирмы “Opton” и аппаратнопрограммный комплекс “ДиаМорф” (Москва), с каждого уровня оцифровывали от 30 до 80 полей зрения с изображениями не менее 500 мякотных нервных волокон (инструментальное увеличение 1250 ) для определения их численно-размерных характеристик.
РЕЗУЛЬТАТЫ
В опытных группах у 4 животных из 49 получено осложнение расхождение швов. Однако концевую неврому и глиому соединял фиброзный тяж, в который врастали регенерировавшие нервные волокна. В отдалённые сроки наблюдения (2 года) этот регенерат внешне напоминал трансплантат. В его продольных гистологических срезах обнаружены минифасцикулы микроскопически малые пучки нервных волокон. Каждый из них заключён в собственное периневральное влагалище, сформированное одним слоем периневральных клеток. В некоторых минифасцикулах внеклеточный матрикс практически не окрашивается (рис. 1, А). Такие минифасцикулы, как правило, содержат небольшое количество мякотных волокон, среди которых нет представителей крупного калибра. В более крупных минифасцикулах тинк-ториальные свойства внеклеточного матрикса сопоставимы с эндоневрием интактного нерва (рис. 1, Б и Г). Нередки картины слияния мини-фасцикул друг с другом (рис. 1, А). Значительная разница в степени дифференцировки мякотных волокон в разных минифасцикулах в отдалённые сроки после операции (рис. 1, Б, сравнить 1 и 2) убеждает в том, что в течение длительного времени в регенерате могут появляться всё новые и новые минифасцикулы. Кроме того, в составе одной минифасцикулы могут встречаться волокна, которые тоже резко отличаются по степени дифференцировки (рис. 1, В) следовательно, минифасци-кулы могут увеличиваться в размерах за счёт появления в их составе новых волокон. Кроме того, двигательные и проприоцептивные мякотные волокна весьма значительно увеличивают свою толщину после реиннервации органов-мишеней. Все эти процессы приводят к постепенному замещению рубца тканями периферического нерва, однако органотипической перестройки не наступает вплоть до 2 лет после операции. Самые крупные пучки могут содержать сотни и тысячи мякотных волокон, но не десятки тысяч, как в интактном седалищном нерве.
Численная плотность мякотных волокон в регенерате выше, чем в проксимальном отрезке нерва в 1,7-2,5 раза за счёт хорошо известного эффекта ар-боризации осевых цилиндров. Однако в пучках дистального отрезка этот параметр резко снижен: он составляет от 50 до 80 % от значений проксимального отрезка (индекс невротизации 0,5-0,8).
Аналогичная закономерность отмечается в опытах с аутопластикой, что совпадает с данными других авторов, полученными на кроликах [14]. Основная причина этого заключается, по-видимому, в том, что значительная часть регенерирующих волокон врастает не в суженные в результате денервационной атрофии периневральные трубки, а в эпиневрий. В препаратах берцовых нервов прослеживается их регенерация на периферию по рыхлой соединитель- ной ткани эпиневрия. Но даже те волокна, которые невротизировали эндоневральные трубки, имеют сниженные показатели дифференцировки: через 2 года после операции доля мякотных проводников толще 7 мкм не превышает 10 %.
В остальных 45 опытах мы не обнаруживали между концами нерва макроскопического диастаза, заполненного фиброзным рубцом. По-видимому, регенерирующие осевые цилиндры прорастали линию швов в течение первых двух недель после операции во всяком случае через 14 дней их филаментозные тяжи отчётливо выявлялись в дистальном отрезке нерва.
Для всех экспериментов с соединением концов нерва "конец в конец" (обеих опытных и контрольной группы с нейроррафией без дефекта) характерно образование скоплений периневральных клеток (рис. 2) в субпериневральной зоне и в области эндоневральных септ на протяжении 0,5-1 см от уровня пересечения как в проксимальном, так и в дистальном отрезке нерва. Такие скопления можно обнаружить в сроки от 2 недель до полугода после операции. На светооптическом уровне периневральные клетки отличаются от фибробластов чёткими контурами, характерным угловатым ядром с тёмной кариоплазмой, в которой практически никогда не выявляются ядрышки. Целостность периневральных футляров крупных пучков, по-видимому, восстанавливается отчасти за счёт 4 соединительнотканного эпи-периневрального рубчика протяжённостью не более 100 мкм, отчасти путём реституции за счёт миграции и пролиферации периневральных клеток.
В пучках с восстановленным периневрием даже в условиях дистракции на уровне швов формируется типичный для эндоневрия фибриллярный коллагеновый каркас, в котором располагаются продольно ориентированные тяжи шванновских клеток, невротизированные регенерирующими аксонами. В течение первого месяца после операции аксо-глиальные комплексы содержат буквально единичные миелинизирующиеся осевые цилиндры. Однако уже через 3-4 месяца отношение численной плотности регенерирующих мякотных волокон в пучках дистального отрезка к соответствующему параметру проксимального (индекс невротизации) у разных животных варьирует от 1,0 до 2,5. Равенство численной плотности мякотных волокон в пучках дистального и проксимального отрезков либо более высокое значение этого параметра в дистальном отрезке прослеживается также в отдалённые сроки наблюдения. Некоторое количество регенерирующих волокон прорастает на периферию по эпинев-рию дистального отрезка так же, как при регенерации через диастаз или трансплантат. Среди них практически не встречаются хорошо миелинизированные крупные мякотные проводники даже через год после операции (рис. 3).
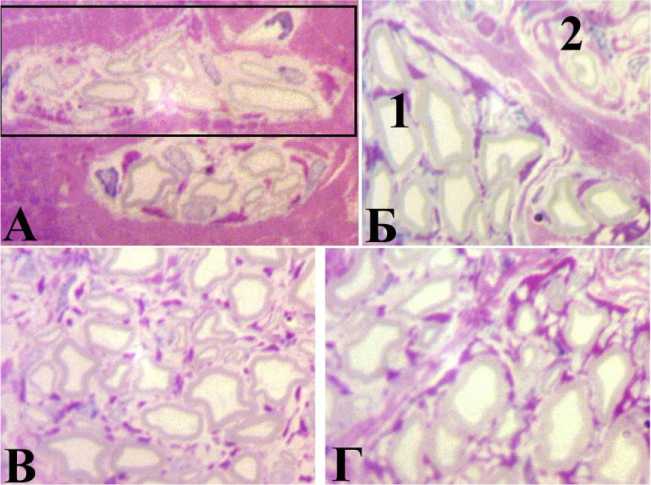
Рис. 1. Фрагменты поперечного полутонкого среза дистракционного минифасцикулярного регенерата через 2 года после операции. Окраска по Уикли. Увеличение 1250 . А в рамке слияние минифасцикул; Б: 1 зрелая минифасцикула с типичным для эндоневрия внеклеточным матриксом; 2 вновь формирующаяся минифасцикула
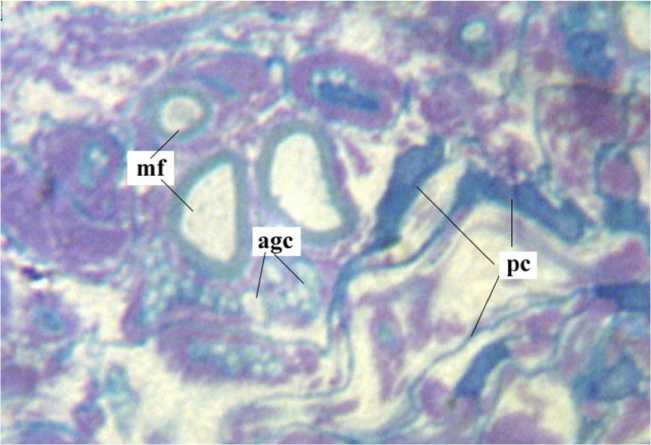
Рис. 2. Скопление периневральных клеток ( pc ) в субпериневральной зоне дистального отрезка нерва через 3 месяца после шва "конец в конец". Mf регенерировавшие мякотные волокна, agc незрелый аксо-глиальный комплекс. Окраска по Уикли. Увеличение 1250
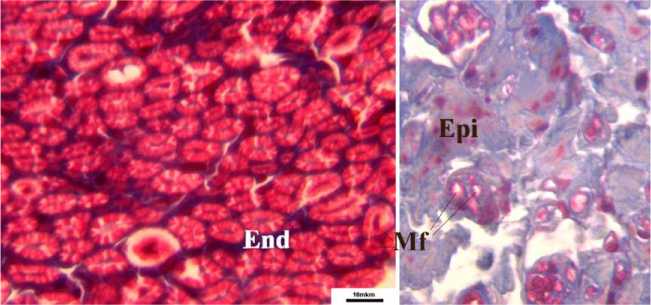
Рис. 3. Регенерировавшие в условиях дозированного растяжения мякотные волокна дистального отрезка седалищного нерва. 12 месяцев после операции. Окраска Массон-трихром. Увеличение 500 . МF крупные мякотные волокна, регенерировавшие интрафасцикулярно (слева) и экстрафасцикулярно (справа). End эндоневрий. Epi эпиневрий
Средние показатели дифференцировки мякотных волокон дистального отрезка нерва, регенерировавших интрафасцикулярно, через 12 месяцев после операции сопоставимы с контрольными (нейроррафия5 без дефекта). В частности, средний диаметр фракции толстых волокон (более 10 мкм) в группе "контроль 2" составлял 96 % от интактной нормы, а в группе "опыт 2"
94,9 %. Средняя толщина миелиновой оболочки этих волокон в группе "контроль 2" 78,1 %, а в группе «опыт 2» 68 %. При этом доля волокон крупного калибра (диаметром более 7 мкм) у разных животных группы "контроль 2" варьирует от 18,6 до 34,1 %, а в группе "опыт 2" от 18,4 до 53,6 % (у интактных собак от 44,4 до 59,2 %).
ОБСУЖДЕНИЕ
Рубцевание зоны повреждения и интранев-ральный фиброз рассматриваются в ряду основных причин, определяющих неудовлетворительные результаты восстановительных операций на нервах в клинике и в опытах на животных. Регенерация периферических нервных волокон в эксперименте изучается больше 100 лет, однако вплоть до настоящего времени появляются экспериментальные данные, заставляющие пересматривать традиционные представления, в частности о том, что плотная соединительная ткань является непреодолимым препятствием для регенераторного роста аксонов. В 2001-2002 гг. опубликованы результаты замещения дефекта седалищного нерва крыс сухожильным трансплантатом [9] и коллагеновыми филаментами [15]: в том и в другом случае регенерирующие аксоны врастают в дистальный отрезок нерва. По-видимому, этому способствует строго упорядоченная продольно-волокнистая структура трансплантата.
Результаты наших исследований свидетельствуют, что регенерирующие нервные волокна могут пенетрировать не только грануляционную ткань, но и плотный фиброзный рубец, причём даже в очень отдалённые сроки после операции. При этом они формируют своеобразные структуры мини-фасцикулы, которые были описаны другими авторами [4] в травматических невромах, где они, как правило, располагаются весьма хаотично. В то же время дистракционный минифасцикулярный регенерат пространственно упорядочен под действием механического фактора (дозированного растяжения), что определяет направленность роста мини-фасцикул и постепенное замещение рубца тканями периферического нерва.
Формированию специфического микроокружения нейральных элементов в минифасцикуляр-ном регенерате, по-видимому, способствуют периневральные клетки. Охватывая мелкие группы нервных волокон, они отделяют их от мезодермальных дериватов фиброзного рубца. По мнению некоторых авторов [11], именно периневральные клетки препятствуют проникновению грануляций и интрапериневральному рубцеванию в зонах повреждения оболочек нервного ствола, что хорошо согласуется с результатами наших опытов по восстановлению нервов швом конец в конец. Следует учитывать, что периневральные клетки имеют нейроэктодермальное происхождение [5, 6]
и, соответственно, специфический иммунофенотип в частности, экспрессируют эпителиальный мембранный антиген [3, 13]. Поэтому так своеобразны их реактивные свойства [2].
Возникает вопрос, обеспечивает ли регенерация нервных волокон через фиброзный рубец эффективное морфо-функциональное6 восстановление нерва?
Следует подчеркнуть, что несмотря на формирование характерного для эндоневрия внеклеточного матрикса внутри минифасцикул и разные механизмы их укрупнения, даже через 2 года после операции не восстанавливается исходная многослойная структура периневрия крупных пучков, определяющая функционирование физиологического нейро-гематического барьера [5, 7], значение которого для поддержания структурного гомеостаза нервных волокон доказывается прицельными физиологическими исследованиями [12]. Отсутствием восстановления барьерных структур можно объяснить недостаточную степень дифференцировки мякотных волокон, вросших в пучки дистального отрезка через трансплантат или фиброзный рубец.
В данном исследовании установлено, что соотношения относительной численности мякотных волокон в проксимальном отрезке нерва, в дистракционном минифасцикулярном регенерате и в дистальном отрезке сопоставимы с теми, которые наблюдаются при пластике дефекта аутотрансплантатом. При восстановлении нерва швом "конец в конец" индекс невротизации дистального отрезка в 2-3 раза выше, чем при регенерации через трансплантат или диастаз.
Недостаточную в количественном отношении невротизацию периферических отделов нерва при регенерации аксонов через фиброзный рубец или трансплантат следует увязывать главным образом с тем, что в данных условиях эндоневральные и периневральные трубки дистального отрезка длительное время денервированы и потому подвергаются более значительной атрофии к моменту реиннервации, чем при шве конец в конец.
Формирование дистракционного минифас-цикулярного регенерата, несомненно, нужно интерпретировать как осложнение метода дозированного растяжения тканей. Соблюдение методических принципов, изложенных нами [8] ранее (качественный гемостаз и восстановление целостности периневрия основных пучков нерва при нейрорррафии7, а также оптимальный режим дистракции в послеоперационном периоде), позволяет профилактировать расхождение даже ультратонких швов нерва.
В этих условиях проявляется тенденция к лучшему, по сравнению с контрольными опытами без дистракции, восстановлению миелоархи-тектоники регенерирующего нерва за счёт увели- чения доли мякотных волокон крупного калибра. При оценке значения этого параметра следует учитывать, что рост аксонов в толщину и, соответственно, появление в составе регенерирующего нерва крупных проводников, имеющих, как известно, высокую скорость проведения, становится возможным только после восстановления функциональных связей аксотомированных нейронов с органами-мишенями [10].
ВЫВОДЫ
-
1. Эффективность разработанных на основе метода Илизарова способов возмещения дефектов нервов у собак сопоставима с результатами ней-роррафии8 "конец в конец" в опытах без дефекта, а в отдельных случаях превышает их, что следует интерпретировать как проявление морфогенетического эффекта дозированного растяжения.
-
2. Дистракционный минифасцикулярный регенерат, формирующийся при осложнениях данного метода, обеспечивает частичное морфофункциональное восстановление, сравнимое с результатами аутопластики.
-
3. При регенерации нервных волокон через трансплантат или диастаз, замещённый фиброз-
- ным рубцом, численная плотность и степень дифференцировки мякотных проводников в дистальном отрезке нерва остаются низкими даже в отдалённые сроки эксперимента. С высокой долей вероятности эти показатели можно рассматривать в качестве структурных коррелят стойкого функционального дефицита, наблюдающегося у многих пациентов при лечении травм нервов в клинике.
-
4. Восстановление нервов швом "конец в конец" в сравнении с аутонейропластикой обеспечивает более эффективную в количественном и качественном отношении невротизацию дистального отрезка повреждённого нерва.


