Морфологические особенности ремоделирования биологических и тканеинженерных сосудистых заплат: результаты испытаний на модели овцы
Автор: Прокудина Е. С., Сенокосова Е. А., Антонова Л. В., Мухамадияров Р. А., Кошелев В. А., Кривкина Е. О., Великанова Е. А., Кочергин Н. А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
Одним из способов реконструкции артериальной стенки является эндартерэктомия с использованием сосудистой заплаты. Применение протезов сосудистой стенки, изготовленных из существующих материалов, может приводить к возникновению осложнений с необходимостью реоперации. Актуален поиск новых материалов для изготовления сосудистых заплат, обладающих оптимальной совместимостью со стенкой сосуда.Цель: изучить динамику и сравнить морфологические особенности ремоделирования тканеинженерных сосудистых заплат из фиброина шелка (ФШ) и биологических лоскутов из ксеноперикарда (КП), имплантированных в стенку сонной артерии овец.Материал и методы. Матриксы из 15% раствора ФШ (n = 2) изготавливали методом электроспиннинга. Для сравнения использовали лоскуты из бычьего перикарда (n = 2). Сосудистые заплаты имплантировали овцам в стенку сонной артерии сроком на 2 и 6 мес. Проводили гистологическое исследование эксплантированных образцов, сканирующую электронную микроскопию и конфокальную микроскопию со специфической иммунофлюоресцентной окраской препаратов.Результаты. На основе имплантированной ФШ-заплаты сформировалась неоинтима и неоадвентиция. Спустя 2 мес. имплантации ФШ-матрикс сохранил свою структуру; через 6 мес. наблюдалась умеренная биодеградация материала с замещением собственной тканью сосуда. Участков кальцификации и массивного воспаления не обнаружено. Спустя 6 мес. выявлена гиперплазия неоинтимы в проекции имплантированной ФШ-заплаты. На основе имплантированного КП-лоскута также сформировалась неоинтима и неоадвентиция. Через 2 мес. выявлено расслоение имплантированного КП. Спустя 6 мес. обнаружена гиперплазия неоинтимы в проекции КП-заплаты.Заключение. Ремоделирование ФШ-заплаты и КП-лоскута, имплантированных в стенку сонной артерии овцы, шло по пути формирования трехслойной структуры, напоминающей архитектуру собственной стенки сосуда, с признаками умеренной биодеградации материала. Гиперплазия неоинтимы объясняется недостаточной комплаентностью артериальной стенки и заплаты, что требует совершенствования состава имплантированного матрикса.
Фиброин шелка, тканевая инженерия, сосудистая заплата, ксеноперикард, сонная артерия, неоинтима, гиперплазия
Короткий адрес: https://sciup.org/149144435
IDR: 149144435 | УДК: 616.133-089-74-092.9:591.4:599.735.52 | DOI: 10.29001/2073-8552-2023-38-4-250-259
Текст научной статьи Морфологические особенности ремоделирования биологических и тканеинженерных сосудистых заплат: результаты испытаний на модели овцы
Распространенность атеросклероза с каждым годом неуклонно растет во всем мире [1]. Образование атеросклеротических бляшек в стенке сонных артерий приводит к их стенозу и необходимости проведения каротидной эндартерэктомии с закрытием артериотомного дефекта сосудистой заплатой [2]. Cосудистые заплаты изготавливают из материалов природного и синтетического происхождения [3, 4]. Недостаточная комплаентность материала заплаты и стенки сосуда может приводить к воспалению в области имплантации, кальцификации, тромбозу, гиперплазии неоинтимы и рестенозу с необходимостью повторной операции [5]. Поиск и разработка новых материалов с целью изготовления сосудистых заплат для артериальной реконструкции является актуальной задачей.
Фиброин шелка (ФШ) является природным материалом с хорошей биосовместимостью [6]. Ранее в экспериментах in vitro нами были изучены его физико-механические характеристики, гемосовместимость и матриксные свойства, сопоставимые с таковыми для нативных сосудов [7]. Для более полной оценки биологических свойств ФШ как материала, пригодного для изготовления сосудистых заплат, необходимо исследование на экспериментальной модели лабораторного животного.
Цель работы: изучить динамику и сравнить морфологические особенности ремоделирования сосудистых заплат из ФШ и лоскутов из ксеноперикарда (КП), имплантированных в стенку сонной артерии овец.
Материал и методы
Работа одобрена локальным этическим комитетом ФГБНУ «Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний» (протокол № 6 от 30.06.2022 г.).
Экспериментальное исследование выполнено с включением 4 случаев имплантации сосудистых заплат из ФШ ( n = 2) и лоскутов из КП ( n = 2) в сонную артерию овец. Сроки наблюдения за животными и вывода из эксперимента составили 2 и 6 мес. для каждого типа протезов.
Заплаты изготавливали методом электроспиннинга в магнитном поле на аппарате Nanon-01A (MECC, Япония) из 15% регенерированного ФШ, растворенного в гексаф-торпропаноле. Стерилизацию образцов, а также перевод материала в водонерастворимую форму проводили в 70% этиловом спирте. Для сравнения использовали биологические лоскуты коммерческого производства из бычьего перикарда (Кем-Периплас Нео, ЗАО «Неокор», Россия), которые широко применяются в сосудистой хирургии.
В качестве экспериментальной модели выбраны несуягные самки овец эдильбаевской породы массой 40–45 кг. Сосудистые протезы имплантировали в сонную артерию овцам последовательно, в соответствии с протоколом, описанным ранее [8]. Размер заплат – 40 × 4 мм. Спустя 2 и 6 мес. животных выводили из эксперимента с последующей эксплантацией артериальных заплат. Проводили гистологическое исследование (ГИ), сканирующую электронную микроскопию (СЭМ) и конфокальную микроскопию с иммунофлюоресцентным окрашиванием образцов.
Гистологическое исследование
Эксплантированные образцы заплат подготавливали для ГИ в соответствии с ранее описанной методикой [8]. Для обзорного ГИ срезы образцов окрашивали гематоксилином Гарриса (БиоВитрум, Россия) и эозином (БиоВи-трум, Россия). Для оценки коллагенизации исследуемых образцов срезы окрашивали по Ван Гизону, последовательно помещая в растворы гематоксилина Вейгерта (БиоВитрум, Россия) и пикрофуксина (БиоВитрум, Россия). Для идентификации присутствия кальция срезы окрашивали ализариновым красным C (Химсервис, Россия) с окраской ядер клеток DAPI (Sigma-Aldrich, США). Окрашенные срезы заливали монтирующей средой (Био-Витрум, Россия) и накрывали покровным стеклом. Образцы исследовали с использованием микроскопа AXIO Imager A1 (Carl Zeiss, Германия) при увеличении × 50, × 100 и × 200.
Сканирующая электронная микроскопия
Образцы эксплантированных заплат для СЭМ подготавливали по ранее описанной методике [8]. Исследуемые образцы окрашивали 2% уранилацетатом (Electron Microscopy Sciences, США) в 95% этаноле, пропитывали смесью ацетона с эпоксидной смолой Epon (Electron Microscopy Sciences, США), далее шлифовали и полировали эпоксидные блоки на установке TegraPol-11 (Struers, США). Образцы контрастировали цитратом свинца по Рейнольдсу. После этого на поверхность эпоксидных блоков напыляли углерод (толщина покрытия 10–15 нм) с помощью вакуумного напылительного поста (EM ACE200, Leica). Визуализацию структуры поверхности образцов выполняли в процессе СЭМ в обратно-рассеянных электронах на электронном микроскопе Hitachi-S-3400N (Hitachi, Япония) в режиме BSECOMP при ускоряющем напряжении 10 кВ.
Иммунофлюоресцентное исследование и конфокальная микроскопия
Образцы для иммунофлюоресцентного окрашивания подготавливали в соответствии с ранее описанной методикой [8]. В качестве первичных антител были выбраны: кроличьи антитела к CD31 (Abcam, Великобритания) и мышиные антитела к α-актину гладкомышечных клеток (ГМК) (α-SMA, Abcam, Великобритания); кроличьи антитела к фактору фон Виллебранда (vWF, Abcam, Великобритания); кроличьи антитела к коллагену IV типа (Abcam, Великобритания) и мышиные антитела к коллагену I типа (Abcam, Великобритания); кроличьи антитела к коллагену III типа (Novus Biologicals, США), мышиные антитела к эластину (SigmaAldrich, США). В качестве вторичных антител использовали: антитела козы к IgG кролика, конъ- югированные с Alexa Fluor 488-conjugated (Thermo Fisher, США), и антитела козы к IgG мыши, конъюгированные с Alexa Fluor 555-conjugated (Thermo Fisher Scientific, США). Для удаления автофлуоресценции срезы обрабатывали Autofluorescence Eliminator Reagent (Millipore, США). Ядра контрастировали при помощи DAPI (10 μg/mL, Sigma-Aldrich, США). Окрашенные препараты заключали под покровное стекло с использованием монтирующей среды ProLong (Thermo Fisher, США). Препараты анализировали с помощью сканирующего лазерного конфокального микроскопа LSM 700 (Carl Zeiss, Германия).
Статистическая обработка данных
Анализ полученных данных проводили с помощью программы Jamovi (версия 2.3, Сидней, Австралия). Для проверки типа распределения количественных признаков использовали критерий Шапиро – Уилка. Для выявления межгрупповых различий применяли однофакторный дисперсионный анализ и апостериорный тест Тьюки.
Достоверными считали различия при уровне значимости p < 0,05. Количественные данные представлены в виде среднего, стандартного отклонения и 95% доверительного интервала M ± SD [5%; 95%].
Результаты
Результаты имплантации ФШ-заплат в сонную артерию овцы
Морфологическое исследование (ГИ и СЭМ) эксплан-тированных образцов ФШ-заплат после 2 мес. имплантации показало сохранность структуры материала: определялись неизменные волокна фиброина. Расслоения в толще матрикса были незначительные, обусловленные, вероятно, воздействием на материал в процессе приготовления гистологических срезов. На внутренней поверхности ФШ-матрикса сформировалась неоинтима, которая имела равномерную толщину на всем протяжении заплаты (таблица, рис. 1).
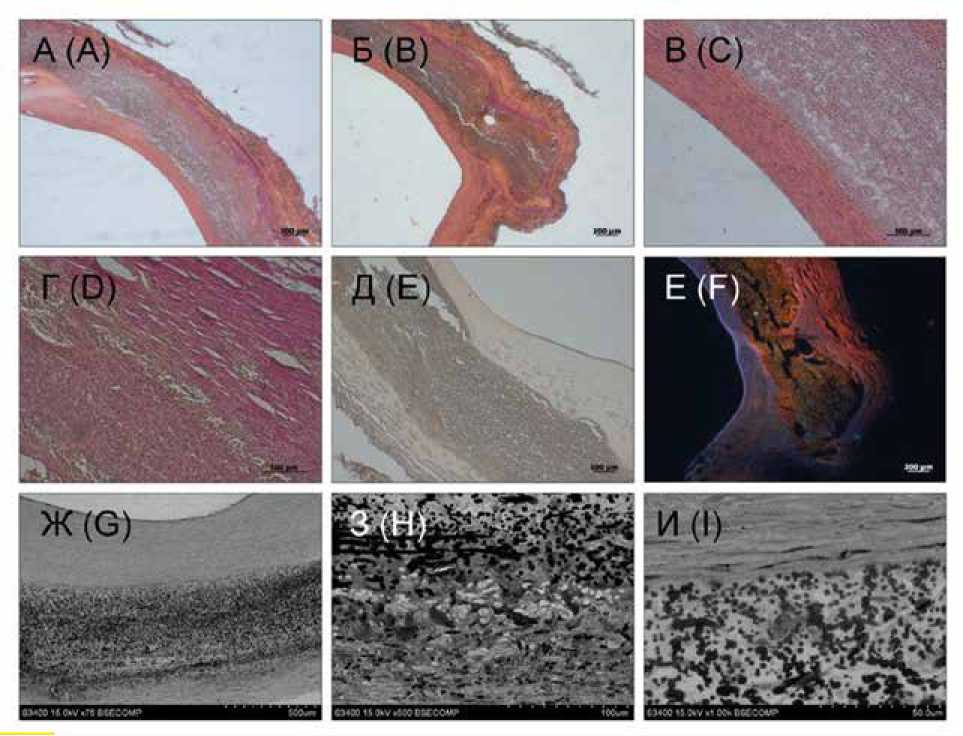
Рис. 1. Результаты гистологического исследования и сканирующей электронной микроскопии ФШ-заплаты (спустя 2 мес. имплантации): А – В – окраска гематоксилин + эозин, увеличение × 50, × 100; Г – окраска по Ван Гизону, увеличение × 100; Д – окраска ализариновым красным С, увеличение × 100; Е – флюоресцентный снимок, окраска ядер клеток Dapi, увеличение × 50; Ж – И – снимки сканирующей электронной микроскопии: Ж – общий вид участка среза сонной артерии с имплантированной ФШ-заплатой, увеличение × 75; З – участок перехода между ФШ-заплатой и неоадвентицией, увеличение × 500; И – участок перехода между неоинтимой и ФШ-заплатой, увеличение × 1000
Fig. 1. Results of histological examination and scanning electron microscopy (SEM) of SF-patch (after 2 months of implantation): A – C – hematoxylin + eosin staining, magnification × 50, × 100; D – Van Gieson staining, magnification × 100; E – staining with alizarin red C, magnification × 100; F – fluorescent image, staining of Dapi cell nuclei, magnification × 50; G – I – SEM images: G – general view of the section of the carotid artery with an implanted SF-patch, magnification × 75; H – area of transition between the SF-patch and neoadventitia, magnification × 500; I – the area of transition between the neointima and the SF-patch, magnification × 1000
Таблица. Толщина неоинтимы и неоадвентиции на разных сроках имплантации сосудистых заплат из фиброина шелка и ксеноперикарда Table. Neointima and neoadventitia thickness at different stages of implantation of vascular patches from SF and XP
|
Сосудистый слой Vascular layer |
ФШ-заплата SF-patch |
КП-лоскут XP-flap |
||
|
2 мес. 2 mounths |
6 мес. 6 mounths |
2 мес. 2 mounths |
6 мес. 6 mounths |
|
|
Неоинтима, мкм |
48,4 ± 5,99 |
831 ± 108 |
20,2 ± 1,69 |
696 ± 131 |
|
Neointima, µm |
[43,4; 53,4] |
[741; 921]* |
[18,8; 21,6] |
[586; 806]# ° |
|
Неоадвентиция, мкм |
41,0 ± 7,81 |
140 ± 18 |
17,2 ± 1,57 |
181 ± 18 |
|
Neoadventitia, µm |
[34,4; 47,5] |
[125; 155]* |
[15,9; 18,5] |
[132; 229]# |
Примечание: ФШ - фиброин шелка, КП – ксеноперикард, * – статистически значимые различия по сравнению с «ФШ-заплата, 2 мес.» ( p < 0,05), # – статистически значимые различия по сравнению с «КП-лоскут, 2 мес.» ( p < 0,05), ° – статистически значимые различия по сравнению с «ФШ-за-плата, 6 мес.» ( p < 0,05).
Note: SF – silk fibroin, XP – xenopericardium, * – statistically significant differences compared to «SF-patch, 2 months» ( p < 0.05), # – statistically significant differences compared to «XP-flap, 2 months» ( p < 0.05), ° – statistically significant differences compared to «SF-patch, 6 months» ( p < 0.05).
Эндотелиоподобные клетки (ЭПК), экспрессирующие vWF, непрерывным слоем покрывали всю поверхность неоинтимы, обращенную в просвет сосуда (рис. 2).
Неоинтима образована клетками с положительной окраской на α-актин. Эластиновые волокна не определялись (см. рис. 2). Коллагены III и IV типов пропитывают неоинтиму, в толще заплаты представлены слабо (см. рис. 2). Клеточность заплаты низкая в центральной части с увеличением в зонах, приближенных к анастомозам. Коллагеновые волокна III и IV типов выявлены преимущественно во внешней соединительнотканной капсуле, сформировавшейся вокруг заплаты со стороны адвентиции (см. рис. 2). Неоадвентиция ярко выражена, наполнена фибробластоподобными клетками (см. таблицу, рис. 1). В толще заплаты на границе с неоадвен- тицией обнаруживались клетки воспалительного ряда с включенными в цитоплазму волокнами фиброина, единичные гигантские многоядерные клетки инородных тел, а также новообразованные кровеносные капилляры (см. рис. 1). В целом признаки биодеградации ФШ выражены незначительно, материал заплаты демонстрирует структурную стабильность. Участков кальцификации не обнаружено.
Спустя 6 мес. имплантации ФШ-матрикса на его основе сформировалась полноценная трехслойная сосудистая ткань (рис. 3). Неоинтима была значительно гиперплазирована, ее толщина в проекции заплаты была достоверно больше, чем на сроке 2 мес. (см. таблицу). Со стороны просвета сосуда неоинтима покрыта слоем ЭПК, экспрессирующих vWF (см. рис. 2, 3).
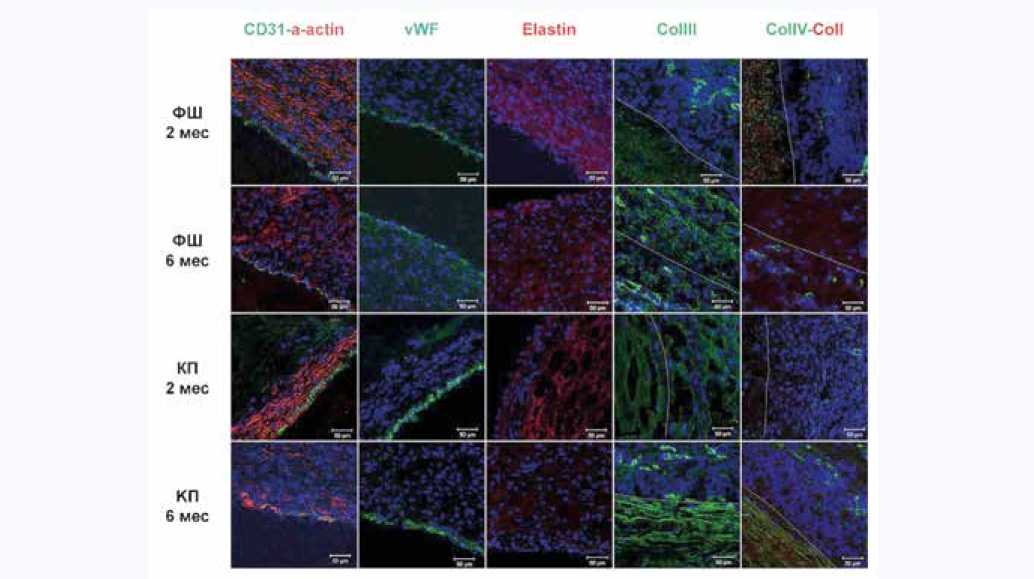
Рис. 2. Иммунофлуоресцентное окрашивание образцов ФШ-заплат и КП-лоскутов: CD31 (зеленый), α-актин гладкомышечных клеток (красный), эластин (красный), коллаген III типа (зеленый), коллаген IV типа (зеленый), коллаген I типа (красный). Ядра клеток докрашены DAPI (синий). Масштабная линейка 50 мкм. Линии на микрофотографиях разграничивают область заплаты и область адвентиции
Fig. 2. Immunofluorescent staining of samples of SF-patches and XP-flaps: CD31 (green), α-SMA (red), elastin (red), type III collagen (green), type IV collagen (green), type I collagen (red). Cell nuclei are counterstained with DAPI (blue). Scale bar 50 µm. The lines in the micrographs demarcate the patch area and the adventitia area
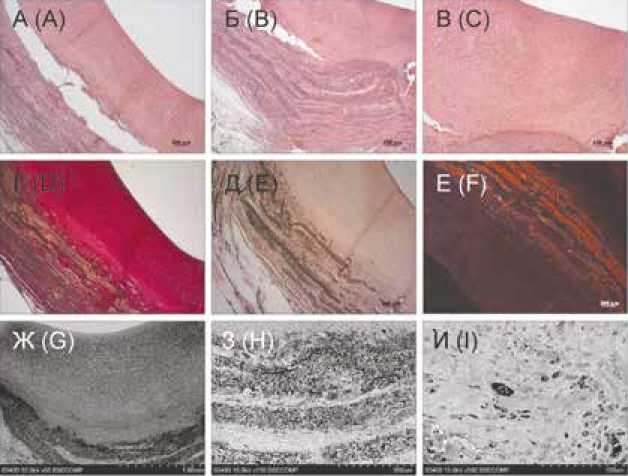
Рис. 3. Результаты гистологического исследования и сканирующей электронной микроскопии ФШ-заплаты (спустя 6 мес. имплантации): А – В – окраска гематоксилин + эозин, увеличение × 50, × 100; Г – окраска по Ван Гизону, увеличение × 50; Д – окраска ализариновым красным С, увеличение × 50; Е – флюоресцентный снимок, окраска ядер клеток Dapi, увеличение × 50; Ж – И – снимки сканирующей электронной микроскопии: Ж – общий вид участка среза сонной артерии с имплантированной ФШ-заплатой, увеличение × 50; З – участок перехода между неоинтимой и ФШ-заплатой, увеличение × 150; И – зона анастомоза с единичными новообразованными кровеносными капиллярами, увеличение × 500 Fig. 3. Results of HE and SEM of the SF-patch (after 6 months of implantation): A – C – hematoxylin + eosin staining, magnification × 50, × 100; D – Van Gieson staining, magnification × 50; E – staining with alizarin red C, magnification × 50; F – fluorescent image, staining of Dapi cell nuclei, magnification × 50; G – I – SEM images: G – general view of the section of the carotid artery with an implanted SF-patch, magnification × 50; H – area of transition between the neointima and the SF-patch, magnification × 150; I – anastomotic zone with single newly formed blood capillaries, magnification × 500
Основную толщу неоинтимы составляли ГМК-подоб-ные клетки, экспрессирующие α-актин (см. рис. 2). Через 6 мес. признаки ремоделирования ФШ-заплаты были выражены в большей степени, чем спустя 2 мес. имплантации – она была представлена расходящимися пластами фиброина, между которыми располагалась вновь сформированная ткань стенки сосуда (см. рис. 3).
Имплантированный ФШ-матрикс был наполнен клеточными элементами (макрофаги, фибробластоподобные и ГМК-подобные клетки, немногочисленные гигантские многоядерные клетки инородного тела), между которыми располагались пучки коллагеновых волокон. Кроме того, в толще ФШ-заплаты и в области анастомозов обнаруживались вновь образованные vasa vasorum (см. рис. 3). В неоадвентиции наблюдались все характерные для нее элементы: коллагеновые волокна, фибробластоподобные клетки, немногочисленные гигантские многоядерные клетки инородного тела, лимфоциты и vasa vasorum . Толщина неоадвентиции была в 3,4 раза больше, чем на сроке имплантации 2 мес. (см. таблицу, рис. 2, 3).
Таким образом, ремоделирование ФШ-заплаты шло по пути формирования трехслойной структуры, повторяющей нормальную стенку сонной артерии овцы. Постепенная биодеградация ФШ сопровождалась замещением собственной тканью стенки сосуда. Гиперплазия неоинтимы в проекции имплантированной ФШ-заплаты, вероятно, объясняется недостаточной комплаентностью материала и стенки артерии и требует дальнейшего поиска оптимального состава тканеинженерного матрикса.
Результаты имплантации КП-лоскутов в сонную артерию овцы
ГИ и СЭМ КП-лоскута после 2 мес. имплантации в стенку сонной артерии овцы показали, что материал сохранил характерную для бычьего перикарда коллагеновую структуру, отмечалось расслоение стенки заплаты по всей ее длине (рис. 4).
Толщина неоинтимы в проекции КП-лоскута достоверно не отличалась от таковой для ФШ-заплаты (см. таблицу, рис. 4). Эндотелизация внутренней поверхности неоинтимы проходила менее качественно – обнаруживались участки отсутствия монослоя ЭПК (см. рис. 4). Клетки эндотелия на всем протяжении экспрессировали vWF (см. рис. 2). В толще неоинтимы обнаружены α-актин-со-держащие клетки, а также диффузно расположенные волокна коллагена III и IV типов (см. рис. 2). Наполненность клетками заплаты низкая, волокна эластина не визуализировались (см. рис. 2, 4). Неоадвентиция в среднем наполнена фибробластоподобными клетками, встречались единичные гигантские многоядерные клетки инородных тел, присутствовали в небольшом количестве коллагеновые волокна III и IV типов (см. таблицу, рис. 2, 4). На границе прилегания неоадвентиции к КП-заплате, а также в области анастомозов обнаруживались немногочисленные vasa vasorum . Кроме того, зона стыка КП-лоскута и собственной ткани артерии окружена валом клеток воспалительного ряда (см. рис. 4).
Спустя 6 мес. имплантации КП-лоскут сохранил свою структуру, несмотря на участки расслоения, которые наблюдались в области прилегания к неоинтиме и неоад-вентиции (рис. 5).
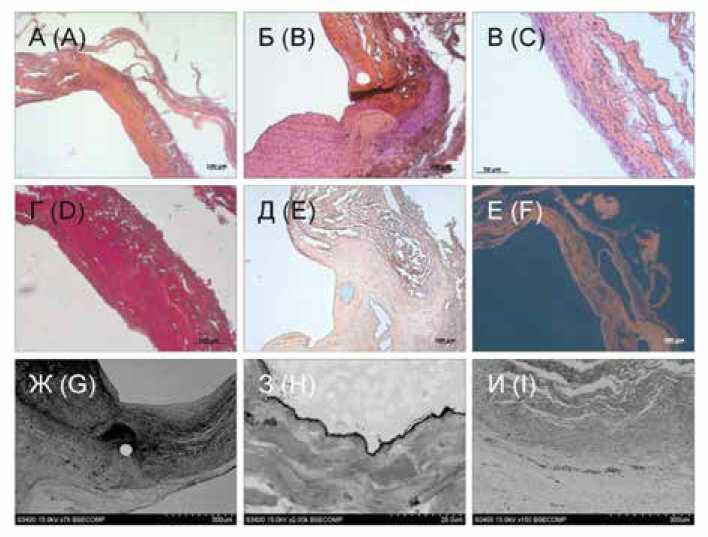
Рис. 4. Результаты гистологического исследования и сканирующей электронной микроскопии КП-лоскута (спустя 2 мес. имплантации): А – В – окраска гематоксилин + эозин, увеличение × 50, × 100, × 400; Г – окраска по Ван Гизону, увеличение × 200; Д – окраска ализариновым красным С, увеличение × 100; Е – флюоресцентный снимок, окраска ядер клеток Dapi, увеличение × 50; Ж – И – снимки сканирующей электронной микроскопии:
Ж – область анастомоза, увеличение × 75; З – эндотелиоподобные клетки на поверхности заплаты из КП, обращенной в просвет сосуда, увеличение × 2000; И – участок перехода между КП-лоскутом и неоадвентицией, новообразованные vasa vasorum , увеличение × 150
Fig. 4. Results of HE and SEM of the XP-flap (after 2 months of implantation): A – C – hematoxylin + eosin staining, magnification × 50, × 100, × 400; D – Van Gieson staining, magnification × 200; D – staining with alizarin red C, magnification × 100; E – fluorescent image, staining of Dapi cell nuclei, magnification × 50; G – I – SEM images: G – area of anastomosis, magnification × 75; H – endothelial-like cells on the surface of the XP-flap, facing the lumen of the vessel, magnification × 2000; I – area of transition between the XP-flap and neoadventitia, newly formed vasa vasorum , magnification × 150
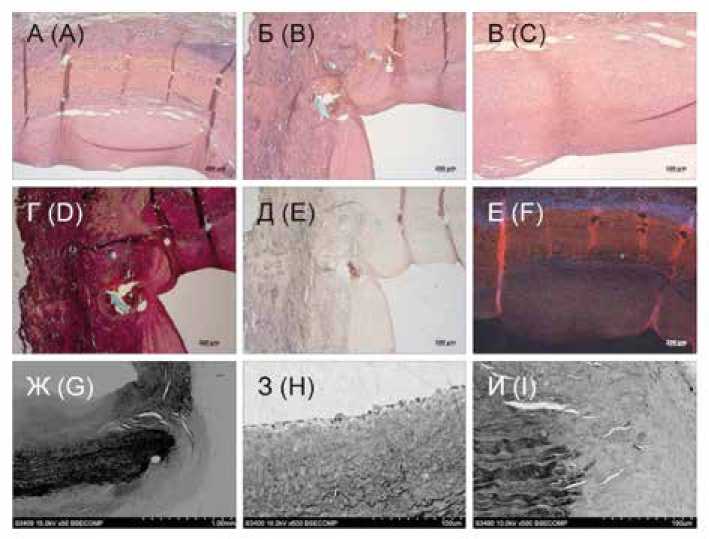
Рис. 5. Результаты гистологического исследования и сканирующей электронной микроскопии КП-лоскута (спустя 6 мес. имплантации): А – В – окраска гематоксилин + эозин, увеличение × 50, × 100; Г – окраска по Ван Гизону, увеличение × 50; Д – окраска ализариновым красным С, увеличение × 50; Е – флюоресцентный снимок, окраска ядер клеток Dapi, увеличение × 50; Ж – И – снимки сканирующей электронной микроскопии: Ж – область анастомоза, увеличение × 50; З – эндотелиоподобные клетки на поверхности неоинтимы, обращенной в просвет сосуда, увеличение × 500; И – область анастомоза с новообразованными vasa vasorum, увеличение × 500
Fig. 5. Results of HE and SEM of the XP-flap (after 6 months of implantation): A – C – hematoxylin + eosin staining, magnification × 50, × 100; D – Van Gieson staining, magnification × 50; E – staining with alizarin red C, magnification × 50; F – fluorescent image, staining of Dapi cell nuclei, magnification × 50; G – I – SEM images: G – area of anastomosis, magnification × 50; H – endothelial-like cells on the surface of the neointima facing the lumen of the vessel, magnification × 500; I – area of anastomosis with newly formed vasa vasorum, magnification × 500
Наполненность заплаты клетками невысокая, однако она выше на границе с неоинтимой и неоадвентицией (см. рис. 2, 5). С внутренней стороны сосуда в проекции КП-лоскута неоинтима гиперплазирована, но ее толщина уступала таковой для ФШ-заплаты (см. таблицу, рис. 2, 3). Неоинтима представлена плоскими α-актин-содер-жащими клетками, присутствие эластических волокон не выявлено (см. рис. 2). Эндотелиальный слой рыхлый, прерывистый, легко слущивается. Экспрессия vWF слабая (см. рис. 2). Коллаген III типа в большом количестве присутствует во всем образце, в основном пропитывает ткани. Коллаген IV типа окрашен ярко, пропитывает заплату; в области неоадвентиции выявлены только отдельные секретирующие клетки и их скопления (см. рис. 2). Со стороны неоадвентиции заплата окружена клетками воспалительного ряда, обнаружены vasa vasorum , которые присутствовали также в зонах анастомозов (см. рис. 5). Толщина неоадвентиции значительно увеличилась по сравнению со сроком имплантации 2 мес. (см. таблицу). В области прокола выявлен единичный участок кальцификации, который, вероятно, объясняется местной реакцией на шовный материал.
В целом ремоделирование КП-лоскута шло по пути образования трехслойной структуры, напоминающей архитектуру стенки сонной артерии овцы. Отличительной особенностью для КП-лоскута является наличие участков расслоения, что в дальнейшем может быть причиной преждевременной деградации материала сосудистой заплаты. Кроме того, гиперплазия неоинтимы свидетельствует о недостаточной совместимости имплантированного КП-лоскута и собственной стенки сосуда.
Обсуждение
Исследование ФШ как материала для тканевой инженерии нашло применение в различных ее областях [9, 10]. Его биологические свойства были изучены как в опытах in vitro , так и в экспериментах in vivo [11, 12]. Ранее в экспериментах in vitro нами было показано, что ФШ обладает хорошей гемосовместимостью и демонстрирует оптимальные матриксные свойства и физико-механические характеристики [7].
Формирование неоинтимы и неоадвентиции, а также полноценная эндотелизация внутренней поверхности сосуда в проекции ФШ-заплаты свидетельствуют о его достаточной биологической привлекательности для собственных клеток организма.
Обращает на себя внимание гиперплазия неоинтимы сосуда, которая наблюдалась спустя 6 мес. имплантации
ФШ-заплаты в стенку сонной артерии овцы. Схожие данные были получены другими исследователями [13]. Это свидетельствует о недостаточной совместимости артериальной стенки и материала заплаты по ряду причин. С одной стороны, повышенная жесткость ФШ [7] может вызывать нарушение ламинарного потока крови в сосуде с последующей активацией эндотелия и экспрессией прооксидантных, провоспалительных, прокоагулянтных и проапоптотических генов [14, 15]. Эндотелиальная дисфункция, возникающая в области имплантации [16], сопровождается нарушением регуляции эндотелиальной NO-синтазы и снижением выработки NO [17, 18]. Кроме того, локальная воспалительная реакция, протекающая с привлечением лейкоцитов и моноцитов в субэндотелиальную область [19], усугубляется активацией матрикс-ных металлопротеиназ и расщеплением белков внеклеточного матрикса [20].
В совокупности эти факторы способствуют миграции в область неоинтимы и пролиферации ГМК с ее последующей гиперплазией. Действительно, по данным гистохимического исследования, спустя 2 и 6 мес. имплантации ФШ-заплаты в области гиперплазированной неоинтимы наблюдаются клетки, экспрессирующие α-актин – ГМК-по-добные клетки (см. рис. 2). Следовательно, для дальнейшего использования ФШ в качестве материала, пригодного для изготовления сосудистых заплат, необходим поиск решений для преодоления проблемы гиперплазии неоинтимы.
Заключение
Ремоделирование имплантированных в сонную артерию овец ФШ-заплат и КП-лоскутов развивалось по пути формирования трехслойной структуры, напоминающей строение стенки сосуда. КП-лоскут отличался наличием участков расслоения заплаты и кальцификации в зонах анастомозов. Обнаруженная спустя 6 мес. имплантации гиперплазия неоинтимы сосуда в проекции КП-лоскута свидетельствует о недостаточной совместимости материала заплаты и артериальной стенки.
Отличительными особенностями ФШ-матриксов была их структурная стабильность спустя 2 и 6 мес. имплантации. Умеренная биорезорбция ФШ проходила с постепенным замещением собственной тканью стенки сосуда. Гиперплазия неоинтимы, сформировавшейся на основе ФШ-заплаты спустя 6 мес. имплантации, вероятно, также связана с недостаточной комплаентностью матрикса и сосудистой стенки и требует совершенствования состава материала.
Список литературы Морфологические особенности ремоделирования биологических и тканеинженерных сосудистых заплат: результаты испытаний на модели овцы
- Mensah G.A., Roth G.A., Fuster V. The global burden of cardiovascular diseases and risk factors: 2020 and beyond. J. Am. Coll. Cardiol. 2019;74(20):2529-2532. https://doi.org/10.1016/j.jacc.2019.10.009.
- AbuRahma A.F., Avgerinos E.D., Chang R.W., Darling R.C. 3rd, Duncan A.A., Forbes T.L. et al. Society for Vascular Surgery clinical practice guidelines for management of extracranial cerebrovascular disease. J. Vasc. Surg. 2022;75(1S):4-22. https://doi.org/10.1016/j.jvs.2021.04.073.
- Севостьянова В.В., Миронов А.В., Антонова Л.В., Тарасов Р.С. Применение сосудистых заплат для артериальной реконструкции, проблемы и перспективные технологии. Комплексные проблемы сердечно-сосудистых заболеваний. 2019;8(3):116-129. https://doi.org/10.17802/2306-1278-2019-8-3-116-129.
- Allen K.B., Adams J.D., Badylak S.F., Garrett H.E., Mouawad N.J., Oweida S.W. et al. Extracellular matrix patches for endarterectomy repair. Front. Cardiovasc. Med. 2021;11(8):1-13. https://doi.org/10.3389/fcvm.2021.631750.
- Liesker D.J., Gareb B., Looman R.S., Donners S.J.A., de Borst G.J., Zeebregts C.J. et al. Patch angioplasty during carotid endarterectomy using different materials has similar clinical outcomes. J. Vasc. Surg. 2023;77(2):559-566. https://doi.org/10.1016/j.jvs.2022.09.027.
- Wang M., Wang Y., Pan P., Liu X., Zhang W., Hu C. et al. A high molecular weight silk fibroin scaffold that resists degradation and promotes cell proliferation. Biopolymers. 2023;114(7):e23554. https://doi.org/10.1002/bip.23554.
- Prokudina E.S., Senokosova E.A., Antonova L.V., Krivkina E.O., Velikanova E.A., Akentieva T.N. et al. New tissue-engineered vascular matrix based on regenerated silk fibroin: in vitro study. Sovremennye tehnologii v medicine. 2023;15(4):41. https://doi.org/10.17691/stm2023.15.4.04.
- Антонова Л.В., Миронов А.В., Шабаев А.Р., Сильников В.Н., Кривкина Е.О., Матвеева В.Г. и др. Тканеинженерные сосудистые запла ты - сравнительная характеристика и результаты преклинических испытаний на модели овцы. Вестник трансплантологии и искусственных органов. 2022;24(4):94-108.. https://doi.org/10.15825/1995-1191-2022-4-94-108.
- Ghorbani M., Vasheghani-Farahani E., Azarpira N., Hashemi-Najafabadi S., Ghasemi A. Dual-crosslinked in-situ forming alginate/silk fibroin hydrogel with potential for bone tissue engineering. Biomater. Adv. 2023;153:213565. https://doi.org/10.1016/j.bioadv.2023.213565.
- Dong Z., Peng R., Zhang Y., Shan Y., Ding W., Liu Y. et al. Tendon repair and regeneration using bioinspired fibrillation engineering that mimicked the structure and mechanics of natural tissue. ACS Nano. 2023;17(18):17858-17872. https://doi.org/10.1021/acsnano.3c03428.
- Wuttisiriboon K., Tippayawat P., Daduang J., Limpaiboon T. Three-dimensional silk fibroin-gelatin/chondroitin sulfate/hyaluronic acid-aloe vera scaffold supports in vitro chondrogenesis of bone marrow mesenchymal stem cells and reduces inflammatory effect. J. Biomed. Mater. Res. B. Appl. Biomater. 2023;111(8):1557-1570. https://doi.org/10.1002/jbm.b.35254.
- Yan Y., Zhang W., Wu R., Guan T., Li Z., Tu Q. et al. Promising application of a novel biomaterial, light chain of silk fibroin combined with NT3, in repairment of rat sciatic nerve defect injury. Int. J. Biol. Macromol. 2023;240:124447. https://doi.org/10.1016/j.ijbiomac.2023.124447.
- Chan A.H.P., Filipe E.C., Tan R.P., Santos M., Yang N., Hung J. et al. Altered processing enhances the efficacy of small-diameter silk fibroin vascular grafts. Sci. Rep. 2019;9(1):17461. https://doi.org/10.1038/s41598-01953972-y.
- Remuzzi A., Ene-Iordache B. Novel paradigms for dialysis vascular access: upstream hemodynamics and vascular remodeling in dialysis access stenosis. Clin. J. Am. Soc. Nephrol. 2013;8(12):2186-2193. https://doi.org/10.2215/CJN.03450413.
- Chiu J.J., Chien S. Effects of disturbed flow on vascular endothelium: pathophysiological basis and clinical perspectives. Physiol. Rev. 2011;91(1):327-387. https://doi.org/10.1152/physrev.00047.2009.
- Bonatti J., Oberhuber A., Schachner T., Zou Y., Hammerer-Lercher A., Mittermair R. et al. Neointimal hyperplasia in coronary vein grafts: pathophysiology and prevention of a significant clinical problem. Heart Surg. Forum. 2004;7(1):72-87. https://doi.org/10.1532/hsf.910.
- Lavin B., Gómez M., Pello O.M., Castejon B., Piedras M.J., Saura M. et al. Nitric oxide prevents aortic neointimal hyperplasia by controlling macrophage polarization. Arterioscler. Thromb. Vasc. Biol. 2014;34(8):1739- 1746. https://doi.org/10.1161/ATVBAHA.114.303866.
- Bahnson E.S., Koo N., Cantu-Medellin N., Tsui A.Y., Havelka G.E., Vercammen J.M. et al. Nitric oxide inhibits neointimal hyperplasia following vascular injury via differential, cell-specific modulation of SOD-1 in the arterial wall. Nitric Oxide. 2015;44:8-17. https://doi.org/10.1016/j.niox.2014.10.009.
- Cai Y., Nagel D.J., Zhou Q., Cygnar K.D., Zhao H., Li F. et al. Role of cAMP-phosphodiesterase 1C signaling in regulating growth factor receptor stability, vascular smooth muscle cell growth, migration, and neointimal hyperplasia. Circ. Res. 2015;116(7):1120-1132. https://doi.org/10.1161/CIRCRESAHA.116.304408.
- Rotmans J.I., Velema E., Verhagen H.J., Blankensteijn J.D., de Kleijn D.P., Stroes E.S. et al. Matrix metalloproteinase inhibition reduces intimal hyperplasia in a porcine arteriovenous-graft model. J. Vasc. Surg. 2004;39(2):432-439. https://doi.org/10.1016/j.jvs.2003.07.009.


