Морфологические особенности заживления гнойных ран при использовании криокислородного метода
Автор: Григорьев Александр Геннадьевич, Григорьева Анна Александровна, Орлинская Наталья Юрьевна, Шевантаева Ольга Николаевна, Щелчкова Наталья Александровна, Миронов Андрей Александрович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.23, 2015 года.
Бесплатный доступ
Криокислородная терапия приводит к быстрому отграничению и очищению гнойной раны от некротических тканей, снижению нейтрофильной инфильтрации, способствует быстрому росту грануляционной ткани и снижению расстройств микроциркуляции. Локальная криокислородная терапия является эффективным методом лечения гнойно-деструктивных ран и может применяться как в комплексном лечении, так и в качестве самостоятельного метода.
Криокислородная терапия, гнойная рана, грануляционная ткань
Короткий адрес: https://sciup.org/143177399
IDR: 143177399
Текст научной статьи Морфологические особенности заживления гнойных ран при использовании криокислородного метода
Введение. Одной из важных проблем хирургии является разработка новых и усовершенствование традиционных методов лечения гнойных и длительно не заживающих ран [1, 2]. В течение последнего десятилетия в решении этой проблемы достигнуты определённые успехи, как в теоретическом, так и в практическом плане. Предложено много средств и методов, ускоряющих репаративно-регенераторные процессы в ранах и профилактике их вторичного инфицирования [3]. Однако, при широкой апробации этих методов, большинство из них оказались малоэффективными и поэтому, проблема в целом остаётся ещё далёкой от своего разрешения.
Цель исследования - оценить в условиях эксперимента эффективность применения кри-окислородного метода при местном лечении гнойно-деструктивных ран.
Материал и методы исследования. Исследование проводилось на 60 белых крысах-самцах породы «Вистар» 6-месячного возраста с массой тела 273±35 г. Животных содержали в условиях вивария при свободном доступе к воде и пище, что соответствует нормативам ГОСТа «Содержание экспериментальных животных в питомниках НИИ». Опыты на животных выполняли в соответствии с правилами гуманного обращения с животными, регламентированными «Правилами проведения работ с использованием экспериментальных животных», утвержденными Приказом МЗ СССР №742 от 13.11.84 г. «Об утверждении правил проведения работ с использованием экспериментальных животных» и №48 от 23.01.85 г. «О контроле за проведением работ с использованием экспериментальных животных». Все оперативные вмешательства проводили в стерильных условиях под общим обезболиванием.
Способ моделирования инфицированной раны заключался в формировании подкожного кармана размером 4х6 см, в который помещался фетровый диск, пропитанный суспензией, содержащий 0,5 мл S. aureus 108. Данный способ обеспечивает получение модели инфицированной кожной раны с заданной бактериальной обсе-мененностью, которая по своим характеристикам максимально приближена к реальному клиническому течению раневого процесса.
Лечение гнойной раны проводилось с использованием антибиотика апефлоксацин (Абактал®, рег № 008768/01) в терапевтической дозе 8 мг/кг 1 раз в сутки в течение 5 дней и кри-окислородного аэрозоля (ККА), для чего применялся криогенный аппарат «Иней». При работе данного аппарата осуществляется конденсация (сжижение) рабочего газа (воздуха, кислорода, озонированного кислорода) на аппликаторе в ране. Сжиженный рабочий газ выходит из отверстия внутреннего канала канюли аппликатора под давлением пропорциональным давлению подаваемого рабочего газа, которое можно регулировать, что позволяет проводить активную криооксигенацию тканей.
Все животные были распределены на группы:
-
1-я группа – животные, получавшие антибиотик;
-
2-я группа – животные, получавшие антибиотик и подвергавшиеся обработке ККА.
-
3-я группа – животные, подвергавшиеся обработке гнойной раны ККА;
-
4-я группа – животные, которым после моделирования инфекционной раны вводили стерильный физраствор в течение 5 дней;
Антибиотик в соответствующих группах животных 1 и 2 начинали вводить через двое суток после моделирования гнойной раны. Спустя 3 дня после формирования раны (1-й день морфологического исследования), проводили первую обработку криокислородным аэрозолем в группах 2 и 3; вторая обработка ККА была через 2 суток после первой, а третья обработка – через 4 суток после второй.
Объектом морфологического исследования стали фрагменты кожных покровов в зоне моделированной гнойной раны белых крыс-самцов (n=60). Забор материала проводился на 3-и, 5-е, 7-е, 12-е сутки после операции, соответственно дизайну экспериментального исследования. Фрагменты подвергались фиксации в 10% формалине при температуре 37 °С в течение 24 часов, затем обезвоживанию в спиртах восходящей кон-цетрации начиная с 70 °С и до абсолютного. После помещения в ксилол подвергался заливке в парафин. Далее срезы толщиной в 5 мкм окрашивали гематоксилином и эозином, и по Ван-Гизону [4].
Для морфометрической обработки и создания видеоархива полученного материала использовался микроскоп Nikon 1001, (Germany), объектив C90, Х40, Х15, окуляр 15. Для компьютерного анализа гистологических препаратов использовалась система анализа изображений, состоящая из микроскопа проходящего света «ECLIPS» (Nikon, Germany), компьютера Pentium IV IBM, цветной цифровой видеокамеры DS, блока управления DS-U1 (Nikon, Germany) и программного обеспечения ФСТ-2U [5].
Для оценки патологических процессов, происходящих в тканях, проведено морфометрическое исследование по следующим параметрам: лимфогистиоцитарная (круглоклеточная) и лейкоцитарная (нейтрофильная) инфильтрация, площадь некроза, площадь просвета сосудов (оценка наличия грануляционной ткани). Морфометрическая оценка клеточных элементов и площади грануляционной и соединительной ткани проводились автоматически расчетом среднего значения из 10 полей зрения при увеличении Х400 и выражались в процентах. Статистическая обработка проводилась с помощью пакета программ «Statistica 6.0». Для оценки вероятности различий между контрольными и опытными группами использовали U-критерий Манна-Уитни, независящий от формы распределения в группе. Различия считали достоверными при уровне значимости р<0,05 [6].
Результаты исследования их обсуждение. При макроскопическом исследовании участков ткани из области скальпированной раны на третьи сутки эксперимента в 1-й и 4-й группах животных отмечаются отечность и синюшность характерные для стаза в венульной части микро-циркуляторного русла. Низподлежащие к раневой поверхности ткани атрофичны, рост грануляционной ткани отсутствует. В области гнойного кармана наблюдается имбибиция окружающих тканей гнойно-деструктивными массами, уплотнение перифокальных тканей (абсцедирование) не выражено. Во 2-й и 3-й группах животных в тканях, прилегающих к скальпированной ране, отечности и синюшности не наблюдается. Прилегающая к ране кожа физиологической окраски, тургор не уплотнен, низподлежащие к раневой поверхности ткани визуально более плотные и больше по толщине по сравнению с группами 1 и 4. Визуально появляются первые грануляции. В области гнойного кармана наблюдается уплотнение тканей прилегающих к гнойно-деструктивному процессу, визуально отмечается картина начала (абсцедирования) отграничения нагноения.
При микроскопическом исследовании во всех случаях определяется некроз ткани, полнокровие и выраженная нейтрофильная инфильтрация различной степени интенсивности. В группе 2 и 3 определяется новообразованная грануляционная ткань (рис. 1).
На пятые сутки исследования при макроскопическом исследовании в 1 группе наблюдаются атрофические изменения тканей, подлежащих к раневой поверхности скальпированного участка. В зоне гнойного кармана окружающие ткани выражено отечны, с картиной венозного полнокровия. Подлежащие к «гнойному карману» фасции и мышцы вертебральной зоны имбибированы гной-
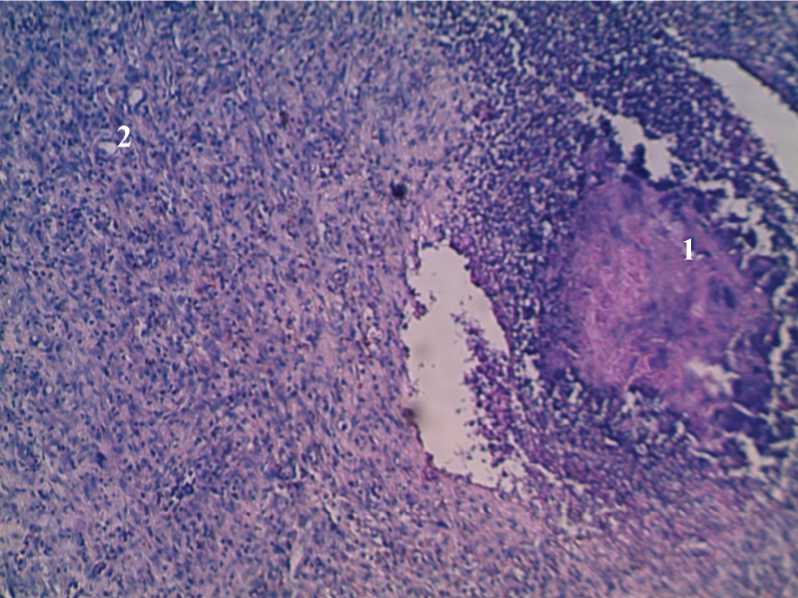
Рис. 1. Гистоструктура кожной раны крысы 2-й группы на 3-и сутки исследования с применением ККА и антибиотика. 1) Некроз и выраженная воспалительная инфильтрация; 2) участки образования грануляционной ткани (2). Окраска гематоксилином и эозином. Ув. 200.
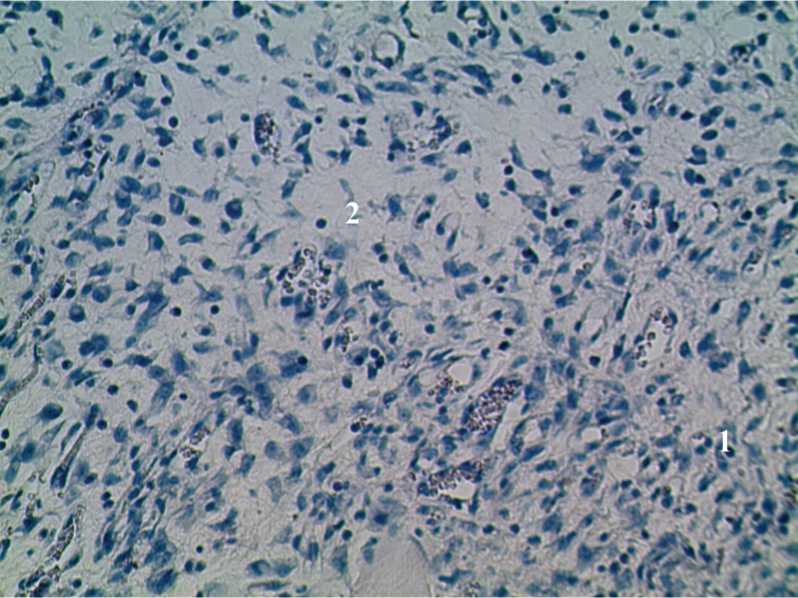
Рис. 2. Гистоструктура кожной раны крысы 2-й группы на 5-е сутки исследования с применением ККА и антибиотика. 1) Слабая воспалительная инфильтрация; 2) образование грануляционной ткани. Окраска гематоксилином и эозином. Ув. 200.
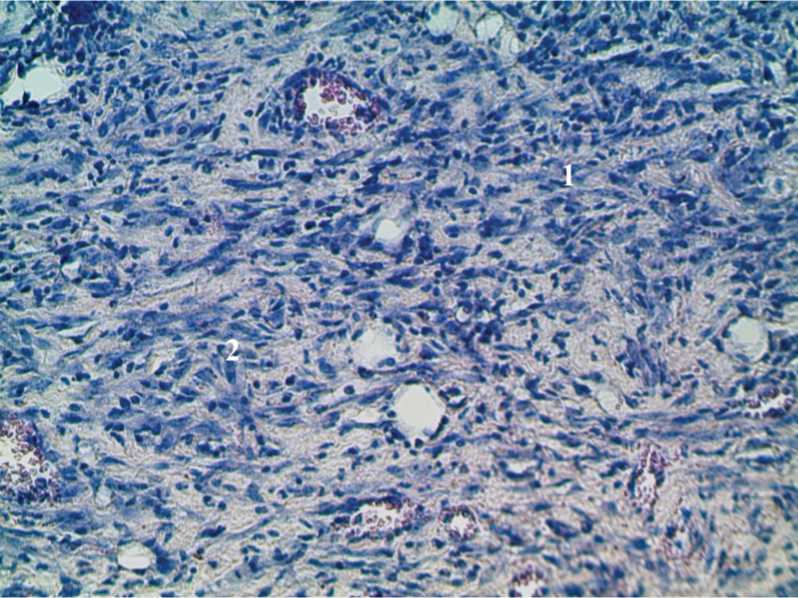
Рис. 3. Гистоструктура кожной раны крысы 2-й группы на 7-е сутки исследования с применением ККА и антибиотика. 1) Формирование нежноволокнистой соединительной ткани; 2) образование грануляционной ткани. Окраска гематоксилином и эозином. Ув. 200.
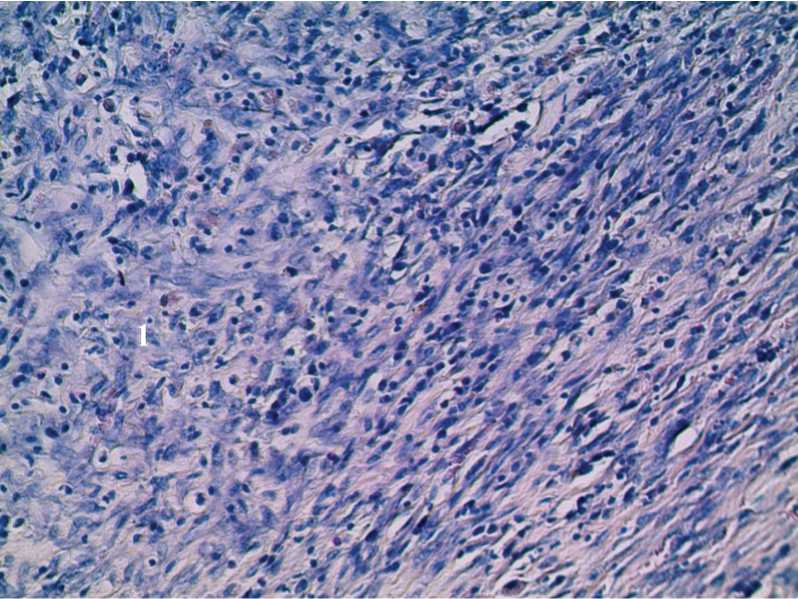
Рис. 4. Гистоструктура кожной раны крысы 2-й группы на 14-е сутки исследования с применением ККА и антибиотика. 1) формирование нежноволокнистой соединительной ткани (1). Окраска гематоксилином и эозином. Ув. 200.
ными массами. Исходя из общей клинической картины, наблюдается флегмона мягких тканей. Во 2 и 3 группах животных на скальпированном участке раны наблюдаются разрастания грануляционной ткани, отсутствие дистрофических изменений в коже, прилегающей к скальпированному участку. На участке гнойной раны отмечается отграничение гнойно-деструктивного процесса гранулирующими тканями. Для 4 группы животных характерно агрессивное течение гнойно-деструктивного процесса, выражающееся в развитии гнойных затеков, доходящих до передней стенки брюшной полости, с угрозой разлитого перитонита, наблюдается имбибиция подлежащих к гнойной ране фасций и мышц.
При микроскопическом исследовании в первой группе животных снижаются площадь некроза и нейтрофильная инфильтрация ткани, остается полнокровие сосудов. В 2-й и 3-й группах животных значительно снижаются явления некроза, полнокровия и нейтрофильная инфильтрация, продолжается формирование грануляционной ткани (рис. 2). При сравнении морфологической картины 3-х и 5-х суток эксперимента оказалось, что интенсивность нейтрофильной инфильтрации в группах 2 и 3 снизилась с 25±1,3 до 20±1,2 и с 30±1,5 до 25±1,6. Площадь некроза снизилась с 20±2,1 до 10±2,3 и с 30±1,7 до 15±1,5. Площадь грануляционной ткани увеличилась во второй группе с 5±2,4 до 10±2,3 и в третьей группе с 0 до 7±1,7.
На седьмые сутки исследования при макроскопическом исследовании в 1-й группе животных наблюдается имбибиция подлежащих тканей, однако, она менее выражена, чем у животных 4 группы. Развитие гнойно-деструктивного процесса продолжается в виде формирования затеков величиной до 3-х см. Во 2-й группе животных наблюдается очищение гнойного участка раны, низподлежащие ткани уплотнены, предположительно, за счет роста гранулирующей соединительной ткани. Отмечается отграничение гнойного процесса. В 3-й группе, раневая поверхность меньше, чем у групп 1, 2, 4. Наблюдается разрешение гнойно-деструктивного процесса разрастанием гранулирующей соединительной ткани. Рана чистая – нагноения не наблюдается. Для 4 группы животных характерна картина выраженного разлитого гнойно- деструктивного воспаления (обширной флегмоны). Затеки доходят до вентральной части животного.
При гистологическом исследовании операционного материала 2 – 3 групп животных отмечается исчезновение явлений отека, полнокровия и нейтрофильной инфильтрации. В этих же группах интенсивно формируются круглоклеточные элементы и грануляционная ткань (рис. 3). В группе 4
продолжаются явления некроза, отека, полнокровия, сохраняется нейтрофильная инфильтрация. Однако появляются небольшие участки грануляционной ткани.
На 12-е сутки эксперимента при макроскопическом исследовании в 1-й группе животных в зоне моделирования гнойного кармана наблюдается отёчность прилегающей кожи. Отмечается затёк переходящий на область поясницы, происходит спаивание поясничных мышц и мышц бедра с тканями кожи. В области гнойных затёков видны подлежащие гнойные массы. В зоне скальпированной раны, края раны не отёчны, не гиперемированы, наблюдается стягивание раны за счёт грануляционной ткани. Во 2-й группе животных по всему участку наблюдается рост грануляционной ткани. В зоне скальпированной раны грануляция более выражена. Кожа вокруг раны не отёчна. Спаивание мышц и кожи не наблюдается. Края кожи, прилегающие к зоне гранулирующей раны, не отёчны и не гиперемированы. Заметно стягивание раны и небольшая отёчность в начале моделированного гнойного кармана. В 3-й группе животных в прилегающих к ране тканях и коже отёчности не наблюдается. Рана покрыта гранулирующей тканью. Спаивания фасций мышц спины с тканями кожи не отмечается. Прилегающая к ране кожа не отёчна, не гиперемирована, нагноения не наблюдается. В 4-й группе животных наблюдается спаивание тканей кожи с фасциями мышц спины. Передняя часть раневой поверхности покрыта гранулирующей тканью, прилегающей к ране кожа отёчна. Продолжение развития гнойно-деструктивного процесса приобретает признаки отграничения -осумкованный гнойный карман.
При гистологическом исследовании операционного материала 2 и 3 группы животных признаков воспаления не обнаружено. В гистологических препаратах фиброзно-мышечные фрагменты. В первой группе животных определяются участки новообразованной грануляционной ткани. В 4группе животных сохраняется круглоклеточная инфильтрация и формирование грануляционной ткани с образованием нежноволокнистых соединительнотканных волокон (рис. 4).
Таким образом, данные морфологического изучения тканей в группе, где гнойно-деструктивные раны лечились традиционно, свидетельствуют о торможении течения раневого процесса, воспалительные проявления превалируют над репаративными, грануляционная ткань остается незрелой. В группах животных, которым проводилось криокислородное лечение, течение раневого процесса интенсифицируется. Отмечается полное очищение раневой поверхности от гнойно-некротического экссудата, что подтверждается данными морфологического исследования.
Выводы:
-
1. Локальная криокислородная терапия является эффективным методом лечения гнойно-деструктивных ран и может применяться в их комплексном лечении и в качестве самостоятельного метода.
-
2. Криокислородная терапия приводит к быстрому отграничению и очищению гнойной раны от некротических тканей, снижению нейтрофильной инфильтрации.
-
3. Криокислородная терапия в зоне скальпированной раны способствует быстрому росту грануляционной ткани и снижению расстройств микроциркуляции.
2.Луцевич О.Э., Тамразова О.Б, Шикунова А.Ю. и др. Современный взгляд на патофизиологию и лечение гнойных ран., Хирургия 5, 2011 72-77 3.Mascellino Ml’. Detogu C, Pelaia MR, et al. Reduced bactericidal activity against Staphylococcus aureus and Pseudomonas aeruginosa of blood neutrophils from patients with early adult respiratory distress syndrome. J Med Microbiol 2001 ;50(I):49-54
-
4. Автандилов Г.Г. Медицинская морфометрия. М.: Медицина, 1990. — 384 с.
-
5. Гринхальт Т. Основы доказательной медицины / пер. с англ. М.: ГЭОТАР-МЕД, 2004. — 240 с.
-
6. Гуцол А.А., Кондратьев Б.Ю. Практическая морфометрия органов и тканей. Томск: Изд-во Томского ун-та, 1988. — 136 с.
Список литературы Морфологические особенности заживления гнойных ран при использовании криокислородного метода
- Гайдуль К.В., Муконян А.А. Внутрибольничные инфекции: некоторые аспекты эпидемиологии, диагностики, лечения и профилактики.//М. -2005.-199 с.
- Луцевич О.Э., Тамразова О.Б., Шикунова А.Ю. и др. Современный взгляд на патофизиологию и лечение гнойных ран., Хирургия 5, 2011 72-77
- Mascellino M.l'., Detogu C., Pelaia M.R., et al. Reduced bactericidal activity against Staphylococcus aureus and Pseudomonas aeruginosa of blood neutrophils from patients with early adult respiratory distress syndrome. J Med Microbiol 2001;50(I):49-54
- Автандилов Г.Г. Медицинская морфометрия. М.: Медицина, 1990. - 384 с.
- Гринхальт Т. Основы доказательной медицины / пер. с англ. М.: ГЭОТАР-МЕД, 2004. - 240 с.
- Гуцол А.А., Кондратьев Б.Ю. Практическая морфометрия органов и тканей. Томск: Изд-во Томского ун-та, 1988. - 136 с.


