Морфологические параллели строения сосудистой стенки при варикозном расширении вен таза и нижних конечностей
Автор: Ахметзянов Рустем Вилевич, Бредихин Роман Александрович, Фомина Елена Евгеньевна, Коновалова Елена Федоровна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.28, 2020 года.
Бесплатный доступ
Гистологические различия строения яичниковой вены и подкожных вен нижних конечностей при их варикозной трансформации в современной литературе изучены недостаточно. Цель - определение морфологических параллелей строения варикозно измененных вен при варикозной болезни таза и варикозной болезни нижних конечностей. Исследовано 50 гистологических биопсионных препаратов удаленных вен. Из них 25 больших подкожных вен было получено у пациенток с варикозной болезнью нижних конечностей и 25 препаратов резецированной яичниковой вены у 25 женщин с варикозной болезнью таза. Препарат окрашивали гематоксилин-эозином и по методу Ван-Гизон, изучали методом световой микроскопии. При исследовании препаратов отмечены существенные структурные изменения всех оболочек венозной стенки, как при варикозной болезни таза, так и при варикозной болезни нижних конечностей в виде совокупности атрофических, фибропластических и гипертрофических процессов, приводящих к потере ее функциональных свойств. В зависимости от декомпенсации патологических процессов выявлено 3 морфологические формы поражения венозной стенки. Гипертрофическая форма выявлена у 17 (34%) оперированных женщин, фиброзная - у 13 (26%), атрофическая - у 20 (40%) пациенток. В группе пациенток с варикозной болезнью таза по сравнению с группой пациенток с варикозной болезнью нижних конечностей выявлено преобладание начальных форм поражения. Отмечена корреляция тяжести поражения венозных сосудов с длительностью заболевания и возрастом пациента, числом предикторов риска и высоким индексом массы тела, что и явилось определяющим фактором возникновения данного феномена. Результаты проведенного исследования свидетельствуют о схожести патоморфологической картины поражения вен, как при варикозной болезни таза, так и при варикозной болезни нижних конечностей.
Яичниковая вена, вены нижних конечностей, строение вены, варикозная болезнь таза, варикозная болезнь нижних конечностей
Короткий адрес: https://sciup.org/143177437
IDR: 143177437 | DOI: 10.20340/mv-mn.2020.28(2)24-31
Текст научной статьи Морфологические параллели строения сосудистой стенки при варикозном расширении вен таза и нижних конечностей
Материалы и методы исследования . Гистологические исследования патологически измененных удаленных вен системы нижней полой вены выполнены у 50 пациенток, находившихся на лечении в отделении сосудистой хирургии Межрегионального клиникодиагностического центра (Казань, Россия) в период с 2017 по 2019 гг. Все пациентки были разбиты на 2 группы. Пациенткам первой группы в количестве 25 человек была проведена операция комбинированной венэктомии варикозно расширенной большой подкожной вены нижней конечности (далее - БПВ). В исследование включали пациенток с клиническим классом не ниже С3 по классификации СЕАР. Для унификации результатов подбирали пациенток с поражением левой нижней конечности. 25-ти женщинам второй группы была выполнена операция резекции левой ЯВ при ВБТ. У каждой пациентки определяли количество факторов риска заболевания. К последним относили особенности трудовой деятельности (вынужденное положение сидя или стоя в течение рабочего дня, тяжелый физический труд, переохлаждение, перегревание, хронический стресс), а также состояния и заболевания, приводящие к повышению внутрибрюшного давления (хронические болезни дыхательных путей, запоры, поднятие тяжестей, занятия силовыми видами спорта).
Диагноз устанавливали путем ультразвукового дуплексного ангиосканирования аппаратами Voluson E10 (GE, США) и LOGIQ E9 (GE, США). У пациенток с ВБТ верификацию диагноза дополняли проведением мультиспиральной компьютерной томографии (томограф Aqulion 64, Toshiba, Япония) и рентгеноконтрастной флебографией с селективной оварикографией (ангиограф Innova 3100, GE, США), выполнением инвазивной прямой флебоманометрии прикроватным монитором HP 1092А (HP, США). Показаниями к операции у пациенток с ВБНК считали принадлежность к клиническим классам С3-С6 по классификации СЕАР, у пациенток с ВБТ – наличие болевой формы заболевания при отсутствии эффекта от проведенной консервативной терапии на фоне дилатации ЯВ более 5 мм в сочетании с ее клапанной несостоятельностью [9-10]. Противопоказанием к резекции ЯВ считали ее вторичное расширение на фоне выявленных обструктивных венозных синдромов. К последним относили синдромы Щелкунчика и Мэя-Тернера, а также посттромботические окклюзионно-стенотические поражения подвздошных вен [11-12].
Оперативное лечение проводили по общепринятым методам под спинномозговой анестезией либо эндотрахеальным наркозом. Стриппинг БПВ включал удаление венозного сегмента от соустья БПВ с бедренной веной до дистальной точки сброса на голени. Выделение ЯВ проводили забрюшинным косым кулисным доступом в подвздошной области с последующей ее резекцией на протяжении 10 см и более. Удаленный биоптат фиксировали в 10% растворе нейтрального формалина. Готовили гистологические поперечные срезы толщиной 5-7 мкм с окраской гематоксилином-эозином и пикрофуксином по Ван-Гизон. Препараты изучали методом световой микроскопии при увеличении микроскопа х4, х10, х20, х40. Определяли характер и выраженность возрастных и патологических процессов во всех оболочках сосуда. Статистически значимые различия изученных показателей считали при уровне p<0,05.
Результаты исследования и обсуждение. Клинико-демографические характеристики пациенток обеих групп, которым проведена операция удаления расширенной вены, с последующим ее гистологическим изучением представлены в таблице 1.
Клинико-демографические характеристики групп пациенток
Таблица 1
|
Показатель |
1-я группа (ВБНК) |
2-я группа (ВБТ) |
p-уровень* |
||
|
M±σ |
min÷max |
M±σ |
min÷max |
||
|
Возраст (лет) |
49,5±8,6 |
26–65 |
33,6±3,6 |
28–42 |
p<0,05 |
|
Индекс массы тела (кг/м 2 ) |
28,2±4,4 |
19,1–34,9 |
22,1±2,7 |
17,2–33,7 |
p<0,05 |
|
Длительность заболевания (лет) |
22,4±7,4 |
5–43 |
6,2±4,1 |
0,5–20 |
p<0,05 |
|
Возраст начала заболевания (лет) |
27,1±4,4 |
19–36 |
26,7±5,9 |
13–39 |
p>0,05 |
|
Факторы риска |
3,1±0,7 |
1–5 |
1,8±1,0 |
0–4 |
p<0,05 |
|
Беременности |
2,8±1,4 |
0–8 |
3,0±1,0 |
1–6 |
p>0,05 |
|
Роды |
1,8±0,8 |
0–4 |
2,0±0,5 |
0–3 |
p>0,05 |
Примечание: * - различия между средними значениями 2-х групп пациенток
Распределение пациенток с ВБНК по классу С клинической классификации СЕАР было следующим: С3 – 13 (52%) женщин, С4 – 10 (40%), С5 – 2 (8%). При изучении гистологической структуры венозной стенки отмечено трехслойное ее строение с идентификацией внутренней, мышечной и адвентициальной оболочек во всех 50 препаратах. Существенные структурные изменения всех составляющих венозной стенки были выражены в послеоперационном материале пациенток обеих групп. Наиболее часто наблюдались такие морфологические феномены, как выраженная гипертрофия и дискомплексация пучков гладких миоцитов во всех оболочках, их миграция в адвентицию и внутреннюю оболочку, депонирование коллагена в интерстициальном пространстве с развитием межмышечного фиброза, явления ангиоматоза с очаговым лимфоцитарным васкулитом мелких сосудов, чередование десквамации и пролиферации эндотелия.
При анализе выявленных нарушений микроструктурной картины в стенках варикозно-трансформированных вен обеих групп было выделены три различные морфологические формы, каждой из которых соответствовали характерные изменения. При первой форме поражения строение венозной стенки было нарушено с преобладанием гипертрофических изменений. При второй форме отмечали явления фиброза. При третьей изменения носили преимущественно атрофический характер. Гипертрофическая форма выявлена у 17 (34%) оперированных женщин, фиброзная у 13 (26%), атрофическая у 20 (40%) пациенток (таблица 2).
При гипертрофической форме поражения визуализировали изменение внутренней оболочки с утолщением за счет гиалинизированных коллагеновых волокон и интегрированных миоцитов. Клетки эндотелия были расположены прерывисто.
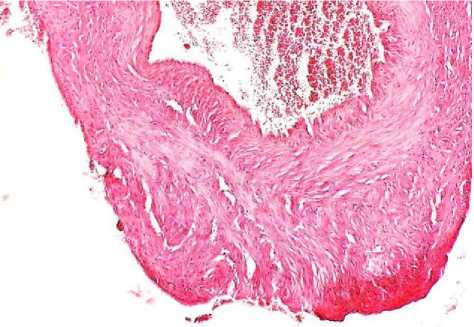
Гиперплазия мышечных элементов с их хаотичным расположением привела к значительному увеличению толщины медиальной оболочки. Ориентация гладкомышечных клеток была циркулярной и косо-поперечной. Выявлено уплотнение адвентиции с гипертрофией ее элементов, неравномерность толщины с очагами ее утончения. В стенках изучаемых вен гипертрофической формы наиболее часто обнаруживали изменения в виде выраженной гипертрофии и дискомплексации пучков гладких миоцитов во всех оболочках венозной стенки с их миграцией в адвентициальную и внутреннюю оболочку, чередование десквамации и пролиферации эндотелия (рис. 1–3).
Таблица 2 Частота выявления различных форм морфологического поражения сосудистой стенки в зависимости от типа вены
|
Препарат |
Гипертрофическая форма |
Фиброзная форма |
Атрофическая форма |
|||
|
n |
% |
n |
% |
n |
% |
|
|
Большая подкожная вена |
5/25 |
20 |
6/25 |
24 |
14/25 |
56 |
|
Яичниковая вена |
12/25 |
48 |
7/25 |
28 |
6/25 |
24 |
|
Обе вены |
17/50 |
34 |
13/50 |
26 |
20/50 |
40 |
При фиброзной форме патологических изменений сосудистой стенки отмечали сохранение утолщения венозной стенки, но уже за счет соединительной ткани. Превалирование элементов соединительной ткани сочеталось с депонированием коллагена в интерстициальном пространстве и развитием межмышечного фиброза. Фиброзная форма поражения представляла собой промежуточное звено между гипертрофическими и атрофическими изменениями венозной стенки (рис. 4-5).
При атрофической форме поражения наблюдали прогрессирование патологических процессов, происходящих во всех оболочках венозной стенки так же, как в выше описанных типах. Последующая декомпенсация заболевания приводит к морфологическим проявлениям в виде атрофии на фоне флебосклероза. Эскалация дистрофических изменений приводит к истончению сосудистой стенки, увеличению внутреннего диаметра, возникновению явлений ангиоматоза с очаговым лимфоцитарным васкулитом мелких сосудов. Отмечено формирование интрамуральных коллатералей за счет увеличения количества vasa vasorum в стенке адвентиции, а также появления их в средней и внутренней оболочках (рис. 6-7).
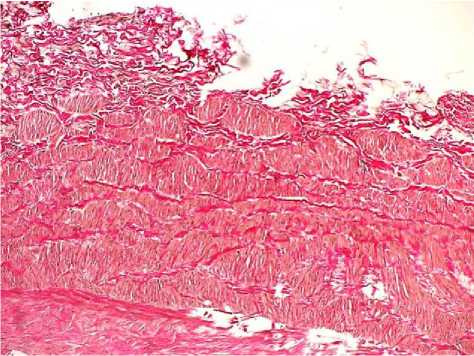
Рис. 2. Гипертрофический тип поражения большой подкожной вены: очаговая гипертрофия пучков гладких миоцитов. Окр.: по Ван-Гизон. Ув.: х10.
' X ^.«fie**
Рис. 1. Гипертрофический тип поражения
яичниковой вены: неравномерная толщина сосудистой стенки за счет гипертрофии пучков гладких миоцитов. Окр.: гематоксилином-эозином. Ув.: х10.
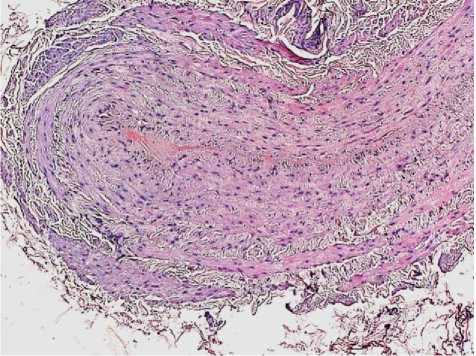
Рис. 3. Гипертрофический тип поражения большой подкожной вены: очаговая гипертрофия средней оболочки сосудистой стенки. Окр.: гематоксилином-эозином. Ув.: х10.
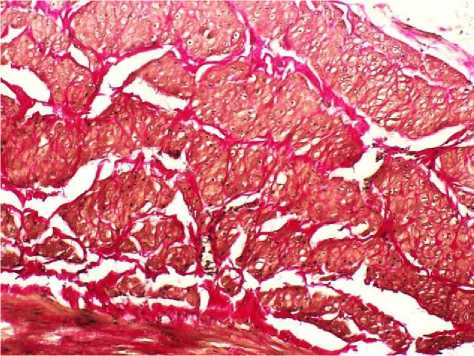
Рис. 4. Фиброзный тип поражения яичниковой вены: неравномерная гипертрофия пучков гладких миоцитов медии и межмышечный фиброз. Окр.: по Ван-Гизон. Ув.: х20.
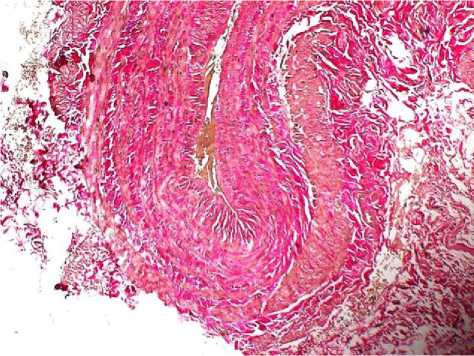
Рис. 5. Фиброзный тип поражения большой подкожной вены: очаговая гипертрофия пучков гладких миоцитов и межмышечный фиброз. Окр.: по Ван-Гизон. Ув.: х10.
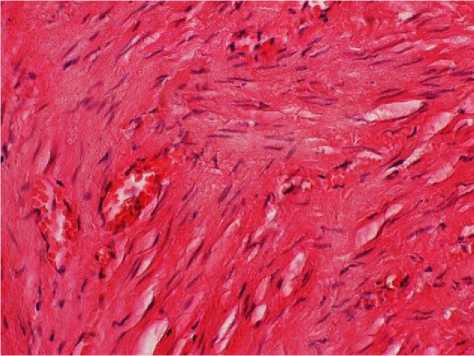
Рис. 6. Атрофический тип поражения яичниковой вены: явления ангиоматоза в сосудистой стенке. Окр. гематоксилином-эозином. Ув.: х40.
При поражении венозного сосуда, независимо от его локализации, в связи с увеличением его емкостного объема, что присуще пациентам с варикозной трансформацией, возникает выраженная флебогипертензия с последующей компенсаторной реакцией в виде поражения соединительнотканных и мышечных элементов венозной стенки. Венозная гипертензия повышает экспрессию матриксных металлопротеиназ, что приводит к деградации эндотелиальных и гладких мышечных клеток. Гипертрофические изменения сопровождаются поражением коллаген-эластинового комплекса: увеличением количества коллагена с одновременным нарушением архитектоники эластических волокон и гладкой мускулатуры, изменением соотношения гликозаминогликанов, коллагена и эластина, образующих внеклеточный матрикс [13-14]. Произошедшие морфологические изменения приводят к снижению эластичности венозного сосуда и его сжимаемости, повышению его ригидности. Эти процессы ведут к эскалации венозного рефлюкса с нарастанием флебогипертензии, что в свою очередь ведет к замыканию порочного патологического круга [15- 16]. Морфологические изменения сосудистой венозной стенки при ее варикозной трансформации неспецифичны и
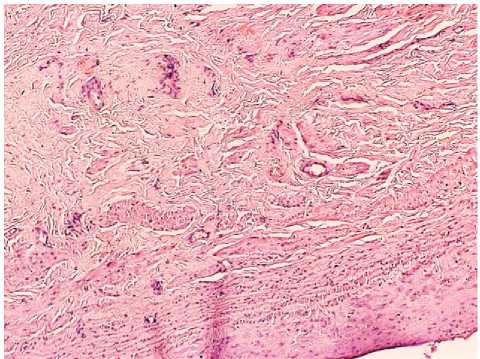
Рис. 7. Атрофический тип поражения большой подкожной вены: явления
ангиоматоза в сосудистой стенке. Окраска гематоксилином-эозином. Ув.: х10.
представлены совокупностью атрофических, фибропластических и гипертрофических процессов в различных сочетаниях, приводящих к потере свойств венозной стенки.
По нашим наблюдениям, патоморфологическая картина была сходной, как для измененных ЯВ у пациенток с ВБТ, так и для расширенных БПВ у женщин с ВБНК. В послеоперационном материале ЯВ преимущественно были выявлены начальные патоморфологические изменения в виде гипертрофических форм поражения, в то время как в венах нижних конечностей в большей степени были обнаружены атрофические формы, соответствующие терминальным стадиям. Подобные различия, вероятнее всего, обусловлены возрастом включенных пациентов и длительностью течения у них данного заболевания. Оба эти фактора взаимосвязаны между собой и являются статистически значимыми предикторами значительной морфофункциональной декомпенсации строения венозного сосуда. Также в качестве статистически значимых показателей, влияющих на развитие терминальных форм поражения венозной стенки, были определены факторы риска, а также высокий индекс массы тела пациентки. Более длительный стаж заболевания пациентов с ВБНК связан, вероятнее всего со значительно более выраженным положительным эффектом от консервативного лечения, по сравнению с пациентками, страдающими проявлениями ВБТ. Это в первую очередь обусловлено доступностью и результативностью компрессионной терапии при поражении вен нижних конечностей. Желание молодых пациенток с ВБТ нормализовать брачно-семейные и социальные функции, обусловленные тазовым болевым синдромом и диспареунией, ведет к более раннему их согласию на оперативное лечение, по сравнению с больными с ВБНК.
Выявленные формы поражения вен при ВБТ и ВБНК (гипертрофическая, фиброзная и атрофическая) являются последовательными стадиями одного заболевания. В начальных стадиях болезни преобладает гипертрофический тип поражения. Прогрессирование и длительное течение заболевания приводит к возникновению фиброзных изменений. На терминальных стадиях в венозной стенке превалируют атрофические изменения.
Длительное течение и дальнейшее развитие заболевания с потерей морфофункциональных свойств венозного сосуда приводит к эскалации патологических процессов и отягощению состояния пациенток с варикозным расширением вен, что предопределяет показания к проведению оперативных вмешательств по предотвращению последующих флебогипертензии и венозного рефлюкса.
Заключение . Таким образом, проведенное исследование показало, что морфологические изменения венозной стенки при ее варикозном расширении неспецифичны и представлены совокупностью атрофических, фибропластических и гипертрофических процессов в различных сочетаниях, приводящих к потере свойств венозной стенки. Результаты проведенного исследования свидетельствуют о схожести патоморфологической картины поражения вен, как при варикозной болезни таза, так и при варикозной болезни вен нижних конечностей. Патоморфологические изменения в яичниковых венах соответствовали преимущественно начальным стадиям поражения с преобладанием гипертрофических форм, в то время как в венах нижних конечностей в большей степени были встречены терминальные стадии в виде атрофических форм, что ассоциировано с более длительным течением заболевания у пациентов с ВБНК.
Список литературы Морфологические параллели строения сосудистой стенки при варикозном расширении вен таза и нижних конечностей
- Rabe E, Puskas A, Scuderi A, Fernandez QF, VCP Coordinators. Epidemiology of chronic venous disorders in geographically diverse populations: results from the Vein Consult Program. Int Angiol. 2012;31(2):105-115.
- Lohr JM, Bush RL. Venous disease in women: epidemiology, manifestations, and treatment. J Vasc Surg. 2013;57(4):37S-45S. https://doi.org/10.1016/j.jvs.2012.10.121.
- Howard FM. Chronic pelvic pain. Obstetrics Gynecology. 2003;101:594-611. https://doi.org/10.1016/S0029-7844(02)02723-0.
- Steenbeek MP, van der Vleuten CJM, Schultze KLJ, Nieboer TE. Noninvasive diagnostic tools for pelvic congestion syndrome: a systematic review. Acta Obstet Gynecol Scand. 2018;97(7):776-786. https://doi.org/10.1111/aogs.13311.
- Ganeshan A, Upponi S, Hon LQ, Uthappa MC, Warakaulle DR, Uberoi R. Chronic pelvic pain due to pelvic congestion syndrome: The role of diagnostic and interventional radiology. Cardiovasc Intervent Radiol. 2007;30:1105-1111.
- Belenky A, Bartal G, Atar E, Cohen M., Bachar G.N. Ovarian varices in healthy female kidney donors: incidence, morbidity, and clinical outcome. AJR Am J Roentgenol 2002;179:625-627.
- Gupta R, Gupta A, Aggarwal N. Variations of gonadal veins: embryological prospective and clinical significance. J Clin Diagn Res. 2015;9(2):AC08-10. https://doi.org/10.7860/JCDR/2015/9493.5578.
- Tsukanov YuT, Tsukanov AYu, Shcheglov AYu, Mozgovoy SI. Patomorfologiche-skie aspekty varikoznogo porazheniya ven nizhney poloviny tulovishcha. Vestnik Sankt-Peterburgskogo universiteta. 2006;11(3):50-61.
- Champaneria R, Shah L, Moss J, Gupta JK, Birch J, Middleton LJ, Daniels JP. The relationship between pelvic vein incompetence and chronic pelvic pain in women: systematic reviews of diagnosis and treatment effectiveness. Health Technology Assessment. 2016;20(5):1-108.
- Sharma K, Bora MK, Varghese J, Malik G, Kuruvilla R. Role of Trans Vaginal Ultrasound and Doppler in Diagnosis of Pelvic Congestion Syndrome. J Clinic and Diagnos Research. 2014;8(7):05-07.
- https://doi.org/10.7860/JCDR/2014/8106.4570.
- Durham JD, Machan L. Pelvic Congestion Syndrome. Semin Intervent Radiol. 2013;30:372-380.
- Ahmed O, Ng J, Patel M, Ward TJ, Wang DS, Shah R, Hofmann LV. Endovascular Stent Placement for May-Thurner Syndrome in the Absence of Acute Deep Vein Thrombosis. J Vasc Interv Radiol. 2016;27(2):167-173. https://doi.org/10.1016/j.jvir.2015.10.028.
- Antignani PL, Lazarashvili Z, Monedero JL, Ezpeleta SZ, Whiteley MS, Khilnani NM, Meissner MH, Wittens CH, Kurstjens RL, Belova L, Bokuchava M, Elkashishi WT, Jeanneret-Gris C, Geroulakos G, Gianesini S, de Graaf R, Krzanowski M, Al Tarazi L, Tessari L, Wikkeling M. Diagnosis and treatment of pelvic congestion syndrome: UIP consensus document. Int Angiol. 2019;38(4):265-283.
- https://doi.org/10.23736/S0392-9590.19.04237-8.
- He L, Giri TK, Vicente CP, Tollefsen DM. Vascular dermatan sulfate regulates the antithrombotic activity of heparin cofactor II. Blood. 2008;111(8):4118-25. https://doi.org/10.1182/blood-2007-12-127928.
- Raffetto JD, Khalil RA. Mechanisms of varicose vein formation: valve dysfunction and wall dilation. Phlebology. 2008;23:85-98.
- Greiner M, Dadon M, Lemasle P, Cluzel P. How does the patho-physiology influence the treatment of pelvic congestion syndrome and is the result long-lasting? Phlebology. 2012;27(1):58-64.


