Морфологическое исследование регионарных лимфатических узлов при экспериментальной злокачественной опухоли простаты
Автор: Ломшаков Андрей Александрович, Бородин Юрий Иванович, Асташов Вадим Васильевич, Казаков Олег Васильевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.23, 2015 года.
Бесплатный доступ
В исследовании с помощью гистологических и гистохимических методов изучено количество лимфатических и кровеносных сосудов в простате, структура тазовых и почечных лимфатических узлов при экспериментальной опухоли в простате у мышей линии CBA при трансплантации асцитной опухоли Эрлиха через 5 и 18 суток. На 5 сутки, в лимфатических узлах метастазов не обнаружено, выявлены характерные морфологические преобразования: паракортикальная гиперплазия, синусный гистиоцитоз, активация бласттрансформации. На 18 сутки в простате обнаружено полное замещение нормальной ткани атипичными клетками, в лимфатических узлах определяются метастазы, в тазовых лимфатических узлах обнаружена фолликулярная реакция, усиление транспортной функции, на фоне увеличения числа лимфатических сосудов в простате; в почечных лимфатических узлах выявлена паракортикальная гиперплазия, сокращение размеров мозговых синусов.
Лимфатические узлы, лимфатические сосуды, экспериментальная опухоль простаты
Короткий адрес: https://sciup.org/143177067
IDR: 143177067
Текст научной статьи Морфологическое исследование регионарных лимфатических узлов при экспериментальной злокачественной опухоли простаты
Введение. Рак простаты является причиной почти 10 % смертей мужчин от рака и одной из главных причин смерти у пожилых мужчин. В России до 70% больных раком предстательной железы обращаются к врачу уже в 3-4 стадии заболевания, при наличии метастазов [1]. Принципиальным моментом генерализации злокачественного роста является метастазирование опухолевых клеток в лимфатические узлы. В значительной степени это связано с прогностической ролью регионарных лимфатических узлов, подверженных структурным изменениям при злокачественном опухолевом процессе, а также обеспечивающих барьерно-детоксикационную функцию в лимфатических регионах [2, 3]. Структурная организация лимфатических узлов при раке простаты является одним из самых важных факторов, определяющих прогноз заболевания [4], выявление метастазов в лимфатических узлах важнейшей задачей определения стадии рака простаты [5]. Исследование регионарных лимфатических узлов и количества кровеносных и лимфатических сосудов простаты при трансплантационной индукции канцерогенеза, позволит нам выявить характерные изменения их структурной организации, зависящие от стадии опухолевого процесса, лимфогенного метастазирования, что имеет важное значение в оценке действия противоопухолевых соединений и препаратов.
Цель исследования - выявить структурные преобразование в опухоли простаты, тазовых и почечных лимфатических узлах в различные сроки формирования экспериментальной злокачественной опухоли простаты.
Материал и методы исследования. В работе использовали половозрелых 14 недельных самцов-мышей СВА в количестве 45 особей (виварий ФГБУ «Институт цитологии и генетики» СО РАН, Новосибирск). Все эксперименты выполнены в соответствии с «Правилами проведения работ с использованием экспериментальных животных», утвержденными приказом Минздрава СССР №577 от 12.08.77 г. Эксперименты выполнены с соблюдением принципов гуманности, изложенных в директиве Европейского Сообщества (86/609/ ЕС). Экспериментальная модель злокачественного опухолевого роста в простате создавалась путем инокуляции (под эфирным наркозом) разведенного клеточного штамма трансплантируемой асцитной опухоли Эрлиха (ОЭ) в паренхиму простаты: инъекциями вводили 0,2 мл асцитической жидкости содержащей 500-550х103 атипичных опухолевых клеток [6]. Экспериментальные животные были разделены на 3 экспериментальные группы:
-
1. интактные животные;
-
2. экспериментальная опухоль простаты (5 сутки);
-
3. экспериментальная опухоль простаты (18 сутки). Эвтаназия животных осуществлялась под эфирным наркозом на 5-е и 18-н сутки роста опухоли.
Для гистологического исследования забирали простату, фрагменты опухолевой ткани, тазовые (каудальные) и почечные лимфатические узлы, являющиеся по своему анатомо-топографическому расположению регионарными лимфатическими узлами I порядка для органов малого таза и простаты у мышей [7]. По стандартной гистологической методике выполняли проводку материала, заливали объекты исследования в парафиновые блоки, с которых делали срединные гистологические срезы толщиной 5 - 7 мкм [8] Срезы окрашивали гематоксилин - эозином и азур II – эозином. Гистологические препараты изучали на световых микроскопах Leica (Германия), МБС-10 при увеличении 32, 400 и 1000 раз, с помощью окулярной тестовой системы производили морфометрию срезов и подсчет клеточных элементов в опухоли и отдельных структурно - функциональных зонах лимфатических узлов, определяли соотношение паренхиматозного и соединительнотканного компонента в опухолевой ткани [9]. В качестве главного гистохимического маркера лимфатических эндотелиоцитов использовали 5’- нуклеотидазу (5Н), а для эндотелиоцитов кровеносных капилляров щелочную фосфатазу (ЩФ). Образцы ткани простаты подвергались быстрому замораживанию в жидком азоте. Далее, на крио-статном микротоме (MICROM HM 550) выполняли резку образцов на срезы толщиной 7 мкм и проводили постфиксацию в смеси ацетон/спирт 95% в течение 5 минут. На полученных срезах ткани простаты лимфатические и кровеносные микрососуды выявляли двухэтапным методом гистохимического окрашивания образца. В препаратах простаты, после гистохимического окрашивания, определяли среднее количество лимфатических и кровеносных сосудов в строме простаты и опухоли на площади 92927 мкм2 [10]. Статистическую обработку данных проводили с помощью t-критерия Стьюдента для зависимых выборок и определяли значимость различий (р – стандартная ошибка среднего). Критический уровень значимости в данном исследовании принимался р < 0,05 [11].
Результаты исследования и их обсуждение. Результаты микроскопического исследования простаты у мышей показали, что она представлена железистой паренхимой, разделенной соединительнотканными перегородками, выводными протоками заключенными в капсулу (рис. 1). В строме простаты в условиях физиологической жизнедеятельности животных (интактные животные, контроль) среднее количество кровеносных сосудов (артериолы) составляет 129,6±12,7, лимфатических сосудов 30,2±1,28 на исследованной площади. Микроскопически выявлено, что на 5 сутки индуцированного канцерогенеза простаты формируется опухолевый узел диаметром 1,5–2 мм, состоящий из полиморфных атипичных клеток (рис. 2).
Морфометрия стромы простаты на 5-е сутки эксперимента, свидетельствует, что количество кровеносных сосудов на площади среза уменьшается, в сравнении с интактными животными на 16%, лимфатических на 15%.
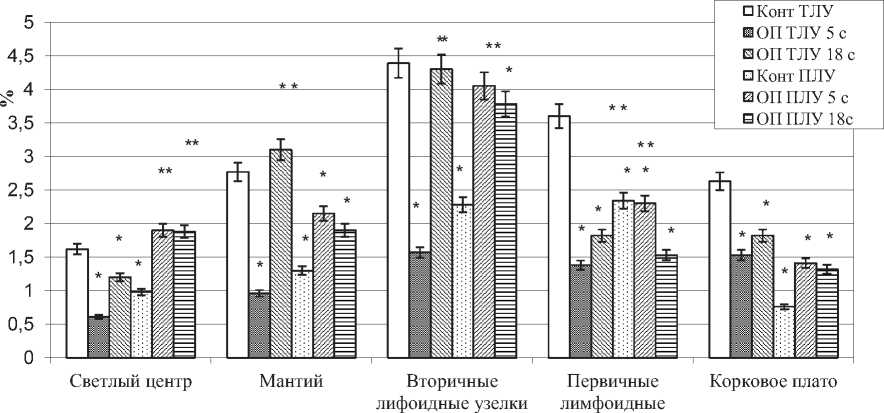
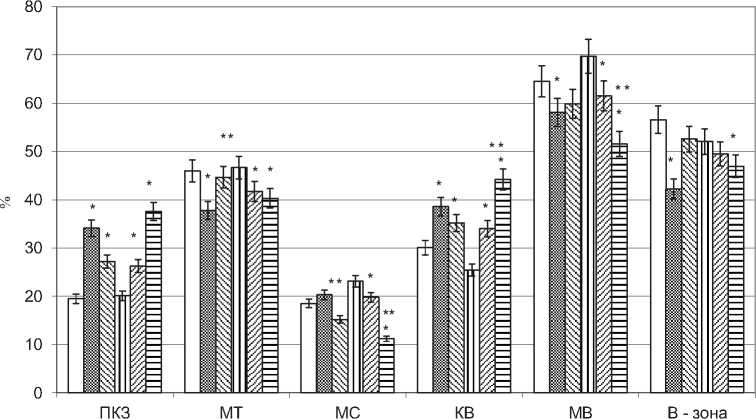
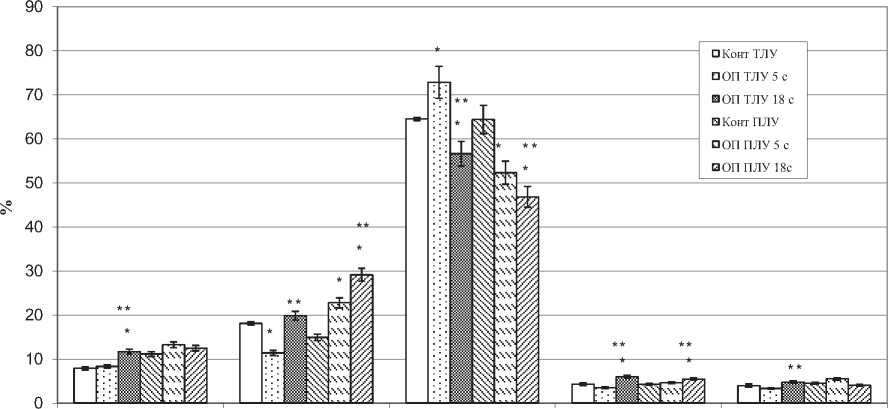
В тазовых лимфатических узлах на 5-е сутки, в сравнении с интактными животными, наблюдали увеличение площади тимусзависимой (паракор-тикальной) зоны на 74,9%, в почечных – на 30%. В тазовых лимфатических узлах уменьшалась площадь первичных и вторичных лимфоидных узелков – на 64,2%, мозговых тяжей – на 18%, В-зоны – на 25,4% (рис. 3 и 4). В почечных лимфатических узлах на данном этапе эксперимента выявлено увеличение размеров вторичных лимфоидных узелков на 77%, как за счет возрастания площади светлого центра, так и мантия, площадь коркового плато увеличилась на 85%. Размеры мозговых тяжей почечных лимфатических узлов уменьшились на 11%, мозговых синусов на 14 %, В-зоны на 5%.
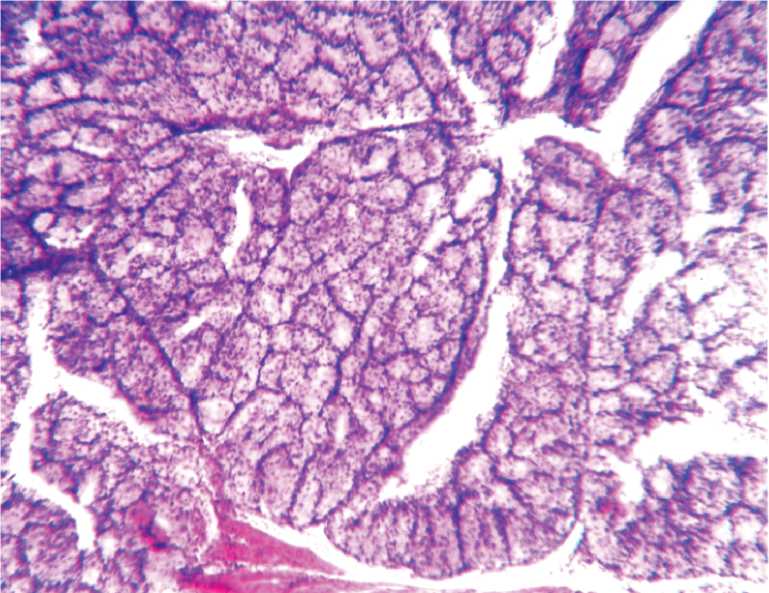
Рис. 1. Простата у интактной мыши. Контроль. Железистая паренхима с соединительнотканными перегородками и выводные протоки. Гематокси-лин-эозин.Ув.100
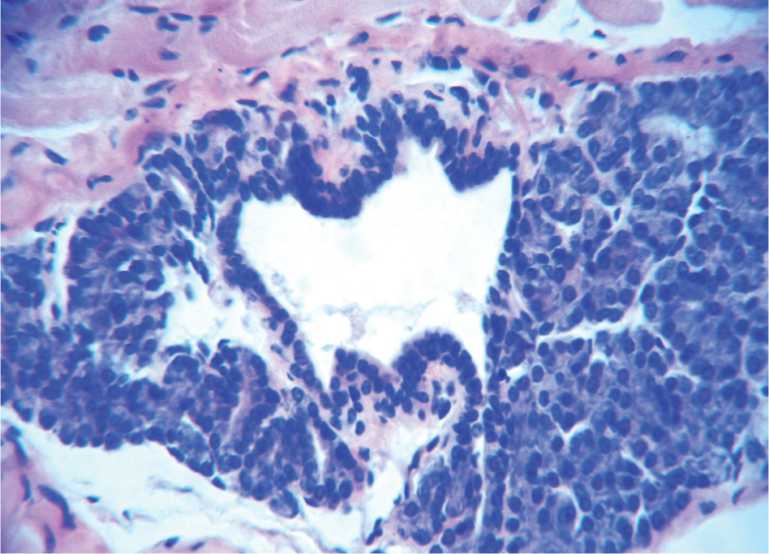
Рис. 2. Опухоль простаты у мышей. 5 сутки. Солидными пласты полиморфных клеток, разделенных тонкими прослойками соединительной ткани. Гематоксилин-эозин. Ув.400
узелки
Рис. 3. Относительная площадь светлых центров, мантия, первичных и вторичных лимфоидных узелков, коркового плато в тазовых (ТЛУ) и почечных (ПЛУ) лимфатических узлах в норме (Конт) и при опухоли простаты на 5 и 18 сутки (ОП 5 с, ОП 18 с), М+m, %, * - отличия достоверны в сравнении с контролем, ** - в сравнении с ОП 5 с при Р<0,05.
В структурных компонентах тазовых лимфатических узлов ответственных за гуморальное звено иммунитета (рис. 5) на 5 сутки роста опухоли выявлено увеличение числа зрелых форм клеток лимфоидного ряда (малых лимфоцитов в светлых центрах – на 13%) и незрелых форм клеток плазматического ряда (иммунобластов в мозговых тяжах – в 3,2 раза, незрелых плазматических клеток на 25% в мозговых синусах). Выраженная макрофа- гальная реакция отмечается только в мозговых тяжах (увеличивалось число макрофагов – на 69,7%) (рис.7). В почечных лимфатических узлах наблюдалась противоположная картина (рис.5), свидетельствующая об активации процессов пролиферации: в светлых центрах численность иммунобластов увеличивалась на 18%, средних лимфоцитов на 53%, клеток на стадии митоза в 2 раза, а количество малых лимфоцитов умень-
Конт ТЛУ
ОП ТЛУ 5 с
ОП ТЛУ 18 с
Конт ПЛУ
ОП ПЛУ 5 с
ОП ПЛУ 18с
Рис. 4. Относительная площадь паракортикальной зоны (ПКЗ), мозговых тяжей (МТ) и мозговых синусов (МС), коркового (КВ) и мозгового вещества (МВ), В- зависимой зоны (В-зона) в тазовых (ТЛУ) и почечных (ПЛУ) лимфатических узлах в норме (Конт) и при опухоли простаты на 5 и 18 сутки (ОП 5 с, ОП 18 с), М+m, %, * - отличия достоверны в сравнении с контролем, ** - в сравнении с ОП 5 с при Р<0,05.
ИБЛ СрЛ МЛ МФ РК
Рис. 5. Клеточный состав светлых центров вторичных лимфоидных узелков (ИБЛ - иммунобласты, СрЛ - средние лимфоциты, МЛ - малые лимфоциты, МФ - макрофаги, РК - ретикулярные клетки в тазовых (ТЛУ) и почечных (ПЛУ) лимфатических узлах в норме (Конт) и при опухоли простаты на 5 и 18 сутки (ОП 5 с, ОП 18 с), М + m, %, * - отличия достоверны в сравнении с контролем, ** - в сравнении с ОП 5 с при Р<0,05.
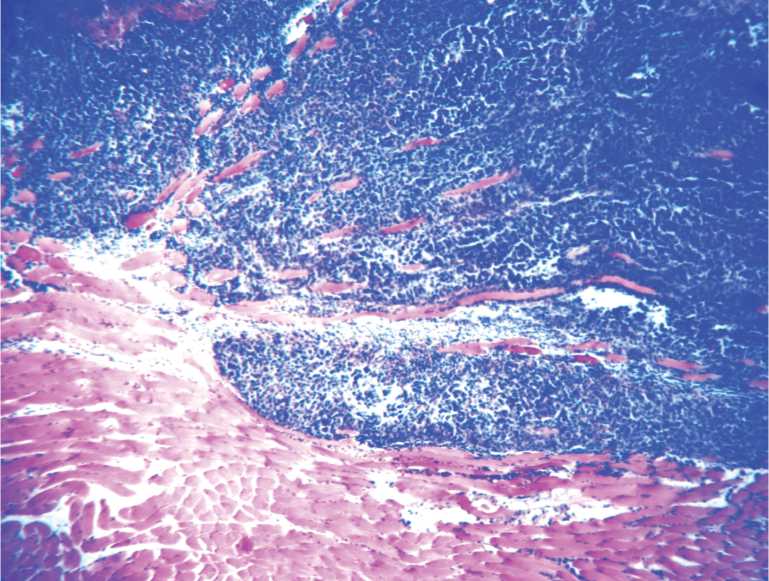
Рис. 6. Опухоль простаты у мышей. 18 сутки. Опухоль по структуре соответствует низкодифференцированной солидно-трабекулярной аденокарциноме с выраженными признаками анаплазии и инфильтрирующим ростом, строма опухоли, представлена аргирофильными волокнами с прослойками коллагеновых волокон. Гематоксилин-эозин.Ув.200
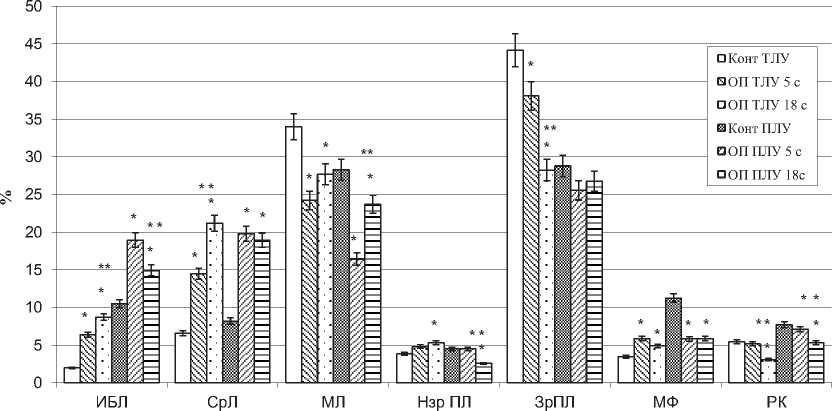
Рис. 7. Клеточный состав мозговых тяжей (ИБЛ - иммунобласты, СрЛ - средние лимфоциты, МЛ - малые лимфоциты, НЗрПЛ - незрелые плазматические клетки, ЗрПЛ - зрелые плазматические клетки, МФ - макрофаги, РК - ретикулярные клетки в тазовых (ТЛУ) и почечных (ПЛУ) лимфатических узлах в норме (Конт) и при опухоли простаты на 5 и 18 сутки (ОП 5 с, ОП 18 с), М + m, %, * - отличия достоверны в сравнении с контролем, ** - в сравнении с ОП 5 с при Р<0,05.
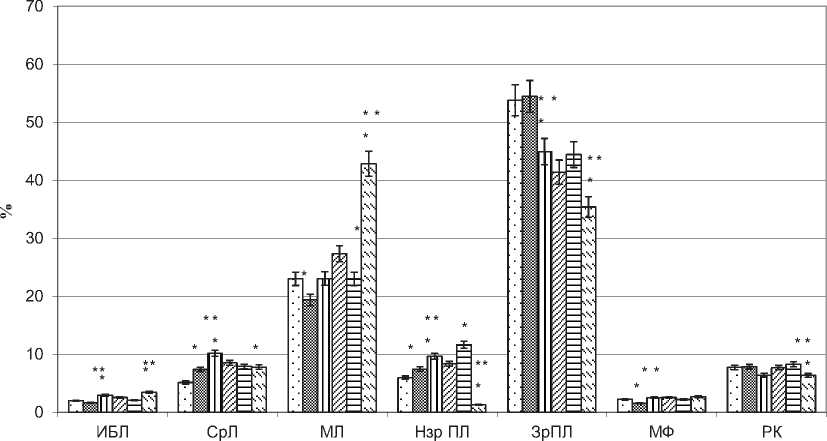
шалось на 19%. В мозговых тяжах увеличивалось число незрелых лимфоидных клеток (иммунобластов на 80%, средних лимфоцитов в 2,4), а количество макрофагов уменьшилось на 48%. Для клеточного состава мозговых синусов характерно было увеличение числа незрелых и зрелых плаз- матических клеток, на фоне уменьшения числа тучных клеток (рис. 8) .
На 18 сутки роста опухоли (2–ая экспериментальная группа) на гистологических срезах простаты мышей выявлено практически полное замещение ее структурных компонентов атипич-
Конт ТЛУ
ОП ТЛУ 5 с
ОП ТЛУ 18 с
Конт ПЛУ
ОП ПЛУ 5 с
ОП ПЛУ 18с
Рис. 8. Клеточный состав моговых синусов (ИБЛ - иммунобласты, СрЛ - средние лимфоциты, МЛ - малые лимфоциты, Нзр ПЛ - незрелые плазматические клетки, ЗрПЛ - зрелые плазматические клетки, МФ - макрофаги, РК - ретикулярные клетки в тазовых (ТЛУ) и почечных (ПЛУ) лимфатических узлах в норме (Конт) и при опухоли простаты на 5 и 18 сутки (ОП 5 с, ОП 18 с), М + m, %, * - отличия достоверны в сравнении с контролем, ** - в сравнении с ОП 5 с при Р<0,05.
ными полиморфными клетками (паренхима опухоли - 82,3±0,63 %, строма опухоли – 17,7± 0,43%, стромально-перенхиматозный индекс – 0,22±0,01, ядерно-цитоплазматический индекс - 1,66±0,3.). Строма опухоли скудная, с прослойками коллагеновых волокон. Хорошо выражена лимфоплазмоцитарная инфильтрация, локализующаяся, преимущественно, по ходу сосудов, много очагов некрозов и кровоизлияний. Паренхима опухоли представлена крупными атипичными клетками, отличающимися выраженным полиморфизмом, овальной, иногда вытянутой или полигональной формы с гиперхромными ядрами (рис. 6).
На 18-е сутки эксперимента, в строме опухоли количество кровеносных сосудов, по сравнению с интактными животными, уменьшилось на 29%, лимфатических на 7%, а по сравнению с 5 сутками эксперимента количество артериол уменьшилось на 16,3%, лимфатических сосудов - увеличилось на 8,5%.
На 18-е сутки опухолевого роста в краевом и мозговых синусах лимфатических узлов выявлены метастазы опухоли - крупные атипичные клетки, отличающиеся выраженным полиморфизмом. По сравнению с интактными животными, в тазовых и почечных лимфатических узлах выраженные признаки паракортикальной гиперплазии - площадь паракортикальной зоны увеличивалась на 40 % и 87% в сравнении с интактными животными (рис.4), при этом в почечных лимфатических узлах площадь паракортикальной зоны возрастала и по сравнению с 5 сутками опухолевого роста, а в тазовых уменьшалась. В почечных лимфатических узлах в сравнении с интактными животными уменьшились размеры мозговых тяжей на 14%, мозговых синусов на 52%. В целом, в данном лимфатическом узле размеры коркового вещества увеличились в сравнении с 5 сутками роста опухоли на 30%, а в тазовых лимфатических узлах уменьшились на 9%. соответственно корковомозговой индекс тазовых лимфатических узлов уменьшился, а почечных увеличился. Площадь В-зависимой зоны в почечных лимфатических узлах, по сравнению с 5 сутками роста опухоли уменьшилась на 6 %, а в тазовых наоборот, увеличилась на 24% (рис. 4).
Определяются кардинальные изменения в цитоархитектонике тазовых лимфатических узлов на 18 сутки эксперимента, в сравнении с интактными животными, свидетельствующие об активации пролиферативных процессов и выраженной макрофагальной реакции в В-зависимой зоне лимфатических узлов: в светлых центрах возрастает число иммунобластов на 48%, макрофагов на 40%, а мозговых тяжах – количество иммунобластов увеличивается в 4 раза, незрелых плазматических клеток на 40%, макрофагов на 41% (рис. 5, 7). По сравнению с 5 сутками опухолевого роста в светлых центрах лимфоидных узелков тазовых лимфатических узлов возрастает число незрелых клеток лимфоидного ряда (иммунобластов на 40%, клеток на стадии митоза на 48%, средних лимфоцитов на 74%), макрофагов на 72%, ретикулярных клеток на 45%; в мозговых тяжах и мозговых синусах, также наблюдалось увеличение иммунобластов на 36% и 78% соответственно, средних лимфоцитов на 46% и 38%, незрелых плазматических клеток на 10% и 28% соответственно, но при этом уменьшалось количество ретикулярных клеток на 40% и 19%, зрелых плазматических клеток на 26% 19% соответственно. В мозговых синусах данных лимфатических узлов численность макрофагов в сравнении с 5 сутками эксперимента возрастала на 84%, а в мозговых тяжах наоборот, уменьшалась на 17% (рис. 8).
В клеточном составе светлых центров почечных лимфатических узлов (рис.5), по сравнению с интактными животными увеличивалось число иммунобластов на 12%, средних лимфоцитов на 95%, клеток на стадии митоза в 2,8 раза, макрофагов на 28%, на фоне снижения количества малых лимфоцитов на 28%. В сравнении 5 сутками роста опухоли, в светлом центре лимфоидных узелков возрастает численность макрофагов (на 17%) незрелых лимфоидных клеток (клеток на стадии митоза на 17%, средних лимфоцитов на 27%). В мозговых тяжах (рис. 7) почечных лимфатических узлов на 18 сутки роста опухоли, по сравнению с интактными животными возрастало количество иммунобластов на 42%, средних лимфоцитов в 2,3 раза, на фоне уменьшения числа плазматических клеток (незрелых плазмоцитов на 44%, зрелых плазмоцитов на 7%), макрофагов на 48%, ретикулярных клеток на 32%. По сравнению с 5 сутками роста опухоли, количество иммунобластов в мозговых тяжах почечных лимфатических узлов наоборот уменьшается на 21%, численность малых лимфоцитов возрастает на 44%, количество незрелых плазматических и ретикулярных клеток уменьшается на 43 и 26% соответственно. В мозговых синусах почечных лимфатических узлов (рис. 8), в сравнении с интактными животными уменьшается количество плазматических клеток (незрелых плазматических клеток на 75%, зрелых – на 15%). В сравнении с 5 сутками опухолевого роста в синусах отмечено значительное сокращение числа этих клеток (незрелых плазматических клеток на 90%, зрелых на 21%), сопровождающееся увеличением количества иммунобластов на 66%, малых лимфоцитов на 86% и уменьшением численности ретикулярных и тучных клеток.
Таким образом, на 5-е сутки роста опухоли в региональных лимфатических узлах простаты обнаружены однонаправленные изменения в их структурной организации, выражающиеся в увеличении площади коркового вещества: в тазовых лимфатических узлах преимущественно за счет размеров паракортикальной зоны (паракорти-кальная гиперплазия), в почечных, как за счет площади вторичных лимфоидных узелков и коркового плато, так и за счет размеров паракотикальной зоны. В цитоархитектонике светлого центра и мозговых тяжей почечных лимфатических узлов на данном этапе эксперимента, в сравнении с тазовыми лимфатическими узлами, отмечается выраженное увеличение численности незрелых лимфоидных клеток (клетки на стадии митоза, иммунобласты, средние лимфоциты), что свидетельствует об активации процессов пролиферации. В светлых центрах тазовых лимфатических узлах, наоборот наблюдалось сокращение числа незрелых лимфоидных клеток, на фоне возрастания количества зрелых (малые лимфоциты), сопровождающееся увеличением количества макрофагов.
На 18-е сутки с момента индукции злокачественной опухоли простаты в тазовых и почечных лимфатических определяются атипичные опухолевые клетки, в сравнении с интактными животными сохраняется паракортикальная гиперплазия, которая в почечных лимфатических узлах нарастает. В сравнении с I –ой стадией канцерогенеза (5 сутки роста опухоли, отсутствие метастазов в лимфатических узлах) структурные преобразования исследуемых лимфатических узлов разнона-правлены, что, по-видимому, обусловлено их анатомической локализацией и регионом лимфос-бора. В тазовых лимфатических узлах размеры коркового вещества уменьшались, увеличивалась площадь В-зависимой зоны, преимущественно за счет возрастания размеров мозговых тяжей, что свидетельствует об активации их транспортной функции. В почечных лимфатических, наоборот, размеры мозговых тяжей и синусов значительно уменьшились, значение корково-мозгового индекса возросло, что может свидетельствовать о снижении транспортного потенциала лимфатического узла, замедлении тока лимфы, активации процессов лимфопоэза. Характерным для цитоархитектоники обеих групп лимфатических узлов, в сравнении с 5 сутками эксперимента, является увеличение числа незрелых лимфоидных клеток, а в тазовых лимфатических узлах активация макрофагальной реакции.
На основании полученных данных можно заключить следующее: а) на ранней стадии канцерогенеза (5-е сутки роста опухоли, I стадия) простаты структурные преобразования в региональных лимфатических узлах простаты свидетельствуют снижении их транспортной функции, активации барьерно-фильтрационной функции
(паракортикальная гиперплазия, активация процессов пролиферации макрофагальной реакции) являющихся показательными для I стадии канцерогенеза [12]; б) на поздней стадии канцерогенеза (18-е сутки роста опухоли, II-III стадия) сопровождающейся метастазированием и увеличением числа лимфатических сосудов в ткани опухоли, по-видимому, происходит перераспределение лим-фотока и изменение структурно специализации лимфатических узлов: в тазовых лимфатических узлах, являющихся магистральными в регионе лимфосбора в малом тазу, наблюдается фолликулярная реакция, усиливается транспортная функция (синусный гистиоцитоз), что, по-видимому, обусловлено увеличение объема поступающей лимфы из опухолевой ткани (увеличение числа лимфатических сосудов в опухоли); в почечных лимфатических узлах выявлена выраженная па-ракортикальная гиперплазия определяется характерная синусная реакция на метастазирование – сокращение размеров мозговых синусов, что приводит к изменению структурно-функциональной специализации лимфатического узла.
Результаты проведенных нами исследований позволяют заключить, что в динамике роста опухоли простаты комплексная реакция регионарного лимфатического аппарата (лимфатические сосуды и узлы) обусловлена стадией опухолевого процесса, наличием метастазов в лимфатических узлах и их анатомической локализацией. На стадии метастазирования опухоли структурные преобразования в лимфатических узлах сопряжены с дилатацией лимфатических сосудов и увеличением их числа в строме опухоли [6].
Список литературы Морфологическое исследование регионарных лимфатических узлов при экспериментальной злокачественной опухоли простаты
- Матвеев Б.П., Бухаркин Б.В., Матвеев В.Б. Рак предстательной железы.-М.-1999.-153с.
- Бородин Ю.И. Лимфология как наука: некоторые итоги и перспективы//Проблемы клинической и экспериментальной лимфологии: Материалы Международной конференции, Новосибирск, 1996. С. 31-42.
- Clayton F., Hopkins C.L. Pathologic correlates of prognosis in limph-node positive breast carcinoma//Cancer, 1993. -№71.P.1780-90.
- Алексеев Б.Я., Русаков И.Г., Франк Г.А., Андреева Ю.Ю., Белова Е.А., Беспалов П.Д., Нюшко К.М. Определение сторожевых лимфатических узлов у больных раком предстательной железы//Российский онкологический журнал. 5. 2006.C.16-22
- Harisinghani M.G., Barentsz J., Hahn P.F., Deserno W.M., Tabatabaei S., van de Kaa C.H., de la Rosette J., Weissleder R. Noninvasive detection of clinically occult lymph-node metastases in prostate cancer//N Engl J. Med. 2003.348(25). P.2491-9
- Асташов В.В. Лимфатические узлы и сосуды при экспериментальной опухоли простаты/В.В. Асташов, А.А. Ломшаков, П.М. Ларионов, О.В. Казаков, Н.Б. Исакова, В.Б. Прохожев//Вестник НГУ. Серия: Биология, медицина. -2011. -Т.9., №2. -С.118-125
- Мичурин И.Е. Регионарные лимфатические узлы яичка в норме, при экспериментальном опухолевом росте в яичке и его лечении цитостатиками и фитопрепаратами/дисс..канд.мед.наук, 14.00.02 -Новосибирск, 2004 -129 с.
- Саркисов Д.С., Перов Ю.Л. Микроскопическая техника: Руководство-М.: Медицина -1996. -544 с.
- Автандилов Г.Г. Медицинская морфометрия. Руководство.-М.:Медицина-1990.-384с.
- Kato S., Itonaga I., Ji R.C. and Miura M. Enzyme triple staining for differentiation of lymphatics from venous and arterial capillaries.//Lymphology -№29 -p.15-19.
- Лапач С.Н., Чубенко Л.В., Бабич П.Н. Статистические методы в медико-биологических исследованиях с использованием Excel. -К.: МОРИОН -2001.-408 с.
- Цыплаков Д.Э., Петров С.В. Рак и регионарные лимфатические узлы (иммуногистохимическое и ультраструктурное исследование)//Архив патологии. -1997. -№1. -C. 12-19.


