Морфологическое обоснование применения интраоперационной лучевой терапии для профилактики локорегионального рецидива у больных с протоковой аденокарциномой поджелудочной железы
Автор: Сетдикова Галия Равилевна, Карпов Алексей Андреевич, Паклина Оксана Владимировна, Кнышинский Григорий Владимирович, Тавобилов Михаил Михайлович, Шабунин Алексей Васильевич
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 1 (22), 2017 года.
Бесплатный доступ
Введение Протоковая аденокарцинома поджелудочной железы ассоциируется с очень плохим прогнозом, ранней локорегиональной инвазией и быстрым развитием отдаленных метастазов. Одной из причин этого является высокая частота периневральной инвазии. Цель В данном исследовании показана необходимость комбинированного подхода к лечению больных с протоковой аденокарциномой поджелудочной железы в виде применения радикального хирургического вмешательства, дополненного ИОЛТ. Результаты В 14,5% (22/152) можно утверждать об ограничении опухоли в пределах ПЖ, что соответствует рТ 1-2, pN0, extraPn 0, R0. Показатель R1 обнаружен в 32,1% случаев (49/152). Экстрапанкреатическая периневральная инвазия выявлена в 36,8% случаев (56/152). Метастазы в региональных лимфатических узлах обнаружили в 62,5% (95/152) случаев ПАК ПЖ. При исследовании аутопсийного материала основные морфологические параметры динамики опухоли включают локорегионарную прогрессию и/или дистантную прогрессию. Локорегионарный рецидив обнаружен в 85% случаев (29/34), проявляющийся наличием экстарпанкреатической периневральной инвазии в ложе удаленной опухоли. Среднее время от оперативного лечения до локорегионарного рецидива без extraPn - 14 месяцев, с наличием extraPn - 9 месяцев. Выводы Локорегионарный рецидив у больных непосредственно связан с наличием именно экстрапериневральной инвазии. Выявленная субпопуляция больных без дистантной прогрессии, а только с наличием локорегионарного распространения, диктует необходимость применения комбинированного подхода с обязательным использованием ИОЛТ для достижения максимального эффекта от проведенного хирургического лечения и увеличения продолжительности жизни больных с протоковым раком поджелудочной железы.
Протоковый рак поджелудочной железы, лучевая терапия, периневральная инвазия
Короткий адрес: https://sciup.org/140223340
IDR: 140223340 | DOI: 10.18027/2224-5057-2017-1-52-60
Текст научной статьи Морфологическое обоснование применения интраоперационной лучевой терапии для профилактики локорегионального рецидива у больных с протоковой аденокарциномой поджелудочной железы
Протоковая аденокарцинома поджелудочной железы (ПАК ПЖ) является одной из пяти ведущих причин смерти от рака во всем мире. В большинстве случаев протоковый рак ПЖ к моменту его диагностики является не-резектабельным, что обуславливает низкую 5-летнюю выживаемость – менее 5–7% [1]. На момент диагностики ПАК ПЖ у абсолютного большинства больных отмечено местное распространение опухоли (периневральная инва- зия и поражение регионарных лимфатических узлов и др.) и наличие отдаленных метастазов [2]. Даже радикальный характер проведенной операции по данным патологоанатомического исследования при протоковом раке поджелудочной железы не исключает прогрессирования заболевания в ближайшее время [3]. Критерии радикальности хирургического лечения (статус R) включают:
– R0 – гистологически радикальная резекция при отсутствии опухолевых комплексов в 1 мм от изучаемого края резекции;
-
– R1 – при наличии опухолевых комплексов менее 1 мм от изучаемого края резекции;
-
– R2 – макроскопически позитивный край резекции.
Ключевое значение этого параметра для исхода резекции ПАК стало общепризнанным ещё в начале 1990 г. [4]. Согласно современным протоколам по диссекции протокового рака ПЖ к краям резекции при ПАК ПЖ следует относить: – хирургический срез железы;
-
– радиальный перидуктальный край (срез общего желчного протока);
-
– заднюю поверхность железы;
-
– медиальную поверхность железы (с обязательным разделением на край верхней брыжеечной вены и артерии – SMA и SMV);
-
– верхняя поверхность железы.
Отличительной чертой ПАК является распространение опухолевого роста по протокам, лимфатическим путям и периневральным пространствам. Приневральная инвазия (Pn) обусловлена анатомическим расположением железы и впервые описана в работах Drapiewski J. R. с коллегами в 1940 г. [5]. Подробное изучение периневральной инвазии при ПАК ПЖ проведено в 1970 г. в Японии благодаря внедрению агрессивного подхода к хирургическому лечению рака ПЖ, включающего удаление забрюшинной клетчатки [9–11]. Периневральную инвазию при протоковом раке ПЖ необходимо разделять на три подтипа: интрапанкреатическую (intraPn), интрапанкреатическую периневральную внеопухолевую инвазию и экстрапанк-реатическую (extraPn). Как правило, интрапанкретаическая периневральная инвазия обнаружена в 90–100% случаев и клинического значения не имеет [9]. В то время как ЭПНИ выявляется в 15–30% случаев и является независимым прогностическим фактором. Согласно японской классификации extraPn разделяют следующим образом [10]: (I) сплетение головки поджелудочной железы; (II) сплетение брюшной полости; (III) сплетение вокруг верхней брыжеечной артерии;
-
( IV) сплетение печеночно-двенадцатиперстной связки; (V) аортальное сплетение; и (IV) селезеночное сплетение. Следует отметить, что корреляции между размером опухоли и наличием экстрапанкреатической периневральной ивазии не прослежено. Также существует микроскопическая градация периневральной инвазии при ПАК ПЖ в зависимости от количества пораженных нервных
стволиков: Pn0 – нет поражения; Pn1 (не выраженная) – поражение от 1–5 нервных стволиков; Pn2 (умеренная) – от 6–10 нервных стволиков; и Pn3 (выраженная) – при поражении более 10 нервных стволиков [11]. Согласно TNM классификации злокачественных опухолей периневральную инвазию классифицируют на [12]:
-
• PnХ – периневральная инвазия не может быть оценена;
-
• Pn0 – нет периневральной инвазии;
-
• Pn1 – есть периневральная инвазия.
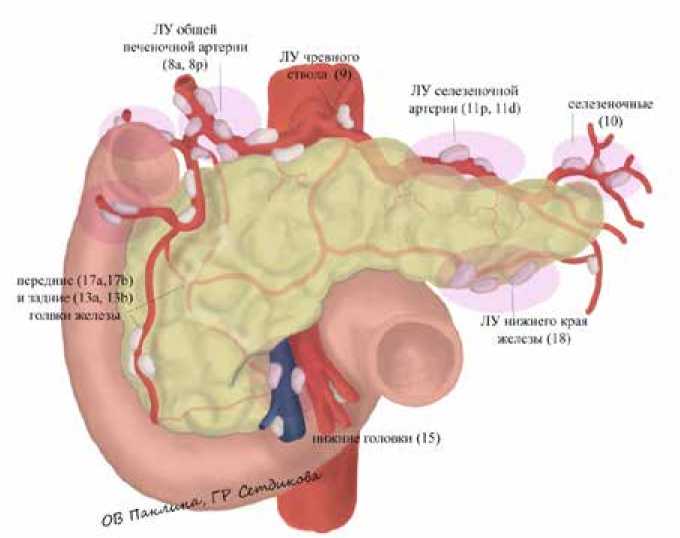
Рис. 1. Группы лимфатических узлов поджелудочной железы
|
Таблица 1 |
||
|
Группа |
Головка |
Тело и хвост |
|
Группа I |
13a, 13b, 17a, 17b |
8a, 8p, 10, 11p, 11d, 18 |
|
Группа II |
6, 8a, 8p, 12a, 12b, 12p, 14p, 14d |
7, 9, 14p, 14d, 15 |
|
Группа III |
1, 2, 3, 4, 5, 7, 9, 10, 11p, 11d, 15, 16a2, 16b1, 18 |
5, 6, 12a, 12b, 12p, 13a, 13b, 17a, 17b, 16a2, 16b1 |
Примечание: Метастазы, обнаруженные в группе III лимфатических узлов, расцениваются как дистантные (рМ1)
приятный прогноз у больных ПАК ПЖ при соотношении ЛУ+/ЛУОбщ > 0,3 [27]. Согласно японской классификации группы лимфатических узлов приведены на рис. 1 и в таблице 1 [28].
Согласно нашим исследованиям для ПАК ПЖ характерны три пути распространения [29]:
– прямой (только R1) – позитивные края резекции;
– локорегионарный тип (рN1 и/или extraPn) – поражение регионарных лимфатических узлов и/или наличие экс-трапанкреатической периневральной инвазии;
– смешанный тип (R1 и рN1 и/или extraPn) – сочетание прямого и локорегионарного распространения.
Таким образом, учитывая большой процент периневральной инвазии при протоковом раке поджелудочной железы, а следовательно, и высокую частоту локорегионарного рецидива опухоли у больных, проблема предотвращения быстрого прогрессирования при ПАК ПЖ остается актуальной и требует поиск комбинированных методов лечения. Одним из таких дополнительных методов лечения больных является интраоперационная лучевая терапия (ИОЛТ) [30]. Данная процедура позволяет прецизионно подвести максимальную дозу облучения к ложу опухоли для элиминирования потенциального риска сохраняющегося опухолевого процесса в ходе симультанного хирургического вмешательства с возможностью защиты окружающих тканей и анатомических структур от лучевого воздействия [31].
Интраоперационная лучевая терапия уже многие годы является дополнительной методикой в комплексном лечении опухолей различной локализации. В 1969 году Yamano впервые опубликовал опыт проведения ИОЛТ при раке головки поджелудочной железы [32]. Но несмотря на это, при ПАК ПЖ выполнено всего 80 процедур ИОЛТ в 21 хирургическом центре Европы, что составило 2,1% [33].
В данном исследовании показана необходимость комбинированного подхода к лечению больных с протоковой аденокарциномой поджелудочной железы в виде применения радикального хирургического вмешательства, дополненного ИОЛТ.
МАТЕРИАЛЫ И МЕТОДЫ
В ходе последующего стандартизированного морфологического исследования особое внимание уделяли поверхностям удаленной поджелудочной железы. Для удобства микроскопического исследования показателей R0, R1 поверхности ткани ПЖ при макроскопическом исследовании маркировали специальными чернилами «Марк Ит» компании «Richard-Allan Scientific™ Mark-It™ Tissue Marking Dyes» согласно рекомендациям [34].
Прогрессию опухоли оценивали через 8–12 недель после завершения химиотерапевтичсекого лечения. Для оценки локорегионарного рецидива ПАК ПЖ у больных использовались клинические, радиологические и биохимические критерии. Клиническими признаками служили: болевой синдром, снижение массы тела, индекса массы тела, дуоденальная непроходимость. В качестве базовой лучевой диагностики рутинно использовалась мульти-спиральная компьютерная томография органов брюшной полости в многофазном режиме. КТ-критерием локоре-гионарного рецидива служило появление гиповаскуляр-ных образований в проекции ложа удаленной опухоли, признаки перисосудистых гиповаскулярных опухолевых масс. При недостаточности МСКТ-данных использовалась МРТ с внутривенным усилением, а по показаниям ПЭТ/ КТ. Лабораторными признаками рецидива опухолевого процесса служила элевация уровня опухолевых маркеров (СА 19–9 и РЭА).
Кроме того, были изучены 34 случая аутопсийного материала больных, перенесших в анамнезе радикальное хирургическое лечение по поводу рака поджелудочной железы. Изучалась только забрюшинная парапанкреати-ческая клетчатка, что соответствовало ложу удаленного комплекса. При изучении протоколов гистологического исследования первичной опухоли не во всех случаях использован стандартизированный протокол диссекции и органокомплекса при ПАК ПЖ и поэтому достоверно оценить влияние частоты R1 статуса в данной группе на развитие локорегионарного рецидива не представляется возможным.
РЕЗУЛЬТАТЫ
При макроскопическом исследовании опухолевый узел на разрезе матового белесовато-серого или беловато-желтого цвета, каменистой плотности. Нередко в центре опухоли можно обнаружить очаги распада с формированием полостей различной формы.
Микроскопически в большинстве случаев, 76,9% (117/152), опухоль представлена железистыми структурами неправильной формы, состоящими из опухолевых клеток с различным содержанием муцина, выраженной десмопластической реакцией стромы, как правило, занимающей большой процент площади опухолевой массы (от 50–80%). В 35/152 наряду с железистыми структурами обнаружен анапластический компонент (саркомо-подобный), представленный крупными полиморфными или веретенообразными клетками с гиперхромными ядрами, иногда многоядерными, с минимальным стромальным компонентом. Объем анапластического компонента разнился и составил от 5 до 20% общей массы опухоли, но во всех случаях не являлся преобладающим.
В большинстве случаев опухоль распространялась за пределы поджелудочной железы (рис. 2):
– инвазия в стенку двенадцатиперстной кишки – обнаружена в 68% случаев (68/100);
– инвазия в селезенку – обнаружена в 48% случаев (25/52);
– инвазия в перипанкреатические мягкие ткани – в 50% случаев (76/152);
– наличие экстрапанкреатической периневральной инвазии – в 36,8% случаев (56/152).
В 24,3% (37/152) случаев опухоль оставалась в пределах ПЖ – рТ 1 и рТ 2 стадии. При этом размер опухолевого узла не влиял на наличие или отсутствие распространения опухоли, поскольку и для небольших карцином также характерен распространенный процесс за пределы ПЖ в виде поражения регионарных лимфатических узлов или наличия экстрапанкреатической периневральной инвазии. Поэтому только в 14,5% (22/152) можно утверждать об ограничении опухоли в пределах ПЖ, что соответствует рТ 1–2, pN0, extraPn 0, R0 (табл. 2).
Показатель R1 обнаружен в 32,1% случаев (49/152), при этом чаще поражалась медиальная поверхности (SMA) – 17/49, далее в убывающем порядке: задняя поверхность – 17/49 и 1/49 случаев – верхняя и радиальный перидук-тальный край. По количеству позитивных краев: один край – 57,1% (28/49), одновременно поражение двух краев – 38,7% (19/49) и трех краев – 4,1% (2/49).
Экстрапанкреатическая периневральная инвазия в большинстве, 31/42 случаев, обнаружена в области верхней брыжеечной артерии (SMA край) при опухоли головки ПЖ. При наличии опухоли в теле/хвосте ПЖ extraPn чаще выявлена в области селезеночного сплетения.
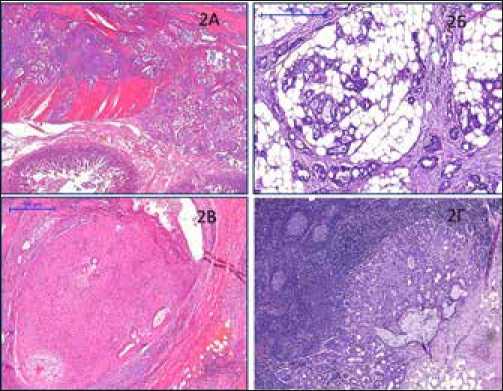
Рис. 2. Микроскопическая характеристика ПАК ПЖ:
Рис. 2А – инвазия в стенку двенадцатиперстной кишки. Окр. гематоксилином и эозином. Ув.x200
Рис. 2Б – инвазия в парапанкреатические мягкие ткани. Окр. гематоксилином и эозином. Ув.x200
Рис. 2В – экстрапанкреатическая периневральная инвазия. Окр. гематоксилином и эозином. Ув.x400
Рис. 2Г – метастаз в регионарный лимфатический узел. Окр. гематоксилином и эозином. Ув.x200
Таблица 2. Распространение протокового рака
|
Тип распространения (n=152) |
рТ 1 |
рТ 2 |
рТ 3 |
рТ 4 |
|
Нет |
7 |
15 |
15 |
0 |
|
Прямое (R1) |
0 |
0 |
14 |
1 |
|
pN1 |
2 |
12 |
25 |
0 |
|
Локорегионарное extraPn1 |
0 |
2 |
9 |
0 |
|
pN1+ extraPn1 |
0 |
0 |
14 |
0 |
|
R1 + pN1 |
0 |
0 |
12 |
0 |
|
Смешенное R1+ extraPn1 |
0 |
0 |
4 |
2 |
|
R1+ pN1+ extraPn1 |
0 |
0 |
18 |
2 |
По нашим данным extraPn можно рассматривать как независимый прогностический фактор. Выявлена обратная корреляционная зависимость между продолжительностью жизни больных после проведенного оперативного лечения и наличием ЭПНИ (r= –0,52 p=0,0002). Так, спустя 6 месяцев после хирургического лечения, КДВ равнялась 0,85 без и с наличием ЭПНИ. А в дальнейшем данные разнились и, спустя 12 месяцев после оперативного лечения, КДВ составила 0,58 и 0,38 без и с наличием ЭПНИ, соответственно. Нами выявлена статистически значимая связь между ЭПНИ и наличием гематогенных метастазов (r=0,71 p= 0,0002), а также стадией заболевания
Таблица 3. Морфологические показатели прогрессии опухоли при аутопсийном исследовании
Группа 1 (n=34)
Локальная прогрессия Да 29/34
Дистантная прогрессия (МКБ)
Печень 17/34 (HEP (C22))
Легкие 12/34 (PUL (C34)) Перитонеум 15/34 (PER (C48.1, 2))
Таблица 4. Обобщающие данные протокового рака ПЖ
Операционный Аутопсийный материал
|
Признак |
материал n=152 |
n=34 первоначальные данные |
|
Локализация |
||
|
Головка |
100 |
20 |
|
Тело/хвост |
52 |
14 |
|
Пол |
||
|
М: Ж |
1,2:1 |
1,5:1 |
|
Возраст (лет) |
40–80 |
54–81 |
|
Средний |
54 |
61,5 |
|
рТ 1 |
9 |
- |
|
рТ 2 |
29 |
6 |
|
рТ 3 |
109 |
28 |
|
рТ 4 |
5 |
- |
|
Pn |
||
|
intraPn |
112 |
Данных нет |
|
extraPn |
56 |
29/34 |
|
G1 |
2 |
|
|
G2 |
71 |
|
|
G3 |
17 |
Данных нет |
|
+АК |
35 |
|
|
R0 |
103 |
|
|
R1 |
49 |
Данных нет |
|
pN1 |
95 |
21 |
|
Адъювантная |
||
|
химиотерапия |
||
|
Нет |
56 |
23 |
|
Монотерапия |
||
|
(ГЦБ) |
54 |
9 |
|
Комбинированная |
42 |
2 |
Примечание: М – мужчины, Ж – женщины, Pn – периневральная инвазия, intraPn – интрапанкреатическая периневральная инвазия, АК – анапластический компонент, extraPn – экстрапан-креатичекая периневральная инвазия, pN1 -позитивные лимфатические узлы. ГЦБ – гемцитабин
(r=0,30 p=0,01). Мы не выявили статистически значимой корреляционной связи между статусом R1 (позитивный край резекции) и наличием ЭПНИ (p>0,05).
Метастазы в региональных лимфатических узлах обнаружили в 62,5% (95/152) случаев ПАК ПЖ. Выявлена статистически значимая корреляция между поражением лимфатических узлов и extraPn (r=0,36 p=0,002) в отличие от случаев с intraPn, что объясняется прогрессированием заболевания и синхронизацией путей метастазирования.
При исследовании аутопсийного материала основные морфологические параметры динамики опухоли включают локорегионарную прогрессию и/или дистантную прогрессию (табл. 4). Локорегионарный рецидив обнаружен в 85% случаев (29/34), проявляющийся наличием экстарпанкреатической периневральной инвазии в ложе удаленной опухоли. Не обнаружено статистически значимой корреляционной зависимости между наличием локорегионарного рецидива и статусом R1 (p>0,05), что связано с отсутствием стандартизированного морфологического исследования первичной опухоли. Очевидно, что проведенное хирургическое лечение в объеме ПДР/ ГПДР не влияет на частоту локорегионарного рецидива, а скорее является временной его характеристикой. Кроме того, ни в одном случае аутопсийного материала не обнаружены метастазы в лимфатические узлы III порядка. Дистантная прогрессия обнаружена в 71% (24/34) случаев. Выявлена субпопуляция больных – 10/24 случаев, у которых выявлена только локорегио-нарная прогрессия, без наличия дистантной прогрессии. Среднее время от оперативного лечения до локорегио-нарного рецидива без extraPn – 14 месяцев, с наличием extraPn – 9 месяцев.
ОБСУЖДЕНИЕ
Одной из основных и актуальных междисциплинарных задач является увеличение процента как безрецидивной, так и общей выживаемости при протоковом раке поджелудочной железы. Согласно данному исследованию, локо-регионарный рецидив у больных непосредственно cвязан с наличием именно экстрапериневральной инвазии. Кроме того, выявленная субпопуляция больных без дистантной прогрессии, а только с наличием локорегионарного распространения, диктует необходимость применения комбинированного подхода лечения протокового рака поджелудочной железы.
Лимфогенное метастазирование также является одним из основных путей распространения злокачественных опухолей желудочно-кишечного тракта. Обнаружена зависимость между поражением регионарных лимфатических узлов и продолжительностью жизни больных (r=–0,24, p=0,04). Медиана выживаемости больных без поражения РЛУ составила 16 месяцев, в отличие от 11 месяцев у пациентов с наличием метастазов. Наши данные совпадают с данными литературы [35]. Однако при исследовании аутопсийного материала у пациентов отсутствовало поражение лимфатических узлов III группы. Это можно объяснить теорией лимфогенного метастазирования, описанной А. А. Лойтом и А. В. Гуляевым. Согласно данной теории каждый коллектор лимфатических узлов является иммунологически отличим от всех остальных, в том числе и рядом расположенных, т.е. каждый коллектор отличается характерными антителами, которые продуцируются в лимфатических узлах. Другими словами, когда злокачественная опухоль развивается из определенного эпителия, во всех лимфатических узлах расположения антитела данной зоны этого типа отсутствуют, поэтому они все будут поражены метастазами [36], что также является немаловажным для поиска новых комбинированных методов лечения больных, в частности, протоковым раком поджелудочной железы.
Поэтому мы считаем, что для достижения максимального эффекта от
Рис. 3. ИОЛТ в течение ПДР
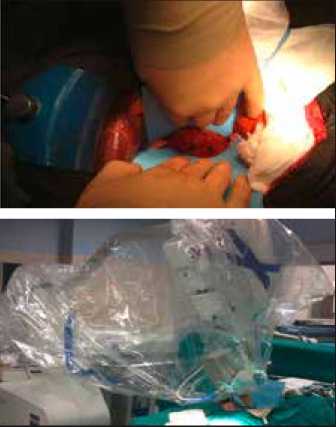
проведенного хирургического ле чения и увеличения продолжительности жизни больных с протоковым раком поджелудочной железы необходим комбинированный подход к лечению с обязательным использованием ИОЛТ. С целью предупреждения возможных осложнений как неоадъювантной, так и адъювантной лучевой терапии был предложен метод интраоперационной лучевой терапии [30]. ИОЛТ подразумевает под собой подведение однократной высокой дозы облучения (обычно не превышающей 20 Гр) под визуальным контролем в ходе хирургического вмешательства с целью предотвращения лучевого повреждения находящихся в зоне облучения органов (рис. 3) [37].
ИОЛТ осуществляется при помощи электронов или вы-сокодозной брахитерапии, рентгеновских лучей и дается в однократной дозе или в комбинации с адъювантной ХРТ. Несколько исследований [38] показали возможность применения ИОЛТ как в комбинированном, так и в комплексном лечении ПАК поджелудочной железы с хорошими результатами по таким показателям, как снижение частоты локорегионарного рецидива и улучшение показателей как безрецидивной, так и общей выживаемости.
Список литературы Морфологическое обоснование применения интраоперационной лучевой терапии для профилактики локорегионального рецидива у больных с протоковой аденокарциномой поджелудочной железы
- American Cancer Society website. http://www.cancer.org/cancer/pancreaticcancer/detailedguide/pancreatic-cancer-key-statistics. Updated June 11, 2014. Accessed September 3, 2014.
- Jemal A., Siegel R., Ward E., Hao Y., Xu J., Murray T. et al. Cancer statistics, 2008.//CA Cancer J. Clin, 2008.-Vol. 58.-P. 71-96.
- Лядов В. К., Маттиас-Лер Й., Оке Андрен-Сандберг. Прогностические факторы при резектабельном раке поджелудочной железы.-М.: ИД Медпрактика-Мб, 2010.
- Esposito I., Kleeff J., Bergmann F., Reiser C., Herpel E., Friess H. et al./Most pancreatic cancer resections are R1 resections./Annals of Surgical Oncology.-2009.-Vol. 15(6).-P. 1651-1660.
- Andea A., Sarkar F., Adsay V. N. Clinicopathological correlates of pancreatic intraepithelial neoplasia: a comparative analysis of 82 cases with and 152 cases without pancreatic ductal adenocarcinoma. Mod Pathol. 2003; 16:996-1006.
- Edge S. B., Byrd D. R., Compton C. C., et al. AJCC Cancer Staging Manual. 7th edn. New York: Wiley & Liss; 2010.
- Matsuda M., Nimura Y./Perineural invasion of pancreas head carcinoma//Nihon Geka Gakkai Zasshi. 1983 Aug; 84(8):719-28.
- Nagakawa T., Kurachi M., Konishi K., Miyazaki I./Translateral retroperitoneal approach in radical surgery for pancreatic carcinoma.//Jpn J Surg. 1982; 12(3):229-33.
- Nagakawa T.1, Mori K., Nakano T., Kadoya M., Kobayashi H., Akiyama T. et al./Perineural invasion of carcinoma of the pancreas and biliary tract.//Br J Surg. 1993 May; 80(5):619-21.
- Nakao A., Harada A., Nonami T., et al. Clinical significance of carcinoma invasion of the extrapancreatic nerve plexus in pancreatic cancer. Pancreas. 1996; 12:357-61 DOI: 10.1097/00006676-199605000-00006
- Qing Lin, Langping Tan, Yu Zhou, Quanbo Zhou, and Rufu Chen/Radical nerve dissection for the carcinoma of head of pancreas: report of 30 cases//Chin J Cancer Res. 2016 Aug; 28(4): 429-434 DOI: 10.21147/j.issn.1000-9604.2016.04.06
- TNM: Классификация злокачественных опухолей./Под ред. Л. Х. Собинина и др.; пер. с англ. и науч. ред. А. И. Щёголева, Е. А. Дубовой, К. А. Павлова.-М.: Логосфера, 2011.-276 с.-Перевод изд. TNM Classification of Malignant Tumours, 7th ed. L. H. Sobin, M. K. Gospodarowicz, Ch. Wittekind. TNM Classification of Malignant Tumours, 7th edition in translate from A. I. Schegolev et al. Moscow: Logosfera, 2011. 276 p.
- Pawlik T. M., Gleisner A. L., Cameron J. L., Winter J. M., Assumpcao L., Lillemoe K. D., et al. Prognostic relevance of lymph node ratio following pancreaticoduodenectomy for pancreatic cancer. Surgery. 2007; 141:610-618.
- Dusch N., Weiss C., Ströbel P., Kienle P., Post S., Niedergethmann M./Factors predicting long-term survival following pancreatic resection for ductal adenocarcinoma of the pancreas: 40 years of experience.//J Gastrointest Surg. 2014; 18:674-681.
- Slidell M.B., Chang D.C., Cameron J.L., Wolfgang C., Herman J.M., Schulick R.D., et.al./Impact of total lymph node count and lymph node ratio on staging and survival after pancreatectomy for pancreatic adenocarcinoma: a large, population-based analysis.//Ann Surg Oncol. 2008; 15:165-174.
- Valsangkar N. P., Bush D. M., Michaelson J. S., Ferrone C. R., Wargo J. A., Lillemoe K. D. еt al./N0/N1, PNL, or LNR? The effect of lymph node number on accurate survival prediction in pancreatic ductal adenocarcinoma.//J Gastrointest Surg. 2013; 17:257-266.
- Lewis R., Drebin J. A., Callery M. P., Fraker D., Kent T. S., Gates J. et al./A contemporary analysis of survival for resected pancreatic ductal adenocarcinoma.//HPB (Oxford) 2013; 15:49-60.
- Bosman F. T.//WHO Classification of tumors of the digestive system// Lyon,2010.
- Sierzega M., Popiela T., Kulig J., Nowak K./The ratio of metastatic/resected lymph nodes is an independent prognostic factor in patients with node-positive pancreatic head cancer. Pancreas.//2006 0ct;33(3):240-5.
- House M. G., Gönen M., Jarnagin W. R., D'Angelica M., DeMatteo R.P., Fong Y., et al./Prognostic significance of pathologic nodal status in patients with resected pancreatic cancer.//Journal of Gastrointestinal Surgery. 2007 Nov; 11(11):1549-55.
- Pawlik T. M., Gleisner A. L., Cameron J. L., Winter J. M., Assumpcao L., Lillemoe K. D., et al./Prognostic relevance of lymph node ratio following pancreaticoduodenectomy for pancreatic cancer.//Surgery. 2007 May; 141(5):610-8.
- Lee S. Y., Hwang I., Park Y. S., Gardner J., Ro J. Y./Metastatic lymph node ratio in advanced gastric carcinoma: a better prognostic factor than number of metastatic lymph nodes?//International journal of oncology. 2010 Jun; 36(6):1461-7.
- Mariette C., Piessen G., Briez N., Triboulet J. P./The number of metastatic lymph nodes and the ratio between metastatic and examined lymph nodes are independent prognostic factors in esophageal cancer regardless of neoadjuvant chemoradiation or lymphadenectomy extent.//Annals of surgery. 2008 Feb; 247(2):365-71.
- Lee J. H., Lee K. G., Ha T. K., Jun Y. J., Paik S. S., Park H. K., et al./Pattern analysis of lymph node metastasis and the prognostic importance of number of metastatic nodes in ampullary adenocarcinoma.//The American Surgeon. 2011 Mar; 77(3):322-9.
- Peparini N., Chirletti P./Lymph node ratio, number of excised nodes and sentinel-node concepts in breast cancer. Breast cancer research and treatment.//2011 Apr; 126(3):829-33.
- Spillane A. J., Cheung B.L.H., Winstanley J., Thompson J. F./Lymph node ratio provides prognostic information in addition to American joint committee on cancer N stage in patients with melanoma, even if quality of surgery is standardized.//Annals of surgery. 2011 Jan; 253(1):109-15.
- Akerberg D.I., Ansari D.I., Andersson R./Re-evaluation of classical prognostic factors in resectable ductal adenocarcinoma of the pancreas//World J. Gastroenterol. 2016 Jul 28; 22(28):6424-33. i28.6424 DOI: 10.3748/wjg.v22
- Kanehara and Co, ltd, Tokio/Classification of pancreatic carcinoma//3rd edition, 2011 P. 58.
- Паклина О. В., Кармазановский Г. Г., Сетдикова Г. Р. Патоморфологическая и лучевая диагностика хирургических заболеваний поджелудочной железы.-М.: Видар-М, 2014-181 с.
- Calvo F.1., Sole C., Herranz R., Lopez-Bote M., Pascau J., Santos A., Munoz-Calero A., Ferrer C., Garcia-Sabrido J./Intraoperative radiotherapy with electrons: fundamentals, results, and innovation.//Ecancermedicalscience. 2013 Aug 15; 7:339 DOI: 10.3332/ecancer.2013.339
- Abe M.I., Nishimura Y., Shibamoto Y./Intraoperative radiation therapy for gastric cancer//World J Surg. 1995 Jul-Aug; 19(4):544-7.
- Abe M., Yamano K., Imura T., Matsuda S./Intraoperative radiotherapy of abdominal tumors. 1. Intraoperative irradiation of carcinoma of the pancreas head and biliary system//Nihon Igaku Hoshasen Gakkai Zasshi. 1969 Apr; 29(1):75-85.
- Krengli M.I., Calvo F. A., Sedlmayer F., Sole C. V., Fastner G., Alessandro M. et al./Clinical and technical characteristics of intraoperative radiotherapy. Analysis of the ISIORT-Europe database.//Strahlenther Onkol. 2013 Sep; 189(9):729-37 DOI: 10.1007/s00066-013-0395-1
- Паклина О. В., Сетдикова Г. Р./Методология исследования операционного материала при протоковом раке поджелудочной железы/Клиническая и экспериментальная морфология 2014 № 1(9) С. 42-50.
- Wenger F. A., Peter F., Zieren J. et al. Prognosis factors in carcinoma of the head of the pancreas. Dig Surg 2000.-Vol.17.-P. 29-35.
- Лойт А. А., Гуляев А. В. Теория лимфогенного метастазирования рака и пролиферации//2005, Санкт-Петербург ЭЛБИ-СПБ,-88 с.
- Jingu K.I., Tanabe T., Nemoto K., Ariga H., Umezawa R., Ogawa Y. et al./Intraoperative radiotherapy for pancreatic cancer: 30-year experience in a single institution in Japan//Int J Radiat Oncol Biol Phys. 2012 Jul 15;83(4): e507-11 DOI: 10.1016/j.ijrobp.2012.01.024
- Yamaguchi K.I., Nakamura K., Kobayashi K., Nakano K., Konomi H., Mizumoto K., Tanaka M./ERT following IORT improves survival of patients with resectable pancreatic cancer//Int J Radiat Oncol Biol Phys.2005 Jul-Aug; 52(64):1244-9.
- Nishimura Y.I., Hosotani R., Shibamoto Y., Kokubo M., Kanamori S., Sasai K., Hiraoka M. et al./External and intraoperative radiotherapy for resectable and unresectable pancreatic cancer: analysis of survival rates and complications.//Int J Radiat Oncol Biol Phys. 1997 Aug 1;39(1):39-49.


