Морфология ядрышек нейронов туберомамиллярного ядра гипоталамуса при сосудистой деменции
Автор: Ишунина Татьяна Александровна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Краткие сообщения
Статья в выпуске: 1 т.31, 2023 года.
Бесплатный доступ
Ядрышковый стресс является частью патогенеза таких нейродегенеративных заболеваний, как болезнь Гентингтона, болезнь Паркинсона, боковой амиотрофический склероз. Однако сведения об изменениях ядрышек при сосудистой деменции, возникающей на фоне постинсультных нарушений мозгового кровообращения, практически отсутствуют. Цель настоящего исследования - определение размеров ядрышек в нейронах туберомамиллярного ядра гипоталамуса, являющегося основным источником синтеза гистамина в мозге, на аутопсийном материале случаев с сосудистой деменцией (n=9) в сравнении с контрольной группой случаев без когнитивных расстройств (n=10). На гистологических препаратах, окрашенных крезиловым фиолетовым по Нисслю площади сечения ядрышек нейронов туберомамиллярного ядра гипоталамуса были достоверно меньше в случаях с сосудистой деменцией по сравнению с контрольной группой, что свидетельствует не только о снижении уровня образования гистамина, участвующего в контроле циклов сна и бодрствования и памяти, но и о возможной инициации клеточной гибели. Выраженность изменений размеров ядрышек была практически идентична изменениям других морфометрических критериев метаболической активности нейронов, а именно размеров комплекса Гольджи, ядер и перикарионов.
Ядрышки, нейроны, гипоталамус, туберомамиллярное ядро, сосудистая деменция
Короткий адрес: https://sciup.org/143180240
IDR: 143180240 | DOI: 10.20340/mv-mn.2023.31(1).673
Текст краткого сообщения Морфология ядрышек нейронов туберомамиллярного ядра гипоталамуса при сосудистой деменции
Ishunina TA. The nucleoli morphology of tuberomamillary nucleus neurons of the hypothalamus in vascular dementia. Morfologicheskie Vedomosti – Morphological newsletter. 2023;31(1):673. (1).673
Article received 06 July 2022
Article accepted 10 January 2023
Введение. Традиционно ядрышки клеток ассоциируются с транскрипцией рибосомальных генов и сборкой рибосом. Однако, в последнее время в литературе все чаще встречается термин «ядрышковый стресс», означающий изменения активности и целостности ядрышек в ответ на различные стрессовые воздействия, такие как нарушения метаболизма, окислительный стресс, интоксикация (в т.ч. алкогольная), ишемия [1–3]. Ядрышки реагируют на стрессовые сигналы выделением в нуклео- плазму целого ряда рибосомальных белков (например, L5, L11, L23, S7), которые нарушают протеосомную деградацию апоптоз-ного фактора р53, приводя к его накоплению и включению р53-зависимых программ остановки клеточного цикла, старения и апоптоза [1]. Помимо использования механизма с участием р53, ядрышки накапливают различные регуляторные белки и РНК, функции которых выходят далеко за пределы традиционного участия в белковом синтезе. Нарушения функции ядрышек описа- ны при некоторых редких генетических заболеваниях, таких как синдром Вернера (прогерия взрослых), врожденный дискера-тоз, синдром Тричера Коллинза. В то же время в литературе авторы акцентируют внимание и на влияние ядрышкового стресса на активность и выживание нейронов, открывая перспективы для исследований ядрышек при нейродегенеративных заболеваний. Показано, что подавление активности рибосомальных генов происходит на ранних стадиях развития болезни Альцгеймера. В допаминэргических нейронах пациентов с болезнью Паркинсона нарушается целостность ядрышек (по результатам иммуногистохимического окрашивания на нуклеофозмин) [1-4]. При болезни Гентингтона изменяется транскрипция рибосомальных генов, а в самих ядрышках накапливаются нерастворимые агрегаты патологического белка гентингтина. Аномальные белки с удлиненным полиглутаминовым участком, как у гентингтина, встречаются в ядрышках нейронов и при других заболеваниях, например, при спиноцеребеллярной атаксии. Дефицит ангиогенной рибонуклеазы ангиогенина, способного связываться с промоторным участком рибосомальных генов и стимулировать их транскрипцию, приводит к развитию бокового амиотрофического склероза. При этой патологии дополнительно отмечается сморщивание ядрышек в двигательных нейронах спинного мозга, которое предшествует основным проявлениям заболевания [5]. Уменьшение размеров ядрышек констатируют в корковых нейронах лобных долей при лобно-височной дегенерации [6]. В то же время отсутствуют сведения о возможных изменениях ядрышек в нейронах при сосудистой деменции (далее - СД), второй по частоте форме слабоумия после болезни Альцгеймера [7].
Целью исследования стало изучение размеров ядрышек нейронов крупноклеточного туберомамиллярного ядра (далее - ТМЯ) гипоталамуса при сосудистой деменции, участвующего в синтезе гистамина и регулирующего когнитивные функции, циклы сна и бодрствования [8].
Материалы и методы исследования. Исследование проведено на ауто-псийном материале 9 случаев с подтвер- жденным диагнозом сосудистой деменции (средний возраст 77,2±3,3 лет) и 10 контрольных случаев (средний возраст 79,2±2,7 лет), соответствующих им по полу и возрасту с соблюдением всех этических требований [9–11]. Гипоталамическая область мозга фиксировалась в 10% растворе формалина в фосфатном буфере методом погружения и заливалась в парафин. Каждый сотый серийный срез толщиной 6 мкм окрашивался 0,5% раствором крезилового фиолетового ацетата. При увеличении в 400 раз с использованием микроскопа Leica CME 3-2 и цифровой камеры Micromed MVV 5000 выполнены микрофотографии препаратов, содержащих ТМЯ. С помощью программы Image J 1.48v на полученных изображениях определяли площадь сечения ядрышек нейронов ТМЯ (в среднем 41,8±3,6 на каждый случай). Согласно тесту Шапиро-Уилка для всех полученных значений характерно нормальное распределение (р=0,93). В связи с этим различия между контрольной группой и пациентами с СД оценивались с помощью t-критерия Стьюдента.
Результаты исследования и обсуждение. Интенсивность окраски по Нисслю во многих случаях с СД оказалась заметно ниже, чем в контрольной группе, что было ранее показано нами в базальном ядре Мейнерта [10]. Площади сечения ядрышек нейронов ТМЯ были достоверно меньше в случаях с СД по сравнению с контрольной группой (см. рис. 1-2, р=0,00026). Сопоставление результатов измерений размеров ядрышек с размерами ядер и перикарионов нейронов показало практически одинаковые изменения. Так, для ядрышек разница между изученными группами (СД-контроль) составила 12%, для ядер – 13%, для перикарионов – 14%, что свидетельствует о тесной связи этих морфометрических показателей друг с другом и об их синхронном снижении при СД. Следует отметить, что уменьшение размеров ядер (р=0,033) и перикарионов (р=0,022) нейронов ТМЯ было статистически значимо у пациентов мужского пола, что соответствует данным эпидемиологических исследований, демонстрирующим более высокую частоту СД у мужчин по сравне-
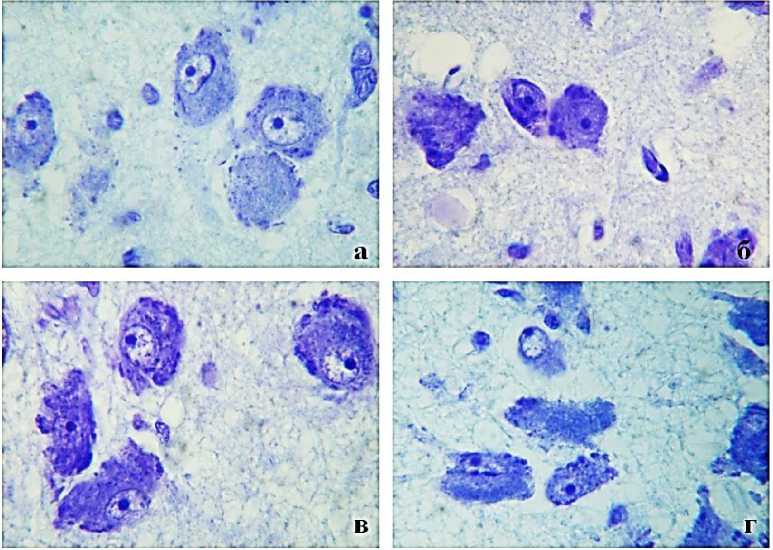
Рис. 1. Микрофото препаратов гипоталамической области мозга. Нейроны туберомамил-лярного ядра гипоталамуса в случаях сосудистой деменции (б, г) и в контрольной группе (а, в). Окр. крезиловым фиолетовым. Ув.: х 1000
нию с женщинами [9, 12]. В случаях с бо-значимое на 34% (р=0,005) уменьшение размеров ядрышек нейронов ТМЯ, что согласуется со значимым снижением размеров комплекса Гольджи, ядер и перикарионов нейронов ТМЯ при этом заболевании [9, 12]. Таким образом, в ТМЯ при сосудистой деменции наблюдается небольшое, но статистически значимое уменьшение размеров ядрышек, свидетельствующее о снижении уровня белкового синтеза и подавлении образования гистамина, что может проявляться нарушениями циклов сна и бодрствования. Клинические исследования подтверждают, что нарушения сна характерны для пациентов с деменциями. При этом у больных с СД они могут быть выражены в большей степени, чем при болезни Альцгеймера [13-14]. Наличие «ядрышкового стресса» в гистаминэргиче-ском ТМЯ при СД и болезни Альцгеймера, наряду со снижением выработки гистамина и связанного с этим нарушением циклов сна и бодрствования, может сопровождаться накоплением про-апоптотического белка р53, и спровоцировать гибель нейронов. Одной из вероятных причин уменьшения ядрышек при СД является ишемия вслед- лезнью Альцгеймера (n=4) было отмечено ствие нарушения кровоснабжения мозговых структур. Подобный механизм был ранее изучен в экспериментальной модели у крыс [3]. Следует отметить, что выраженность ядрышкового стресса в ТМЯ при болезни Альцгеймера больше, чем при СД, что может быть связано с наличием нейрофибриллярных клубков.
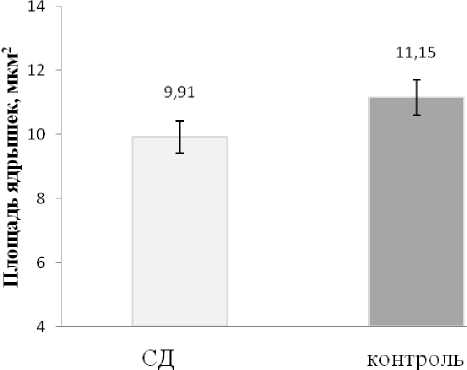
Рис. 2. Диаграмма площадей сечения ядрышек в нейронах туберомамиллярного ядра в случаях с сосудистой деменцией и в контрольной группе (пояснения см. в тексте)
Заключение. В нейронах туберо-мамиллярного ядра при сосудистой деменции наблюдается умеренно выраженный ядрышковый стресс, проявляющийся небольшим, но значимым уменьшением размеров ядрышек. При этом морфометрические критерии метаболической ак- тивности нейронов туберомамиллярного ядра (размеры ядрышек, комплекса Гольджи, ядер и перикарионов) синхронно и в равной степени реагируют на патогенетические процессы при сосудистой деменции.
Список литературы Морфология ядрышек нейронов туберомамиллярного ядра гипоталамуса при сосудистой деменции
- Parlato R, Kreiner G. Nucleolar activity in neurodegenerative diseases: a missing piece of the puzzle? J Mol Med (Berl). 2013;91(5):541-547. DOI: 10.1007/s00109-012-0981-1
- Sokolov DA, Il'icheva VN, Minasyan VV, Spitsin VV. Vliyanie ostroy alkogol'noy intoksikatsii na staruyu i drevnyuyu koru golovnogo mozga. Evraziyskiy soyuz uchyonykh. 2015;4(13):9-11. In Russian
- Stepanov SS, Akulinin VA, Avdeev DB i dr. Strukturno-funktsional'naya reorganizatsiya yadryshkovogo apparata neyronov neokorteksa, ark-hekorteksa i bazal'nykh gangliev golovnogo mozga belykh krys posle 20-minutnoy okklyuzii obshchikh sonnykh arteriy. Zhurnal anatomii i gistopatologii. 2018;7(4):67-74. In Russian
- Rieker C, Engblom D, Kreiner G et al. Nucleolar disruption in dopaminergic neurons leads to oxidative damage and parkinsonism through repression of mammalian target of rapamycin signaling. J Neurosci. 2011;31(2):453-460. DOI: 10.1523/JNEUR0SCI.0590-10.2011
- Aladesuyi Arogundade O, Nguyen S, Leung R et al. Nucleolar stress in C9orf72 and sporadic ALS spinal motor neurons precedes TDP-43 miss localization. Acta Neuropathol Commun. 2021;9(1):26. DOI: 10.1186/s40478-021-01125-6
- Mizielinska S, Ridler CE, Balendra R et al. Bidirectional nucleolar dysfunction in C9orf72 frontotemporal lobar degeneration. Acta Neuropathol Commun. 2017;5(1):29. DOI: 10.1186/s40478-017-0432-x
- Uspenskaya OV, Iakhno NN, Belushkina NN. Neurochemical markers of neurodegeneration in the early diagnosis of Alzheimer's disease, vascular and mixed dementia. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2010;110(8):36-40. In Russian
- Shan L, Fronczek R, Lammers GJ, Swaab DF. The tuberomamillary nucleus in neuropsychiatric disorders. Handb Clin Neurol. 2021;180:389-400. DOI: 10.1016/B978-0-12-820107-7.00024-0
- Ishunina TA, Bogolepova IN, Swaab DF. Increased Neuronal Nuclear and Perinuclear Size in the Medial Mamillary Nucleus of Vascular Dementia and Alzheimer's Disease Patients: Relation to Nuclear Estrogen Receptor a. Dement Geriatr Cogn Disord. 2019;47(4-6):274-280. DOI: 10.1159/000500244
- Ishunina TA, Bogolepova IN. Tsitoarhitektonika bazal'nogo yadra Mejnerta pri sosudistom slaboumii. Morfologicheskie vedomosti. 2008;16(1-2):61-63. In Russian
- Ishunina TA, Swaab DF, Bogolepova IN. Sravnitel'noe immunotsitokhimicheskoe issledovanie estrogenovogo receptora v neyronakh gipotal-amusa i perednego bazal'nogo mozga pri sosudistoy dementsii i bolezni Al'tsgeymera. Morfologicheskie vedomosti. 2007;15(1-2):62-65. In Russian
- Ishunina TA, Kamphorst W, Swaab DF. Metabolic alterations in the hypothalamus and basal forebrain in vascular dementia. J Neuropathol Exp Neurol. 2004;63(12): 1243-1254. DOI: 10.1093/jnen/63.12.1243
- Anor CJ, O'Connor S, Saund A et al. Neuropsychiatric Symptoms in Alzheimer Disease, Vascular Dementia, and Mixed Dementia. Neuro-degener Dis. 2017;17(4-5):127-134. DOI: 10.1159/000455127
- Fuh JL, Wang SJ, Cummings JL. Neuropsychiatric profiles in patients with Alzheimer's disease and vascular dementia. J Neurol Neurosurg Psychiatry. 2005;76(10):1337-1341. DOI: 10.1136/jnnp.2004.056408


