Морфология легких при экспериментальном остром повреждении и его фармакокоррекции
Автор: Куликов Олег Александрович, Балашов Владимир Павлович, Агеев Валентин Павлович, Семенова Елена Васильевна, Шляпкина Василиса Игоревна, Замышляев Павел Сергеевич, Ломачкина Марина Сергеевна, Летин Александр Владиславович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.28, 2020 года.
Бесплатный доступ
Изучение морфологии легких при влиянии различных факторов внешней среды представляет большой интерес для различных направлений медицины и биологии. В работе проведено исследование патоморфологических изменений респираторного отдела легкого крыс при аспирационном остром повреждении и действии фармакокоррекции. В качестве повреждающего агента был использован ацетон, в качестве средств фармакокоррекции - препарат ГиперХАЕС, содержащий 7,2% раствор NaCl в сочетании с 6% гидроксиэтилкрахмала, а также липосомальную форму N-ацетилцистеина, которые вводили подопытным животным внутривенно однократно после индуцирования острого повреждения легких. Контрольная группа животных получала антибиотикотерапию. Окраску микропрепаратов осуществляли с помощью гематоксилина и эозина. Проводили количественную оценку гистологических признаков повреждения тканей легких. В результате исследования макропрепаратов легких была установлена степень легочного отека, а также противоотечное действие средств фармакокоррекции. На 6-е сутки эксперимента противоотечное действие сохранялось только после введения N-ацетилцистеина. Гистологическое исследование легких показало генерализованную деструкцию архитектоники органа в ответ на воздействие повреждающего фактора и ее редукцию под влиянием средств фармакокоррекции. В контрольной группе, признаки острого повреждения легких были наиболее обширными. Спустя сутки после введения раствора ГиперХАЕС в гистологической картине легких отсутствовали кровоизлияния. При количественной оценке гистологических признаков острого повреждения легких показано, что максимальный положительный эффект от введения ГиперХАЕС развивается через 24 часа после применения. N-ацетилцистеин в первую очередь приводил к уменьшению лейкоцитарной инфильтрации и препятствовал развитию нагноительного процесса. Пульмо-протективное действие N-ацетилцистеина реализовывалось через 24 часа от момента введения и сохранялось до 6-х суток эксперимента. Использование при остром повреждении легких средств фармакологической коррекции отражалось на картине летальности подопытных животных. При применении ГиперХАЕС к 6 дню погибло 37,5% животных, в группе с N-ацетилцистеином - 28,6%, тогда как в контрольной группе все животные погибли.
Острое повреждение легких, патоморфология легкого, ацетон, n-ацетилцистеин, гиперхаес
Короткий адрес: https://sciup.org/143177442
IDR: 143177442 | DOI: 10.20340/mv-mn.2020.28(2)64-73
Текст научной статьи Морфология легких при экспериментальном остром повреждении и его фармакокоррекции
Куликов О.А., Балашов В.П., Агеев В.П., Семенова Е.В., Шляпкина В.И., Замышляев П.С., Ломачкина М.С., Летин А.В. Морфология легких при экспериментальном остром повреждении и его фармакокоррекции// Морфологические ведомости.-2020. - Том 28.- № 2.- С. 64-73. (2):64-73
Kulikov OA, Balashov VP, Ageev VP, Shlyapkina VI, Zamyshlyaev PS, Lomachkina MS, Semenova EV, Letin AV. The morphology of the lungs at the experimental acute injury and its pharmacocorrection. Morfologicheskie Vedomosti – Morphological Newsletter. 2020;28(2):64-73. (2):64-73
Введение . Морфология легких при действии различных факторов внешней среды представляет собой интерес для специалистов различного профиля. При решении этой проблемы сталкиваются интересы гистологии, патологии, клиники и фармакологии. Важно не только изучать суть и динамику морфологических перестроек в органе, но и предлагать пути их коррекции. Морфологически выделяют три стадии острого повреждения легких – (далее - ОПЛ). Первая из них - ранняя экссудативная стадия (до пяти суток). Для нее характерно полнокровие капилляров, спадение легочных альвеол, микротромбы, повреждение альвеолоцитов, нейтрофильная инфильтрация, отек легких, наличие гиалиновых мембран и фибрина внутри альвеол. Вторая стадия - фибринопролиферативная (от шести до десяти суток). Происходит постепенное разрешение отека легких, начинается пролиферация фибробластов. Третья фибротическая стадия, формирующаяся с десятых суток после возникновения ОПЛ, характеризуется появлением соеденительной ткани (клеток и волокон) в очагах деструкции [1]. На всех стадиях главным декомпенсаторным явлением является увеличение проницаемости компонентов аэро-гематического барьера, что способствует развитию и прогрессированию отека легких. Возникновение острой эмфиземы при этом является компенсаторным механизмом. Ателектазы и дистелектазы возникают при обтурации бронхиол секретом, слущенными эпителиальными клетками, при повреждении альвеолоцитов II типа, ответственных за синтез и секрецию сурфактанта, что способствует дальнейшему прогрессированию структурных изменений в легких и нарастанию гипоксии [2]. Во многих исследованиях показано, что триггером развития ОПЛ является высвобождение реакционноспособного кислорода, реактивного азота, что в свою очередь усиливает действие, протеолитических ферментов, провоспалительных цитокинов и активацию нейтрофилов, альвеолярных и интерстициальных макрофагов [3]. При этом истощается эндотелиальный вазодилятирующий фактор NO, а усиление антиоксидантной защиты его восстанавливает [4]. Имеющий место противовоспалительный эффект при использовании антиоксидантов на фоне ОПЛ реализуется за счет сокращения миграции макрофагов, моноцитов и нейтрофилов в легкие и производства реакционноспособного кислорода и реактивного азота этими клетками [5].
В настоящее время ясно, что фармакологические методы ограничения проницаемости альвеолярно-капиллярной мембраны и уменьшения внесосудистой жидкости легких оказывают благоприятное действие на прогноз и исход ОПЛ [6]. Например, гипертонические растворы за счет осмоса способны перераспределять жидкость из внутриклеточного пространства во внеклеточное (сосудистое) [7]. Комбинация гипертонического раствора хлорида натрия с растворами гидроксиэтилкрахмала предотвращает нарушение оксигенирующей функции легких и улучшает доставку кислорода в позднем периоде шока и усиливает альвеолярно-капиллярный барьер [8]. Но на этот счет литературные данные долгое время остаются противоречивыми [9-10]. Давно замечено, что ацетилцистеин оказывает защитное действие на легочную ткань за счет антиоксидантного действия, а его липосомальная форма представляется, как наиболее перспективная для лечения прямого и непрямого повреждения легких [11]. Кроме того, посредством липосом можно осуществлять направленную доставку лекарств в легкие [12].
Цель исследования: изучить морфологию легких при экспериментальном остром повреждении и экспериментальной фармакологической коррекции с помощью гиперосмолярного раствора и липосомальной формы N-ацетилцистеина.
Материалы и методы исследования. Липосомы c N-ацетилцистеином (далее - L-NAC) были изготовлены по ранее описанному нами методу [13]. Для эксперимента использовались белые нелинейные крысы обоего пола массой 220-300 г (n=64). ОПЛ моделировали введением в трахею ацетона в количестве 0,1мг/кг [14]. Для этого производили разрез на шее крысы около 5 мм в проекции доступа к трахее, выше щитовидной железы и устанавливали в трахею катетер 18G, через который осуществляли инъекцию. Затем катетер извлекали и ушивали место разреза. Для профилактики рефлекторной остановки дыхания использовали искусственную вентиляцию легких с параметрами 0,5 л/мин, ЧД – 60 в минуту, дыхательный объем 5 мл/кг массы животного. Хирургические манипуляции с животными, включая эвтаназию, осуществляли под инъекционным наркозом (рометар 8мг/кг + золетил 20 мг/кг внутривенно, в боковую вену хвоста). Эксперимент проводился в соответствии с правилами работы с животными, сформулированными в директиве 2010/63/EU Европейского парламента и Совета Европейского Союза по охране животных, используемых в научных целях.
Всем животным после моделирования ОПЛ с целью профилактики инфекционных осложнений вводили цефтриаксон в дозе 200 мг/кг внутримышечно 1 раз в сутки в течение 6 дней (для базовой поддержки при повреждении легких) [15]. Было сформировано 3 группы животных. Животные 1-ой группы (контрольной) другого лечения, кроме антибиотикотерапии не получали. Крысам 2-ой группы внутривенно однократно вводили раствор ГиперХАЕС в объеме 4 мл/кг [16]. ГиперХАЕС представляет собой гипертонический изоонкотический раствор или гидроксиэтилкрахмал со степенью молярного замещения 0,5 и средней молекулярной массой 200000 Дальтон в 7,2% растворе хлорида натрия. 3-й группе вводили 0,5 мл взвеси L-NAC (средняя доза N-ацетилцистеина 25-30 мг/кг). Отдельную группу составили интактные крысы. За животными вели ежедневное наблюдение и фиксировали летальность в каждой группе.
Животных выводили из опыта на 1-е и 6-е сутки после его начала под наркозом путем аккуратной одномоментной перерезки сонных артерий без травматизации трахеи [17]. У животных извлекались легкие и взвешивались с последующим определением степени легочного отека на основе легочного коэффициента [18]. Для гистологического исследования легкие фиксировали в растворе 10% формалина. Препараты заливали в парафин и изготавливали срезы толщиной 7-8 мкм на роторном микротоме PFM Rotary 3003. Депарафинированные срезы окрашивали гематоксилином и эозином. Гистологические препараты просматривали в световой микроскоп Nikon Eclipse NI-SS. Микрофотографии изготавливали с помощью насадки (фотокамеры) Nikon DS-F21 при увеличении в 100, 200 и 400 раз. Для количественной оценки гистологической картины готовили по пять срезов толщиной 5 мкм с каждой доли легкого различной глубины. Степень повреждения легких оценивали количественно по наличию и выраженности трех групп морфологических признаков: 1) присутствия внутри альвеол фибрина или гиалиновых мембран, 2) наличия клеток крови в просвете альвеол и очагов некроза альвеолярных септ, 3) инфильтрации гранулоцитарными и моноцитарными клетками различной локализации [19]. Каждой группе признаков присваивался балл от 0 до 3-х в соответствии со степенью выраженности (0 - признак отсутствует, 1 - слабо выражен, 2 -умеренно выражен, 3 - максимально выраженные изменения) [19-20]. Если в разных гистологических срезах одной доли легкого выраженность изменений была разная, то статистическому анализу подвергали срез с максимальными признаками повреждения. Для каждого животного в группе определяли сумму баллов каждого признака во всех 5-и легочных долях, так что максимальный балл мог составить 15. Наблюдаемые различия числовых значений оценивали с использованием t -критерия Стьюдента и критерия χ-квадрат. Вывод о статистически достоверных различиях делали при уровне значимости р<0,05.
Результаты исследования и обсуждение. На первые сутки ГиперХАЕС снижал уровень легочного отека по отношению к животным контрольной группы (табл. 1). К 6-м суткам эксперимента ГиперХАЕС утрачивал свой противоотечный эффект. У животных, получавших ГиперХАЭС, легочный коэффициент был значимо больше, чем у интактных животных (табл. 1). Таким образом, признать эффективность гиперосмолярного раствора в устранении легочного отека на модели ОПЛ можно с ограничениями. L-NAС наилучшим образом предотвращал развитие легочного отека, так как через 24 часа после его введения легочный коэффициент был ниже, чем в контроле и сохранялся таковым на 6-е сутки (табл. 1). Следовательно, при выбранной форме экспериментального аспирационного повреждения легких можно обсуждать защитное действие L-NAC.
Таблица 1 Легочный коэффициент при остром повреждении легких лабораторных крыс, вызванном аспирацией ацетона при использовании экспериментальных средств терапии (M±m)
|
Время |
Экспериментальные группы животных |
|||
|
Контроль |
ГиперХАЕС |
L-NAC |
Интактные |
|
|
24 часа |
13,4±0,87 р 1 <0,001 |
7,63±0,6 р 2 <0,01 |
8,5±0,61 р 1 <0,05, р 2 <0,01 |
7,01±0,19 |
|
6 дней |
– |
10,46±0,36 р 1 <0,001 |
8,88±0,37 р 1 <0,01, р 3 <0,05 |
|
Примечание: р 1 - достоверность различий рассчитана по отношению к интактной группе; р 2 - по отношению к контрольной группе р 3 – по отношению к группе с ГиперХАЕС.
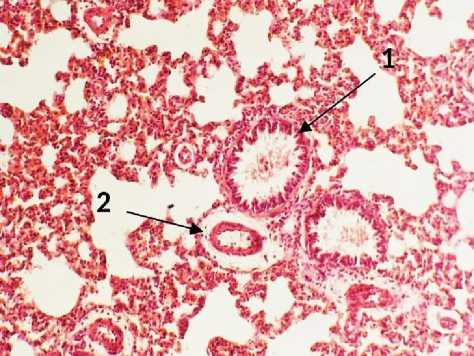
Микроскопически поражение легких при аспирации ацетона носило диффузный характер. Преобладали экссудативные изменения в виде интерстициального и внутриальвеолярного отека, кровоизлияний, скоплений фибрина в альвеолах. Межальвеолярные перегородки были утолщены за счет отека и инфильтрации (рис. 1). Воспалительный инфильтрат в межальвеолярных перегородках состоял из лимфоцитов, нейтрофилов и макрофагов. В легких крыс через сутки после начала развития процесса отмечались крупноочаговые кровоизлияния. Стенки артериол были утолщены. Эритроциты выходили за пределы просветов сосудов и располагались в альвеолах. Воздушность легочной ткани была резко снижена за счет очагов ателектазов (рис. 1). Очаги спавшихся альвеол соседствовали с очагами альвеолярной эмфиземы. Стенка бронхов была утолщена в просвете бронхов экссудат.
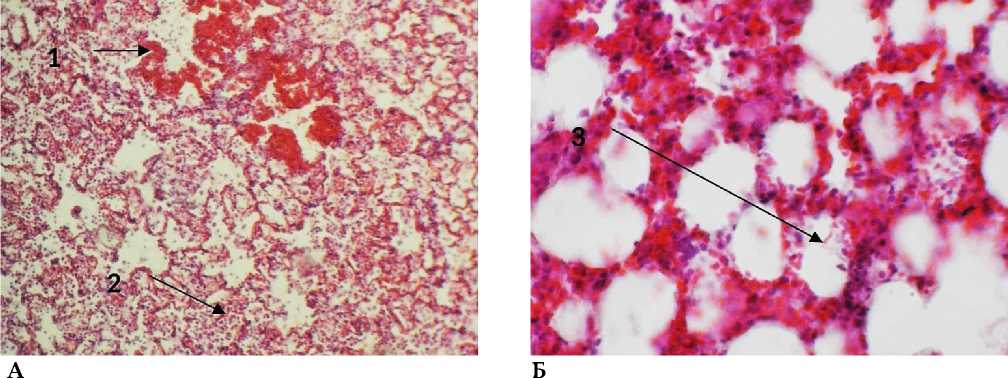
Рис. 1. Легкое крысы через 24 часа после моделирования острого повреждения легких без экспериментальной терапии: 1 – очаги кровоизлияний, 2 – лейкоцитарная инфильтрация, 3 - фибрин внутри альвеол. Окр.: гематотоксилином-эозином. Ув.: А - х100, Б - х200.
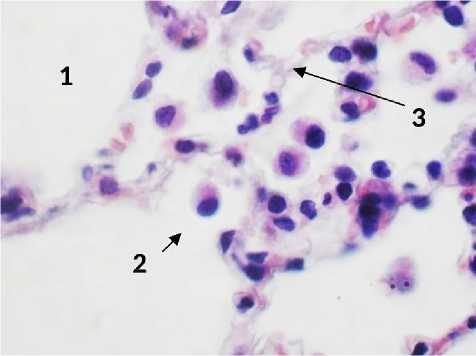
После введения раствора ГиперХАЕС на 1-е сутки после начала эксперимента в легких выживших крыс альвеолярное пространство, и просветы бронхиол были чистыми. Явлений экссудации не наблюдалось. Отсутствовали эритроциты, вышедшие за пределы капиллярного русла (рис. 2). Эритроциты в капиллярах располагались небольшими группами, но в большинстве случаев разрозненно, sludge-явления отсутствовали. Отмечались участки с утолщенными межальвеолярными перегородками. Перегородки имели утолщения за счет отека и наличия мононуклеарных клеток (рис. 2). Очаги инфильтрации гранулоцитами встречались редко и были небольшого размера. Зоны со спавшимися альвеолами встречались разрозненно и крупных очагов пневмонии не отмечалось (рис. 2). Картина острой альвеолярной эмфиземы была схожа с таковой у животных контрольной группы. При этом в микроскопической картине не обнаруживалось слияния нескольких альвеол за счет множественных разрывов альвеолярных перегородок. Данный факт может свидетельствовать в пользу того, что у животных была сохранена, необходимая для нормального газообмена площадь альвеол.
А
Рис. 2. Легкое крысы через 24 часа после моделирования острого повреждения легких с экспериментальной терапией раствором ГиперХАЕС. А: 1 – просвет альвеолы, 2 – мононуклеар, 3 – межальвеолярная септа. Б: 1 – разрывы межальвеолярных перегородок, 2 – утолщенные межальвеолярные перегородки, спавшиеся альвеолы, лейкоцитарные инфильтраты. Окр.: гематоксилином-эозином. Ув.: А – х400, Б – х100.
Б
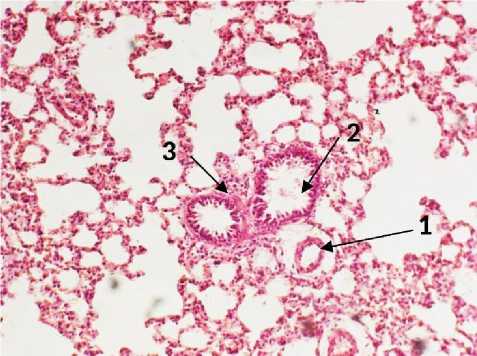
На 1-е сутки после введения L-NAC в зонах очаговой пневмонии наблюдаеются морфологические проявления типичного отечно-геморрагического синдрома. Межальвеолярные перегородки были неравномерно утолщены за счет лимфогистиоцитарной инфильтрации (рис. 3). Редко встречались диапедезные микрогеморрагии. Вокруг артериол визуализировались отеки адвентиции (рис. 3). К некоторым сосудам и мелким бронхам прилегали полиморфноклеточные инфильтраты с преобладанием гранулоцитов. Воздушность ткани легких на всей площади среза была неравномерная. Участки полного инфильтративного уплотнения чередовались с неполными ателектазами и нормальными альвеолами. Участки альвеолярной эмфиземы встречались крайне редко и без разрывов межальвеолярных перегородок. Просвет капилляров был четко различим, возможно, в связи с повышенным давлением в сосудистом русле легких (рис. 3). Об этом свидетельствовали и спазмированные артериолы с утолщенным мышечным слоем, хорошо воспринимающим эозин. В отдельных бронхах визуализировались слущенный эпителий и слабо различимые розовые тяжи (мокрота) (рис. 3).
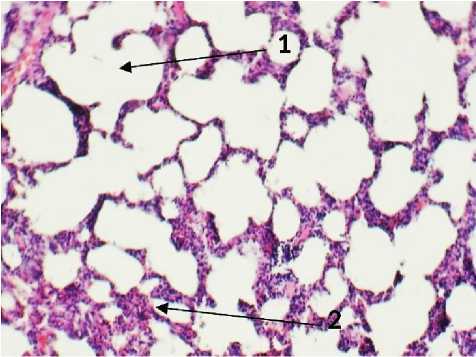
На 6-й день эксперимента в группе с введением раствора ГиперХАЕС легкие микроскопически имели очаги абсцедирования на фоне спавшихся альвеол. Микроскопически картина имела динамику нагноительного процесса, что закономерно для аспирационного синдрома. Встречалось перивазальное и перибронхиальное расположение микроабсцессов и лейкоцитарных инфильтратов без четкой границы (рис. 4). Крупных некротических масс обнаружено не было. В группе с применением ГиперХАЕС отмечено повреждение стенки бронха прилегающей к лейкоцитарному инфильтрату (рис. 4).
Присутствовали обширные зоны коллабированных альвеол, зоны повышенной воздушности легких с разрывами межальвеолярных септ, микротромбы в сосудах зон с периваскулярными лейкоцитарными инфильтратами (рис. 4).
А
Б
Рис. 3. Легкое крысы через 24 часа после моделирования острого повреждения легких с экспериментальной терапией L-NAC. А: 1 - мелкоочаговая инфильтрация. Б: 1 – отек периартериального пространства, 2 – слущенный эпителий в просвете бронха, 3 – перибронхиальный инфильтрат. Окр.: гематоксилином-эозином. Ув.: х100.
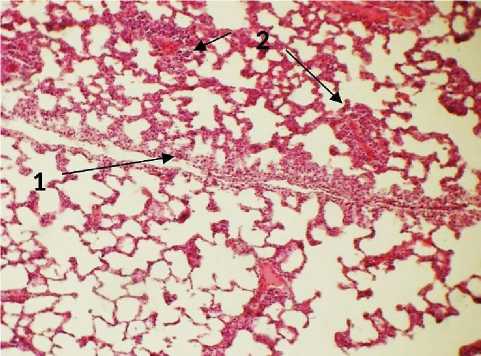
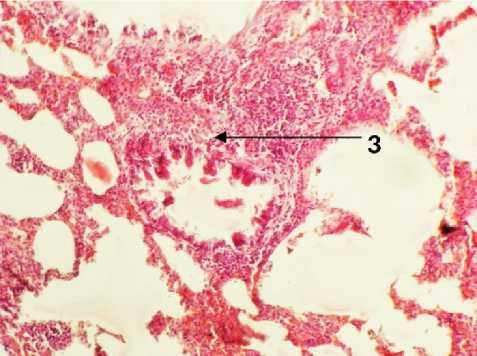
Рис. 4. Легкое крысы через 6 дней после моделирования острого повреждения легких с экспериментальной терапией раствором ГиперХАЕС. 1 – интерлобарное пространство, 2 – перивазальные инфильтраты лейкоцитов, тромбы внутри сосудов, 3 – зона микроабсцесса с повреждением стенки бронха. Окр.: гематоксилином-эозином. Ув.: х100.
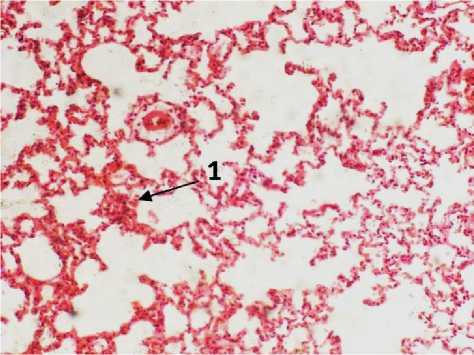
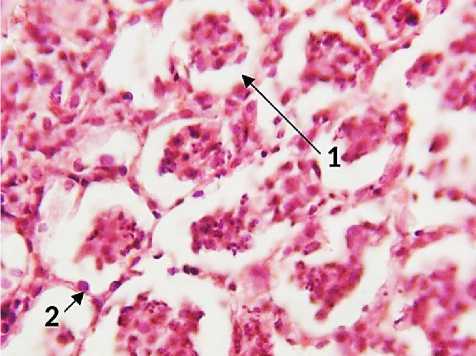
В легких крыс, которые получили внутривенно L-NAC на 6-е сутки произошли сходные изменения. Микроабсцессы визуально не определялись, однако, имели место множественные очаги лейкоцитарной инфильтрации. Кроме этого, в просветах отдельных групп альвеол макрофаги сливаются в многоядерные гомогенные структуры (рис. 5). Данный факт характерен для последствий глубокой аспирации агрессивных жидких сред, таких как ацетон. Впоследствии, вероятно, развитие пневмосклеротических очагов на этом месте. В предыдущих группах таких изменений не отмечено. По-видимому, процесс течения патологии в данной группе животных был несколько более быстрым. Это может иметь как положительное, так и отрицательное значение.
При количественной оценке гистологических срезов легких через 24 часа выявлено уменьшение основных патологических признаков ОПЛ в группах с применением опытной терапии. Если в контрольной группе внутриальвеолярные скопления фибрина имели высокий балл оценки, то в группе с ГиперХАЕС средний балл был почти в два раза меньше. Лейкоцитарная инфильтрация в контроле также имела в два раза большую степень выраженности, чем для группы с ГиперХАЕС (рис. 6).
А
Рис. 5. Легкое крысы через 6 дней после моделирования острого повреждения легких с экспериментальной терапией L-NAC. А: 1 – скопления мононуклеаров в просвете альвеолы, 2 – межальвеолярная перегородка, альвеолоцит. Б: 1 – мокрота в просвете бронхов, 2 – расширение перивазального пространства. Окр.: гематоксилином-эозином. Ув.: А – х400, Б – х100.
Кровоизлияния после введения ГиперХАЕС не наблюдались. Во всех случаях оценка морфологических изменений при использовании ГиперХАЕС была меньше, чем в группе с аспирацией ацетона без лечения. На микропрепаратах легких после введения L-NAC первый комплекс критериев ОПЛ ввиду отсутствия данных явлений остался с нулевым баллом, тем самым составив достоверно меньшее значение, чем в других группах при данной модели (р<0,001; рис. 6).
Б
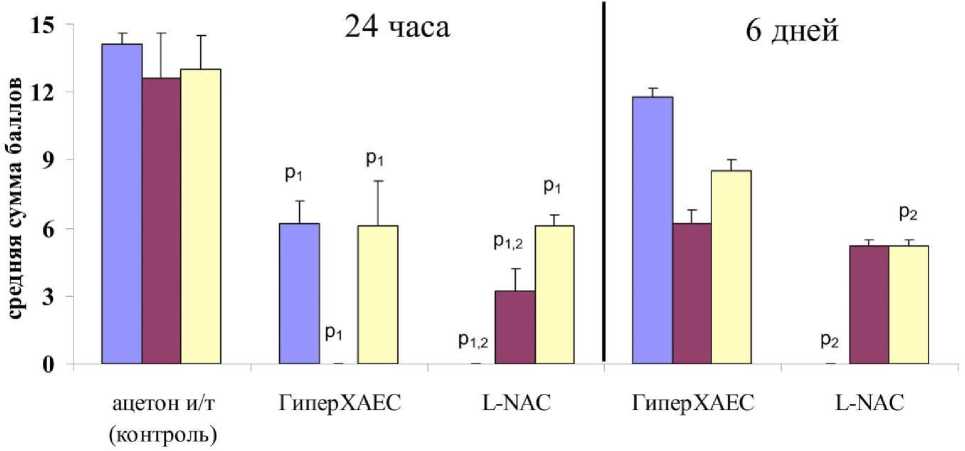
□ фибрин, ГМ □ кровь в альвеолах, некроз септ □ лейкоцитарная инфильтрация
Рис. 6. Количественная оценка гистологических признаков острого повреждения легких лабораторных крыс после аспирации ацетона на фоне экспериментальной терапии. Примечание: р 1 – достоверность различий по отношению к контрольной группе; р 2 – достоверность различий по отношению к группе ГиперХАЕС.
По картине внутриальвеолярного кровяного выпота группа с L-NAC имела достоверно меньший балл, чем в контрольной группе. Баллы, отражавшие степень лейкоцитарной инфильтрации легочной ткани в группе с L-NAC были схожи с таковыми при введении ГиперХАЕС и достоверно меньше, чем в контрольной группе (рис. 6). Легкие крыс на 6-е сутки после введения L-NAC не имели отложений фибрина, отличаясь в этом отношении от группы с введением ГиперХАЕС. Также в данной группе были достаточно низкие оценки наличия очагов некроза альвеолярных перегородок и внутриальвеолярных кровоизлияний. Лейкоцитарная инфильтрация легочной ткани в группе с L-NAC была достоверно менее выражена, чем после введения ГиперХАЕС (рис. 6).
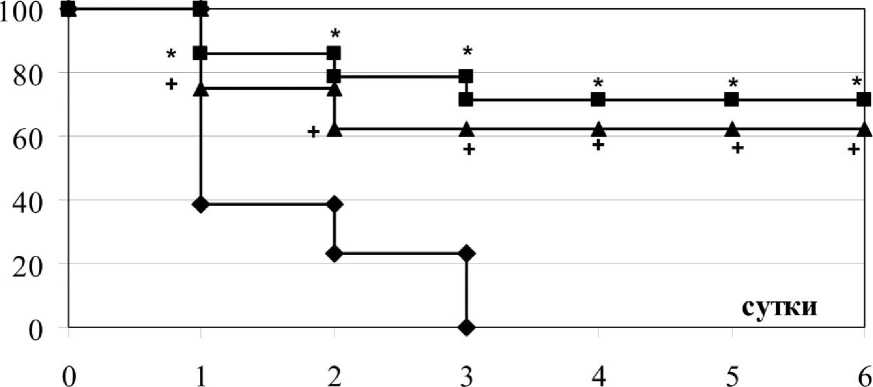
Спустя 24 часа после аспирации ацетона 61,53% животных, получивших лишь антибиотик, погибли (рис. 7). Уровень летальности в группах с однократным введением раствора ГиперХАЕС и L-NAC, был 25% и 14,3%, соответственно, что достоверно меньше, чем в группе без лечения. На 2-е сутки наблюдения число летальных исходов во всех изучаемых группах возросло. В контрольной группе летальность составила 76,9%, а после введения раствора ГиперХАЕС 37,5% (рис. 7). На 2-е сутки после применения L-NAC погибло 21,4%. В группах, в которых проводилось лечение, летальность была достоверно меньше, чем в контрольной группе. На 3-и сутки все животные из контрольной группы погибли (рис. 7). На 3-и сутки возросла летальность и в группе после применения L-NAC, до 28,6%. Уровень летальности в группе с ГиперХАЕС остался прежним.
Рис. 7. Выживаемость лабораторных крыс при остром повреждении легких, развившемся на фоне аспирации ацетона и после экспериментальной фармакокоррекции. * + - достоверность различий относительно контрольной группы.
Заключение. Таким образом, в течение шести суток наблюдения после аспирации ацетона наименьшая летальность наблюдалась у крыс, которые получили внутривенную инъекцию липосомального N-ацетилцистеина. Однако достоверное отличие было только относительно группы, где опытная терапия не проводилась. Таким образом, оба способа фармакокоррекции являлись способом снижения летальности при аспирации ацетона. Микроскопическая морфология легких выживших крыс на первые сутки после момента аспирации имела все признаки острой интерстициальной пневмонии. С этим была связана высокая летальность крыс на первые сутки, так как наблюдалась большая площадь поражения всех легочных долей, а также нарушение их альвеолярной архитектоники. Выше описанные микроскопические патологические признаки в легких крыс говорят о неэффективности процессов газообмена в таких условиях. Таким образом, в исследовании показано, что гиперосмолярный раствор ГиперХАЕС и липосомальный N-ацетилцистеин повышают выживаемость животных при остром повреждении легких и улучшают патологоанатомическую картину легких, уменьшая степень легочного отека. Однако фармакологический эффект липосом оказался более стойким по сравнению с эффектом использования гиперосмолярного гипертонического раствора гидроксиэтилкрахмала.
Список литературы Морфология легких при экспериментальном остром повреждении и его фармакокоррекции
- Novikov NY. Vliyanie gemodinamicheskogo i membranogennogo faktorov oteka na morfologicheskie izmeneniya v legkikh. Zaporozhskiy meditsinskiy zhurnal. 2012;71(2):41-42.
- Shaman. Premradzh Sudebno-meditsinskaya otsenka dinamiki morfologicheskikh izmeneniy dykhatel'noy sistemy pri aspiratsii zheludochnogo soderzhimogo i krovi. Avtoreferat diss. kand. med. nauk: 14.03.05. Moskva, 2011. S. 22.
- Chow CW, Herrera MT, Suzuki T, Downey GP. Oxidative stress and acute lung injury. Am J Respir Cell Mol Biol. 2003;29(4):427-431. https://doi.org/10.1165/rcmb.F278.
- Shuvaev VV, Han J, Tliba S, Arguiri E, Christofidou-Solomidou M, Ramirez SH, Dykstra H, Persidsky Y, Atochin DN, Huang PL, Muzykantov VR. Anti-inflammatory effect of targeted delivery of SOD to endothelium: mechanism, synergism with NO donors and protective effects in vitro and in vivo. PLoS ONE. 2013;(8)10:e77002. https://doi.org/10.1371/journal.pone.0077002.
- Gorąca A, Józefowicz-Okonkwo G. Protective effect of an early treatment with lipoic acid in LPS-induced lung injury in rats. J Physiol Pharmacol. 2007;58(3):541-549.
- Jozwiak M, Silva S, Persichini R, Anguel N, Osman D, Richard C, Teboul JL, Monnet X. Extravascular lung water is an independent prognostic factor in patients with acute respiratory distress syndrome. Crit Care Med. 2013;41(2):472-480. https://doi.org/10.1097/CCM.0b013e31826ab377
- Zafar MA, Hussain MH, Muhammad G, Saqib M. Potential Use of Hypertonic Saline Solution (7-7.5% NaCl) Resuscitation in Hypovolemic and Endotoxic Shock. International journal of agriculture and biology. 2004;6(5):926-930.
- Yu G, Chi X, Hei Z, Shen N, Chen J, Zhang W, Li S. Small volume resuscitation with 7.5% hypertonic saline, hydroxyethyl starch 130/0.4 solution and hypertonic sodium chloride hydroxyethyl starch 40 injection reduced lung injury in endotoxin shock rats: Comparison with saline. Pulmonary Pharmacology & Therapeutics. 2012;25(1):27-32. https://doi.org/10.1016/j.pupt.2011.10.003.
- Roch A, Hraiech S, Dizier S, Papazian L. Pharmacological interventions in acute respiratory distress syndrome. Annals of Intensive Care. 2013;3(20):1-9. https://doi.org/10.1186/2110-5820-3-20.
- Bulger EM, May S, Kerby JD, Emerson S, Stiell IG, Schreiber MA, Brasel KJ, Tisherman SA, Coimbra R, Rizoli S, Minei JP, Hata JS, Sopko G, Evans DC, Hoyt DB. Out-of-hospital hypertonic resuscitation after traumatic hypovolemic shock: a randomized, placebo controlled trial. Ann Surg. 2011;253(3):431-441. https://doi.org/10.1097/SLA.0b013e3181fcdb22.
- Mitsopoulos P, Suntres ZE. Protective Effects of Liposomal N-Acetylcysteine against Paraquat-Induced Cytotoxicity and Gene Expression. Journal of Toxicology. 2011;2011:1-14. https://doi.org/10.1155/2011/808967.
- Morecroft I, White K, Caruso P, Nilsen M, Loughlin L, Alba R, Reynolds PN, Danilov SM, Baker AH, Maclean MR. Gene therapy by targeted adenovirus-mediated knockdown of pulmonary endothelial Tph1 attenuates hypoxia-induced pulmonary hypertension. Mol Ther. 2012;20(8):1516-1528. https://doi.org/10.1038/mt.2012.70.
- Kulikov OA, Ageev VP, Marochkina EE, Dolgacheva IS, Minayeva OV, Inchina VI. Efficacy of liposomal dosage forms and hyperosmolar salines in experimental pharmacotherapy of acute lung injury. Research Results in Pharmacology. 2019;5(2):23-41. https://doi.org/10.3897/rrpharmacology.5.35529.
- Kulikov OA, Inchina VI, Semenova EV, Semenov AV. Sposob modelirovaniya i farmakologicheskoy korrektsii sindroma ostrogo povrezhdeniya legkikh v eksperimente. Patent na izobretenie. № 2541831. 2015. https://patentinform.ru/inventions/reg-2541831.html.
- Galvão AM, Galvão JS, Pereira MA, Cadena PG, Magalhães NS, Fink JB, de Andrade AD, Castro CM, de Sousa Maia MB. Cationic liposomes containing antioxidants reduces pulmonary injury in experimental model of sepsis. Respiratory Physiology & Neurobiology. 2016;231:55-62. https://doi.org/10.1016/j.resp.2016.06.001.
- Fominskiy EV Ispol'zovanie rastvora 7,2% NaCl / 6% gidroksietilirovannogo krakhmala 200/0,5 pri operatsiyakh revaskulyarizatsii miokarda v usloviyakh iskusstvennogo krovoobrashcheniya. Diss. kand. med. nauk: 14.01.20. Novosibirsk, 2013. 125s.
- Gushchin YI, Muzhikyan AA Vliyanie razlichnykh metodov evtanazii na gistologicheskuyu kartinu legkikh melkikh laboratornykh zhivotnykh. Mezhdunarodnyy vestnik veterinarii. 2014;(4):96-104. https://doi.org/10.29296/2618723X-2018-03-05.
- Torkunov PA. Farmakologicheskaya korrektsiya toksicheskogo oteka legkikh. Diss. d-ra. med. nauk. SPb, 2007. 240s.
- Shen W, Gan J, Xu S, Jiang G, Wu H. Penehyclidine hydrochloride attenuates LPS-induced acute lung injury involvement of NF-kappaB pathway. Pharmacol. Res. 2009;60(4):296-302. https://doi.org/10.1016/j.phrs.2009.04.007.
- Holms CA, Otsuki DA, Kahvegian M, Massoco CO, Fantoni DT, Gutierrez PS, Auler Junior JO. Effect of hypertonic saline treatment on the inflammatory response after hydrochloric acid-induced lung injury in pig. Clinics. 2015;70(8):577-583. https://doi.org/10.6061/clinics/2015(08)08.


