Морфология соединительной ткани шейки матки крыс в ходе репаративной регенерации при экспериментальном растяжении
Автор: Григорьева Юлия Владимировна, Ваньков Владимир Александрович, Чемидронов Сергей Николаевич
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 1 (13), 2014 года.
Бесплатный доступ
В статье представлено исследование морфологии соединительной ткани шейки матки крыс в ходе репаративной регенерации при экспериментальном растяжении. Установлено, что при механическом экспериментальном растяжении нижнего сегмента матки происходит растяжение волокон, а к 21 суткам регенерации наступает их фрагментация, что может быть результатом повреждения и коллагенолиза, вследствие действия коллагеназы клеток воспаления. Протеолиз коллагена различными клетками играет важную роль в регуляции типового состава коллагена при воспалении и регенерации. В любом варианте течения регенераторного процесса при травматическом повреждении тканей шейки матки фрагментированные коллагеновые волокна не могут полноценно выполнять биомеханическую функцию, так как нарушается архитектоника их расположения.
Соединительная ткань, шейка матки, коллаген, репаративная регенерация
Короткий адрес: https://sciup.org/14344074
IDR: 14344074 | УДК: 616-018
Текст научной статьи Морфология соединительной ткани шейки матки крыс в ходе репаративной регенерации при экспериментальном растяжении
Растяжение матки – это одно из основных ее свойств и функциональных назначений, реализуемое в основном при беременности и родах. Растяжение сопровождается сглаживанием и раскрытием цервикального канала шейки матки, которое в современной медицине принято называть «созреванием» [1,6,11,12]. При созревании могут наблюдаться патологические состояния, среди которых самыми распространенными являются преждевременное рас- крытие шейки матки и незрелость шейки матки в родах. И в том, и в другом случае, нет полноценного морфологического обоснования патологическим процессам, однако считается, что наиболее частая причина – травма, приводящая к так называемой органической истмико-цервикальной недостаточности [13,14].
Так, по данным Любимовой А.И., истмико-цервикальная недостаточность возникает во время искусственных абортов в 72,17 % случаев, а также при оперативных родах (наложении акушерских щипцов, ручном отделении плаценты), родах крупным плодом, в случаях родоразрешения при неполном раскрытии маточного зева, неправильном заживлении разрывов и наложении швов на шейку матки.
Совсем недавно официальное акушерство преодолело заблуждение, по которому в шейке матки женщин признавалось существование, в основном, мышечных клеток, с сокращением которых связывали запирательную функцию последней.
В настоящее время установлено, что у человека имеется небольшое количество миоцитов в шейке матки, но в основном она состоит из соединительной ткани [1,7,10].
У многих млекопитающих, в том числе и у крыс, в каудальном отделе матки также имеется соединительная ткань, несмотря на наличие сформированного мышечного сфинктера. Вероятнее всего, что при многоплодной беременности животных этот сфинктер обеспечивает продвижение плодов и удержание их до момента готовности матки к очередному изгнанию, но он не выполняет запирательную функцию, так как эта необходимость отсутствует из-за горизонтального положения тела в пространстве [8].
Несмотря на вышесказанное, у всех представителей млекопитающих в шейке матки при беременности отмечается увеличение соединительнотканных элементов, в частности, коллагеновых волокон [2,11]. Возможно, это имеет важное значение в механизме размягчения, укорочения, сглаживания шейки матки и раскрытия её в процессе родов [6,9,11,12].
Механические повреждения шейки возникают непосредственно в процессе родов, а также при проведении искусственного аборта. Повреждение шейки матки при проведении абортов обусловлено насильственным расширением ее канала, которое достигается путем постепенного введения в него специальных расширителей с все более и более широким диаметром. При этом нередко возникают трещины, надрывы шейки, ссадины, иногда довольно значительные.
Учитывая, что в литературе отсутствуют сведения о морфологическом обосновании развития органической недостаточности и о динамике регенераторного процесса данного состояния, нами предпринята попытка изучить изменения волокон соединительной ткани в условии экспериментального растяжения нижнего сегмента интактной матки.
Материал и методы. Объектом исследования служили нерожавшие половозрелые белые лабораторные крысы в количестве 12 штук. Экспериментальная часть осуществлялась в соответствии с «Правилами проведения работ с использованием экспериментальных животных». Для достижения поставленной цели крысам под эфирным наркозом было выполнено расширение нижнего сегмента матки. С целью изучения хода репаративной регенерации забор материала проводили на 3, 10 и 21 сутки. Контролем служил материал от интактных крыс аналогичного возраста. Материал фиксировали в глютаровом альдегиде и заливали в эпон-аралдитовую смесь. Готовили полутонкие срезы без окраски и исследовали их методом фазово-контрастной микроскопии.
В результате исследования установлено , что при экспериментальном растяжении слоистое строение органа сохраняется, однако травма провоцирует развитие воспалительного процесса во всех слоях нижнего сегмента.
Соединительная ткань в шейке определяется в составе собственной пластинки эндометрия и в межмышечных промежутках миометрия. В строении соединительной ткани, помимо клеток, видно хорошо развитое межклеточное вещество, основу которого в шейке матки составляют волокна, расположенные в аморфном веществе. Волокна имеют фибриллярное строение. В интактной шейке матки коллагеновые волокна тонкие и слабо контурируют. В целом, по характеру расположения волокон заметно их различное направление. Такой ход волокон, вероятно, главным образом, призван выполнять биомеханическую и амортизирующую функции при движении беременной самки.
При растяжении на 3 сутки посттравматического периода имеет место резкое вытягивание волокон в длину. В межмышечных пространствах волокна преимущественно имеют параллельный ход (рис. 1). Обращает на себя внимание, и наличие участков с выраженным волнообразным ходом волокон (рис. 1).
До 10 дня регенерации сохраняется расположение волокон на расстоянии друг от друга за счет интерстициального отека (рис. 2).
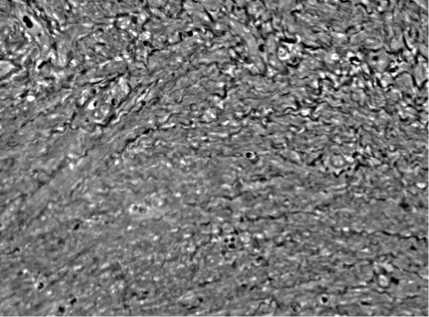
Рис. 1. Коллагеновые волокна в шейке матки крысы на 3 сутки экспериментального растяжения. Виден волнообразный ход волокон в верхней части фотограции и вытягивание волокон по ходу мышечных клеток, идущие в одном направлении.
Метод фазово-контрастной микроскопии.
Увел. 100 Х
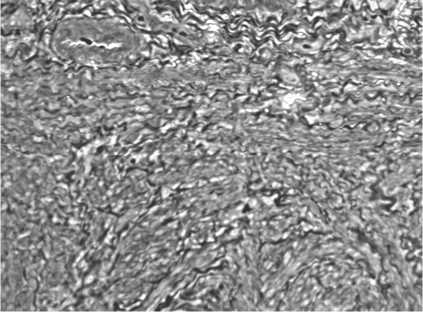
Рис. 2. Коллагеновые волокна в шейке матки крысы на 10 сутки после растяжения, идущие в различном направлении с участками вытягивания и волнообразным ходом. В поле зрения эндометрий и миометрий. Метод фазово-контрастной микроскопии. Увел. 100 Х
В прослойках интерстициальной ткани к 10 суткам увеличивается содержание моноцитов и главным образом тканевых базофилов, в небольшом количестве встречаются палочноядерные лейкоциты (рис. 3). Как известно, тучные клетки являются источником гепарина и гистамина и участвуют в регуляции местного гомеостаза. Однако полного их участия в воспалительном процессе до сих пор не установлено. В 1973 г. В.В. Виноградов на основании электронной микроскопии предположил, что тучные клетки являются специализированной разновидностью клеток макрофагального ряда. Что касается макрофагов, то они имеются в единичном количестве и к 21 суткам восстановительного периода.
К 10 и 21 суткам регенерации становится заметна фрагментация волокон. Сохраняется волнообразный ход фрагментированных участков волокон. Фрагментацию коллагеновых волокон можно расценить как результат механического разрыва, так и проявление коллагеноли-за. Известно, что коллагенолиз происходит под действием коллагеназы, выработка которой осуществляется полиморфно-ядерными лейкоцитами, фибробластами и макрофагами [3,5].
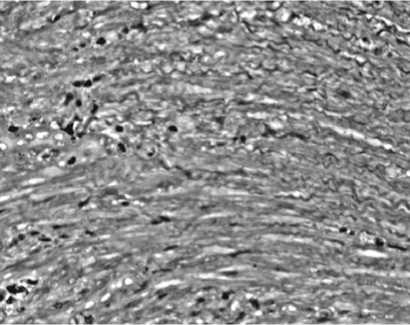
Рис. 3. Шейка матки крысы на 10 сутки после травмы. Отмечается фрагментация и истончение колагеновых волокон. В просклойках соединительной ткани видна полиморфная инфильтрация. Заметен рост кровеносных сосудов
Таким образом, в интактной шейке матки в представленной соединительной ткани много коллагеновых волокон фибриллярного строения и, учитывая данные литературы, это коллаген I и III типов [1,7]. В норме они имеют длинные фибриллы с волнообразным ходом. Волокна в шейке имеют различное направление и формируют сеть.
При механическом экспериментальном растяжении нижнего сегмента матки происходит растяжение волокон, а к 21 суткам регенерации наступает их фрагментация, что может быть результатом повреждения и коллагенолиза, вследствие действия коллагеназы клеток воспаления. Следует помнить, что коллагеназа полиморфно-ядерных лейкоцитов значительно сильнее (в 15 раз) действует на коллаген I типа, чем на коллаген III типа, а у коллагеназы фибробластов и макрофагов такой избирательности нет [4]. Эти данные свидетельствуют о том, что протеолиз коллагена различными клетками может играть роль в регуляции типового состава коллагена при воспалении и регенерации.
В любом варианте течения регенераторного процесса при травматическом повреждении тканей шейки матки фрагментированные коллагеновые волокна не могут полноценно выполнять биомеханическую функцию, так как нарушается архитектоника их расположения.
Список литературы Морфология соединительной ткани шейки матки крыс в ходе репаративной регенерации при экспериментальном растяжении
- Мол Х., Маккей Л., Гарфилд Р. Э. Биохимические, молекулярные и клинические аспекты зрелости шейки матки//Сlinical Оbstetrics and Gynecology. -V. 49. -№3. -Р. 551-563.
- Shi L, Shi SQ, Saade GR, et al. Changes in cervical resistance and collagen fluores-cence during gestation in rats. J Perinat/Med, 1999.
- Junqueira LC. Zugaib M, Montes GS, et al. Morphologic and histochemical evidence for the occurrence of collagenolysis and for the role of neutrophilic polymorphonuclear leukocytes during cervical dilation. Am J.Obstet Gynecol. 1980.
- Horwitz AL, Hance AJ, Crystal RG. Granulocyte collagenase: selective digestion of type I relative to type III collagen//Proc Natl Acad Sci USA. -1977. -№ 3(74). -Р. 897-901.
- Cury JD, Campbell EJ, Lazarus CJ, Albin RJ, Welgus HG. Selective up-regulation of human alveolar macrophage collagenase production by lipopolysaccharide and comparison to collagenase production by fibroblasts//J Immunol. -1988. -№ 12 (141).
- Глаголева Е.А. Способы подготовки шейки матки к родам/Е.А. Глаголева, О.И. Михайлова, А.А. Балушкина//Русский медицинский журнал. Хирургия. -2013. -№15.
- Minamoto T, Arai K, Hirakawa S, Nagai Y. Immunohistochemical studies on collagen types in the uterine cervix in pregnant and nonpregnant states//Am J Obstet Gynecol. -1987. -№ 1(156).
- Григорьева Ю.В. Особенности строения. Миометрия нижнего сегмента матки лабораторных крыс/Григорьева Ю.В. [и др.]//Фундаментальные исследования. -2012. -№ 12 (часть 1). -С. 48-51.
- Winkler M, Rath W. Changes in the cervical extracellular matrix during pregnancy and parturition//J Perinat. -1999. -№ 27. -Р. 45-60.
- Leppert PC. Anatomy and physiology of cervical ripening//Clin Obstet Gynecol. -1995 -Jun; 38(2).
- Ludmir J, Sehdev HM. Anatomy and physiology of the uterine cervix//Clin Obstet Gynecol. -2000. -Sep;43(3).
- Yu SY, Tozzi CA, Babiarz J, Leppert PC. Collagen changes in rat cervix in pregnancy-polarized light microscopic and electron microscopic studies//Proc Soc Exp Biol Med. -1995. -Sep;209(4).
- Бодяжина В.И. Привычный выкидыш/В.И. Бодяжина, А.И. Любимова, И.С. Розовский. -М., 1973. -136 с.
- Сидельникова В.М. Невынашивание беременности. -М., 1986. -41 с.
- Сидельникова В.М. Привычная потеря беременности. -М.: Триада-Х, 2000. -304 с.


