Морфология внутренних органов и опухоли лабораторных крыс с перевитым раком печени РС-1 при пероральном введении флавоноидсодержащих экстрактов аврана лекарственного (Gratiola officinalis L.) и кукурузы антоциановой (Zea mays L.)
Автор: Наволокин Н.А., Полуконова Н.В., Маслякова Г.Н., Бучарская А.Б., Дурнова Н.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Макро- и микроморфология
Статья в выпуске: 2 т.9, 2013 года.
Бесплатный доступ
Цель: в экспериментах in vivo исследовать противоопухолевую активность флавоноидсодержащих экстрактов кукурузы антоциановой и аврана лекарственного и их влияние на внутренние органы, опухоль и кровь лабораторных крыс с перевиваемым раком печени РС-1. Материал и методы. С помощью морфологических и биохимических методов изучено влияние экстрактов кукурузы антоциановой и аврана лекарственного в экспериментах in vivo на 30 лабораторных крысах с перевиваемым раком печени РС-1. Результаты. Установлено, что экстракт аврана, полученный определенным способом, обладает избирательным цитотоксическим эффектом на клетки опухоли и снижает эндогенную интоксикацию. Экстракт кукурузы только уменьшает эндогенную интоксикацию. Заключение. Результаты нашего исследования позволяют сделать вывод о положительных эффектах экстракта аврана лекарственного на организм животных с перевиваемым раком печени и негативном воздействии на опухолевые клетки, проявляющемся в виде как цитотоксического, так и цитостатическо-го эффектов, что открывает перспективу дальнейшего изучения приготовленного данным способом экстракта аврана в различных экспериментальных моделях. Исследуемый экстракт кукурузы антоциановой может быть перспективен при разработке препаратов, уменьшающих эндогенную интоксикацию, при комплексной терапии онкологических заболеваний.
Авран, биофлавоноиды, кукуруза, рак печени, токсичность, экстракт
Короткий адрес: https://sciup.org/14917709
IDR: 14917709
Текст научной статьи Морфология внутренних органов и опухоли лабораторных крыс с перевитым раком печени РС-1 при пероральном введении флавоноидсодержащих экстрактов аврана лекарственного (Gratiola officinalis L.) и кукурузы антоциановой (Zea mays L.)
-
1 Введение. Недостатками синтезируемых противоопухолевых препаратов являются их токсическое влияние на нормальные органы и ткани организма и развитие к ним устойчивости опухолей [1], что стимулирует поиск новых, более безопасных и высокоэффективных лекарственных средств. В настоящее время большое внимание стало уделяться нетоксичным или слаботоксичным препаратам растительного происхождения, которые могут быть использованы как для профилактики развития опухолевого процесса, так и для протекции нормальных клеток при проведении стандартного курса химио- и радиотерапии. В терапии онкологических заболеваний часто используются алкалоидсодержащие препараты растительного происхождения с достаточно хорошо изученными механизмами цитостатического действия [1–3]. Перспективным при создании противоопухолевых препаратов может оказаться комбинирование алкалоид- и флавоноидсодержащих экстрактов, так как флавоноидсодержащие компоненты, наряду с противоопухолевой и антиоксидантной активностью, способны защищать клеточные мембраны и снижать токсическое действие алкалоидсодержащих соединений [4].
Для исследования нами выбраны два растения: авран лекарственный, содержащий, по крайней мере, четыре флавоноида (апигенин, космосиин, аврозид и кверцетин) [4, 5], и антоциановая форма кукурузы обыкновенной, изначально созданная ге-
нетиками как источник стойкого антоцианового красителя [6–9], в которой обнаружены три антоциана: цианидин, хризантемин (3-О-β-D-гликопиранозоид цианидина), идеин (3-O-β-D-галактопиранозоид циа-нидина) и пять флавоноидов: трицин (5,7,4» — три-гидрокси-3»,5» — диметоксифлавон), кампферол (3,5,7,4» — тетрагидроксифлавонол), кверцетин (3,5,7,3»,4» — пентагидроксифлавонол), астрагалин (3-O-β-D-глюкопиранозоид кемпферола), изокверцетин (3-O-β-D- глюкопиранозоид кверцетина).
Цель исследования : в экспериментах in vivo исследовать противоопухолевую активность флавоноидсодержащих экстрактов кукурузы антоциановой и аврана лекарственного и их влияние на внутренние органы, опухоль и кровь лабораторных крыс с перевиваемым раком печени PC-1.
Материал и методы. Использованы отдельно водные растворы сухого спиртового экстракта аврана лекарственного ( Gratiola officinalis L.), собранного в экологически чистом районе на острове Волгоградского водохранилища выше Саратова, и сухого спиртового экстракта кукурузы антоциановой ( Zea mays L.). Сырье кукурузы антоциановой, выращенной в стандартных для данного вида условиях на территории Саратовской области, предоставлено сотрудниками кафедры генетики Саратовского государственного университета им. Н. Г. Чернышевского.
Экстракты были получены нами авторским способом (заявка на изобретение № 2012105384/15 (008220), положительное решение о выдаче патента от 7.02.2013 г.), позволяющим существенно повысить выход биофлавоноидов и предус- матривающим минимальный выход токсичных соединений (алкалоидов, гликозидов и др.) [4], что особенно актуально при получении нетоксичных экстрактов ядовитых растений, к которым относится авран лекарственный. Ранее в составе травы аврана была описана бетулиновая кислота, обладающая противоопухолевой активностью, но использованная нами технология получения экстракта исключала выход данного соединения. Химический анализ, проведенный нами на газовом хромато-масс-спектрометре Finnigan, позволил определить в полученном данным способом экстракте аврана следующие соединения: 4-винил-2-метоксифенол; 2,3-дигидро-3,5-дигидрокси-6-метил-4Н-пиран-4-он; 2,3-дигидробензофуран; 3-фуранкарбоновую кислоту; 5-гидроксиметил-2-фуральдегид; этил-a-d-рибозид; 4-пропилфенол; пирокатехин; L-луксоза (пентоза); 6-деоксигексоза L-галактозу; бензоилуксусной кислоты этиловый эфир; гексадекановую кислоту (пальмитиновая кислота); гомованилиновую кислоту; глюкозу; 1,4-ангидро-d-маннитол; бензойную кислоту; кверцетин. Экстракт кукурузы антоциановой, по данным газовой хромато-масс-спектрометрии [10], содержит: этиловый эфир гексадекановой кислоты; 5-гидроксиметил-2-фуральдегид; 1- (4-метоксифенил) — метоксипропан; 2,3-дигидро-3,5-дигидрокси-6-метил-4Н-пиран-4-он; гексадекановую кислоту (пальмитиновая кислота); этиловый эфир линоленовой кислоты; 9,12-октадекановую кислоту; 2- (5-хлор-2-метоксифенил) пиррол.
В эксперименте, проводимом в соответствии с руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ [11], использовано 30 самцов белых лабораторных крыс массой 150±50 г, которым имплантировали подкожно в области лопатки по 0,5 мл 25% опухолевой взвеси в растворе Хэнкса штамма альвеолярного рака печени РС-1, полученного из банка опухолевых штаммов ГУ РОНЦ им. Н. Н. Блохина РАМН. Животные с перевиваемым раком методом случайной выборки были разделены на три группы по 10 крыс: первую опытную, получавшую экстракт аврана в дозировке 110,88 мг/кг, вторую опытную, получавшую экстракт кукурузы (637,58 мг/кг), и третью контрольную. В опытных группах крысам раствор вводили перорально один раз в двое суток в течение трех недель с момента трансплантации опухоли. После отмены введения экстракта наблюдения за животными продолжались еще неделю.
Динамику роста опухоли оценивали по изменению ее объема по формуле: V = А х В х С , где А — ширина, В — толщина, С — высота опухоли. Измерения проводили электронным штангенциркулем каждые два дня от начала эксперимента. На 26-е сутки крыс выводили из эксперимента и производили забор образцов ткани органов, опухоли, крови для исследований.
Для изучения патоморфоза опухоли и структурных изменений в органах применялись морфологические и морфометрические методы с использованием стандартных гистологических методик окраски гематоксилином и эозином, по Романовскому — Гимзе; гистохимические методики: PAS-реакция, окраска на лектин зародышей пшеницы (WGA), визуализация с помощью пероксидазы, а также окраска метиловым зеленым пиронином по Браше для выявления ДНК и РНК. Учитывали наличие дистрофических и некро-биотических изменений и такие цитоморфологиче-ские метрические показатели, как диаметр раковой клетки, соотношение диаметров раковой клетки и её ядра, ядерно-цитоплазматический индекс (ЯЦИ). Подсчет проводили на 100 клеток в 10 полях зрения каждого микропрепарата, с помощью микровизора медицинского проходящего света µVizo-101 (ЛОМО) [12, 13].
Антиоксидантную активность (АО) выявляли стандартными биохимическими методами с определением: малонового диальдегида (МДА) с помощью тиобарбитуровой кислоты, активности каталазы в эритроцитах, активности супероксиддисмутазы крови (СОД), показателя перикисного окисления липидов (ПОЛ) [14, 15]. Лейкоцитарную формулу крови анализировали по количеству палочек, сегментов, базофилов, моноцитов, лимфоцитов и индексу эндогенной интоксикации Каль-Калифа в модификации Б. А. Рейса и соавторов [16].
Работу с лабораторными животными осуществляли согласно протоколу исследований, не противоречащих Женевской конвенции 1985 г. о Международных принципах биомедицинских исследований с использованием животных. Тема и описания экспериментов одобрены этической комиссией ГБОУ ВПО «СГМУ им. В. И. Разумовского» Минздрава России (протокол № 13 от 3 мая 2011 г.).
Статистическую обработку результатов проводили в программе «SPSS 13.0» методами медикобиологической статистики с вычислением средней и стандартной ошибки средней. Значимость различий при параметрическом распределении определяли при помощи t-критерия Стьюдента для независимых выборок при Р<0,05.
Результаты. В группе крыс, получавших экстракт аврана, обнаружено замедление темпа роста опухоли через неделю на 2,5%, через две недели на 28% по сравнению с контролем, а через три недели достоверно на 41 %. Еще через неделю, к концу эксперимента, отмечалось замедление темпов уменьшения опухоли (на 15% по сравнению с контролем), что может быть обусловлено прекращением введения экстракта (рис. 1). В группе крыс, получавших экстракт кукурузы, выявлено, наоборот, увеличение объема опухоли через неделю на 61 %, достоверно через две недели на 115%, через три недели на 59% и к концу эксперимента на 22% по сравнению с контрольной группой (рис. 1).
Данные контрольной группы достоверно отличаются при Р<0, 05 на 14-й и 20-й день с группой, получавшей экстракт кукурузы, и на 20-й и 22-й день с группой, получавшей экстракт авран.
Перевиваемая опухоль в контроле микроскопически состояла из ячеек различной величины, разделенных тонкими прослойками соединительной ткани. Опухолевые клетки овально-округлой формы имели эксцентрично расположенные ядра. Значительная часть цитоплазмы занята крупными вакуолями, содержащими слизь. В одном и том же поле зрения можно было обнаружить клеточные элементы со слизистыми вакуолями различной величины. В клетках с небольшими эксцентричными вакуолями ядра чаще имели округлую или бобовидную форму. В клетках с крупными вакуолями в цитоплазме ядро было оттеснено к периферии, и такие клетки напоминали по своему строению перстневидные клетки слизистого рака. Выявлены единичные митозы. В небольших очагах некроза, наряду с фрагментами разрушенных клеток, обнаруживали скопления слизистых масс. Слизистые массы присутствовали также в межклеточных пространствах.
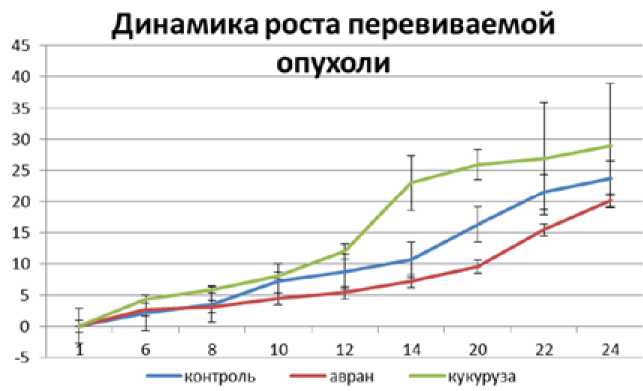
Рис. 1. Динамика роста опухоли в контрольной группе крыс и в группах крыс, получавших экстракты аврана и кукурузы
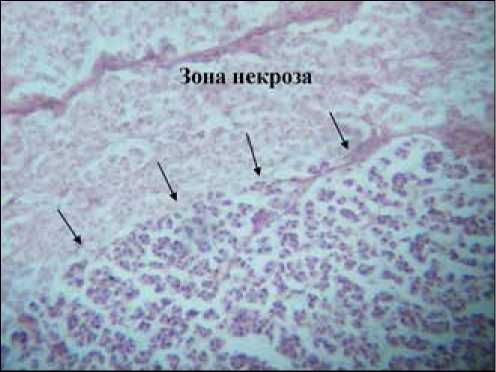
Рис. 2. Четкая зона некроза в раке печени РС-1 в группе животных, получавших экстракт аврана. Окраска гематоксилином и эозином (ув. 100)
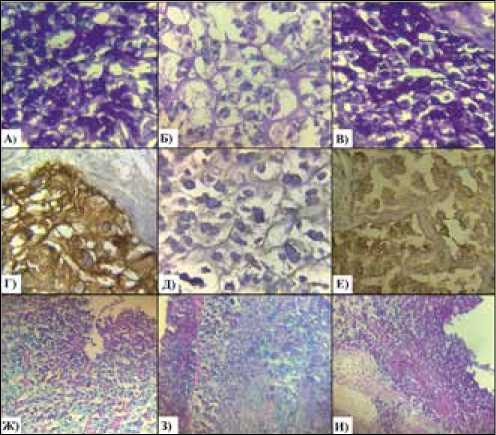
Рис. 3. Гистологические изменения в опухоли по группам животных. PAS-реакция (ув. 400): А) в контроле, Б) в эксперименте с экстрактом аврана, В) в эксперименте с экстрактом кукурузы; WGA (ув. 400),: Г) в контроле, Д) в эксперименте с экстрактом аврана, Е) в эксперименте с экстрактом кукурузы; метиловый зеленый пиронин по Браше (ув. 100),: Ж) в контроле, З) в эксперименте с экстрактом аврана, И) в эксперименте с экстрактом кукурузы
В группе крыс, получавших экстракты как аврана, так и кукурузы, опухоль в целом сохраняла строение, описанное в контрольной группе. Однако, по сравнению с контролем, в опухоли крыс из группы, получавшей экстракт аврана, наблюдалось уменьшение количества слизистого компонента и развитие атрофических и дистрофических изменений опухолевых клеток, о чем свидетельствовало появление клеток по типу «клеток-теней»; в ткани опухоли обнаружено появление четких зон некроза и отсутствие митозов (рис. 2). В группе крыс, получавших экстракт кукурузы, в опухолевой ткани зоны некроза не имели четких границ.
При гистохимической окраске опухоли с помощью лектина зародышей пшеницы WGA (положительная визуализация пероксидазой, при взаимодействии WGA c гликопротеидами) и PAS-реакции (окраска на мукополисахариды) в группе крыс, получавших экстракт аврана, отмечали значительное снижение интенсивности окраски по сравнению с контролем, что свидетельствовало о повреждении поверхностных мембран клеток. В группе крыс, получавших экстракт кукурузы, как и в группе контроля, выявлено выраженное окрашивание опухолевой ткани (рис. 3).
При окраске на ДНК и РНК метиловым зеленым пиронином по Браше в опухоли крыс, получавших экстракт аврана, отмечено снижение количества клеток, в которых окраска на РНК была положительная и, следовательно, снижение транскрипционной активности в опухолевых клетках. Под действием экстракта кукурузы выявлено увеличение количества клеток с окрашенной РНК метиловым зеленым пиро-нином по сравнению с контрольной группой, что указывало, наоборот, на повышение транскрипционной активности в опухолевых клетках.
Следует отметить, что в группе крыс, получавших экстракт аврана, наиболее выраженный патоморфоз опухоли наблюдали в центральных ее отделах.
При морфометрическом исследовании диаметр ядер опухолевых клеток в группе крыс, получавших авран, составил 3,4±0,15, что на 13,5% меньше диаметра ядер клеток в контроле (4,05±0,15); в группе крыс, получавших экстракт кукурузы, диаметр ядер (4,07±0,15) достоверно не изменялся. Диаметр самих клеток (5,03±0,22) в группе крыс, получавших экстракт аврана, был достоверно меньше на 32,7%, по сравнению с диаметром клеток в контроле (7,45±0,15); в группе крыс, получавших экстракт кукурузы, диаметр клеток (5,9±0,15) был на 21 % меньше по сравнению с контролем (табл. 1). Значения показателя ЯЦИ под действием экстрактов увеличивались по сравнению с контролем. Снижение диаметра опухолевых клеток под действием экстракта аврана указывало на снижение их митотической активности, что также согласуется со снижением транскрипционной активности в автокаталитической интерфазе.
При гистологическом изучении органов животных, получавших экстракты, в головном мозге, сердце, легких, кишечнике, по сравнению с контролем, изменений не выявлено, и только в печени развивалась умеренная дистрофия гепатоцитов, более выраженная в группе крыс, получавших экстракт аврана, но данные изменения являлись обратимыми.
В лейкоцитарной формуле животных под действием экстрактов аврана и кукурузы по сравнению с контролем достоверно уменьшалось количество сегментоядерных нейтрофилов на 22,3% (под действием аврана) и 24,5% (под действием кукурузы) и увеличивалось количество лимфоцитов на 55% (под действием аврана) и 46% (под действием кукурузы) (табл. 2).
Таблица 1
Изменение метрических показателей клеток опухоли в контроле и под действием экстрактов
|
Показатели клеток опухоли |
В контроле |
Под действием экстрактов |
|
|
аврана |
кукурузы |
||
|
Размер ядра |
4,05±0,04 |
3,40±0,04* |
4,07±0,04 |
|
Размер клетки |
7,45±0,04 |
5,03±0,05* |
5,90±0,04* |
|
ЯЦИ |
0,54±0,008 |
0,68±0,008* |
0,69±0,007* |
П р и м еч а н и е : * — Р<0,001 достоверность различий при сравнении значений опытной и контрольной групп.
Таблица 2
Изменения лейкоцитарной формулы крови крыс в контрольной группе и группе, получавшей экстракты
|
Форменные элементы крови |
В контроле (%) |
Под действием экстрактов (%) |
|
|
кукурузы |
аврана |
||
|
Палочки |
3±0,28 |
4,5±0,56* |
3±0,21 |
|
Сегменты |
60,3±1,09 |
45,5±0,56** |
46,8±1,43** |
|
Базофилы |
1,67±0,33 |
3±0,3* |
2,75±0,33 |
|
Моноциты |
10,67±0,6 |
13,5±0,56* |
10,4±3,44 |
|
Лимфоциты |
24,67±0,44 |
36±0,37* |
38,2±0,95** |
П р и м еч а н и е : * — Р<0,05; ** — Р<0,001 достоверность различий при сравнении значений опытной и контрольной групп.
Таблица 3
Биохимические показатели крови (МДА, каталазы, и СОД) у крыс с перевитой опухолью под действием экстрактов аврана и кукурузы
|
Показатели |
Группы животных |
||
|
контрольная |
с экстрактом аврана |
с экстрактом кукурузы |
|
|
МДА, ммоль/л |
1,933±0,14 |
5,248±1,3** |
2,215±0,04** |
|
Каталаза, МЕ |
0,175±0,22 |
0,369±0,017* |
0,114±0,008** |
|
СОД, МЕ |
4,527±0,28 |
7,188±1,46* |
2,940±0,41* |
П р и м еча н ие : * — Р<0,05; ** — Р<0,005 достоверность различий при сравнении значений опытной и контрольной групп.
Показатели эндогенной интоксикации
Таблица 4
|
Группы животных |
ЛИИ |
Степень интоксикации |
|
Контрольная |
2,58±0,2 |
Выраженная |
|
С экстрактом аврана |
1,02±0,12* |
Умеренная |
|
С экстрактом кукурузы |
1,02±0,12* |
Умеренная |
П р и м еч а н и е : * — Р<0,05 достоверность различий при сравнении значений опытной и контрольной групп.
В эксперименте с экстрактом кукурузы показатель ПОЛ и АО ферментов не отличались от группы контроля (табл. 3), что свидетельствовало о слабой эффективности АО систем клеток при данном типе опухолей. В эксперименте с авраном наблюдалось повышение МДА на 171% относительно контроля, что свидетельствовало о разрушении эритроцитарных мембран под действием АФК, несмотря на то что активность ферментов также возросла: каталазы на 111%, СОД на 59% (табл. 3). Полученные данные свидетельствуют о высокой АО активности экстракта аврана.
При определении степени эндогенной интоксикации было установлено, что у животных в контрольной группе отмечалась высокая эндогенная интоксикация за счет развития опухолевого процесса, а под действием экстрактов уровень интоксикации снижался в 2,5 раза, соответствуя значениям умеренной интоксикации (табл. 4). Снижение уровня интоксикации, возможно, обусловлено наличием биофлавоноидов в обоих экстрактах.
Обсуждение. В группе крыс, получавших экстракт аврана, зафиксировано достоверное уменьшение диаметров опухолевых клеток и их ядер по сравнению c контролем. Не выявлено морфологических признаков потери дифференцировки и появления признаков атипизма клеток опухоли. Уменьшение размеров ядра и цитоплазмы раковых клеток, наряду с отсутствием митозов и низким содержанием в них РНК, указывает на низкую митотическую и транскрипционную активность клеток опухоли, и торможение клеточного цикла в период S- и G2-фаз с последующим резким снижением их пролиферации, что в целом свидетельствует о цитостатическом действии экстракта аврана. Данный эффект экстракта аврана подтверждается значительным замедлением темпов роста опу- холи, а также атрофическими и дистрофическими изменениями в опухолевых клетках, появлением в опухолях четких зон некроза по сравнению с контрольной группой.
Отсутствие выраженных изменений в органах крыс под действием экстракта аврана связано с его выраженной антиоксидантной активностью на фоне развивающейся опухоли, служащей защитным механизмом, снижающим токсическую нагрузку, и, наряду с увеличением количества лимфоцитов в крови, свидетельствует об общем благоприятном влиянии на организм животных, что характерно для флавоноидсодержащих экстрактов. Вместе с тем отсутствие выраженных изменений в органах крыс под действием экстракта свидетельствует о его избирательном цитотоксическом действии на клетки опухоли.
Появление некрозов в опухоли крыс, получавших экстракт кукурузы, может иметь другой генез, возможно связанный с недостаточным ростом сосудов, который не обеспечивает адекватного питания опухоли при ее выявленном более быстром и интенсивном по сравнению с контролем росте. Снижение значений цитометрических показателей раковых клеток под влиянием экстракта кукурузы наряду с отсутствием уменьшения размеров их ядер, возможно, происходит в результате высокой митотической активностью клеток, сопровождающейся также высокой транскрипционной активностью, о чем свидетельствует более высокое содержание РНК. Такие данные могут свидетельствовать об отсутствии включения механизмов торможения митотического цикла в клетках опухоли под действием данного экстракта кукурузы и даже о стимулирующем воздействии на рост исследуемого типа опухоли при пероральном введении. Вместе с тем уменьшение эндогенной интоксикации в целом на фоне растущей опухоли заслуживает особого дальнейшего исследования.
Заключение. Результаты нашего исследования позволяют сделать вывод о положительных эффектах экстракта аврана лекарственного на организм животных с перевиваемым раком печени и негативном воздействии на опухолевые клетки, проявляющемся в виде как цитотоксического, так и цитостатического эффектов, что открывает перспективу дальнейшего изучения приготовленного данным способом экстракта аврана в различных экспериментальных моделях. Приготовленный авторским способом экстракт сырья кукурузы, исследованный в настоящей работе, требует дальнейших экспериментальных исследований; он может быть перспективен при разработке препаратов, уменьшающих эндогенную интоксикацию, например при комплексной терапии онкологических заболеваний.
Список литературы Морфология внутренних органов и опухоли лабораторных крыс с перевитым раком печени РС-1 при пероральном введении флавоноидсодержащих экстрактов аврана лекарственного (Gratiola officinalis L.) и кукурузы антоциановой (Zea mays L.)
- Корман Д. Б. Основы противоопухолевой химиотерапии. М.: Практическая медицина, 2006. 512 с.
- Наволокин Н.А., Полуконова Н.В., Маслякова Г. Н., Бучарская А.Б., Тырнов B.C. Морфологические изменения в органах и опухоли крыс с перевитым раком печени РС-1 при пероральном введении экстракта пурпурной кукурузы (Zea Mays L.)//Российский биотерапевтический журнал. 2012. Т. 11., №2. С. 37
- Stanislaw Boryczka, Ewa Bebenek, Maria Jastrzebska, Joachim Kusz, and Maciej Zubko. Crystal structure of betulinic acid-DMSO solvate//Zeitschrift fur Kristallographie -Crystalline Materials. 2012. Vol. 227, № 6. P. 379-384 DOI: 10.1524/zkri.2012.1527
- Navolokin N.A., Polukonova N.V., Maslyakova G.N., Bucharskaya А. В., Durnova N.A. Effect of extracts of Gratiola officinalis and Zea mays on the tumor and the morphology of the internal organs of rats with trasplanted liver cancer//Russian Open Medical Journal. 2012. T. 1, № 2. P. 0203
- Куркин В. А. Фармакогнозия: учебник для фармацевтических вузов (факультетов) 2-е изд., перераб. и доп. Самара, 2007. 1239 с.
- Тырнов B.C., Завалишина А. Н., Смолькина Ю.В., Сериков Л. В. Создание форм кукурузы -источника пищевых красителей//Химия и технология растительных веществ. Ill Всерос. конф. Саратов, 2004. С. 258-259
- Купчак Т. В., Николаева Л. О., Шимолина Л. Л. Выделение и идентификация антоцианов из гибридной кукурузы//Фармацевтический журнал. 1995. № 6. С. 62-64
- Купчак Т. В. Фитохимическая характеристика гибридной формы кукурузы Zea mays L. и технология антоцианово-го красящего препарата: автореф. дис.... канд. фарм. наук. СПб., 1998.23 с.
- Полуконова Н.В., Федорова И.А., Гопиенко А. В., Тырнов B.C. Токсикологическая, канцерогенная и мутагенная безопасность антоциановой формы кукурузы Zea mays L. как источника красного красителя//Бюллетень ботанического сада СГУ. Саратов: Изд-во Сарат ун-та, 2010. Вып. 9. С. 158-162
- Полуконова Н.В., Дурнова Н.А., Райкова С. В. Анализ химического состава и биологических свойств спиртового экстракта растительного сырья гибридной формы кукурузы Zea mays L.//Мат. IV Всерос. конф. «Фармобразование 2010», Воронеж, 2010. С. 306-311
- Хабриев Р. У. Руководство по экспериметнальному (доклиническому) изучению новых фармакологических веществ. М.: ОАО «Изд-во «Медицина». 2005. 832 с.
- Маслякова Г. Н., Бучарская А. Б., Наволокин Н.А., Широков А.А., Буров A.M. Применение морфологических методов исследования в наноонкологии//Вестн. биотерапевт, журн. 2011. №4. С. 104
- Гельфандбейн Я.А., Каплан Б.Л., Маеро-вич И.М. Ядерно-цитоплазматические константы малигнизи-рованных структур//Экспериментальная медицина и анестезиология. 1973. № 3. С. 3-9
- Артюхов В. Г., Наквасина М.А. Биологические мембраны: структурная организация, функция, модификация физико-химическими агентами. Воронеж.: Изд-во Ворон, унта, 2000. 243 с.
- Полуконова Н.В., Меркулова Е.П., Дурнова Н.А., Ро-мантеева Ю.В., Бородулин В. Г. Изучение антиоксидантной активности экстракта аврана лекарственного на крысах с перевитой опухолью печени РС-1//Научн.-практич. конф. «Биологически активные вещества: фундаментальные и прикладные вопросы получения и применения». Новый Свет, Крым, Украина, 23-28 мая 2011: тез. докл. Киев, 2011. С. 585
- Рейс Б. А., Полуэктов Л. В. Выделение токсического полипептида средней молекулярной массы при экспериментальном разлитом перитоните//Бюлл. экспер. биол. мед. 1983. №7. С. 53-55
- Наволокин Н.А., Павлова А.В. Морфологические изменения в мышцах у лабораторных крыс и определение токсичности при введении экстракта аврана//Бюллетень медицинских Интернет-конференций. 2012. Т. 2, вып. 2. С. 82.


