Морфолого-биологическая характеристика мужской генеративной сферы Clematis vitalba L
Автор: Шевченко С.В., Кузьмина Т.Н.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Ботаника
Статья в выпуске: 2, 2015 года.
Бесплатный доступ
Проведено изучение процессов формирования мужских генеративных структур Clematis vi-talba L. Установлено, что особенности развития и строения элементов мужской генеративной сферы C. vitalba сходны с таковыми у других видов рода Clematis и некоторых представителей семейства Ranunculaceae. Основными эмбриологическими чертами C. vitalba является центростремительный тип формирования стенки микроспорангия, 2-3-рядный средний слой, секреторный тапетум, 2-клеточные пыльцевые зерна, образование большого количества нормальных пыльцевых зерен, приспособленность не только к аллогении, но и к автогении. Показаны перспективы использования данного вида в озеленении и в селекции.
Микроспорангий, мужской гаметофит
Короткий адрес: https://sciup.org/147204715
IDR: 147204715 | УДК: 582.675.1:581.34
Текст научной статьи Морфолого-биологическая характеристика мужской генеративной сферы Clematis vitalba L
Многие представители семейства Лютиковых (Rammcitlaceae) благодаря ярко окрашенным цветкам ЯВЛЯЮТСЯ Признанными декоративными растениями. В настоящее время часть из них введены в культуру и широко используются в озеленении. К таким привлекательным декоративным растениям относятся виды рода Clematis L., которые отличаются продолжительным цветением и весьма эстетичны практически на протяжении всего вегетационного периода
Во флоре Крыма отмечены 3 вида данного рода: С. jlammula L., С. integrijolia L. и С. vitalba L. [Голубев, 1996: Ена, 2012]. Наиболее распространенным из них является С. vitalba L_ который благодаря обильному цветению, ароматным цветкам и устойчивости к высоким температурам воздуха перспективен для использования в селекции.
(С Шевченко С. В., Кузьмина Т. Н., 2015
Целью данной работы было выявление особенностей развития мужских генеративных структур С. vitalba и возможностей использования данного вида в качестве родительской формы при гибридизации.
Материал и методы исследований
Объектом исследования был лиановидный кустарник С. vitalba. произрастающий в естественной флоре Крымского полуострова. С. vitalba (ломонос виноградолистный) - лиановидный кустарник с сильно ребристой корой и ветвями, которые цепляются за опору с помощью завивающихся черешков листьев. Листья непарноперистые, сложные, из 5-7 яйцевидных, заостренных листочков. Цветки мелкие, ароматные, белые, многочисленные, собранные в метельчатые соцветия (рис. 1). Природный ареал С. vitalba Охватывает Северную Африку7, практически всю территорию Европы, Кавказ. Ближний и Средний
Ближний и Средний Восток. В Крыму произрастает в горной его части, в светлых лесах, на каменистых склонах. Цветет в июне-июле, на одном побеге может быть до 1200 цветков [Шевченко, Зубкова. 2008]. весьма декоративен и в период плодо- ристыми столбиками. Цветки имеют простой венчиковидный околоцветник, представленный свободными лепестковидными чашелистиками, густо-опушенными с обеих сторон. Цветки обоеполые, гинецей состоит из многочисленных свободных

Рис. 1. Общий вид цветоносного побега Clematis vitalba L.
Для изучения процессов формирования мужских генеративных структур брали бутоны и пыль-ники С. vitalba на разных стадиях развития, которые фиксировали фиксатором Карнуа (6:3:1) в течение 6 ч. Постоянные препараты готовили по общепринятым цитоэмбриологическим методикам [Паушева. 1990; Ромейс, 1954]. После промывки и обезвоживания фиксированный материал пропитывали хлороформом и парафином. Срезы толщиной 10-12 мкм выполняли с помощью ротационного микротома марки МРТУ. Постоянные препараты окрашивали метилгрюнпирониом с подкраской ал циановым синим [Шевченко, Чеботарь, 19921. Анализ препаратов осуществляли с помощью микроскопа «Jenamed 2» фирмы Carl Zeiss. Морфометрические измерения проводили при помощи микроскопа Axio-Scope A.l (Carl Zeiss), используя программное приложение Ах ioVision Rei. 4.8.2. Наблюдения проводили методами светло- Рис. 2. Фрагменты цветущего (А) и плодоносящего (Б)
польной и поляризационной микроскопии. Микрофотографии получены с помощью системы анализа изображения AxioCam ERc5s и цифровой фотокамеры Canon А550.
Результаты и их обсуждение
Андроцей ломоноса виноградолистного представлен многочисленными прямыми тычинками, расположенными спирально в несколько кругов. Тычиночная нить более чем в 3 раза длиннее пыльника. В начале цветения тычинки плотно прижаты к столбику. затем постепенно отклоняются, начиная с наружного круга (рис. 2). Пыльники 4-гнездные, 2-тековые, вскрываются экстрорзно, также начиная с наружного круга.

побегов Clematis vitalba L.
Стенка микроспорангия развивается центростремительно. тапетум является производным вторичного париетального слоя. К началу мейоза стенка микроспорангия уже сформирована и состоит из эпидермиса, эндотеция. 2-3 средних слоев
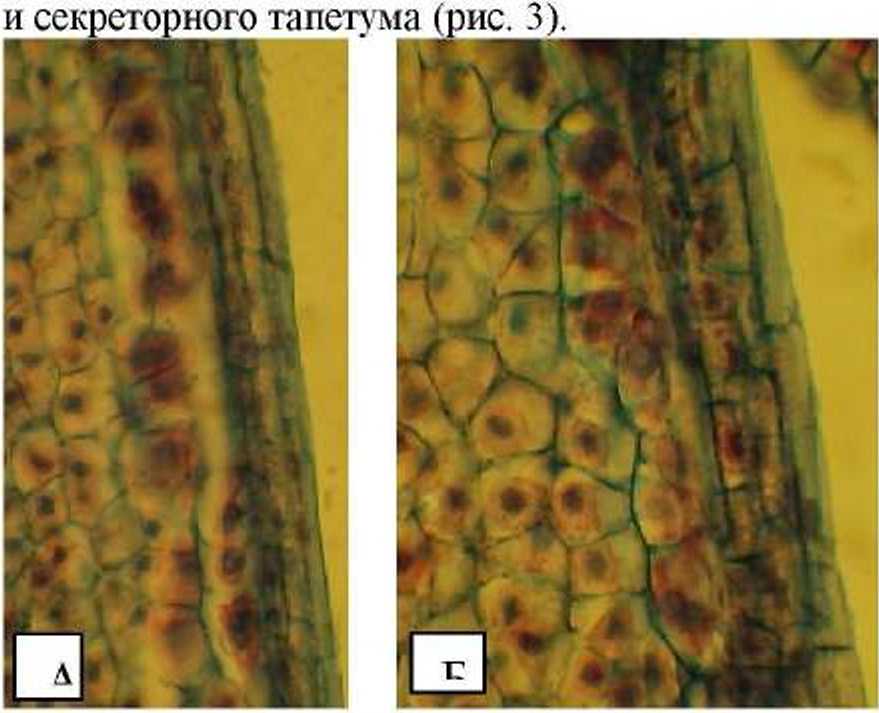
Рис. 3. Фрагменты сформированных стенок микроспорангиев Clematis vitalba L.
Клетки эпидермиса крупные, радиально вытянуты. Клетки эндотеция также вытянуты, но мельче эпидермальных, средние слои представлены рядами радиально вытянутых клеток. Ядра клеток тапетума могут делиться, и тогда образуются либо 2-4-ядерные клетки, либо происходит цитокинез, в результате чего формируется два ряда клеток. Спорогенная ткань представлена несколькими слоями довольно крупных клеток (рис. 3).
Тетрада микроспор образуется симультанно (рис. 4). Микроспоры расположены тетраэдрически. Мейоз в одном пыльнике проходит довольно синхронно. К периоду мейоза тапетум начинает распадаться на отдельные клетки, средние слои дегенерируют. начиная с ряда, примыкающего к та-пету му (рис. 4).
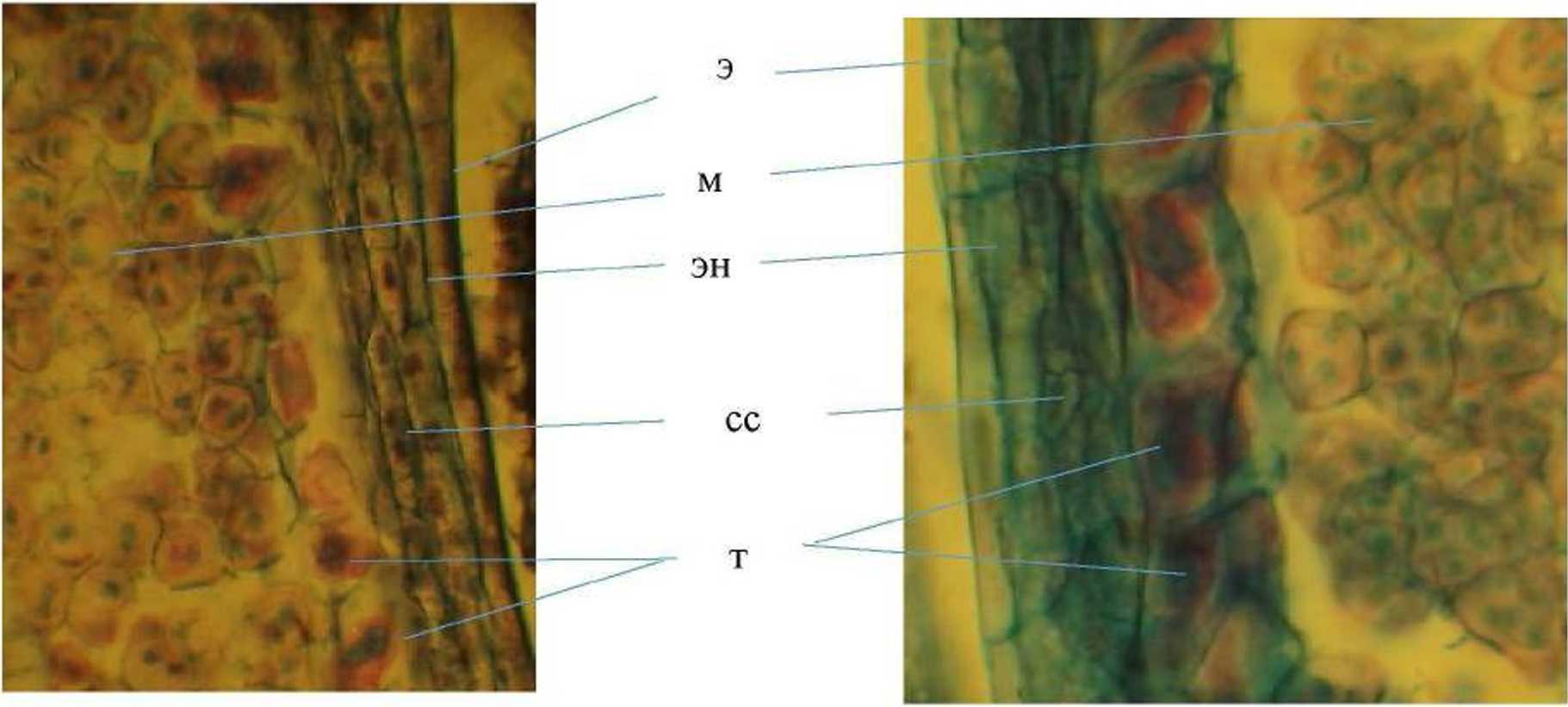
Рис. 4. Фрагменты микроспорангиев Clematis vitalba L. в период мейоза:
м - микроспорогенез, сс - средние слои, т - тапетум э - эпидермис, эн - эндотеций
На стадии дифференцирующего митоза клеток эпидермиса стенки микроспорангия С. vitalba уплощаются. а в клеточных стенках эндотеция формируются фиброзные утолщения, которые отчетливо видны в поляризованном свете (рис. 5 А. 1). Средние слои в этот период облитерируют (рис. 5А). В зрелом пыльнике стенка микроспорангия представлена уплощенными клетками эпидермиса и фиброзным эндотецием (рис. 5Б).
Следует отметить, что по основным чертам развитие стенки микроспорангия и формирование мужского гаметофита С. vitalba сходны с таковыми у других представителей семейства Ranuncu-laceae (С?, integhjblia, С. jackmanii, Adonis vernal is) [Марко. 2008; Соколовская. 1981; Шевченко. Чеботарь. 1992|. хотя и есть некоторые отличия. Например. у Anemone L. и Aquilegia vulgaris L. в эн- дотеции фиброзные утолщения не образуются [Bhandari. 1968; Bhandari. Vijyaraghavan. 1970].
Зрелая пыльца С. vitalba 2-клеточная. 3-поровая. с довольно крупной генеративной клеткой в центре (рис. 5 Б). Пыльцевые зерна округлой формы, их диаметр составляет 19.60±0.11pm. В массе зрелой пыльцы преобладают морфологические нормальные пыльцевые зерна, доля которых составляет 70-90%. Доля дефективных пыльцевых зерен около 10%. В качестве аномалий развития отмечено образование многоклеточных и многоядерных структур и полиплоидных пыльцевых зерен.
Следует отметить асинхронность в развитии структур в пыльниках наружных и внутренних слоев тычинок: когда пыльники наружных слоев вскрываются и из них высыпается зрелая пыльца.
и асинхронность развития генеративных структур в пыльниках разных слоев тычинок создает дополнительную возможность для автогении к концу' цветения.
пыльники внутренних слоев тычинок еще закрыты, и в них проходит дифференцирующий митоз. Отставание в развитии внутренних слоев пыльников можно наблюдать и визуально в раскрытом цветке. С. vitalba относится к энтомофильным растениям.
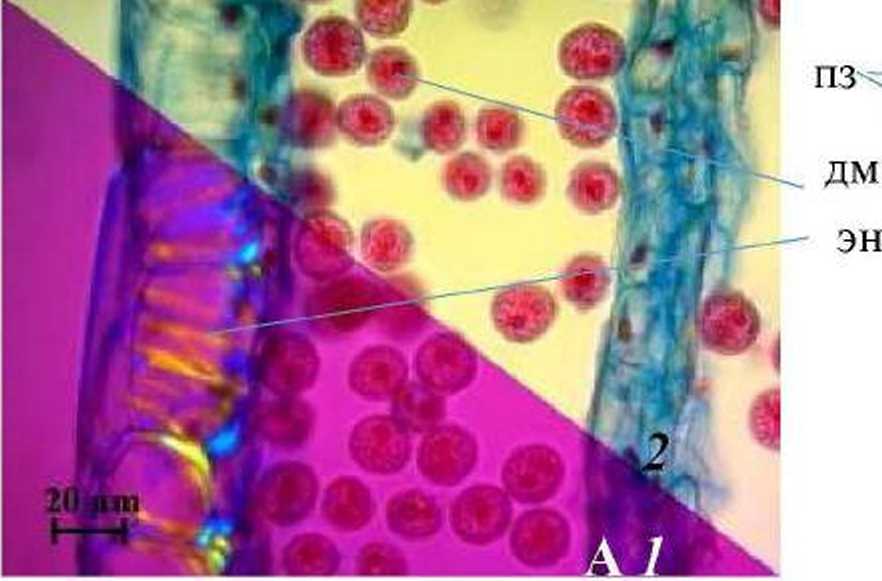
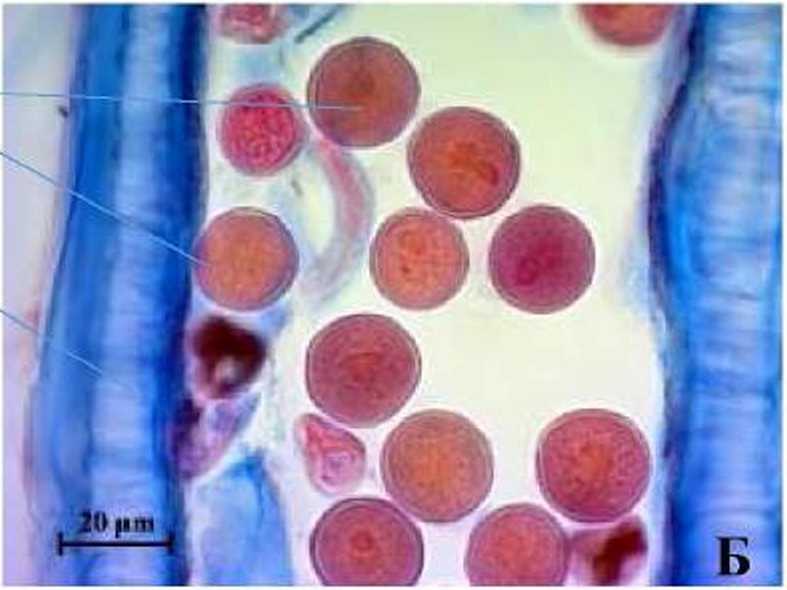
Рис. 5. Фрагменты микроспорангиев Clematis vitalba Ь.на стадиях дифференцирующего митоза (А) и зрелого пыльника (Б):
1 - в изображение в поляризованном свете; 2 - в светлом поле (пз - пыльцевые зерна, дм -дифференцирующий митоз, эн - эндотелий с фиброзными утолщениями)
Заключение
Таким образом, особенности развития и строения элементов му жской генеративной с(|)еры С. vitalba сходны с таковыми у других видов рода Clematis и некоторых продета Bine лей семейства Ranunculaceae. Основными эмбриологическими чертами С. vitalba является центростремительный тип (формирования стенки микроспорангия, 2-3-рядный средний слой, секреторный тапетум, 2-клеточные пыльцевые зерна, образование большого количества нормальных пыльцевых зерен, приспособленность нс только к аллогении. но и к автогении. Учитывая длительность цветения данного вида и способность к различным способам опыления, высокую долю морфологически нормальной пыльцы, устойчивость к засушливым условиям среды, его можно рекомендовать для использования в озеленении. а также в качестве отцовской формы при гибридизации с целью создания новых, устойчивых к экстремальным факторам сортов.
Работа выполнена при частичной финансовой поддержке Российского научного фонда по проекту № 14-50-00079 (2014-2018 гг.).
Список литературы Морфолого-биологическая характеристика мужской генеративной сферы Clematis vitalba L
- Голубев В.Н. Биологическая флора Крыма. Ялта, 1996. 126 с
- Ена А.В. Природная флора Крымского полуострова. Симферополь, 2012. 232 с
- Марко Н.В. Эмбриология и особенности естественного возобновления Adonis vernalis L. и Paeonia tenuifolia L. в Крыму: дис.... канд. биол. наук. Ялта, 2008. 193 с
- Паушева З.П. Практикум по цитологии растений. М.: Колос, 1990. 283 с
- Ромейс Б. Микроскопическая техника. М.: Из-во иностр. лит-ры, 1954. 718 с
- Соколовская Т.Б. Семейство Ranunculaceae//Сравнительная эмбриология цветковых растений. Winteraceae -Juglandaceae. Л.: Наука, 1981. С. 130-138
- Шевченко С.В., Зубкова Н.В. Некоторые аспекты репродуктивной биологии Clematis L. (сем. Ranunculaceae)//Тр. Никит. бот. сада. 2008. Т. 129. С. 6-21
- Шевченко С.В., Чеботарь А.А. Особенности эмбриологии маслины европейской (Olea eu-ropaea)//Тр. Никит. бот. сада. 1992. Т. 113. С. 52-61
- Bhandari N.N. Studies in the family Ranunculaceae. X. Embryology of Anemone L.//Phytomorphol-ogy. 1968. Vol. 18. № 4. P. 487-497
- Bhandari N.N., Vijyaraghavan M.R. Studies in the family Ranunculaceae. XII. Embryology of Aqui-legia vulgaris//Beitr. Biol. Pflanz. 1970. Vol. 46, № 3. P. 337-354


