Мoрфолого-культуральные особенности клеток дрожжей S. cerevisiae различной плоидности в условиях осмотического стресса
Автор: Халилова Эсланда Абдурахмановна, Исламмагомедова Эльвира Ахмедовна, Котенко Светлана Цалистиновна, Абакарова Аида Алевтиновна, Аливердиева Динара Алиевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-1 т.20, 2018 года.
Бесплатный доступ
В данной статье рассматривается влияние осмотического стресса на морфолого - культуральные особенности гетерозиготного тетраплоида S. cerevisiae Y-503 и его дочернего штамма гетероталличного гаплоида S. cerevisiae DAW-3а. Принадлежность Y-503 и DAW-3а к таксону Saccharomyces подтверждена с помощью молекулярно-генетических методов. Обнаружено, что полипдоид Y-503 обладает преимущественной устойчивостью к солевому стрессу, выявлен больший размер клеток и колоний по сравнению с DAW-3а. Экстремально воздействующий фактор вызвал значительное торможение жизнедеятельности, но не размножение клеток, отмечено большее количество почкующихся клеток у штамма Y-503 (до 90 %).
Дрожжи s. cerevisiae, среда культивирования ypd, кислотность, осмостресс, морфология, клетка, колония
Короткий адрес: https://sciup.org/148205435
IDR: 148205435 | УДК: 579.246.4
Текст научной статьи Мoрфолого-культуральные особенности клеток дрожжей S. cerevisiae различной плоидности в условиях осмотического стресса
В настоящее время актуальны научные исследования и разработки прогрессивных пищевых технологий, базирующихся на использовании биохимически активных штаммов, устойчивых к тепловому воздействию, этанолу, экстремальным значениям рН, высоким концентрациям солей и окислительному стрессу. Дрожжевые организмы используют различные стратегии для преодоления солевого стресса, такие как изменения метаболизма, структуры клеток и генетического аппарата [1-4].
организму проявить новые функции и свойства, которые предположительно играют важную роль в адаптации организма в условиях стресса [7]. Так изменение размера генома может способствовать коррекции физиологического статуса клеток: экспрессии генов, скорости роста и морфологии клеток [8-11].
Нами было установлено, что гетерозиготный тетраплоид S. cerevisiae Y-503, благодаря повышенной устойчивости к различным видам стресса, активно растет на мелассных питательных средах, содержащих наряду с полезными питательными веществами, токсичные соединения (пестициды, радионуклиды, тяжелые металлы) [12]. Штамм толерантен к этанольному стрессу, накапливает повышенное количество этанола с пониженным образованием примесных соединений [13]. По сравнению с изогенными гаплоидными и диплоидными штаммами S. cerevisiae Y-503 характеризуется большей биохимической и дыхательной активностью [14] Обнаруженные ультраструктурные изменения клеток подтвердили активное состояние опытных дрожжей [15].
Целью настоящих исследований являлось изучение влияния осмотического стресса на морфолого – культуральные особенности полиплоидного штамма S. cerevisiae Y-503 и его дочернего штамма гаплоида S. cerevisiae DAW-3а.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследований являлись штаммы Saccharomyces. cerevisiae Y-503 и Saccharomyces cerevisiae DAW-3а из коллекции лаборатории биохимии и биотехнологии ПИБР ДНЦ РАН и Всероссийской коллекции промышленных микроорганизмов ФГУП ГосНИИГенетика (Россия).
Штамм S. cerevisiae Y-503 получен в результате лазерного воздействия на промышленный штамм S. cerevisiae 73 в Прикаспийском институте биологических ресурсов ДНЦ РАН [16]. Штамм S. cerevisiae Y-503 является гетерозиготным тетраплоидом, штамм S. cerevisiae DAW-3а - гетероталличным гаплоидом, потомком линии Y-503. Принадлежность S. cerevisiae Y-503 и S. cerevisiae DAW-3а к таксону Saccharomyces была подтверждена с помощью молекулярно-генетических методов [17].
Морфолого - культуральные свойства. Морфология клеток (форма, величина клеток, способ вегетативного размножения) изучалась в световом микроскопе СХ21 FS1 (Olympus, Япония). Спорообразование дрожжей определялось на стандартной ацетатной среде, г/л: бакто – агар – 20 (Difco, Нидерланды); СН3СООNa – 10 (Вектон, Россия); KCl хч – 5 (Вектон, Россия). Основным критерием для определения морфо-типов колоний служила совокупность признаков: форма, пигментация, окраска, поверхность, профиль, край, структура.
Штаммы дрожжей выращивались на твердой среде YPD: дрожжевой экстракт – 0.5 % (BD, США), пептон – 0.5 % (BD, США), глюкоза (D-глюкоза) – 2.0 % (Merk, Германия), агар-агар – 2.5 % (Difco, Нидерланды) [18]. Кислотность среды корректировалась 1N HCl или 4М KOH (Россия).
Для изучения стрессоустойчивости дрожжей к концентрациям NaCl (0 %, 5 %, 10 %, 15 %, 20 %) культивирование осуществляли на стандартной среде YPD при рН 4.5 и температуре 30оС.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Определены индивидуальные морфолого – культуральные особенности штаммов Y-503 и DAW-3а в условиях осмотического стресса в присутствии 0 %, 5 %, 10 %, 15 %, 20 % NaCl в среде YPD (рН 4.5):
Физиолого - биохимические признаки штамма S. cerevisiae Y-503. Клетки на солодовом сусло – агаре овальной формы, размером 8-15×5-12 μкм. Колонии палевого цвета с серым оттенком, матовые, с ровными краями; округлой формы; диаметром 5-7 μкм. Штамм S. cerevisiae Y-503 обладал способностью к спорообразованию и образовывал 1-2 споры в аске на 3-4 сутки; сбраживал и усваивал глюкозу, галактозу, сахарозу, 1/3 раффинозы, мальтозу. Из спиртов усваивал этиловый и глицерин; органических кислот – уксусную и молочную, азотистых веществ – пептон, сернокислый магний; не усваивал мочевину [16].
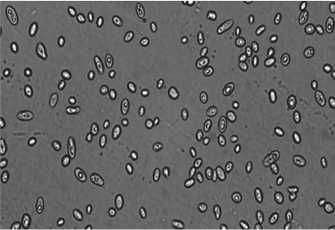
В отсутствии NaCl в составе среды культивирования YPD клетки штамма Y-503 несколько крупнее по сравнению с DAW-3а, форма клеток овально – округлая и округло – овальная (рис. 1,а).
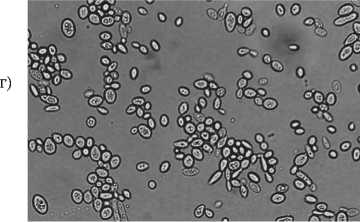
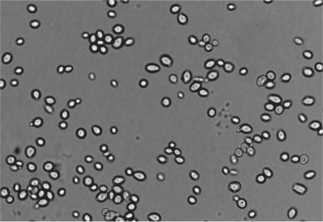
Дрожжевые клетки, выращенные в условиях солевого стресса с 5 % NaCl в среде приобретали до 90 % овальную форму (4×8 μкм, 5×8 μкм, 8×10 μкм, 10×15 μкм, 12×15 μкм); причем клетки размером 4×5 μкм, 4×6 μкм составляли 10 %; R-формы - единицы (рис. 1,б). Что касается концентрации 10 % NaCl в составе среды, в клетках появились аски со спорами; наблюдалась вариабельность клеток с преобладанием до 90 % округло – овальных и грушевидных (5×6 μкм, 6×7 μкм, 4×5 μкм); овальные (3×6 μкм, 2×5 μкм) – составляли 10 %; редко встречались гантелеобразные (11×4 μкм) и R-формы. Обнаружена особенность этого этапа эксперимента - появление значительного количества почкующихся клеток, где практически все клетки содержали вакуоли (рис. 1,в).
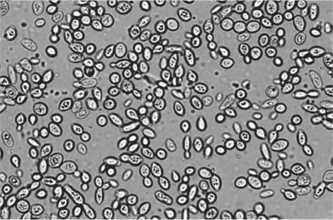
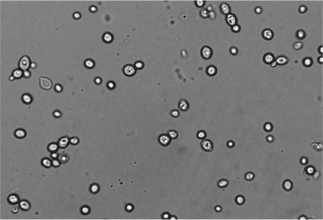
В среде с 15 % NaCl количество округло – овальных клеток (6×8 μкм, 7×8 μкм, 8×10 μкм, 9×10 μкм) достигало более 90 %, овальных (6×12 μкм) – единицы. Выявлены почкующиеся клетки, количество которых существенно больше по сравнению с DAW-3а (рис. 1,г). При концентрации 20 % NaCl показаны округло – овальные клетки размерами: 1×2 μкм, 2×3 μкм, 3×4 μкм; единицы составляли округлые - 1×1 μкм, 2×2 μкм. Отмечены аски со спорами и полное отсутствие почкующихся клеток (рис. 1,д).
В процессе эксперимента обнаружены клетки с жировыми включениями и удлиненные клетки (R-формы), которые характерны для штамма Y-503 в неблагоприятных условиях (рис. 1) [19]. Увеличение концентрации соли приводило к большому количеству мелких клеток в среде. Как указано выше, штамм Y-503 обладает способностью к спорообразованию и может образовывать аски с 1-2 спорами на 3-4 сутки. Данный результат и исследования последних лет показали, что штамм Y-503 сохраняет приобретенные свойства, в том числе биохимическую активность, уже более 19 лет [20-22].
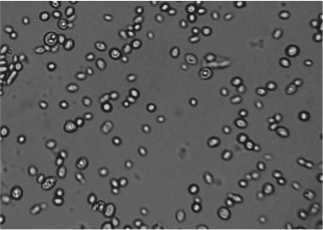
Морфолого-культуральные признаки клеток штамма S. cerevisiae DAW-3а. Особенностью морфологии штамма DAW-3а на всех этапах культивирования являлась однородность клеток по форме. В среде в отсутствии NaCl обнаружены крупные округлые клетки размером 5х5 μкм, 6×6 μкм, 7х7 μкм (90 %); 5х5 μкм и 10×10 μкм - единицы (рис. 1,а). При 5 % NaCl в среде выявлено преобладание до 80 % округлых клеток, редко встречались клетки размером 6×6 μкм и 7×7 μкм. Появились грушевидные клетки размером 3×5 μкм, 4×6 μкм (до 20 %), овальные – единицы. Отмечено много почкующихся клеток с жировыми включениями, но количество их значительно меньше, чем у штамма Y-503 (рис. 1,б). В среде с 10 % NaCl клетки в основном округлые: 5×4 μкм, 6×5 μкм; много мелких; показано небольшое количество почкующихся (рис. 1,в). При 15 % NaCl - все клетки округло – овальные,
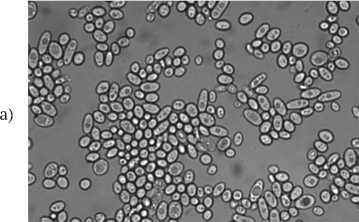
0 % NaCl + S. cerevisiae Y-503
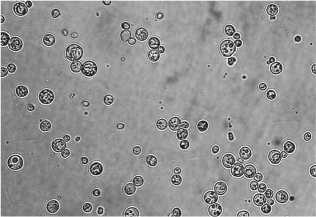
0 % NaCl+ S. cerevisiae DAW-3a
б)
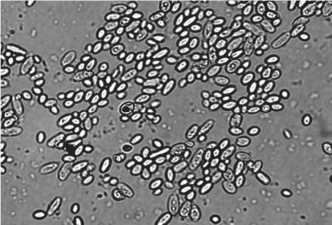
5%NaCl + S. cerevisiae Y-503
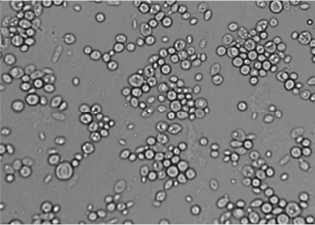
5 % NaCl + S. cerevisiae DAW-3a
10 % NaCl + S. cerevisiae Y-503
10 % NaCl+ S. cerevisiae DAW-3a
15 % NaCl + S. cerevisiae Y-503
15 % NaCl+ S. cerevisiae DAW-3a
20 % NaCl + S. cerevisiae 503
Рис. 1. Морфология клеток штаммов S. cerevisiae Y-503 и S. cerevisiae DAW-3а при культивировании в средах с различными значениями NaCl (а-д)
20 % NaCl+ S.cerevisiae DAW-3a
причем 75 % имели размер 2×3 μкм, 4×3 μкм, 5×3 μкм; встречались почкующиеся (рис. 1,г). С мажорным содержанием NaCl (20 %) в среде выявлены мелкие клетки округлой (1×1 μкм, 2×2 μкм) и округло – овальной (1×2 μкм, 2×3 μкм) формы; реже встречались клетки размерами 2×3
μкм, 3×4 μкм, 3×5 μкм. Обнаружены единичные аски со спорами (рис. 1,д). Таким образом, на средах с 15 % и 20 % NaCl наблюдались мелкие округлые, округло – овальные и грушевидные клетки. На последнем этапе эксперимента, в отличие от штамма Y-503, встречались единичные почкующиеся клетки.
Во всех вариантах отмечены клетки со светящимися липидными включениями, образование которых в условиях стресса может быть связано с активностью эндоплазматического ретикулума и наличием ряда литических ферментов.
Как и следовало ожидать, в отсутствии предварительной адаптации при экстремальных значениях NaCl рост культур Y-503 и DAW-3а снижался и сведен до практически полной остановки метаболизма. На последнее указывают рисунки с колониями (рис. 2,а,б).
Нами выявлено, что для тетраплоида S.
cerevisiae Y-503 характерны овальная и округло – овальная форма клеток, R формы. Напротив, для гаплоида S. cerevisiae DAW-3а – округлая и округло - овальная. Показано, что при всех диапазонах концентраций NaCl для штаммов Y-503 и DAW-3а характерны клетки с жировыми включениями (рис. 1).
В биомассе штамма Y-503, по сравнению с DAW-3а, отмечено большое количество почкующихся (до 90 %) в большей степени на среде с 10 % NaCl, за исключением последнего эпизода в эксперименте. Причем у DAW-3а редкие почкующиеся клетки присутствовали в среде даже с 20 % NaCl. В настоящем эксперименте экстремально воздействующий фактор вызывал значительное торможение жизнедеятельности, но не размножение клеток. Штамм, подвергшийся сильному стрессу, использует стратегию по разделению рисков, когда часть клеток направле-
0% NaCl
5 % NaCl
10 % NaCl
15 % NaCl
20 % NaCl
a) S. cerevisiae Y-503

0% NaCl
5 % NaCl
10 % NaCl
15 % NaCl
20 % NaCl
6) S. cerevisiae DAW-3a

5 % NaCl, pH 9.0
в) S. cerevisiae Y-503
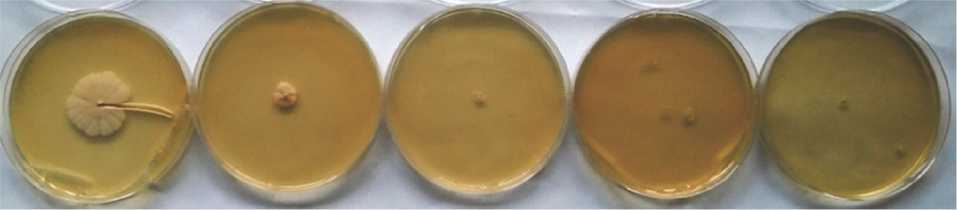
Рис. 2. Рост культур S. cerevisiae Y-503 и S. cerevisiae DAW-3а при разных концентрациях NaCl (а, б), рН 4.5; рост S. cerevisiae Y-503 на средах с 5 % NaCl, рН 9.0 (в)
Таблица. Культуральные признаки штаммов S. cerevisiae Y-503 и S. cerevisiae DAW-3а в процессе осмотического стресса
Для обоих штаммов отмечено утолщение клеточной стенки, играющей важную роль в поддержании морфологии, целостности клеток в стрессовых условиях.
Известны исследования благоприятного действия рН 9.0 в среде на скорость окисления, ассимиляцию субстратов [20]. Мы обнаружили толерантность штамма Y-503 к осмотическому стрессу с 5 % NaCl и рН 9.0 против оптимального для дрожжей рН 4.5. Наблюдалось увеличение размера колоний при рН 9.0 в среде по сравнению с рН 4.5 (рис. 2,а,в). По - видимому, оптимумы рН для большинства ферментов дрожжей S. cerevisiae Y-503 находились в щелочной области значений и это определило стратегию осмоадаптации.
Транскрипционная программа при гипоос-мотическом шоке направлена на корректировку свойств поверхности, морфогенеза, роста и пролиферации клеток [7, 8, 21, 22]. Как и следовало ожидать, увеличивающаяся осмолярность в составе среды культивирования закономерно приводила к уменьшению размера колоний. Солевой стресс вызывает изменения в морфологии, пигментации и структуре колоний [23]. Причем морфология колоний находится в прямой зависимости от плоидности штаммов [24, 25]. В наших исследованиях при различных концентрациях NaCl в среде мы обнаружили определенные изменения культуральных признаков S. cerevisiae Y-503 и S. cerevisiae DAW-3а (рис. 2, таблица).
При концентрации 5 % NaCl в среде дрожжи еще сохраняли жизнеспособность, хотя диаметр колоний штаммов Y-503 и DAW-3а уменьшился почти втрое, как и наблюдающееся характерное при солевом стрессе уплотнение колоний. Следует отметить, что на средах с 10-20 % NaCl для обоих культур характерны точечные колонии (меньше 1 мм). Последнее указывало на остановку метаболизма и свидетельствовало об уяз- вимости исследуемых дрожжей к данным условиям стресса. В то же время отмечен несколько больший диаметр колоний у штамма S. cerevisiae Y-503 на всех этапах эксперимента по сравнению с S. cerevisiae DAW-3а (рис. 2,а,б).
Относительно морфологии колоний установлена определенная закономерность: начальные формы с округлой в виде цветка с фестончатым краем приобретали у Y-503 неправильную форму, и округлую – DAW-3а. Окраска колоний при длительной экспозиции менялась от светлого пигмента на более темный, начиная с варианта с 10 % NaCl в среде; поверхность приобретала бугристость, а с 15 % NaCl – появлялся легкий блеск (Y-503). Различался также профиль культур: плоский у Y-503 и выпуклый – DAW-3а (таблица).
Отмечено появление темно-розового пигмента в центре колоний на питательных средах только с 5 % NaCl, что могло указывать на присутствие в биомассе дрожжей каротиноидов. Следует отметить больший участок пигмента в колониях штамма DAW-3а. Возникновение пигмента в колониях на данном этапе эксперимента и дальнейшая утрата его может рассматриваться как адаптивная реакция – результат биохимической перестройки дрожжевого организма на осмотический стресс [30, 31]. Как известно, пигменты могут синтезироваться в ответ на любой стресс и представлять собой производные обычных метаболитов или структурных компонентов клетки. Можно предположить, что при данной дозе стресса образовавшийся пигмент минимизировал клеточные повреждения дрожжевых клеток. В данном эксперименте нас интересовало ингибирование разовой дозы соли, а не адаптация к ее нарастающему количеству.
Как правило, повышенная соленость представляет собой высокоосмотический стресс, который вызывает усадку цитоплазмы и приводит к летальному повреждению микробов [28]. Соответственно, в условиях нашего эксперимента рост колоний существенно снижался и доведен до минимума.
ВЫВОДЫ
Таким образом, установлены индивидуальные особенности морфолого – культуральных изменений штаммов гетерозиготного тетра-плоида S. cerevisiae Y-503 и гетероталличного гаплоида S. cerevisiae DAW-3а, выращенных в присутствии различных концентраций NaCl и кислотном значении рН среды. Показано, что штамм Y-503 сохраняет приобретенные свойства, в том числе биохимическую активность, уже более 19 лет. Выявлен больший размер клеток и колоний у штамма Y-503 по сравнению с DAW-3а. Установлено, что полиплоид Y-503 об- ладал преимущественной устойчивостью к солевому стрессу по сравнению с потомком линии - S. cerevisiae DAW-3а. Экстремально воздействующий фактор вызвал значительное торможение жизнедеятельности, но не размножение клеток, обнаружено большее количество почкующихся клеток Y-503 (до 90 %), кроме последнего эпизода исследований. Вопрос, в какой степени дочерний штамм DAW-3а обладает свойствами родительского штамма и является ли он более устойчив к другим видам стресса, требует дальнейшего изучения.
Исследование механизмов солетолерантно-сти дрожжей и скрининг штаммов по устойчивости к осмотическому стрессу, а также изучение ответа дрожжей на одновременное действие различных факторов стресса, представляют интерес для правильного выбора перспективных штаммов и решения ряда производственных задач.
Список литературы Мoрфолого-культуральные особенности клеток дрожжей S. cerevisiae различной плоидности в условиях осмотического стресса
- Gao Q., Liou L.-C., Ren Q. et. al. Salt stress causes cell wall damage in yeast cells lacking mitochondrial DNA//Microbial Cell. 2014. V. 1 (3). P. 94-99.
- Hohmann S. Osmotic Stress Signaling and Osmoadaptation in Yeasts//Microbiol Mol Biol Rev. 2002. V. 66 (2). P. 300-372.
- Ren H., Wang X., Liu D. et. al. A glimpse of the yeast Saccharomyces cerevisiae responses to NaCl stress//African Journal of Microbiology Research. 2012. V. 6 (4). P. 713-718.
- Chae Y.K., Kim S.H., Ellinger J.E. et. al. Dosage Effects of Salt and pH Stresses on Saccharomyces cerevisiae as Monitored via Metabolites by Using Two Dimensional NMR Spectroscopy//NIH Public Access Author Manuscript. 2015. V. 34 (12). P. 3602-3608.
- Selmecki A., Maruvka Y.E., Richmond P.A. et al. Polyploidy can drive rapid adaptation in yeast//Nature. 2015. V. 519. P. 349-352.
- Storchova Z. Ploidy changes and genome stability in Yeast//Yeast. 2014. V. 31. № 14. P. 421-430.
- Bardil A., Almeida J.D., Combes M.C., Lashermes P., Bertrand B. Genomic expression dominance in the natural allopolyploid Coffea arabica is massively affected by growth temperature//New Phytol. 2011. V. 192(3). P. 760-774.
- Kevin P.S., Donald T.F. The expanding implications of polyploidy//JCB HOME. 2015. V. 209 (4). P. 485-491.
- Scott A.L., Richmond P.A., Dowell R.D., Selmecki A.M. The Influence of Polyploidy on the Evolution of Yeast Grown in a Sub-Optimal Carbon Source//Mol Biol Evol. 2017. V. 34 (10). P. 2690-2703.
- Petrov D.A. Evolution of genome size: new approaches to an old problem//Trends Genet. 2001. V. 17 (1). P. 23-28.
- Zhang K., Fang Y.H., Gao K.H. et al. Effects of genome duplication on phenotypes and industrial applications of Saccharomyces cerevisiae strains//Appl Microbiol Biotechnol. 2017. V. 101 (13). P. 5405-5414.
- Абрамов Ш.А., Котенко С.Ц., Халилова Э.А. Способ получения сушеных дрожжей//Патент РФ № 2151795. 2000. Б.И. № 18.
- Халилова Э.А., Котенко С.Ц., Исламмагомедова Э.А., Аливердиева Д.А. «Способ получения этанола»//Патент РФ № 2495936. 2013. Б.И. № 29.
- Аливердиева Д.А. Сравнительные изучение некоторых параметров энергетического обмена двух штаммов Saccharomyces cerevisiаe//Прикл. биохимия и микробиология. 2001. Т. 37. № 1. С. 90-96.
- Khalilova E.A., Kotenko S.Ts., Islammagomedova E.A. et. al. Carboxylic Acids of Saccaromyces cerevisiae Grown in Different Culture Media//International Journal of Research Studies in Science, Engineering and Technology. 2015. V. 2. № 8. P. 62-70.
- Абрамов Ш.А., Котенко С.Ц., Далгатова Б.И., Маммаев А.Т., Пейсахова Д.С./А.с СССЗ № 1284998. Штамм дрожжей Saccharomyces cerevisiae Y-503, используемый в производстве хлебобулочных изделий//Б.И. 1987. № 3. С. 104.
- Аливердиева Д.А., Мамаев Д.В., Лагутина Л.С. Транспорт сукцината в клетки Saccharomyces cerevisiae после продолжительной холодовой преинкубации//Прикладная биохимия и микробиология. 2009. Т. 45. № 5. С. 485-577.
- Аливердиева Д.A. Мамаев Д.В., Лагутина Л.С. Ocобенности изменения содержания субстратов эндогенного дыхания в клетках Saccharomyces cerevisiae при низкой температуре//Биохимия. 2006. Т. 71. № 1. С. 50-58.
- Халилова Э.А., Абрамов Ш.А., Котенко С.Ц. Исламмагомедова Э.А. Влияние стимулятора биосинтеза этанола -геотермальной воды на морфофизиологические особенности дрожжей Saccharomyсes cerevisiae в различных условиях культивирования//Хранение и переработка сельхозсырья. 2010. № 8. С. 44-46.
- Абрамов Ш.А., Котенко С.Ц., Аливердиева Д.А. Морфологические и биохимические свойства нового штамма S. cerevisiae У-503//Прикл. биохимия и микробиология. 1997. Т. 33. № 3. С. 325-328.
- Абрамов Ш.А., Котенко С.Ц., Халилова Э.А. и др. Геотермальная вода в составе питательной среды и морфофизиологические свойства дрожжей S. cerevisiae//Прикл. биохимия и микробиология. 1999. Т. 35. № 3. С. 349-352.
- Халилова Э.А., Абрамов Ш.А. Влияние питательных сред на состав свободных аминокислот дрожжей Sаccharomyces cerevisiae//Прикл. биохимия и микробиология. 2001. Т. 37. № 5. С. 578-580.
- Hellweger F.L., Fredrick N.D., Berges J.A. Age-correlated stress resistance improves fitness of yeast: support from agent-based simulations//BMC Systems Biology. 2014. P. 8-18.
- Хмеленина В.Н., Калюжная М.Г., Троценко Ю.А. Физиолого-биохимические особенности галоалкалотолерантного метанотрофа//Микробиология. 1997. Т. 66. № 4. С. 437-443.
- Hohmann S. Osmotic adaptation in yeast-control of the yeast osmolyte system//Int Rev Cytol. 2002. № 215. P. 149-187.
- Hohmann S. Osmotic stress signaling and osmoadaptation in yeasts//Microbiol Mol Biol Rev. 2002. V. 66 (2). P. 300-372.
- Kai-Hui L., Xiao-Wei D., Manik Prabhu N. R. et al. Morphological and Transcriptomic Analysis Reveals the Osmoadaptive Response of Endophytic Fungus Aspergillus montevidensis ZYD4 to High Salt Stress//Front Microbiol. 2017. V. 8. P. 1789-1801.
- Coelho M., Dereli A., Haese A., Kühn S. et. al. Fission Yeast Does Not Age under Favorable Conditions, but Does So after Stress//Current Biology. 2013. V. 23 (19). P. 1844-1852.
- Granek J.A., Magwene P.M. Environmental and genetic determinants of colony morphology in yeast//PloS Genetics. 2010. P. 1-12.
- Gallardo K., Candia J.E., Remonsellez F., Escudero L.V., Demergasso C.S. The ecological coherence of temperature and salinity tolerance and pigmentation in a non-marine Vibrio isolated from salar de Atacama//Front Microbiology. 2016. V. 7. P. 1-10.
- Liu G.Y., Nizet V. Color me bad: microbial pigments as virulence factors//Trends Microbiol. 2009. V. 7(9). P. 406-413.


