Морфометрическая характеристика изменений в ретроспленальной коре мышей при моделировании социального стресса
Автор: Дорофеев Н.А., Смирнов А.В., Самаркин Д.Д., Тюренков И.Н., Быхалов Л.С.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Статьи
Статья в выпуске: 1 т.22, 2025 года.
Бесплатный доступ
Исследования морфологического субстрата воздействия стресса на организм помогают понять роль различных структур головного мозга в реакциях на стрессоры, однако детальные механизмы этих реакций остаются недостаточно изученными.
Социальное поражение, хронический стресс, мыши, ретроспленальная кора, морфометрия
Короткий адрес: https://sciup.org/142245448
IDR: 142245448 | УДК: 616.8-091 | DOI: 10.19163/2658-4514-2025-22-1-57-65
Текст научной статьи Морфометрическая характеристика изменений в ретроспленальной коре мышей при моделировании социального стресса
doi:
Согласно современным представлениям хронический умеренный стресс могут вызывать различные причины. У человека особое значение имеют социальные факторы, связанные как с конфликтами в повседневной жизни, так и с глобальными событиями. Эти негативные воздействия, затрагивающие широкие слои населения, могут привести к дезадаптации и развитию заболеваний психической сферы с развернутой симптоматикой, в том числе депрессии и посттравматического стрессового расстройства [1–4].
На текущий момент существует много методов лекарственной терапии как указанных заболеваний, так и более мягких психических расстройств и тревожных состояний. Однако детальные механизмы их действия во многом остаются недостаточно изученными [4]. Особенно данный факт относится к исследованиям морфологического субстрата воздействия хронического стресса на организм, что возможно только в рамках эксперимента с участием животных, преимущественно крыс и мышей. С помощью различных экспериментальных моделей депрессии изучается роль отдельных структур головного мозга в реакции организма на патологические воздействия различной природы, в том числе физической, химической, социальной. Среди наиболее значимых и изученных в контексте развития депрессивно- / тревожно-подобных состояний выделяют гиппокамп и медиальную префронтальную кору, в меньшей степени – ядра миндалевидного тела и иные структуры конечного мозга, например, переднюю поясную кору, зрительную кору, таламус, скорлупу, латеральную перегородку [1–11]. В последнее время накапливаются данные относительно участия в реакциях на подобные стрессоры ретроспленальной коры (РСК), описанную как у грызунов, так и у приматов, в том числе у человека [3, 9, 10, 12].
Структурно в РСК выделяют гранулярную и агранулярную (дисгранулярную) части, в которых выражены или, наоборот, не выражены II и IV зернистые (гранулярные) слои [9]. В головном мозге мыши гранулярная часть располагается на медиальной поверхности в межполушарной борозде, начинаясь вентрально от мозолистого тела и переходя дорсально в агранулярную часть. Последняя располагается на границе медиальной и верхнелатеральной поверхностей с продолжением латерально во вторичную моторную кору.
Топографическая близость к зрительным областям и структурам лимбической системы, в частности к гиппокампу, обеспечивают значимую роль РСК в пространственной ориентации, процессах запоминания, воображении и связанных когнитивных функциях [3, 8–10, 12]. В контексте реакций на стресс и развития депрессивно- / тревожно-подобных состояний РСК отводится роль в запоминании условий, в которых происходило патологическое воздействие, и информации о предшествовавших ему стимулах при моделировании контекстно-обусловленного страха [9, 10, 12]. При этом накапливаются данные, что разные ее области могут иметь различные и даже противоположные функции при моделировании указанных процессов [9, 12].
ЦЕЛЬ РАБОТЫ
Изучить качественные и количественные морфофункциональные изменения в РСК головного мозга мышей при моделировании хронического социального стресса поражения в сравнении с интактными животными.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследование выполнено на мышах ( n = 13) линии CBA (lac) возрастом 4 месяца массой 20– 25 граммов, а также животных линии C57BL/6 и нелинейных мышах. Работу с животными проводили в соответствии с Европейской конвенцией о защите позвоночных животных, используемых в экспериментальных и других научных целях (Страсбург, 1986). На проведение исследования получено разрешение локального этического комитета ФГБОУ ВО ВолгГМУ Минздрава России (№ 2022/160 от 3.11.2022).
Эксперимент производился в парадигме хронического социального стресса поражения [2, 6, 7, 13, 14]. Для этого использовались специальные клетки, разделенные пополам прозрачным барьером со сквозными отверстиями, которые позволяли мышам видеть, слышать и чувствовать запахи друг друга, но предотвращали физический контакт между ними.
Предварительно, перед началом моделирования депрессивного состояния, осуществлялся отбор животных «агрессоров» – победителей. Для этого в домашнюю клетку с животными (линии C57BL/6 и нелинейными) помещалось одно незнакомое животное из другой клетки и оценивался характер их взаимодействия. В группу «агрессоры» выбирались те мыши, которые активно защищали свою территорию, проявляли агрессивные действия в отношении «чужака». После выявления с целью обосноваться в новой среде животное «агрессор» на 3 суток перемещалось в свою часть клетки, разделенной барьером, где заранее были подготовлены опилки и материалы, необходимые для строительства домика и обогащения среды.
В группу «жертв» выбирались самцы линии CBA (lac) возрастом 4 месяца, каждый из которых спустя 3 суток перемещался в свою часть клетки, разделенной перегородкой. В последующем ежедневно, на протяжении 10 суток, побежденное животное перемещали в новую клетку к неизвестному ему ранее агрессору и убирали барьер, отделяющий их друг от друга, провоцируя, таким образом, агрессора защищать собственную территорию от новичка и вступать в физические конфронтации с ним. Если физический контакт (драка) между агрессором и жертвой продолжались непрерывно 3 минуты, то между ними обратно устанавливали преграду, в противном случае продолжительность столкновений длилась 10 минут. На 4–5-е сутки ежедневных столкнове- ний животные со статусом «жертвы» в большей части прекращали оказывать должное сопротивление на акты агрессии со стороны победителя, в результате чего продолжительность конфронтаций между мышами сокращали до 30 секунд, с целью предотвращения травмирования животных.
Далее начинался этап 10-дневного лечения, которое проводилось на фоне продолжения ежедневных социальных конфронтаций. В данной статье рассматриваются группы интактных животных (не подвергающихся воздействую стрессовых факторов) и стрессированные животные, которым во втором периоде вводился 0,9%-й раствор NaCl. Спустя 10 дней терапии стрессиро-вание прекращалось, животных выводили из эксперимента методом цервикальной дислокации с последующей декапитацией.
Для дальнейшего анализа использовались образцы головного мозга 6 мышей интактной группы и 7 – группы стресса. Морфологическое исследование проводилось на фронтальных срезах на уровне -1,255 : -2,555 мм от Брегмы, из которых изготавливались микропрепараты, окрашенные тионином по методу Ниссля по стандартной процедуре. Далее проводилась фотофиксация с использованием микроскопа «Axio Lab. A1» (Carl Zeiss Microscopy GmbH, Germany), фото- / видеокамеры «AxioCam 105 color» (Carl Zeiss Microscopy GmbH, Germany). На полученных микрофотографиях выполнена морфометрия с подсчетом площади (мкм2) и периметра (мкм) ядер и перикарионов нейронов, площади (мкм2) цитоплазмы перикарионов на 30 клетках. Также были рассчитаны относительные площади ядер, перикарионов нейронов и цитоплазмы перикарионов по формуле « Относительный показатель = Площадь структуры / Площадь тест системы », где под тест-системой подразумевается анализируемая область интереса. Кроме того, представлен показатель ядерно-цитоплаз-матического отношения (ЯЦО), рассчитанный по формуле « ЯЦО = площадь ядра / площадь цитоплазмы перикариона ». Измерения выполнялись в программе Image-Pro Plus (Media Cybernetics, USA) каждой из следующих структур: II/III, V слоях гранулярной (РСГК) и агранулярной / дисграну-лярной (РСАК) частей РСК.
Статистическая обработка осуществлялась с использованием языка программирования R (версия 4.3.1) и среды разработки RStudio. Производился расчет параметров описательной статистики, включая среднее (M, Mean), стандартное отклонение (SD, Standard Deviation), медиану (Me, Median), 1-й и 3-й квартили (Q1, Q3).
Характер распределения указанных количественных непрерывных переменных оценивался с помощью приведенных показателей описательной статистики, теста Shapiro-Wilk (SW-test, тест на нормальность распределения), а также графической визуализации с построением «box-plot» («ящик с усами»).
На следующем этапе, в зависимости от характера распределения, проводился либо Welch Two Sample t-test (t-критерий Уэлча, модификация t-критерия Стьюдента, не предполагающий равенства дисперсий в сравниваемых выборках), либо его непараметрический аналог – Wilcoxon rank sum test (критерий суммы рангов Уилкоксона, син. тест Манна – Уитни) – с расчетом уровня значимости «p-value».
Для показателей и локализаций, в которых установлены статистически значимые различия, рассчитана разность средних между группой стресса и группой интакта с построением 95 % доверительного интервала (ДИ) методом классического бутсрэпа (bootstrap) с представлением в виде «Средняя разность (Нижняя граница 95 % ДИ – Верхняя граница 95 % ДИ)». Также указанные показатели разности представлены в формате процентного изменения относительно значений в интактной группе в виде «Средний % изменений [Нижняя граница 95 % ДИ (%) – Верхняя граница 95 % ДИ (%)]».
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В работах, посвященных исследованию участия РСК в реакции организма на стрессовые воздействия, наиболее часто исследовались II и V слои гранулярной части, а также II/III и V слои агранулярной части, так как в данной области отсутствует оформленный II слой.
При гистологическом исследовании препаратов головного мозга, окрашенных по Нисслю, в гранулярной части ретроспленальной коры не отмечено значительной вариабельности формы и расположения нейронов II/III и V слоев между животными разных групп (см. рис.). В группе стрессированных мышей нейроны данной зоны имели тенденцию к более компактному и упорядоченному расположению. В то же время заметные различия в морфологии слоев агранулярной части ретроспленальной коры не были обнаружены при визуальной качественной оценке микропрепаратов.
По данным морфометрии в каждой из описанных 4 зон (по 2 слоя нейронов в двух частях) ретроспленальной коры головного мозга получены результаты, представленные в табл. 1–4.
Согласно анализу характера распределений полученных данных в качестве метода сравнения t-критерий Уэлча был выбран для показателей «Периметр перикариона нейрона» в зонах РСГК V, РСАК II/III, РСАК V; «Площадь ядра нейрона» в зонах РСГК V, РСАК V; «ЯЦО нейрона» в зонах РСГК II/III, РСАК V. Для остальных комбинаций «Показатель-Зона ретроспленальной коры» сравнение производилось с помощью теста Манна – Уитни.
По результатам попарных сравнений и расчетов p-value по описанной выше методике достоверные различия между интактной и стрессированной группами установлены для следующих показателей:
-
- «Периметр перикариона нейрона» – зоны РСГК V [увеличение на 3,31 (1,76–4,85) мкм либо 9,5 % (5,1–14,0 %) в группе стресса], РСАК II/III [уменьшение на 2,4 (1,27–3,53) мкм либо 7,1 % (3,7–10,4 %) в группе стресса];
-
- «Периметр ядра нейрона» – зоны РСГК V [увеличение на 1,56 (0,65–2,46) мкм либо 7,3 % (3,0–11,5 %) в группе стресса], РСАК II/III [уменьшение на 1,66 (0,96–2,36) мкм, 7,8 % (4,5–11,1 %) в группе стресса];
-
- «Относительная площадь перикариона нейрона» – зона РСГК V [уменьшение на 0,17 (0,09– 0,25) либо 16,5 % (8,7–24,3 %) в группе стресса];
-
- «Площадь ядра нейрона» – зона РСАК II/III [уменьшение на 3,87 (2,31–5,43) мкм2 либо 15,9 % (9,5–22,3 %) в группе стресса];
-
- «Относительная площадь ядра нейрона» – зона РСГК V [уменьшение на 0,07 (0,04–0,11) либо 16,3 % (9,3–25,6 %) в группе стресса], РСАК II/III [уменьшение 0,07 (0,04–0,1) либо на 13,2 % (7,5–18,9 %) в группе стресса].
Для показателей «Площадь перикариона нейрона», «Площадь цитоплазмы перикариона нейрона», «Относительная площадь цитоплазмы перикариона нейрона», «ЯЦО нейрона» не обнаружено достоверных различий в исследуемых зонах ретроспленальной коры.
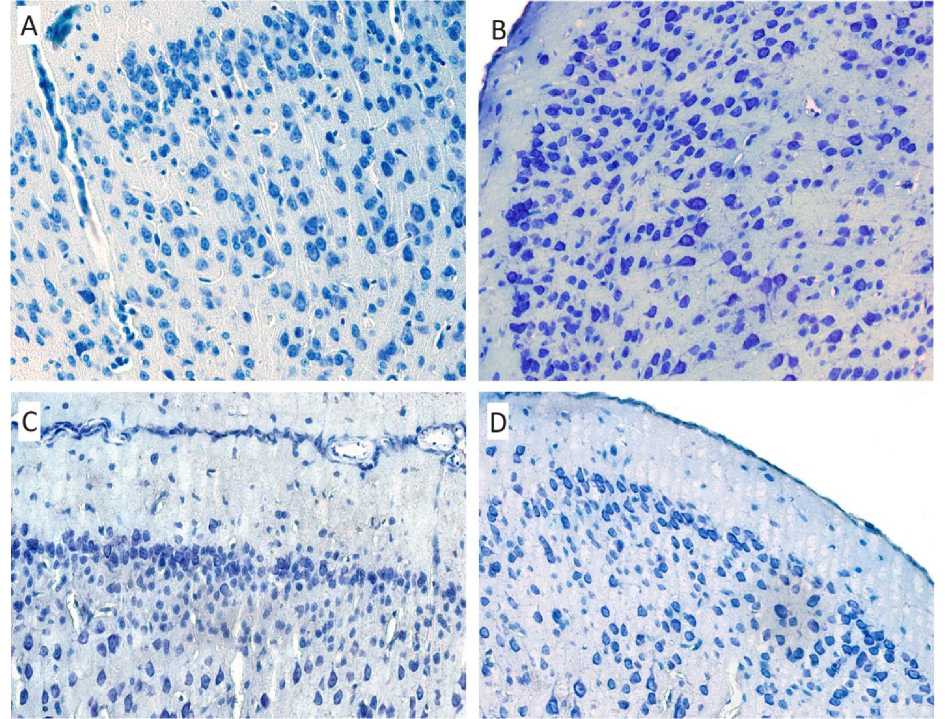
Рис. Гистологическое строение ретроспленальной коры головного мозга мыши, окраска тионином по методу Ниссля, ×400:
A, C – гранулярная ретроспленальная кора головного мозга; B, D – агранулярная ретроспленальная кора головного мозга; A, B – группа интактных мышей; C, D – группа стрессированных мышей
Таблица 1
Морфометрические показатели нейронов гранулярной ретроспленальной коры головного мозга II–III слоев
|
Показатель |
Интакт |
Стресс |
|
Периметр перикариона нейрона, мкм |
28,84 ± 7,43, 25,89 (23,36; 33,31) |
28,22 ± 5,56, 27,1 (24,69; 30,25) |
|
Периметр ядра нейрона, мкм |
18,32 ± 4,86, 16,5 (14,79; 21,64) |
17,80 ± 3,68, 17,04 (15,63; 19,18) |
|
Площадь перикариона нейрона, мкм2 |
42,10 ± 21,45, 32,93 (27,47; 52,08) |
38,89 ± 15,49, 35,14 (29,8; 42,34) |
|
Относительная площадь перикариона нейрона |
1,16 ± 0,46, 1,08 (0,86; 1,36) |
1,08 ± 0,37, 1,02 (0,78; 1,33) |
|
Площадь цито плазмы перикариона нейрона, мкм2 |
23,21 ± 12,00, 19,27 (14,61; 28,44) |
21,78 ± 8,80, 19,94 (16,09; 24,82) |
|
Относительная площадь цитоплазмы перикариона нейрона |
0,64 ± 0,27, 0,58 (0,45; 0,75) |
0,61 ± 0,23, 0,54 (0,43; 0,77) |
|
Площадь ядра нейрона, мкм2 |
18,88 ± 10,07, 14,68 (12,06, 23,98) |
17,11 ± 7,53, 15,53 (12,88; 18,61) |
|
Относительная площадь ядра нейрона |
0,52 ± 0,21, 0,48 (0,38; 0,61) |
0,47 ± 0,17, 0,46 (0,34;0,57) |
|
ЯЦО нейрона |
0,83 ± 0,19, 0,81 (0,69; 0,96) |
0,80 ± 0,19, 0,78 (0,67; 0,92) |
Примечание: данные в ячейках представлены в формате M ± SD, Me (Q1; Q3).
Таблица 2
|
Показатель |
Интакт |
Стресс |
|
Периметр перикариона нейрона, мкм |
34,75 ± 7,88, 34,39 (28,16; 40,75) |
38,06 ± 7,56, 37,36 (33,83; 42,37) |
|
Периметр ядра нейрона, мкм |
21,33 ± 4,86, 21,11 (17,68; 25,11) |
22,89 ± 4,10, 22,93 (20,4; 25,68) |
|
Площадь перикариона нейрона, мкм2 |
59,05 ± 25,39, 55,90 (38,94; 75,93) |
65,44 ± 23,23, 63,67 (50,52; 76,99) |
|
Относительная площадь перикариона нейрона |
1,03 ± 0,46, 0,99 (0,67; 1,29) |
0,86 ± 0,33, 0,8 (0,63; 1,03) |
|
Площадь цитоплазмы перикариона нейрона, мкм2 |
34,58 ± 16,43, 32,25 (21,79; 44,58) |
38,65 ± 15,86, 36,94 (27,94; 46,24) |
|
Относительная площадь цитоплазмы перикариона нейрона |
0,60 ± 0,29, 0,56 (0,39; 0,75) |
0,51 ± 0,21, 0,47 (0,36; 0,60) |
|
Площадь ядра нейрона, мкм2 |
24,47 ± 10,65, 22,56 (16,03; 32,04) |
26,79 ± 9,25, 25,97 (21,23; 31,22) |
|
Относительная площадь ядра нейрона |
0,43 ± 0,20, 0,40 (0,27; 0,56) |
0,36 ± 0,14, 0,33 (0,26; 0,42) |
|
ЯЦО нейрона |
0,75 ± 0,21, 0,73 (0,60; 0,87) |
0,74 ± 0,21, 0,72 (0,59; 0,88) |
Примечание: данные в ячейках представлены в формате M ± SD, Me (Q1, Q3).
Таблица 3
|
Показатель |
Интакт |
Стресс |
|
Периметр перикариона нейрона, мкм |
33,96 ± 6,41, 32,87 (29,19; 38,03) |
31,56 ± 4,60, 31,36 (28,13; 34,65) |
|
Периметр ядра нейрона, мкм |
21,21 ± 3,79, 20,83 (18,4; 23,65) |
19,54 ± 3,13, 19,27 (17,56; 21,46) |
|
Площадь перикариона нейрона, мкм2 |
55,49 ± 19,73, 49,45 (41,48; 65,45) |
48,44 ± 14,05, 47 (38,9; 56,21) |
|
Относительная площадь перикариона нейрона |
1,21 ± 0,41, 1,14 (0,92; 1,48) |
1,08 ± 0,31, 1,06 (0,88;1,27) |
|
Площадь цитоплазмы перикариона нейрона, мкм2 |
31,11 ± 12,39, 28,73 (22,65; 37,7) |
27,92 ± 9,02, 27,14 (21,39; 33,88) |
|
Относительная площадь цитоплазмы перикариона нейрона |
0,68 ± 0,26, 0,65 (0,50; 0,82) |
0,62 ± 0,19, 0,61 (0,49; 0,72) |
|
Площадь ядра нейрона, мкм2 |
24,38 ± 8,9, 22,10 (18,50; 28,40) |
20,51 ± 6,29, 19,59 (16,41; 23,39) |
|
Относительная площадь ядра нейрона |
0,53 ± 0,18, 0,50 (0,41; 0,66) |
0,46 ± 0,15, 0,45 (0,35; 0,53) |
|
ЯЦО нейрона |
0,82 ± 0,23, 0,81 (0,67; 0,94) |
0,76 ± 0,21, 0,72 (0,62; 0,89) |
Примечание: данные в ячейках представлены в формате M ± SD, Me (Q1, Q3).
Таблица 4
|
Показатель |
Интакт |
Стресс |
|
Периметр перикариона нейрона, мкм |
35,00 ± 8,46, 35,01 (28,81; 40,75) |
36,90 ± 9,70, 35,51 (30,54; 43,21) |
|
Периметр ядра нейрона, мкм |
20,87 ± 4,47, 21,10 (17,79; 23,82) |
21,37 ± 4,50, 21,85 (18,05; 24,56) |
|
Площадь перикариона нейрона, мкм2 |
60,87 ± 26,29, 57,92 (40,40; 78,65) |
65,07 ± 31,19, 57,10 (42,18; 85,92) |
|
Относительная площадь перикариона нейрона |
1,00 ± 0,44, 0,96 (0,65; 1,29) |
0,96 ± 0,45, 0,86 (0,61; 1,19) |
|
Площадь цитоплазмы перикариона нейрона, мкм |
37,14 ± 18,62, 32,94 (22,32; 50,28) |
40,61 ± 23,32, 33,73 (23,59; 54,47) |
|
Относительная площадь цитоплазмы перикариона нейрона |
0,61 ± 0,30, 0,55 (0,36; 0,82) |
0,59 ± 0,31, 0,51 (0,36; 0,74) |
|
Площадь ядра нейрона, мкм2 |
23,73 ± 9,39, 23,53 (16,42; 29,92) |
24,46 ± 9,56, 23,95 (17; 30,77) |
|
Относительная площадь ядра нейрона |
0,39 ± 0,16, 0,38 (0,27; 0,48) |
0,37 ± 0,16, 0,33 (0,25; 0,47) |
|
ЯЦО нейрона |
0,69 ± 0,19, 0,69 (0,56; 0,82) |
0,68 ± 0,23, 0,64 (0,51; 0,85) |
Примечание: данные в ячейках представлены в формате M ± SD, Me (Q1, Q3).
При этом имелись противоположные изменения во II/III слое агранулярной РСК в виде процессов атрофии нейронов, подтверждающихся достоверным уменьшением размеров нейронов – площади ядер на 15,9 % (9,5–22,3 %), периметра ядер на 7,8 % (4,5–11,1 %) и периметра перикарионов на 7,1 % (3,7–10,4 %), которым также сопутствовало снижение плотности нейронов в ви-
де снижения относительной площади их ядер на 13,2 % (7,5–18,9 %).
Таким образом, получены дополнительные морфологические доказательства участия ретро-спленальной коры головного мозга в ответе организма на хронический социальный стресс поражения в виде реципрокных изменений в ее субструктурах.


