Морфометрическая характеристика сосудов микроциркуляторного русла бронхиального дерева у курящих лиц, страдающих и не страдающих хронической обструктивной болезнью легких
Автор: Кремис Иван Сергеевич, Букреева Екатерина Борисовна, Геренг Елена Андреевна, Боярко Валентина Владимировна, Буланова Анна Александровна, Зенгер Георг Владимирович
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.33, 2018 года.
Бесплатный доступ
Цель исследования: выявить особенности сосудов микроциркуляторного русла собственной пластинки слизистой оболочки бронхов у курящих, страдающих и не страдающих хронической обструктивной болезнью легких, на основании светооптического и ультраструктурного анализа бронхобиоптатов. Материал и методы. Осуществили морфологическое исследование слизистой оболочки бронхов у курящих пациентов с хронической обструктивной болезнью легких и без нее с акцентом на морфометрический анализ сосудов микроциркуляторного русла. Проведено одномоментное исследование 115 курильщиков в возрасте от 40 до 60 лет (58,3±3,24 года), среди которых преобладали мужчины (90,9%). Результаты. В группе курящих с хронической обструктивной болезнью легких в отличие от группы сравнения были выявлены признаки сосудистого ремоделирования и нарушения микроциркуляции, которые проявлялись эндотелиальной дисфункцией, увеличением объемной плотности соединительной ткани в собственной пластинке слизистой оболочки бронхов с преимущественной периваскулярной локализацией, что сопровождалось снижением относительного объема капилляров (р=0,016) и уменьшением удельного объема микропиноцитозных везикул (р=0,005) и размера секреторных гранул Вейбеля - Палади (р=0,004) в эндотелиоцитах. Заключение. У курящих лиц без хронической обструктивной болезни легких в бронхах регистрировались структурные изменения компенсаторного характера без признаков ремоделирования сосудов бронхиальной стенки. У курящих, страдающих хронической обструктивной болезнью легких, наблюдались морфологические признаки эндотелиальной дисфункции, нарушения гемодинамики, периваскулярный фиброз с редукцией микрососудистого русла.
Бронхобиоптаты, морфология бронхиальной стенки, курение, хроническая обструктивная болезнь легких, сосудистое ремоделирование, эндотелиальная дисфункция
Короткий адрес: https://sciup.org/149125206
IDR: 149125206 | УДК: 616.24-036.12-07:616.233-018.25-091 | DOI: 10.29001/2073-8552-2018-33-1-79-85
Текст научной статьи Морфометрическая характеристика сосудов микроциркуляторного русла бронхиального дерева у курящих лиц, страдающих и не страдающих хронической обструктивной болезнью легких
Хроническая обструктивная болезнь легких (ХОБЛ) относится к заболеваниям с неуклонно прогрессирующим течением, имеющим широкое распространение среди людей трудоспособного возраста [1–3].
Известно, что фактором риска развития ХОБЛ является курение. По данным эпидемиологических исследований установлено, что только 15–20% курящих лиц заболевают ХОБЛ. Риск развития болезни повышается у лиц с табачной зависимостью на фоне наследственной отя-гощенности до 95% [1, 3, 4]. Особое значение отводится генетическому полиморфизму генов, кодирующих АВ0 группу, α 1-антитрипсин, витамин D-связывающий белок, α 2-макроглобулин, цитохром Р-450А1 [3, 5, 6].
В последние годы большинство исследований направлено на изучение структурных и функциональных изменений слизистой оболочки бронхов (СОБ) у больных ХОБЛ, развивающихся на фоне постоянного воздействия табачного дыма. Единичные работы посвящены комплексной оценке морфофункциональных показателей бронхиальной стенки у курящих, страдающих и не страдающих ХОБЛ, с целью выявления факторов резистентности к развитию исследуемой болезни. В рамках данной проблемы актуальным направлением является анализ морфофункционального состояния микрососудистого русла собственной пластинки СОБ у курящих лиц.
Цель исследования: выявить особенности строения микроциркуляторного русла собственной пластинки СОБ у курящих лиц, страдающих и не страдающих ХОБЛ, на основании морфологического и ультраструктурного анализа бронхобиоптатов.
Материал и методы
Проведено одномоментное исследование 115 курильщиков в возрасте от 40 до 65 лет (58,3±3,24 года), среди которых преобладали мужчины (90,9%).
На основании спирометрического исследования пациенты были разделены на две группы: I группа — 32 «здоровых» курящих без ХОБЛ (группа сравнения), II группа — 83 курящих пациента с верифицированным диагнозом ХОБЛ (основная группа).
Критерии включения в исследование:
-
• возраст — от 40 до 65 лет (58,3±3,24 года);
-
• стаж курения — не менее 20 лет;
-
• интенсивность курения — 22 (20–45) пачка-лет;
-
• для основной группы — верифицированный диагноз ХОБЛ.
Критерии исключения из исследования:
-
• нежелание пациента принимать участие в исследовании;
-
• отсутствие информированного согласия;
-
• наличие тяжелых сопутствующих заболеваний, злокачественных новообразований или обострение хронических болезней, наличие других заболеваний бронхолегочной системы (бронхиальной астмы, бронхоэктатической болезни, буллезной эмфиземы легких, кисты легких, асбестоза, резекции части легких или их трансплантация, туберкулеза легких, травмы грудной клетки), прием психотропных и наркотических препаратов.
До проведения любых процедур, связанных с исследованием, было получено письменное информированное согласие больного (одобрено локальным комитетом по этике ФГБОУ ВО СибГМУ Минздрава России г. Томска № 2833/1 от 31.11.2011). В ходе исследования были соблюдены все принципы Хельсинкской декларации Всемирной медицинской ассоциации.
Бронхоскопию больным выполняли по стандартной методике гибким фиброскопом (BF1T20, Olympus Corporation, Japan) с соблюдением всех необходимых условий, натощак, в утренние часы, в условиях фибробронхоскопического кабинета. Бронхобиоптаты (3–4 фрагмента) получали методом щипковой биопсии слизистой оболочки правого среднедолевого бронха. Материал фиксировали в 10–12%-ном нейтральном растворе формалина, проводили по спиртам возрастающей концентрации и заливали в парафин по стандартной методике.
Морфометрический анализ СОБ в исследуемых группах пациентов проводился с помощью компьютерной программы ImageJ 1.43 (режим доступа: http://wwwrsb. .
С помощью метода точечного счета Автандилова с использованием Plugins «Grid» в бронхобиоптатах подсчитывали объемную плотность следующих структур (мм3/мм3): соединительной ткани (VVст) и сосудов микроциркуля-торного русла (VVмс). Используя окуляр-микрометр определяли диаметр сосудов, высоту эндотелия в них (мкм) [7].
Образцы бронхобиоптатов не более 2 мм3 после предварительной фиксации и постфиксации подвергали дегидратации в этаноле восходящей концентрации, заливали в смесь эпона и аралдита. Полутонкие и ультра-тонкие срезы готовили на ультратоме LKB III (Швеция). Полутонкие срезы толщиной 1 мкм окрашивали 1%-ным раствором толуидинового синего или азур II, просматривали в световом микроскопе. Ультратонкие срезы толщиной 60–100 нм наносили на сетки-подложки с формваровой пленкой-подложкой и контрастировали 2%-ным раствором уранилацетата и цитратом свинца.
Препараты просматривали в электронном микроскопе JEM-100 CXII (JEOL, Япония) с апертурной диафрагмой 25–30 мкм при ускоряющем напряжении 80 кВ. Описание и морфометрию ультраструктур проводили на оцифрованных негативных фотопластинках с начальным увеличением 4800–12000 с помощью программ обработки графических изображений. Вычисляли удельный объем внутриклеточных структур, используя метод точечно-счетной морфометрии, предложенный А. А. Глаголевым. На электронных микрофотографиях подсчитывали удельный объем (УО) следующих тканевых и клеточных структур (мкм3/мкм3): сосудов микроцирку-ляторного русла (VVкап), удельный объем микропино-цитозных везикул (VVпиноц), удельный объем секреторных гранул Вейбеля — Палади, а также их размер (нм) [7–9]. Во внутренней выстилке сосудов СОБ выделяли три типа клеток с предварительным подсчетом доли (%) каждой из эндотелиальной популяции клеток — основного типа, светлые (отечные) и темные (гиперосмированные) эндотелиоциты [10].
Статистическую обработку результатов производили при помощи пакета программ Statistica 6.0. Данные представляли в виде медианы (Me), меру рассеяния — в виде квартильного интервала (Q0,25–Q0,75). Для оценки различий в попарно несвязанных выборках использовали метод Манна – Уитни. Сопряженность между полученными морфологическими и клинико-функциональными данными определяли посредством оценки коэффициентов корреляции рангов Спирмена. Для решения задач распознавания признаков и оценки роли различных маркеров в ремоделировании бронхиальной стенки использовали дискриминантный анализ. Критическим уровнем значимости считали значение p <0,05.
Результаты и обсуждение
В последние годы активно обсуждаются тканевые, клеточные и молекулярные механизмы, обуславливающие устойчивость к развитию ремоделирования бронхиальной стенки у лиц с длительным стажем курения.
При морфологическом исследовании бронхобиопта-тов у курящих пациентов, страдающих и не страдающих ХОБЛ, нами был сделан акцент на изучение характера изменений в микроциркуляторном русле бронхиальной стенки.
В бронхобиоптатах у курящих лиц без клинических признаков ХОБЛ микроциркуляторное русло бронхиальной стенки характеризовалось венозным полнокровием, стазом, нередко с набуханием эндотелиоцитов в капиллярах. В некоторых случаях у этой группы пациентов визуализировался периваскулярный и межжелезистый отеки и плазматическое пропитывание собственной пластинки СОБ. Бронхиальный эпителий у данной группы пациентов был в состоянии дистрофии (рис. 1).
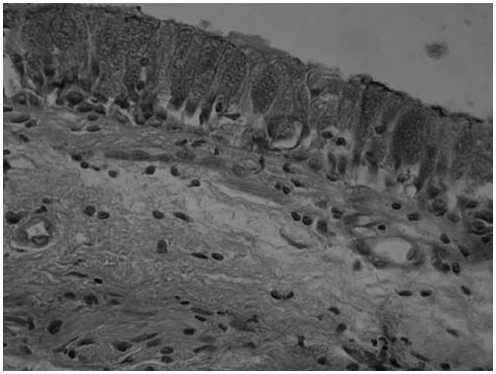
Рис. 1. СОБ у курящего пациента без клинических признаков ХОБЛ. Внутри- и субэпителиальный отеки, расширение просвета капилляров, набухание и увеличение объема эндотелиоци-тов. Окраска гематоксилин-эозином. Ув. 450
При ультраструктурном исследовании сосудов ми-кроциркуляторного русла собственной пластинки СОБ у курящих без клинических признаков ХОБЛ установлено, что среди сосудов преобладали капилляры «открытого» типа. Последние характеризовались расширенным просветом, который был заполнен многочисленными вакуолями, формирующимися по типу клазматоза люминальными цитолеммами эндотелиоцитов и «белковыми» конгломератами внутри них (рис. 2).
Популяция эндотелиальных клеток в сосудах микро-циркуляторного русла собственной пластинки СОБ у обследованных лиц состоит как минимум из трех типов клеток — основных (типичных), светлых (отечных) и темных (гиперосмированных). При этом в популяциях эндотелиоцитов капилляров СОБ преобладали основные (типичные) и светлые (отечные) клетки. Люминальная поверхность основных и светлых эндотелиоцитов имела
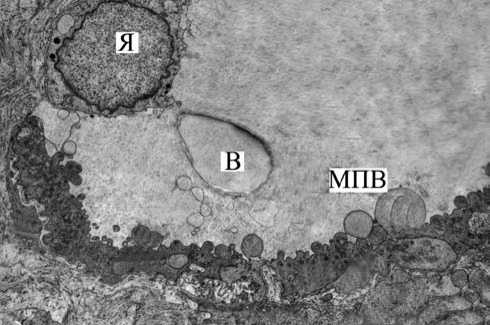
Рис. 2. СОБ у курящего без клинических признаков ХОБЛ. Фрагмент капилляра в собственной пластинке СОБ. Неровность контуров люминальной поверхности эндотелиоцита с множественными крупными вакуолями (В) и микропиноцитозными везикулами (МПВ). Я — ядро. Ув. 8500
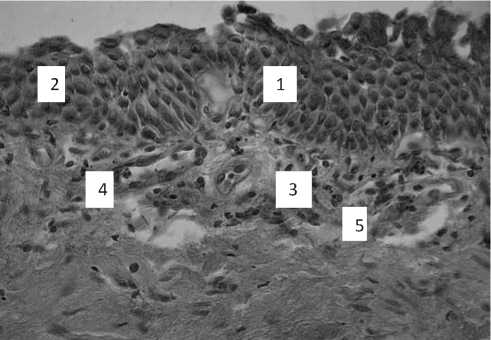
Рис. 3. СОБ у курящего с ХОБЛ. Метаплазия бронхиального эпителия в многослойный плоский (1) с формированием трех слоев клеток — базального, шиповатого и поверхностного. Межэпителиальная локализация нейтрофилов (2), субэпителиальная круглоклеточная инфильтрация (3), расширение капилляров (4), стаз и тромбоз сосудов (5). Окраска гематоксилином и эозином. Ув. 350
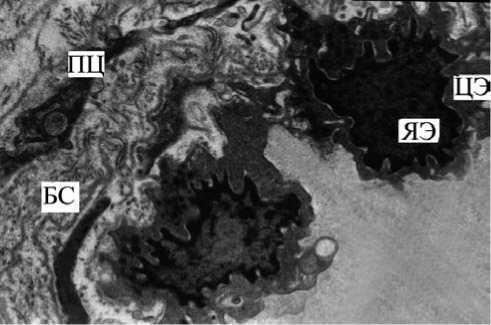
Рис. 4. СОБ у курящего с ХОБЛ. Фрагмент капилляра собственной пластинки СОБ. Нарушение целостности эндотелиальной выстилки. Дегенеративные процессы в ядре (ЯЭ), цитоплазме (ЦЭ) эндотелиальной клетки и перицита (ПЦ). БС — базальный слой. Ув. 19 500
неровный рельеф с признаками клазматоза, образовывала большое количество мелких пиноцитозных инвагинаций. По всей цитоплазме эндотелиальных клеток наблюдали множество светлых полиморфных микро-пиноцитозных везикул. Ядра этих эндотелиоцитов — овальной или бобовидной формы с неровными контурами в связи с множественными выростами нуклеолеммы, маргинальная компактизация хроматина. В цитоплазме «светлых» эндотелиоцитов таких капилляров присутствовали единичные электронно-плотные секреторные гранулы Вейбеля — Палади, которые располагались в безъядерной зоне, при этом выявлялись как тельца с плотной фибриллярной структурой, так и образования, заполненные большим количеством мелких, ориентированных по длине и заключенных в плотный матрикс цитоплазматических трубочек.
В собственной пластинке СОБ у пациентов с ХОБЛ определялся диффузный субэпителиальный полиморфно-клеточный инфильтрат с преобладанием нейтрофильных гранулоцитов, нередко с внутриэпителиальной локализацией. В бронхобиоптатах у курящих с ХОБЛ диагностировался выраженный фиброз. Пучки коллагеновых волокон локализовались преимущественно в межжелезистой строме. В белково-слизистых железах мукоциты и сероциты находились в состоянии дистрофии и распада с выраженным нарушением секреторной активности.
Часть сосудов микроциркуляторного русла спазмирована, в них обнаруживались стаз, сладж эритроцитов и признаки тромбоза (рис. 3). Другие сосуды компенсаторно расширены, вокруг них определялись периваскулярные отеки.
При электронно-микроскопическом анализе эпителиального пласта у курящих с ХОБЛ также подтверждался выраженный периваскулярный фиброз в сочетании с умеренным отеком, который приводил к резкому уменьшению просвета капилляров. При периваскулярной локализации коллагена нарушалась транскапиллярная диффузия, что сопровождалось изменением формы эндотелиальных клеток, в некоторых не визуализировались органоиды, ядра с множественными инвагинациями, хроматин резко конденсирован, нередко с признаками кариопикноза и кариорексиса (рис. 4).
У части пациентов в сосудах собственной пластинки СОБ выявлялась гибель эндотелиоцитов с разрывом эндотелиальной выстилки (рис. 5).
Нередко у этих пациентов в периваскулярной зоне идентифицировались фибробласты активированного фенотипа, формирующие тонкие и нежные пучки коллагеновых волокон.
В сосудах микроциркуляторного русла собственной пластинки СОБ в большом количестве определялись кровяные пластинки, стаз эритроцитов. Интересно, что у пациентов с ХОБЛ в капиллярах бронхобиоптатов наряду с клетками нормального строения определялись эритроциты в виде гантели, булавы или других причудливых форм (рис. 6).
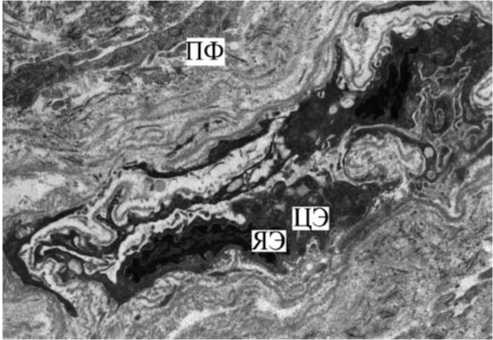
Рис. 5. СОБ у курящего с ХОБЛ. Фрагмент сосуда собственной пластинки СОБ. Истончение, множественные разрывы эндотелиальной выстилки сосуда. ПФ — периваскулярный фиброз, ЦЭ — цитоплазма эндотелиоцита, ЯЭ — ядро эндотелиоцита. Ув. 17 000
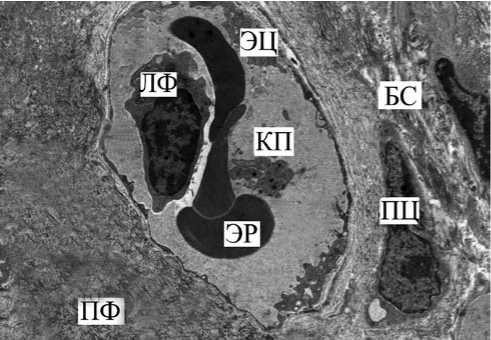
Рис. 6. СОБ у курящего с ХОБЛ. Фрагмент капилляра собственной пластинки СОБ. Истончение люминальной поверхности эндотелиоцита (ЭЦ) и утолщение базального слоя (БС) в сочетании с периваскулярным фиброзом (ПФ). Лимфоцит (ЛФ), сладж и деформация эритроцитов (ЭР), кровяные пластинки (КП). Ув. 14 000
При морфометрическом исследовании были подтверждены морфологические изменения микроциркуля-торного русла и получены статистически значимые различия между группами пациентов. Анализ сосудистого звена собственной пластинки СОБ у пациентов с ХОБЛ по сравнению с группой без клинических признаков заболевания обнаружил статистически значимое снижение удельного объема капилляров как на светооптическом уровне (0,06 и 0,09 мм3/мм3 соответственно, р <0,05), так и на ультраструктурном — 0,44 (0,28–0,56) и 0,69 (0,36–0,88) мкм3/мкм3 соответственно, p =0,004. Также при светооптическом анализе было подтверждено статистически значимое увеличение объемной плотности соединительной ткани в собственной пластинке СОБ у курящих с ХОБЛ — 0,74 мм3/мм3 против 0,69 мм3/мм3 в группе сравнения ( р <0,05).
Морфометрическая оценка ультраструктур эндотелиальных клеток в капиллярах СОБ у пациентов с ХОБЛ по сравнению со «здоровыми» курящими показала снижение удельного объема микропиноцитозных везикул в эндотелиоцитах капилляров бронхиальной стенки (см. таблицу), что может быть связано с нарушением функциональной активности эндотелиальных клеток капилляров СОБ у исследуемых пациентов и приводит к нарушению транскапиллярного обмена в стенке бронхов. При морфометрической оценке секреторных гранул Вейбеля – Палади у пациентов с ХОБЛ установлено снижение размера секреторных гранул по сравнению с группой без клинических признаков ХОБЛ (см. таблицу). При построении уравнения линейной дискриминантной функции установлено, что УО микропиноци-тозных везикул (мкм3/мкм3) является одним из ведущих показателей при сосудистом ремоделировании бронхиальной стенки, наблюдаемом у пациентов с ХОБЛ при воздействии табачного дыма (λ=0,39; F=72,99; р<0,0001).
Таблица
Ультраструктурные характеристики эндотелиоцитов капилляров собственной пластинки СОБ в группе сравнения и курящих с ХОБЛ, Me (Q0,25–Q0,75)
|
Исследуемые параметры |
Группа сравнения, n =32 |
ХОБЛ, n =83 |
p |
|
Удельный объем микропино-цитозных везикул, VV пиноц (мкм3/мкм3) |
0,26 (0,18– 0,34) |
0,18 (0,15–0,28) |
0,005 |
|
Размер секреторных гранул Вейбеля – Палади, нм |
432,2 (355,6– 492,5) |
429,6 (356,2– 500,2) |
0,004 |
|
Удельный объем секреторных гранул Вейбеля – Палади, VV, % |
15,04 (9,26–23,0) |
16,42 (12,5–24,35) |
0,10 |
Примечание: n — количество пациентов; р — статистическая значимость различий.
Обсуждение
В последние годы возрастает количество исследований, направленных на изучение проблемы расстройств микроциркуляции при ХОБЛ как звена патогенеза заболевания [5, 11–15]. Так, по данным Кузубовой Н. А. и соавт., было показано, что у больных ХОБЛ нарушения вазорегулирующей функции эндотелия возникают уже на ранней стадии заболевания и нарастают по мере прогрессирования патологического процесса, что нередко сопровождалось повышением эндотелина-1 в плазме крови и приводило к формированию хронического легочного сердца. Наши морфометрические данные подтверждают дисциркуляторные расстройства, наблюдаемые у курящих с ХОБЛ, что отражалось в уменьшении удельного объема микропиноцитозных везикул на люминальной поверхности эндотелиоцитов, диаметра и размера гранул Вейбеля — Палади. Эти ультраструктурные признаки, определяющиеся в эндотелиальных клетках капилляров бронхов у курящих пациентов с ХОБЛ, отражают признаки эндотелиальной дисфункции. Учитывая, что в гранулах Вейбеля — Палади находится и накапливается множество биологически активных веществ (эндоте-лин-1, P-селектин, фактор Виллебранда и др.), массивное высвобождение содержимого гранул у курильщиков с ХОБЛ может приводить к резкому увеличению вазомоторного тонуса и усилению тромбообразования [12, 14]. В нашем исследовании это подтверждается уменьшением УО капилляров собственной пластинки СОБ, а также повышением доли сосудов с ультраструктурными признаками реологических расстройств (стаз, сладж, тромбоз), что приводит к нарушению перфузии через микрососуды и блокаде транскапиллярного обмена. У курящих пациентов с ХОБЛ развитие эндотелиальной дисфункции с последующим изменением сосудов микроциркулятор-ного русла в бронхиальной стенке вносит значимый вклад в формирование необратимой бронхиальной обструкции и хронической легочной гипертензии. Это подтверждает дискриминантный анализ и отрицательная корреляция между отношением ОФВ1/ФЖЕЛ и удельным объемом микропиноцитозных везикул в эндотелиоцитах капилляров СОБ (r=–0,65, р<0,05).
Таким образом, у курящих без клинических признаков ХОБЛ (группа сравнения) в собственной пластинке СОБ выявлялись гемодинамические изменения, которые на ультраструктурном уровне реализовывались интенсификацией обменных и транскапиллярных реакций в эндотелиальных клетках сосудов. Это сопровождалось возрастанием общего числа микропиноцитозных везикул и цитоплазматических выростов в эндотелиоцитах. У курящих с ХОБЛ нами выявлен выраженный фиброз собственной пластинки СОБ, который приводил к изменению кровоснабжения с последующей ультраструктур-ной модификацией сосудов микроциркуляторного русла и эндотелиальных клеток. Регенераторно-пластическая недостаточность, выявленная нами в эндотелиальных клетках собственной пластинки СОБ, сопровождалась появлением большого количества эндотелиоцитов с единичными микропиноцитозными везикулами и гранулами Вейбеля — Палади.
Выводы
У курящих без признаков ХОБЛ морфологические изменения микрососудистого русла СОБ у пациентов группы сравнения реализуются преимущественно на ультра-структурном уровне и связаны с адаптивной реакцией на длительное воздействие табачного дыма без изменения гемодинамики и снижения интенсивности транскапиллярного обмена.
Сосудистое ремоделирование, определяющееся у курящих с ХОБЛ, проявляется в редукции микроциркуля-торного русла, периваскулярном фиброзе, а также в нарушении ультраструктурной организации эндотелиоцитов капилляров СОБ, что приводит к местным нарушениям реологических свойств крови и выраженному снижению интенсивности транскапиллярного обмена.
У курящих с ХОБЛ развитие эндотелиальной дисфункции с последующим изменением сосудов (ремо- делированием) микроциркуляторного русла в бронхиальной стенке вносит значимый вклад в формирование необратимой бронхиальной обструкции и хронической легочной гипертензии.
Список литературы Морфометрическая характеристика сосудов микроциркуляторного русла бронхиального дерева у курящих лиц, страдающих и не страдающих хронической обструктивной болезнью легких
- Черняев А. Л., Самсонова М. В. Варианты хронической обструктивной болезни легких с позиции патологоанатома. Пульмонология. 2013; 3: 93-96
- Геренг Е. А., Суходоло И. В., Плешко Р. И., Огородова Л. М., Букреева Е. Б., Селиванова П. А., Дзюман А. Н., Кремис И. С., Еремина Т. А. Сравнительная ультраструктурная характеристика слизистой оболочки бронхов при различных типах воспаления дыхательных путей. Вестник Волгоградского государственного медицинского университета. 2011; 1(37): 70-73
- Цветкова О. А., Мустафина М. Х. Полиморфизм гена ADRВ2: роль в предрасположенности к заболеванию, тяжести течения и терапевтическом ответе при хронической обструктивной болезни легких. Пульмонология. 2013; 2: 5-9
- Кадушкин А. Г., Таганович А. Д., Картун Л. В., Ходосовская Е. В., Чупик В. Н. Уровень цитокинов в плазме крови некурящих и курящих пациентов с хронической обструктивной болезнью легких. Пульмонология. 2013; 6: 27-32
- Кузубова Н. А., Лебедева Е. С., Золотницкая В. П., Двораковская И. В., Федин А. Н., Титова О. Н. Сосудистые нарушения в легких при хронической обструктивной болезни легких как мишень для терапевтического воздействия. Пульмонология. 2012; 4: 71-77
- Непомнящих Г. И. Биопсия бронхов: морфогенез общепатологических процессов в легких. М.: Издательство РАМН; 2010
- Автандилов Г. Г. Основы количественной патологической анатомии. М.: Медицина; 2002: 240
- Автандилов Г. Г. Диагностическая медицинская плоидометрия. М.: Медицина; 2006: 192
- Глаголев В. В. Геометрические методы количественного анализа агрегатов под микроскопом. Львов; 1968: 263
- Казанская Г. М., Непомнящих Л. М., Лушникова Е. Л., Волков А. М. Ультраструктурная организация капилляров в разных отделах сердца собак при искусственной иммерсион ной гипотермии. Бюллетень экспериментальной биологии и медицины. 2009; 2: 211-216
- Holgate S. T. The Epithelium and airway remodeling. Eur. Respir. J. 2012; 6(29): 7-43.
- Kubo H., Takahashi T. The role of microparticles in chronic obstructive pulmonary disease. International Journal of Chronic Obstructive Pulmonary Disease. 2014; 9: 303-314.
- DOI: 10.2147/copd.s38931
- Kosciuch J., Krenke R., Gorska K., Baran W., Kujawa M., Hildebrand K., Chazan R. Comparison of airway wall remodeling in asthma and COPD: biopsy findings. Respiratory Care. 2012; 57(4): 557-564.
- DOI: 10.4187/respcare.01359
- Rodella L. F., Favero G., Rossini C., Foglio, E., Reiter R. J., Rezzani R. Endothelin-1 as a potential marker of melatonin's therapeutic effects in smoking-induced vasculopathy. Life Sci. 2010; 87(17-: 558-564.
- DOI: 10.1016/j.lfs.2010.09.011
- Soltani A., Reid D., Sohal S., Wood-Baker R., Weston S., Muller H. K., Walters E. H. Basement membrane and vascular remodeling in smokers and chronic obstructive pulmonary disease: a crosssectional study. Respiratory Research. 2010; 11(1): 105.
- DOI: 10.1186/1465-9921-11-105


