Морфометрические изменения в гиппокампе и миндалевидном теле мышей при моделировании хронического стресса поражения
Автор: Дорофеев Н.А., Смирнов А.В., Самаркин Д.Д., Тюренков И.Н., Быхалов Л.С.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 3 т.22, 2025 года.
Бесплатный доступ
Под влиянием хронических стрессовых воздействий, в том числе социального характера, у человека могу развиваться пограничные состояния и психические заболевания. Изучение механизмов и морфологического субстрата, лежащих в их основе, проводится с помощью моделирования на животных, в том числе в парадигме хронического социального стресса поражения. Однако в литературе имеются слабо проработанные аспекты и несоответствия, требующие уточнений. Цель работы. Изучение морфологических изменений в гиппокампе и миндалевидном теле при моделировании хронического социального стресса у мышей в сравнении с контрольными животными. Материалы и методы. Исследование проведено в парадигме «хронического социального стресса поражения» по методике, описанной ранее, на линейных мышах (CBA/lac). По окончании эксперимента производилось изучение микропрепаратов головного мозга, окрашенных по Нисслю, с визуальной и морфометрической оценкой. Результаты. Полученные результаты подтверждают, что субструктуры гиппокампа и миндалевидного тела участвуют в реакциях организма на хронический социальный стресс, что проявляется в изменении морфометрических характеристик нейронов. В поле CA1 гиппокампа наблюдается увеличение плотности нейронов при незначительной атрофии самих клеток, тогда как в поле CA3 выявляется гипертрофия нейронов, главным образом за счет увеличения объема цитоплазмы, с уменьшением складчатости клеточной и ядерной мембран на фоне небольшого среднего снижения плотности нейронов. В латеральном, базолатеральном и базомедиальном ядрах миндалевидного тела отмечены атрофические изменения нейронов, которые не сопровождаются значительными изменениями их плотности. Заключение. Описанные морфометрические данные согласуются с рядом функционально-биохимических изменений, которые могут их обуславливать. При этом имеются расхождения, требующие дальнейшего комплексного изучения вопроса с точки зрения морфофункционального подхода.
Хронический стресс, социальное поражение, мыши, гиппокамп, миндалевидное тело
Короткий адрес: https://sciup.org/142245919
IDR: 142245919 | УДК: 616.8-091 | DOI: 10.19163/2658-4514-2025-22-3-65-72
Текст научной статьи Морфометрические изменения в гиппокампе и миндалевидном теле мышей при моделировании хронического стресса поражения
doi:
Влияние различных внешних социальных факторов на организм человека являются неотъемлемой и необходимой частью его жизни. Под их действием происходит адаптация в непрерывно меняющихся окружающих условиях, начиная от семьи и близкого окружения и заканчивая глобальными мировыми событиями. В тех случаях, когда подобные внешние стимулы становятся избыточными по своей силе и/или продолжительности, они могут из физиологических перейти в разряд патологических. Такое негативное воздействие может приводить к целому ряду пограничных состояний и заболеваний, в том числе психических, таких как тревожное расстройство, депрессия и посттравматическое стрессовое расстройство [1, 2]. В силу широкого распространения хронического воздействия негативных социальных факторов в настоящее время одной из актуальных задач медицины является исследование их влияния на разные системы организма [3–12]. На основании этих знаний, в свою очередь, разрабатываются методы предотвращения развития патологических состояний и их лечение.
Основная часть научных работ, в которых данная тематика изучается в контексте морфологических изменений, основана на анализе материала, полученного от экспериментальных животных, особенно мышей и крыс, при моделировании схожих стрессовых воздействий. При этом большее внимание направлено на моделирование тревожно-депрессивных состояний, для чего разработано множество типов проведения эксперимента.
Разные их варианты в большей или меньшей степени воспроизводят патологические стимулы, происходящие в организме процесс и их последствия, что соответствует критериям наличной, конструктивной, предсказательной и этиологической валидности.
В литературе описаны несколько групп моделей депрессии и хронического стресса [1, 13]. Первая из них, так называемые «модели повреждения», в которых моделирование депрессивноподобного поведения достигается созданием искусственного дефекта на разных уровнях – от генного до органного. Ко второй группе можно отнести близкие к первой группе модели «фармакологической» депрессии, основанные на использовании химических соединений, приводящих к развитию исследуемого состояния. Также выделяют третью группу, представленную различными моделями непосредственно острого, подострого и хронического стресса. Среди последних особое место занимают «социальные» модели.
«Модели повреждения» и модели «фармакологической» депрессии в большинстве ориентированы на исследование конкретных механизмов развития тревожно-подобного и/или депрессивно-подобного поведения, не представляя, однако, целостной картины, что ограниченно позволяет экстраполировать полученные данные на широко распространенные клинические ситуации. Данный минус в значительной степени нивелирован в моделях стресса, особенно моделях умеренного хронического непредсказуемого стресса и модели хронического социального стресса поражения. Последний класс моделей – один из немногих, исследующих воздействие непосредственно социальных факторов, имеющих наибольшее этиологическое соответствие в рамках эксперимента на грызунах.
Кроме того, согласно данным разных коллективов авторов, несмотря на моделирование неспецифической реакции организма – стресса – есть целый ряд биохимических, морфологических и поведенческих отличий, наблюдаемых у животных. При этом имеются и схожие аспекты, среди которых центральную роль в физиологических и патологических реакциях организма на стресс отводят гиппокампу [8, 12, 14]. При детальном изучении также установлено, что разные его субструктуры – поля CA1, CA2, CA3 – могут по-разному реагировать на исследуемые воздействия, как количественно, так и качественно.
Кроме гиппокампа одной из наиболее исследованных структур конечного мозга стало миндалевидное тело, ядра которого также, потенциально, могут играть разную роль в адаптационнодезадаптационных реакциях на стресс.
ЦЕЛЬ РАБОТЫ
Изучение морфологических изменений в гиппокампе и миндалевидном теле при моделировании хронического социального стресса у мышей в сравнении с интактными животными.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследование выполнено в парадигме «хронического социального стресса поражения» по методике, описанной ранее [15]. В часть эксперимента, описанную в текущей работе, были включены 13 мышей линии CBA (lac) возрастом 4 месяца (масса 20–25 г), разделенные на группу «стресса» (7 животных, С) и интактную группу (6 животных, И). Также в эксперименте участвовали животные линии C57BL/6 и нелинейных мышах в качестве животных-«агрессоров». Работа с животными была проведена в соответствии с Европейской конвенцией о защите позвоночных животных, используемых в экспериментальных и других научных целях (Страсбург, 1986). На проведение исследования получено разрешение локального этического комитета ФГБОУ ВО ВолгГМУ Минздрава России (№ 2022/160 от 3.11.2022).
После вывода животных из эксперимента, исследовался материал головного мозга животных интактной группы и группы «стресса» с окраской фронтальных срезов (-1.255:-2.555 мм от Брегмы) тионином по методу Ниссля. Полученные микропрепараты фотографировались и подвергались качественному, количественному (морфометрическому) анализу и статистической обработке, согласно описанной ранее методике.
В настоящей работе представлены результаты анализа полей CA1, CA2, CA3 гиппокампа, а также латерального (ЛА), базолатерального (БЛА) и базомедиального (БМА) ядер миндалевидного тела (амигдалы). При проведении морфометрии рассчитывались следующие показатели нейронов согласно представленной методике:
периметр перикариона, периметр ядра, площадь перикариона, относительная площадь перикариона, площадь цитоплазмы перикариона, относительная площадь цитоплазмы перикариона, площадь ядра, относительная площадь ядра, ядерно-цитолазматическое отношение (ЯЦО). Результаты предоставлены в формате «Процент изменения (95 % доверительный интервал процента изменения)» либо «среднее ± стандартное отклонение».
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Гиппокамп
При качественном морфологическом анализе в полях CA1 и CA2 не обнаружено заметных цитологических различий между нейронами у животных интактной и стрессированной групп (рис. 1). Также визуально не отмечено изменение характера их взаимного расположения и плотности. В поле CA3 имелась тенденция к более компактному расположению пирамидных нейронов с более частыми перекрытиями границ клеток в рамках стандартных срезов. При этом структурно отмечалась тенденция к более частому формированию пустых пространств в толщине слоя с «выпадением» нейронов.
По результатам морфометрии с последующей статистической обработкой, в полях CA1 и CA2 по абсолютным показателям не обнаружено достоверных различий, однако имелась тенденция к их уменьшению в группе стресса по сравнению с интактной группой.
В поле CA1 по относительным морфометрическим показателям имелась обратная тенденция к увеличению в группе стресса с достижением порога статистической значимости ( р- значение < 0,05) по следующим из них:
-
- относительная площадь перикариона нейрона – увеличение на 13,9 % (4,8–23,0 %) в группе стресса (И – 1,65 ± 0,77, С – 1,88 ± 0,72);
-
- относительная площадь цитоплазмы перикариона нейрона – увеличение на 14,1 % (3,3– 23,9 %) в группе стресса (И – 0,92 ± 0,46, С – 1,05 ± 0,48);
-
- относительная площадь ядра нейрона – увеличение на 15,1 % (5,5–23,3 %) в группе стресса (И – 0,73 ± 0,36, С – 0,84 ± 0,3).
В поле CA2 не установлено достоверных различий по относительным показателям с отсутствием тенденции как к увеличению, так и к уменьшению.
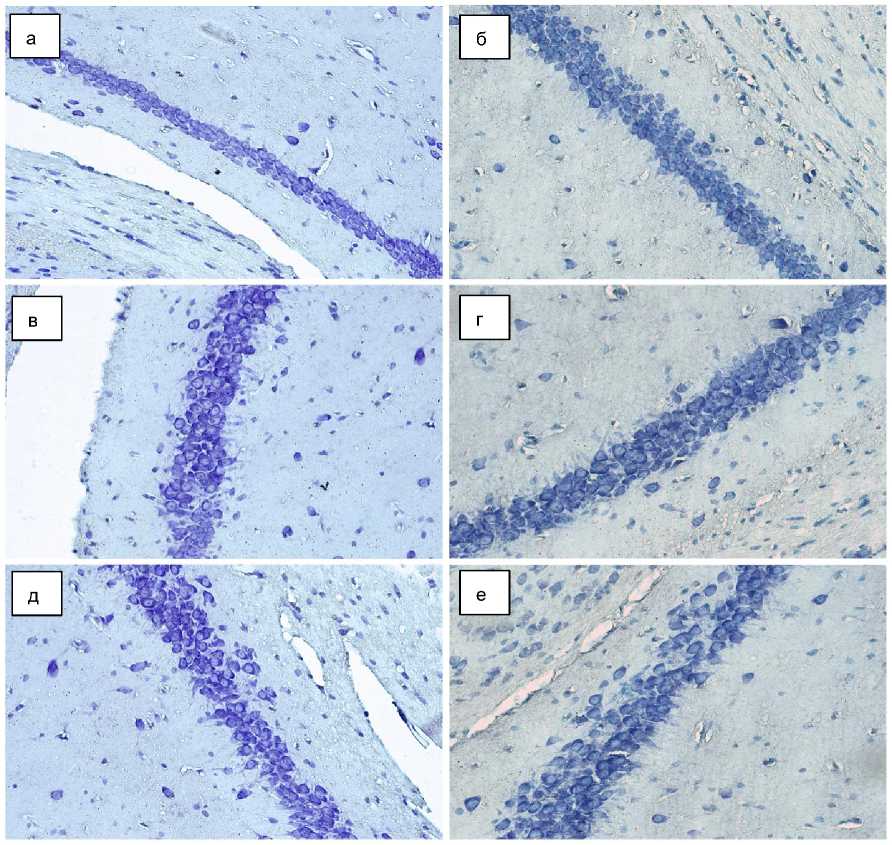
Рис. 1. Морфология гиппокампа мыши, окраска тионином по методу Ниссля, ×400:
а, б – поле CA1; в, г – поле CA2; д, е – поле CA3; а, в, д – группа интактных мышей; б, г, е – группа стрессированных мышей
В нейронах поля CA3, в свою очередь, имелась тенденция к увеличению как абсолютных, так и относительных показателей, кроме ЯЦО, с наличием достоверных различий в части абсолютных показателей:
-
- периметр ядра нейрона – увеличение на 4,7 % (1,9–7,6 %) в группе стресса [И – (29,34 ± 3,91) мкм, С – (30,73 ± 4,49) мкм];
-
- площадь перикариона нейрона – увеличение на 12,7 % (6,5–18,8 %) в группе стресса [И – (111,78 ± 30,96) мкм2, С – (125,94 ± 38,07) мкм2];
-
- площадь цитоплазмы перикариона нейрона – увеличение на 14,1% (6,2–22,0 %) в группе стресса [И – (64,53 ± 23,05) мкм2, С – (73,63 ± 28,37) мкм2];
-
- площадь ядра нейрона – увеличение на 10,7 % (5,2–16,2 %) в группе стресса [И – (47,25 ± 11,68) мкм2, С – (52,31 ± 14,31) мкм2].
Таким образом, несмотря на незначительные качественные отличия при визуальной оценке нейронов в полях CA1-3 гиппокампа, имелись статистически значимые количественные различия по ряду морфометрических параметров в сторону их увеличения в группе стресса по сравнению с интактной группой. Вместе с тем описанные изменения для поля CA1 достигли порога значимости только по параметрам относительных площадей перикариона нейрона, цитоплазмы перикариона нейрона и ядра нейрона. Стоит также отметить, что изменения абсолютных параметров имели тенденцию к уменьшению, что в сумме соответствует увеличению плотности нейронов в данной зоне на фоне незначительной атрофии самих клеток.
Для поля CA3, наоборот, достоверные различия отмечены только для абсолютных показа- телей, превосходящие разницу между группами по относительным показателям.
Обобщая данные результаты с тенденцией к снижению ЯЦО, а также более выраженному увеличению площадей цитоплазмы, ядра и перикариона по сравнению с их периметрами, в поле CA3 имелась гипертрофия нейронов, в большей степени за счет цитоплазмы, с уменьшением складчатости клеточной и ядерной мембран на фоне незначительного среднего снижения плотности нейронов.
Миндалевидное тело
При визуальной оценке нейронов (рис. 2) исследуемых ядер миндалевидного тела не от- мечено значительных различий в размерах перикарионов и ядер, однако в группе стресса чаще встречались нейроны с более гиперхром-ными ядрами и конденсированным хроматином, чем в материале животных интактной группы.
Кроме того, в латеральном ядре в группе стресса нейроны имели визуально более эллиптическую форму со сглаженными углами, в отличие от нейронов в интактной группе с более выраженной пирамидально-полигональной формой перикариона.
В базолатеральном ядре у части животных контрольной группы отмечены более выраженные ядрышки по сравнению с интактной группой.
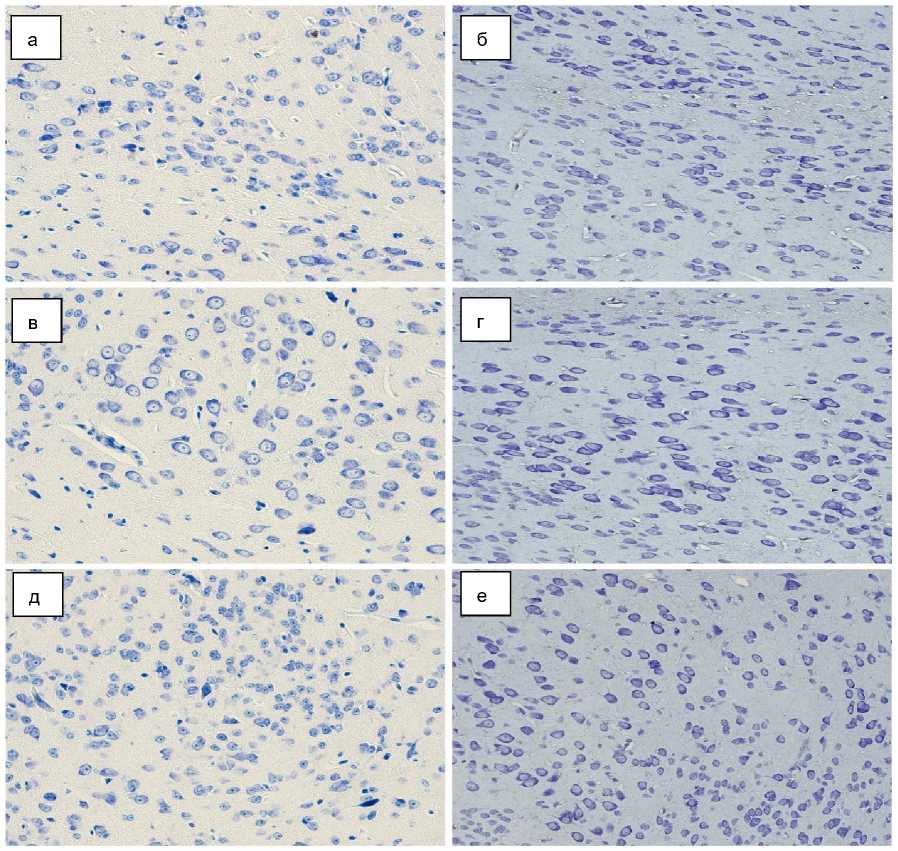
Рис. 2. Морфология миндалевидного тела мыши, окраска тионином по методу Ниссля, ×400: а, б - латеральное ядро;
в, г - базо-латеральное ядро; д, е - базо-медиальное ядро;
а, в, д - группа интактных мышей;
б, г, е - группа стрессированных мышей
Согласно полученным морфометрическим результатам с последующей статистической обработкой установлены достоверные различия по всем анализируемым показателям, кроме ядерно-цитоплазматического отношения.
Для латерального ядра отмечены следующие статистически значимые различия:
-
- периметр перикариона нейрона – уменьшение на 6,1 % (2,5–9,7 %) в группе стресса [И – (37,59 ± 7,36) мкм, С – (35,3 ± 6,19) мкм];
-
- периметр ядра нейрона – уменьшение на 7,0 % (3,4–10,6 %) в группе стресса [И – (23,86 ± 4,29) мкм, С – (22,19 ± 4,38) мкм];
-
- площадь перикариона нейрона – уменьшение на 20,7 % [15,0–26,3 %) в группе стресса [И – (66,67 ± 21,61) мкм2, С – (52,89 ± 14,9) мкм2];
-
- относительная площадь перикариона нейрона – уменьшение на 26,4 % (19,1–33,6 %) в группе стресса (И – 1,1 ± 0,5, С – 0,81 ± 0,3);
-
- площадь цитоплазмы перикариона нейрона – уменьшение на 19,0 % (12,6–25,4 %) в группе стресса [И – (36,96 ± 13,8) мкм2, С – (29,94 ± 9,15) мкм2];
-
- относительная площадь цитоплазмы перикариона нейрона – уменьшение на 25,0 % (16,7 – 33,3 %) в группе стресса (И – 0,6 ± 0,29, С – 0,45 ± 0,17);
-
- площадь ядра нейрона – уменьшение на 22,7 % (16,4–29,1 %) в группе стресса [И – (29,7 ± 10,26) мкм2, С – (22,95 ± 8,29) мкм2];
-
- относительная площадь ядра нейрона – уменьшение на 28,0 % (20,0–36,0 %) в группе стресса (И – 0,5 ± 0,24, С – 0,36 ± 0,16).
Для базолатерального ядра получены следующие результаты:
-
- периметр перикариона нейрона – уменьшение на 12,3 % (9,3–15,3 %) в группе стресса [И – (47,17 ± 6,43) мкм, С – (41,36 ± 7,61) мкм];
-
- периметр ядра нейрона – уменьшение на 11,6 % (8,5–14,8 %) в группе стресса [И – (29,15 ± 4,31) мкм, С – (25,76 ± 4,85) мкм];
-
- площадь перикариона нейрона – уменьшение на 24,8 % (19,2–30,5 %) в группе стресса [И – (105,18 ± 28,63) мкм2, С – (79,05 ± 30,81) мкм2];
-
- относительная площадь перикариона нейрона – уменьшение на 21,4 % (14,3–28,6 %) в группе стресса (И – 0,98 ± 0,39, С – 0,77 ± 0,29);
-
- площадь цитоплазмы перикариона нейрона – уменьшение на 24,3 % (17,8–30,7 %) в группе стресса [И – (60,26 ± 19,42) мкм2, С – (45,63 ± 19,52) мкм2];
-
- относительная площадь цитоплазмы перикариона нейрона – уменьшение на 20,0 % (12,7–27,3 %) в группе стресса (И – 0,55 ± 0,23, С – 0,44 ± 0,18);
-
- площадь ядра нейрона – уменьшение на 25,6 % (19,5–31,7 %) в группе стресса [И – (44,92 ± 14,09) мкм2, С – (33,43 ± 13,51) мкм2];
-
- относительная площадь ядра нейрона – уменьшение на 23,3 % (16,3–30,2 %) в группе стресса [И – 0,43 ± 0,19, С – 0,33 ± 0,13];.
В базомедиальном ядре миндалевидного тела имелись достоверные различия по указанным морфометрическим параметрам:
-
- периметр перикариона нейрона – уменьшение на 7,3 % (3,0–11,6 %) в группе стресса [И – (41,16 ± 9,67) мкм, С – (38,15 ± 7,78) мкм];
-
- периметр ядра нейрона – уменьшение на 6,5 % (2,6–10,3 %) в группе стресса [И – 25,41 ± 5,4 мкм, С – 23,77 ± 4,14 мкм];
-
- площадь перикариона нейрона – уменьшение на 15,8 % (8,3–23,2 %) в группе стресса [И – (84,34 ± 35,77) мкм2, С – (71,04 ± 25,55) мкм2];
-
- относительная площадь перикариона нейрона – уменьшение на 23,8 % (16,8–30,7 %) в группе стресса (И – 1,01 ± 0,41, С – 0,77 ± 0,26);
-
- площадь цитоплазмы перикариона нейрона – уменьшение на 15,3 % (6,9–23,8 %) в группе стресса [И – (48,17 ± 22,46) мкм2, С – (40,78 ± 17,75) мкм2];
-
- относительная площадь цитоплазмы перикариона нейрона – уменьшение на 22,8 % (15,8–29,8 %) в группе стресса [И – 0,57 ± 0,24, С – 0,44 ± 0,17];
-
- площадь ядра нейрона – уменьшение на 16,3 % (9,1–23,6 %) в группе стресса [И – (36,16 ± 15,33) мкм2, С – (0,84 ± 0,3) мкм2];
-
- относительная площадь ядра нейрона – уменьшение на 25,0 % (15,9–31,8 %) в группе стресса (И – 0,44 ± 0,2, С – 0,33 ± 0,12).
Согласно полученным результатам в ЛА, БЛА и БМА имелись атрофические изменения нейронов, не сопровождающиеся значительным изменение их плотности. При этом показатели площадей цитоплазмы, ядра и перикариона по сравнению с их периметром имели более выраженное уменьшение, что по модулю схоже с обнаруженными в CA3 различиями, и показывает большую консервативность «периметров» и большую лабильность «площадей» нейронов.
В научной литературе имеются разнородные и противоречивые данные относительно реакций миндалевидного тела и гиппокампа на стресс.
Среди них изучают вклад дофаминергических и серотонинергических нейронов в реакции организма на стресс. Кроме того, исследователи оценивали изменения в качественных и количественных характеристиках митохондриального звена, активации нейронов и изменение морфологии их отростков под влиянием хронического социального стресса поражения.
Так, одни авторы описали значительное снижение экспрессии рецепторов дофамина D1 в миндалевидном теле стрессированных «чувствительных» мышей, но не в CA1, и не получили достоверных изменений в экспрессии рецепторов D2 ни в амигдале, ни в CA1 [3].
Другие авторы не получили достоверных различий по обоим типам рецепторов ни в миндалевидном теле, ни в гиппокампе [4]. Согласно исследованиям морфологии отростков нейронов под действием указанных стимулов повышается и количество, и плотность отростков, а также их ветвление в ЛА и БЛА [5]. При этом интактные мыши, нокаутные по гену транспортеру серотонина (5-HTT) имели схожие изменения со стрессированными животными «дикого» типа, что показывает роль гомеостаза серотонина в данном процессе.
При изучении участия митохондриального звена, установлено значительное снижение митохондриальной массы, количества копий митохондриальной ДНК (митДНК) и повышение мито-фагии и мутаций в митДНК в БЛА, но не CA1 и CA3 гиппокампа [6]. Исследование активации нейронов с помощью анализа экспрессии белков семейства Fos показало, что в БЛА количество Fos-позитивных клеток возрастает при социальном стрессе [9]. Однако при раздельном изучении вклада c-Fos (быстро индуцируемая форма) и del-taFosB (более стабильная изоформа) установлено, что количество c-Fos-позитивных клеток в первые дни стресса повышается в БЛА, а затем возвращается к норме, а в вентральном гиппокампе наоборот, сначала снижается, а затем приходит к исходному уровню [7]. При этом, по данным других авторов, на конец эксперимента
СПИСОК ИСТОЧНИКОВ / REFERENCES в миндалевидном теле отмечалось повышение экспрессии c-Fos, а в гиппокампе – снижение [10].
Количество deltaFosB-позитивных нейронов и в БЛА, и в вентральном гиппокампе повышалось при социальном стресса, а в дорсальном гиппокампе – снижалось [8].
Таким образом, полученные нами данные относительно изменения морфометрических показателей нейронов в полях CA1, CA3 гиппокампа и ЛА, БЛА и БМА имеют ряд соответствий с функционально-биохимическими изменениями в схожих локализациях и могут быть, в определенной мере, ими обусловлены. Вместе с тем в данных различных авторов имеются расхождения, которые могут возникать из-за различий в деталях моделирования социального стресса, различиях в экспериментальных животных (например, линейные / нелинейные, отбор чувствительных / нечувствительных).
ЗАКЛЮЧЕНИЕ
Получены данные, подтверждающие участие субструктур гиппокампа и миндалевидного тела в реакциях организма на хронический социальный стресс в виде изменения морфометрических характеристик нейронов. При этом в поле CA1 гиппокампа отмечено увеличение плотности нейронов на фоне незначительной атрофии самих клеток, а поле CA3 – гипертрофия нейронов, в большей степени за счет цитоплазмы, с уменьшением складчатости клеточной и ядерной мембран на фоне незначительного среднего снижения плотности нейронов.
В латеральном, базолатеральном и базомедиальном ядрах миндалевидного тела обнаружены атрофические изменения нейронов, не сопровождающиеся значительным изменение их плотности.
Описанные нами результаты согласуются с рядом функционально-биохимических изменений, которые могут лежать в их основе, однако, имеются и расхождения, требующие дальнейшего комплексного изучения вопроса с точки зрения морфофункционального подхода.
Information about authors
Nikita A. Dorofeev – Assistant of the Department, Pathologist, ,
Alexey V. Smirnov – Doctor of Medical Sciences, Professor, Head of the Department, alexey-
,
Daniil D. Samarkin – postgraduate student of the Department, ,
Ivan N. Tyurenkov – Corresponding Member of the Russian Academy of Sciences, Doctor of Medical Sciences, Professor, Head of the Department, ,


