Мозг, депрессия, эпигенетика: новые данные
Автор: Романчук Наталья Петровна, Пятин Василий Федорович, Волобуев Андрей Николаевич, Булгакова Светлана Викторовна, Тренева Екатерина Вячеславовна, Романов Дмитрий Валентинович
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 5 т.6, 2020 года.
Бесплатный доступ
Депрессия - это разрушительный синдром, с аллостатической перегрузкой и транзиторной дисрегуляцией функций неврологического, метаболического и иммунологического статуса, а также с перепрограммированием в гипоталамо-гипофизарно-надпочечниковой оси. Депрессия вызывает патологические изменения в секреции и моторике пищеварительной системы, а сбой в работе двунаправленных кишечно-мозговых связей модифицируют микробиоту кишечника. Хроническая депрессия дестабилизирует работу «когнитивного и висцерального мозга». Нейроэндокринная составляющая нового нейросетевого мозга моделирует и управляет молекулярными, функциональными, поведенческими и автономными реакциями, в ответ на формирование (создание, культивирование) новой здоровой биомикробиоты. Постоянная самоорганизация функциональных систем организма обеспечивается гомеостатическим регулированием в рамках детерминистской и стохастической науки. Архитектура и функции мозга, поддерживают эффективную регуляцию энергии. Внутренняя модель мозга отрицательно влияет на развитие и поддержание депрессии...
Аллостаз, аллостатическая перегрузка, депрессия, диетическая психиатрия, инсомния, искусственный интеллект, нейросети мозг-микробиота, психонейроиммунология, функциональное и сбалансированное питание, циркадианные очки, эпигенетика
Короткий адрес: https://sciup.org/14116237
IDR: 14116237 | УДК: 616.83/.85:616.89 | DOI: 10.33619/2414-2948/54/21
Текст обзорной статьи Мозг, депрессия, эпигенетика: новые данные
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.83/.85:616.89
Целью исследования, является установить междисциплинарные защитные механизмы аллостатической дисрегуляции в работе «когнитивного и висцерального мозга» Homo
Sapiens, его нейроэндокринные и нейроиммунологические нейросетевые взаимосвязи, а также эпигенетическое воздействие (перепрограммирование).
Основные задачи исследования заключаются в определении роли классического гомеостаза в современных нейронауках: нейрофизиологии, нейроэндокринологии, нейроиммунологии и психонейроиммунологии.
Основные направления:
-
1. Мозг Homo sapiens — the central mediator of allostasis.
-
2. Генетические и эпигенетические модели профилактики депрессии.
-
3. Депрессия: диетические и биомикробиотические защитные программы.
-
4. Диетическая психиатрия — будущее психиатрического лечения.
-
5. Искусственный интеллект и депрессия: мультидисциплинарные нейросетевые коммуникативные аспекты «когнитивного и висцерального мозга».
-
6. Детерминистская и стохастическая фундаментальная платформа новой аллостатической модели гибридного стрессового процесса — современный прогноз физического и психического здоровья человека.
-
7. Авторские работы нового защитного функционального и эпигенетического питания, клиническое применение стратегических комбинированных и гибридных методов и инструментов в нейрореабилитации циркадианной системы, использование искусственного интеллекта в функционировании «когнитивного мозга» и «висцерального мозга» и нейросетей «мозг–микробиота».
-
8. Психонейроиммунологические коммуникации и нейроэндокринологические мультимодальные методы увеличения продолжительности активной и качественной здоровой жизни человека.
Новая эпигенетика H. sapiens управляет взаимодействием эпигенетических механизмов старения и долголетия с биологией, биофизикой, физиологией и факторами окружающей среды в регуляции транскрипции. Старение — это структурно–функциональная перестройка (перепрограммирование) и постепенное снижение физиологических функций организма, которые приводят к возрастной потере профессиональной пригодности, болезням, и к смерти. Понимание причин здорового старения составляет одно из самых проблемных междисциплинарных направлений. Продолжительность жизни человека в значительной степени определяется эпигенетически. Эпигенетическая информация — обратима, наши исследования дают возможность терапевтического вмешательства при здоровом старении и связанных с возрастом заболеваниях. Авторские разработки позволяют управлять острым и хроническим стрессом, снижают аллостатическую перегрузку, повышают нейропластичность мозга, включают гибридные и комбинированные инструменты и методики нейрореабилитации и психонейроиммунореабилитации [1].
В исследовании [2] установлены основные современные инструменты и методики эпигенетической защиты здорового старения и долголетия человека разумного.
Центральное место в интегративной модели стресса занимает проблема, требующая от человека принятия решения. Понятие такой проблемы определяют как проявление, воздействие на человека стимулов или условий, требующих от него превышения либо ограничения обычного уровня деятельности. Возникновение проблемы (трудностей с ее решением) сопровождается напряжением функций организма, — если проблема не решается, напряжение сохраняется или даже нарастает — развивается стресс.
Способности человека в решении возникающих перед ним проблем зависят от ряда факторов:
–ресурсов человека — его общих возможностей по разрешению различных проблем;

–личного энергетического потенциала, необходимого для решения конкретной проблемы;
–происхождения проблемы, степени неожиданности ее возникновения;
–наличия и адекватности психологической и физиологической установки на конкретную проблему;
–типа выбранного реагирования — защитного или агрессивного.
Диетическая психиатрия — будущее психиатрического лечения
Новое направление «диетическая психиатрия» доминирует в персонализированной медицине по профилактике депрессии и является важным компонентом психического здоровья человека. Здоровая биомикробиота и коммуникационные пути оси «микробиота– кишечник–мозг» играют решающую роль в нормальном развитии головного мозга, своевременном перепрограммировании и модуляции физиологических систем организма, важных при стрессовых расстройствах и профилактике депрессии. Новое защитное функциональное и эпигенетическое питание, являются эффективными в восстановлении психического здоровья человека.
Личность, определяет главную цель — это стремление улучшить качество и количество сна, улучшить социальную поддержку и способствовать позитивному взгляду на жизнь, поддерживать здоровое питание, избегать курения и регулярно заниматься умеренной физической активностью. Что касается физической активности, то нет необходимости становиться экстремальным спортсменом, и умеренная физическая активность имеет преимущества для мозга и тела (организма). Для того чтобы изменить траектории психического и физического здоровья, важно сосредоточиться на использовании целенаправленных поведенческих методов лечения наряду с лечением, включая фармацевтические препараты, которые «открывают окна пластичности» в головном мозге и способствуют эффективности поведенческих вмешательств.
H. sapiens на протяжении всей жизни стремится к поиску путей переориентации будущего поведения и физиологии на более позитивные и здоровые направления.
Мозг H. sapiens определяет характер стрессового воздействия (транзиторный и / или токсический), его патологическое разрушение организма (аллостатическая нагрузка и перегрузка), активация эпигенетической защиты. В условиях стресса, такие области мозга, как гиппокамп, миндалина и префронтальная кора подвергаются структурному ремоделированию, которое изменяет поведенческие и физиологические реакции (Рисунок 1).
Продолжительное время мозг человека рассматривали как статическую, не изменяющуюся структуру, однако, современные нейробиологические исследования показали, что это чрезвычайно динамичная система, способная к морфологическим изменениям на разных уровнях. При стрессе и депрессии отмечаются выраженные ультраструктурные и макроморфологические повреждения нервной ткани, которые частично обратимы. Этот феномен — нейродегенерации и последующей частичной репарации нервной ткани, получил название нейрональной пластичности (нейропластичности). При стрессе и депрессии наблюдаются такие проявления нейрональной пластичности, как нарушения структуры и функции дендритов: их укорочение, уменьшение числа шипиков и синаптических контактов, а также гибель нервных и глиальных клеток. Основной причиной повреждения и гибели клеток мозга при стрессе считают избыток гормонов стресса, прежде всего кортизола. Восстановление функций связано с реорганизацией и образованием новых синапсов, удлинением и разрастанием дендритов и аксонов, а также с нейрогенезом, т. е. образованием новых нервных элементов из стволовых клеток.
Конструкция «когнитивного резерва» мозга H. sapiens указывает на устойчивость к нейропатологическим повреждениям и может быть определена как способность оптимизировать или максимизировать производительность за счет эффективного набора нейронных сетей и/или альтернативных когнитивных стратегий [3].
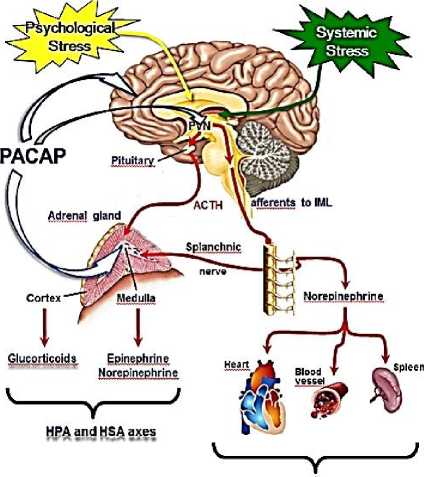
Sympathetic nervous system
Рисунок 1. Системный и психологический стресс.
Нейропластичность — это внутреннее свойство и перепрограммирование мозга на протяжении всей его жизнедеятельности [3].
Три области головного мозга наиболее подвержены патологическим изменениям при стрессе – гиппокамп, префронтальная часть коры головного мозга и мозжечковая миндалина. Эти области отвечают за интерпретацию стрессовых переживаний и соответствующую ответную реакцию. Гиппокамп — наиболее стресс-чувствительная область мозга вследствие того, что в ней находится большое количество рецепторов к глюкокортикоидам (Рисунок 2).
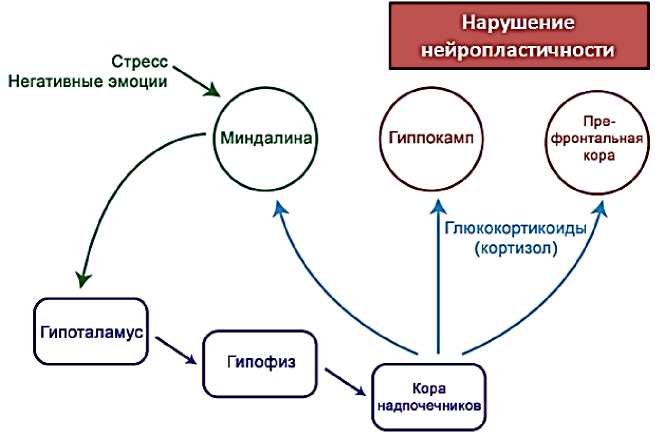
Рисунок 2. Перепрограммирование гипоталамо–гипофизарно–надпочечниковой оси при воздействии стресса.
Новая управляемая здоровая биомикробиота и персонализированное функциональное и сбалансированное питание «мозга и микробиоты» — это долговременная медицинская программа пациента, которая позволяет комбинированному применению питательной эпигенетики и фармэпигенетики, а главное проведению профилактики полипрагмазии. Мультимодальные инструменты, биочипирование, нейронные и мозговые чипы, технологии секвенирования следующего (нового) поколения создают биомаркеры для управления структурой здоровой биомикробиоты и функционального питания, в зависимости от достигаемых целевых показателей [1].
Внедрение результатов авторских исследований позволяет восстановить функционирование циркадианной системы человека, нормализовать уровень и концентрацию мелатонина в организме, осуществлять регуляцию процессов сна и бодрствования, управлять нейропластичностью, проводить профилактику когнитивных нарушений, активировать собственные циркадианные ритмы и их синхронизацию с окружающей средой, через использование мультимодальной схемы повышения циркадного уровня гормона мелатонина в крови человека: циркадианные очки, функциональное питание и физическая активность [4].
В исследованиях Романчук П. И. [1], установлены современные инструменты и методики эпигенетической, диетической и биомикробиотической защиты здорового старения — это междисциплинарные, межвузовские и межведомственные направления, которые фокусируются на изучении нервной системы и влияния мозга на поведение и мыслительную способность людей. В исследовании [1], сделаны следующие прогнозы:
–продолжительность жизни человека в значительной степени определяется эпигенетически;
–эпигенетическая информация — обратима, наши исследования дают возможность терапевтического вмешательства при здоровом старении и связанных с возрастом заболеваниях;
–микробиологическая память будет оставаться стабильной, когда рацион функционального (здорового) диетического питания и здоровая биомикробиота остаются почти неизменными;
–искусственный интеллект, нейросети «мозг–микробиота» позволяют управлять взаимодействием генетических и эпигенетических программ старения и здорового долголетия;
–новая управляемая здоровая биомикробиота и персонализированное функциональное и сбалансированное питание «мозга и микробиоты» — это долговременные медицинские программы пациента, которые позволяет проведению профилактики полипрагмазии;
–мультимодальные инструменты, биочипирование, нейронные и мозговые чипы, технологии секвенирования следующего (нового) поколения создают биомаркеры для управления структурой здоровой биомикробиоты и функционального питания, в зависимости от целевых показателей;
–функциональный продукт питания с помощью биомаркеров и технологий искусственного интеллекта является целевой питательной средой как для организма в целом, так и для биомикробиоты в частности;
–хрономедицинские технологии — это математические модели и искусственный интеллект, которые предсказывают биологический возраст человека с помощью данных метилирования ДНК, модификации гистонов, ремоделирование нуклеосом и микроРНК, и являются наиболее точными биомаркерами процесса старения;
–факторы образа жизни и воздействия окружающей среды оставляют эпигенетические следы на нашей ДНК, которые влияют на экспрессию генов, некоторые из них оказывают защитное действие, а другие — вредное;
–генетические и эпигенетические факторы: обеспечивающие здоровое старение, долголетие и сверхдолголетие, требуют от человека разумного нового взаимодействия с природой и обществом, и ответственности за будущие здоровые поколения.
Мультидисциплинарное и мультимодальное взаимодействие в триаде «мозг–глаза– сосуды» позволяет выявить ранние биомаркеры как общего ускоренного и патологического старения, так и своевременно диагностировать нейродегенерацию, и провести эффективную нейрореабилитацию когнитивных нарушений [5].
Биоэлектромагнитические характеристики светового воздействия на зрительный анализатор, является самым сильным синхронизирующим сигналом для циркадианной системы и оптимальной работы мозга H. sapiens [5].
Более глубокое знание многих взаимодействий между глазом, мозгом и сердечно– сосудистой системой являются ключевыми для эффективной профилактики и нейрореабилитация когнитивных нарушений.
Комбинированные и гибридные методы нейровизуализации в содружестве с технологиями искусственного интеллекта и циркадианные очки в комбинированной схеме светотерапии являются современными инструментами профилактики когнитивных нарушений и здорового старения мозга H. sapiens .
Микробиологическая память будет оставаться стабильной, когда рацион функционального (здорового) диетического питания и здоровая биомикробиота остаются почти неизменными [1–2].
Генетический и эпигенетический вклад в старение и долголетие человека огромен. В то время как факторы окружающей среды и образа жизни важны в более молодом возрасте, вклад генетики проявляется более доминантно в достижении долголетия и здоровой старости. Эпигеномные изменения во время старения глубоко влияют на клеточную функцию и стрессоустойчивость. Дисрегуляция транскрипционных и хроматиновых сетей, вероятно, является важнейшим компонентом старения. В ближайшем будущем искусственный интеллект и крупномасштабная биоинформационная система анализа сможет выявить вовлеченность многочисленных сетей взаимодействия [1–2].
Разработан и внедрен комбинированный и гибридный кластер в диагностике, лечении, профилактике и реабилитации когнитивных нарушений и когнитивных расстройств [3].
Дальнейшее исследование полимодальности нейросетей с нейрофизиологическими и нейроэндокринными механизмами в нейробиологических и хрономедицинских процессах функционирования «когнитивного» и «висцерального» мозга, позволит сохранить достаточную нейропластичность и повысить когнитивный резерв головного мозга [3].
В настоящее время активно используются нейросети, не только для современной диагностики и профилактики заболеваний в гериатрии, психиатрии и неврологии, а главное — их применение с новыми методами нейромодуляции в комбинированной терапии (медикаментозные, нефармакологические и др.) в клинической гериатрии [6].
Нейрокогнитивные действия половых гормонов осуществляется во взаимодействии нейросетей с когнитивным и висцеральным мозгом, для нейросетевого контроля и многофункционального управления, включая баланс между их уровнями, а также возраст и пол человека. Нейрональное действие половых гормонов представляет собой один из четко определенных патогенетических факторов болезни Альцгеймера и может представлять собой надежду понять нейробиологию и нейробиофизику половой и возрастной зависимости вариабельности в предрасположенности к нейродегенеративным заболеваниям. Болезнь Альцгеймера — это гетерогенное расстройство с множеством вариантов и широким разнообразием проявлений, которое возникает в результате взаимодействия множества этиологических факторов, включая генетические, эпигенетические, экологические и жизненные факторы. Влияния эстрогена, прогестерона и андрогена важные «строительные камни» в патогенезе болезни Альцгеймера, и их влияние в результатах модуляции и развития мозга в различной подверженности пола к заболеванию. Эти половые гормоны, будь то гонадные или нейростероиды, играют важную нейропротекторную роль, влияя на уязвимость человека к развитию болезни Альцгеймера, скорости конверсии умеренных когнитивных нарушений и скорости прогрессирования данной нейродегенерации. Гормональная заместительная терапия в профилактике и лечении болезни Альцгеймера, представляет собой сложный и обнадеживающий способ построения стратегии развития персонализированного, нейрокогнитивного управления нервной и эндокринной системами H. sapiens [6].
Современная геронтология и клиническая гериатрия (важным составляющим, именно практического здравоохранения) определила приоритетные области (взаимосвязь нейросетей с нейроэндокринологическими методами нейромодуляции когнитивного и висцерального мозга), которые заслуживают дальнейшего изучения в диагностике, лечении и профилактике нейродегенеративных заболеваний, в первую очередь болезни Альцгеймера:
–степень, в которой половые различия в риске болезни Альцгеймера обусловлены различиями в продолжительности жизни и хронических заболеваний;
–влияние факторов, которые влияют только на один пол, таких как беременность и менопауза;
–влияние эстрогенов и гормонотерапии на функцию мозга и риск развития болезни Альцгеймера;
–различия между женщинами и мужчинами в генетических факторах риска болезни Альцгеймера, таких как апоЕ4;
–влияние факторов, влияющих на оба пола, таких как сердечно–сосудистые заболевания, диабет и депрессия;
–половые различия в прогрессировании болезни Альцгеймера, включая изменения когнитивных функций и биологических маркеров болезни Альцгеймера;
–половые различия в развитии мозга и старении мозга;
–половые различия факторов риска и прогрессирования заболевания в расовых и этнических подгруппах;
–гендерные различия в бремени ухода и его влияние на риск развития болезни Альцгеймера для лица, осуществляющего уход;
–половые различия в реакции на текущую терапию Альцгеймера и в клиническом развитии;
–половые различия в выявлении, диагностике и лечении болезни Альцгеймера.
Особенностью лимбической системы является то, что между ее структурами имеются простые двусторонние связи и сложные пути, образующие множество замкнутых кругов. Такая организация создает условия для длительного циркулирования одного и того же возбуждения в системе и тем самым для сохранения в ней единого состояния и доминирование этого состояния над другими системами мозга. Лимбическая система организует и обеспечивает протекание вегетативных, соматических и психических процессов при эмоционально-мотивационной деятельности. А также осуществляет восприятие и хранение эмоционально значимой информации, выбор и реализацию адаптивных форм
эмоционального поведения. В связи с этим лимбическая система носит название «висцерального мозга».
Главной медицинской и социальной значимостью висцерального мозга является формирование эмоций. Висцеральный мозг участвует в регуляции функций внутренних органов, обоняния, автоматической регуляции, эмоций, памяти, сна, бодрствования и др. Висцеральный мозг определяет выбор и реализацию адаптационных форм поведения, динамику врожденных форм поведения, поддержание гомеостаза, генеративных процессов. Он обеспечивает гормональную стимуляцию организма, создание эмоционального фона, формирование и реализацию процессов высшей нервной деятельности.
Когнитивная память — одно из самых больших и емких понятий, которое представляет основную функцию памяти вообще. Знания, которые человек получает при обучении, сначала воспринимаются как нечто внешнее, но затем постепенно они превращаются в опыт и убеждения. Когнитивная память сохраняет в себе все полученные знания, представляя собой своего рода «библиотеку», причем процесс усваивания и сохранения усложняется по мере усложнения получаемой информации.
Механизм памяти головного мозга представляет собой сеть циклических нейронных цепей (ЦНЦ), охватывающую весь мозг. Команда на активацию отдельных ЦНЦ исходит из гиппокампов, где содержатся адреса всех ЦНЦ [7]. Для выключения из активированного состояния гиппокамп дает соответствующую команду в ЦНЦ. Это приводит к выбросу ГАМК в синаптическую щель и подавлению активности ЦНЦ. При дефиците ГАМК в головном мозге многие ЦНЦ выключаются из механизма памяти, что вызывает когнитивную дисфункцию, часто проявляющуюся в виде симптомов болезни Альцгеймера и сенильной деменции альцгеймеровского типа [7].
Повреждение гиппокампа у человека нарушает память на события, близкие к моменту повреждения (ретро–антероградная амнезия). Нарушаются продуктивность запоминания, обработка новой информации, различение пространственных сигналов. Повреждение гиппокампа ведет к снижению эмоциональности, инициативности, замедлению скорости протекания основных нервных процессов, повышаются пороги вызова эмоциональных реакций.
Миндалина — подкорковая структура лимбической системы, расположенная в глубине височной доли мозга. Нейроны миндалины разнообразны по форме, функциям и нейрохимической природе. Функции миндалины связаны с обеспечением оборонительного поведения, вегетативными, двигательными, эмоциональными реакциями, мотивацией условно рефлекторного поведения.
Лимбическая система организует и обеспечивает протекание вегетативных, соматических и психических процессов при эмоционально-мотивационной деятельности. А также осуществляет восприятие и хранение эмоционально значимой информации, выбор и реализацию адаптивных форм эмоционального поведения. В связи с этим лимбическая система носит название «висцерального мозга».
Наиболее многофункциональными образованиями лимбической системы являются гиппокамп и миндалевидные тела. Лимбическая система (синоним: лимбический комплекс, висцеральный мозг, ринэнцефалон, тимэнцефалон) — комплекс структур среднего, промежуточного и конечного мозга, участвующих в организации висцеральных, мотивационных и эмоциональных реакций организма.
Основную часть структур лимбической системы составляют образования головного мозга, относящиеся к древней, старой и новой коре, расположенные преимущественно на
медиальной поверхности полушарий большого мозга, а также многочисленные подкорковые структуры, тесно с ними связанные.
Нужно отметить, что древняя и старая кора лимбической системы имеет прямое отношение к обонятельной функции. В свою очередь обонятельный анализатор, как самый древний из анализаторов, является неспецифическим активатором всех видов деятельности коры большого мозга.
Некоторые авторы называют лимбическую систему висцеральным мозгом, т. е. структурой ЦНС, участвующей в регуляции деятельности внутренних органов. И действительно, миндалевидные тела, прозрачная перегородка, обонятельный мозг при их возбуждении изменяют активность вегетативных систем организма в соответствии с условиями окружающей среды. Это стало возможно благодаря установлению морфологических и функциональных связей с более молодыми образованиями мозга, обеспечивающими взаимодействие экстероцептивных, интероцептивных систем и коры височной доли.
Хронический дистресс и ассоциированная с ним депрессия служат первопричиной нарушений нейропластичности/нейрогенеза и развития нейродегенеративных изменений в структурах лимбической системы.
Роль висцерального мозга в гормональной стимуляции организма. Лимбическая система обладает уникальным набором эффекторных структур. В них входят управление моторикой внутренних органов, двигательная активность для выражения эмоций и гормональная стимуляция организма (Рисунок 3). Чем ниже уровень развития неокортекса (коры больших полушарий), тем больше поведение животного зависит от лимбической системы.
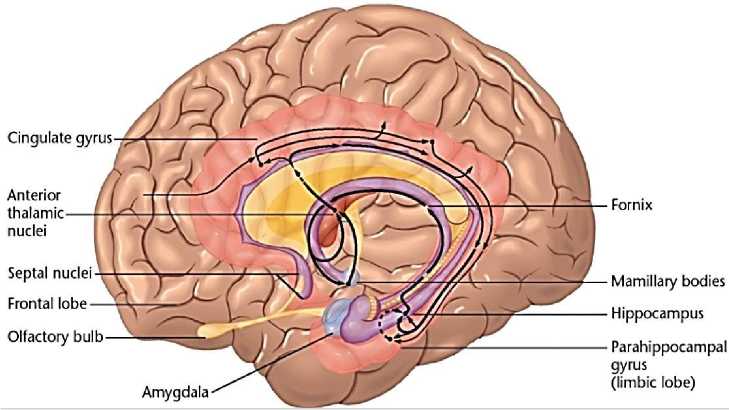
Рисунок 3. Висцеральный мозг.
Связь хронического дистресса/депрессии и снижения синтеза факторов роста опосредуется, повышением при стрессе уровня основного стресс-гормона кортизола, запускающим целый каскад нейрогуморальных изменений, что в итоге приводит к нарушениям в системе факторов роста центральной нервной системы. В развитии метаболических и нейроэндокринных нарушений принимают участи также противовоспалительные цитокины (интерлейкин 1 и 6, фактор некроза опухолей и пр.), повышение секреции которых снижает нейротрофическую поддержку клеток и способствует их апоптозу (Рисунок 4).
При стрессовой реакции происходит усиление глутаматной нейротрансмиссии (избыточный выброс глутамата и возбуждающих нейропептидов), что приводит к преждевременному апоптозу нейронов. Важную роль играет и генетическая предрасположенность («стресс–уязвимость»).
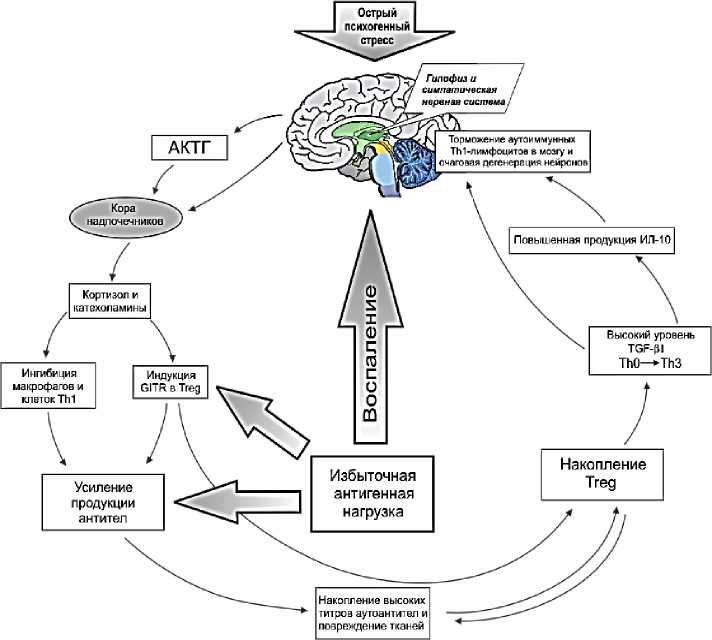
Рисунок 4. Образование порочного круга при гиперактивации гипоталамо–гипофизарно– надпочечниковой оси.
Мобилизация гормонов стресса и супрессорная активность регуляторных Т-клеток (Treg) — хорошо сбалансированы и в норме обеспечивают оптимальное равновесие между про- и противовоспалительными механизмами. В ряде случаев гиперактивация гипоталамо-гипофизарно-надпочечниковой (ГГН) оси может стать причиной ее последующего истощения, что в конечном итоге приводит к накоплению Treg, остающихся единственным инструментом, с помощью которого организм способен ограничивать реакцию воспаления. Избыточное накопление этих клеток можно рассматривать как своеобразную компенсаторную реакцию на истощение гормональных механизмов защиты (Рисунок 5).
Порочный круг замыкается в виде двух петель, одна из которых более длинная (сопровождается избыточным образованием Treg), другая — более короткая (связана с гиперпродукцией цитокинов воспаления: TGF-, ФНО-α и ИЛ-6), которые в высоких концентрациях способны преодолевать гематоэнцефалический барьер [8].
Существует множество механизмов, посредством которых микробиота кишечника может подавать сигналы мозгу для управления физиологическими процессами. Они включают высвобождение пептидов кишечника энтероэндокринными клетками, где они активируют родственные рецепторы иммунной системы и на блуждающих терминалях в кишечнике. Пептиды кишечника как нейропептид Y могут также быть секретированы цитокинами под иммунным стимулированием. Изменения в микробиоте кишечника и пептидах кишечника могут играть ключевую сигнальную роль в психиатрии (Рисунок 6) [8].
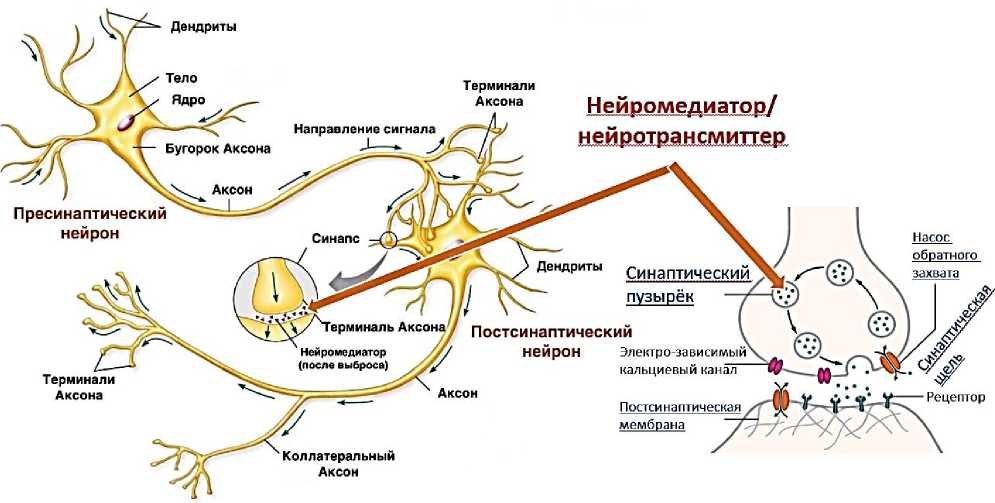
Рисунок 5. Нейрофизиология депрессии.
Современная когнитивная психология — это четкая система когнитивных операций. Нарушения психики можно объяснить неверно выстроенным самосознанием. Если психика человека нарушена, то он не сможет адекватно оценить не только окружающий мир, людей вокруг, но и самого себя. Основным методом когнитивной психологии является анализ микроструктуры того или иного психологического процесса. Когнитивно-поведенческая психология – это одно из основных направлений когнитивной психологии. Главная задача обучить человека адаптивному, адекватному поведению, закрепить его навыки, разрешив, тем самым, его проблемы. Междисциплинарная когнитивная социальная психология устанавливает, как личность воспринимает правила окружающей действительности.
В исследовании, показано [9], что размер и сложность человеческого мозга наделяют наш вид огромным энергетическим диапазоном и поведенческой гибкостью, предоставляя нам самую большую экологическую нишу среди всех млекопитающих. Концептуализируя аллостаз и интероцепцию как единые процессы в прогнозирующем мозге, единая теория вычислительно воспроизводит многие из «психических» симптомов аффективного дистресса, руминации и усталости в метаболических терминах. Теория предполагает, что более глубокое понимание роли метаболизма в управлении базовым восприятием и действием обеспечит более богатую и мощную основу для изучения основных депрессивных заболеваний. С этой точки зрения депрессия — это внутренняя модель, связанная с дистрессом, умственным отстранением от мира, а иногда и буквальным физическим отстранением от мира. Лечение депрессии, таким образом, потребует предоставления мозгу ресурсов для изменения его внутренней модели тела в мире и восстановления его энергетической регуляции [9].
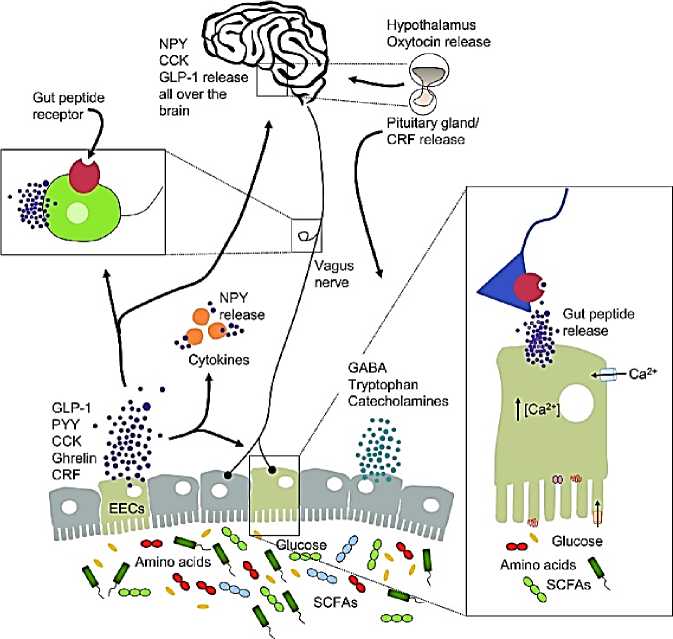
Рисунок 6. Основные коммуникационные пути оси микробиота–кишечник–мозг (Enteroendocrine cells (EECs), neuropeptide Y (NPY), cholecystokinin (CCK), glucagon-like peptide (GLP-1), corticotropin-releasing factor (CRF), peptide YY (PYY), γ-aminobutyric acid (GABA), short-chain fatty acid (SCFA)) [8].
Современная нейрофизиология депрессии — это дефицит нейротрансмиттеров (нейромедиаторов): серотонина, дофамина и норадреналина (Рисунок 5).
Дефицит всех моноаминов в комплексе говорит о подавленном настроении, психомоторной дисфункции и нарушении сна [10].
На Рисунке 7 показаны отделы головного мозга, где нарушения функции представленных моноаминов приводит к развитию депрессивной симптоматики [10].
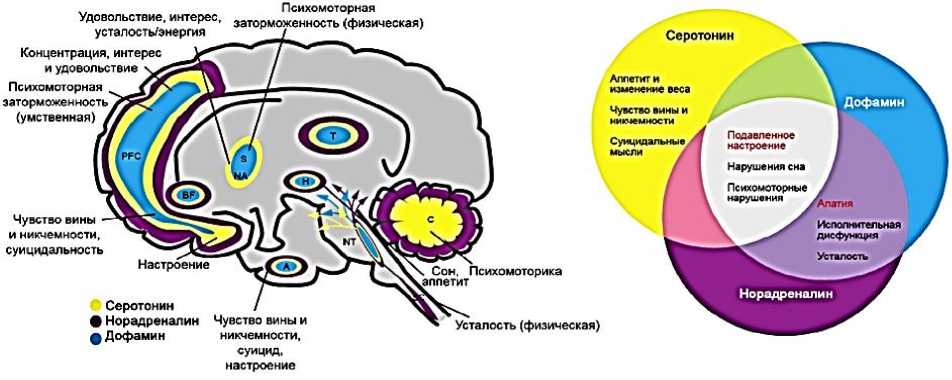
Рисунок 7. Роль нейротрансмиттеров (нейромедиаторов) серотонина, дофамина и норадреналина в развитии депрессии [10].
Нейромедиаторные и нейроэндокринные маркеры [11], изучены в течение многих десятилетий, недавние исследования подчеркивают воспалительную реакцию (и иммунную систему в целом), метаболические и ростовые факторы, которые играют важную роль в депрессии. Однако, существует ряд проблем, которые необходимо решить до того, как можно будет применить исследование биомаркеров для улучшения ведения и ухода за людьми с депрессией. Оптимизация измерения как нейробиологических параметров, так и клинических показателей депрессии, вероятно, будет способствовать более глубокому пониманию проблемы. Биомаркеры участвующие в воспалительных, нейротрофических и метаболических процессах, а также нейромедиаторные и нейроэндокринные компоненты системы, являются перспективными исследованиями. Они могут быть измерены с помощью генетических и эпигенетических, транскриптомных и протеомных, метаболических и нейровизуализационных оценок [11].
При депрессивном расстройстве измененная экспрессия генов в коре головного мозга и лейкоцитах крови обусловлена аберрантной экспрессией генов, кодирующих эпигенетические механизмы. Аберрантная активация эпигенетических репрессивных систем вовлечена в патогенез, как в мозговой ткани, так и в лейкоцитах крови [12].
Все больше данных подтверждают гипотезу о том, что эпигенетика является ключевым механизмом, посредством которого воздействие окружающей среды взаимодействует с генетической конституцией индивида для определения риска депрессии на протяжении всей жизни. Эпигенетика, в самом широком ее значении, относится к стабильным изменениям в экспрессии генов, которые опосредованы через измененную структуру хроматина без изменения последовательности ДНК. Согласно этой гипотезе, сильный стресс вызывает изменения — у уязвимых людей — в структуре хроматина в определенных геномных локусах в лимбических областях мозга, которые вызывают устойчивые изменения в экспрессии генов, которые способствуют эпизодам депрессии. Следствием этой гипотезы является то, что такие вызванные стрессом эпигенетические модификации также происходят в раннем возрасте и помогают определить пожизненную уязвимость или устойчивость индивида к последующим стрессовым событиям [13].
Исследовано [13], два дополнительных способа, с помощью которых эпигенетические механизмы могут влиять на депрессию. Первый, связан со стохастическими событиями в процессе развития. Второй, касается истинного эпигенетического наследования в нескольких поколениях (Рисунок 8).
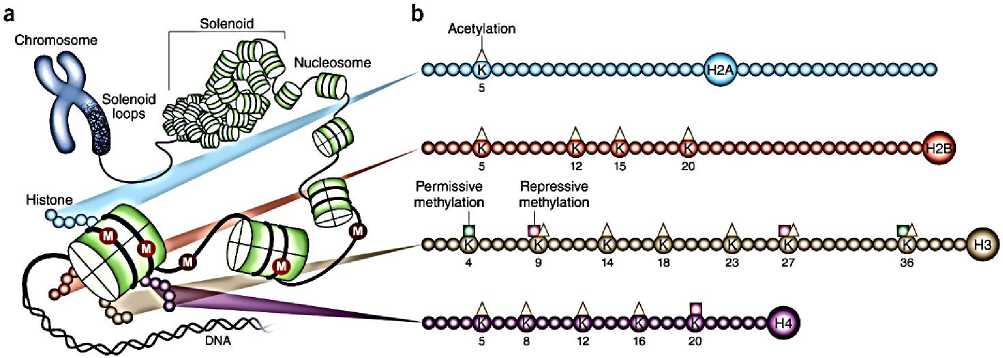
Рисунок 8. Структура хроматина и модификации гистона на N-концевых хвостах гистона [13].
-
А, геном эукариот организован путем оборачивать ДНК вокруг октамеров гистона для того чтобы сформировать основные блоки хроматина, нуклеосомы, которые после этого более добавочно организованы и компактированы в структуры более высокого порядка.
-
B, октамер гистона состоит из 2 копий каждого из H2A, H2B, H3 и H4.
В дополнение к шаровидным доменам, у каждого из них есть хвосты N-Термини, которые выступают из нуклеосомы, в то время как H2A также имеет c-концевой хвост. Эти хвосты могут быть посттрансляционно модифицированы, и выделены основные формы модификаций ацетилирования и метилирования остатков лизина у млекопитающих на каждом хвосте. Молекулы рисуются примерно пропорционально размеру белка, хотя количество показанных остатков не должно отражать точный размер N-концевых хвостов.
Расстояние между нуклеосомами определяется чрезвычайно сложными процессами, которые включают посттрансляционную модификацию гистонов (рисунок 10) и ДНК и рекрутирование большого количества регуляторных белков хроматина, взаимодействующих с этими модификациями [13].
Точная генетическая и эпигенетическая пространственно-временная регуляция экспрессии генов имеет решающее значение для правильного развития мозга, его функционирования и формирования микросхем в центральной нервной системе млекопитающих. Процессы нейрональной дифференцировки жестко регулируются эпигенетическими механизмами, включая метилирование ДНК, модификации гистонов, ремоделеры хроматина и некодирующие РНК. Нарушение регуляции любого из этих путей пагубно сказывается на нормальном развитии и функциях нейронов, что может привести к разрушительным нервно-психическим расстройствам, таким как депрессия, шизофрения и расстройства аутистического спектра [14].
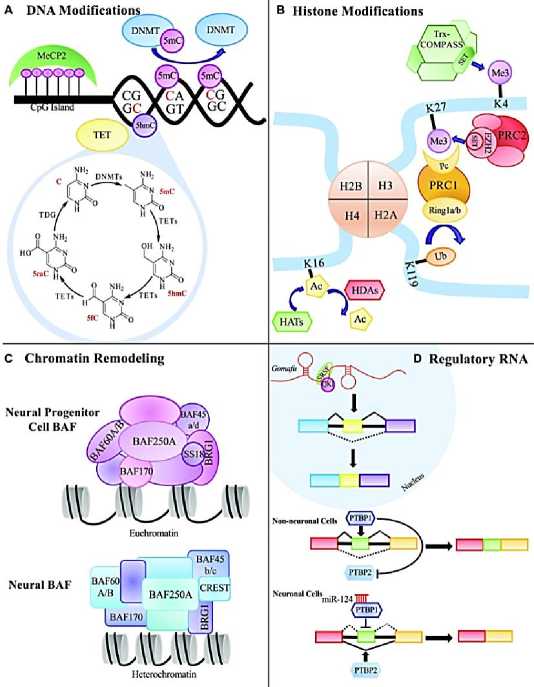
Рисунок 9. Генетическая и эпигенетическая пространственно-временная регуляция экспрессии генов [14].
Существует несколько основных эпигенетических механизмов, которые широко изучаются, включая модификации ДНК, модификации гистонов, ремоделирование хромосом и регуляцию РНК с помощью некодирующих РНК, таких как микроРНК (миРНК) и длинные некодирующие РНК (lncRNA) (Рисунок 9) [14].
В свою очередь, стрессовые переживания приводят к изменению секреции и моторики желудочно-кишечного тракта. В настоящее время продолжаются исследования о клинической значимости двунаправленной связи наряду с модификацией состава микробиоты кишечника. Двунаправленная кишечно-мозговая связь может начинаться как сенсорная информация из желудочно-кишечного тракта, и, следовательно, трансформируется в нейронные, гормональные и иммунологические сигналы.
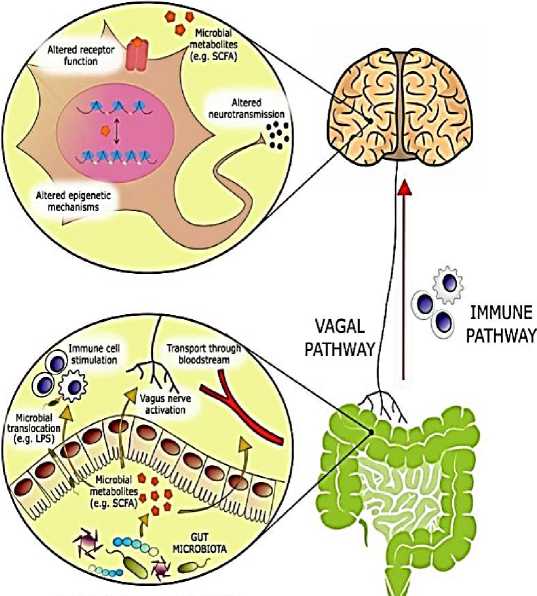
Кишечный микробиом играет решающую роль в нормальном развитии головного мозга, а также модуляции физиологических систем хозяина, важных при стрессовых расстройствах. Среди разнообразных путей, по которым кишечник может сигнализировать мозгу, эндокринная система, по-видимому, играет важную роль, поскольку она способна модулировать не только другие эндокринные функции, но и нервную и иммунную системы (Рисунок 10). Пептиды управляют молекулярными, функциональными, поведенческими и автономными реакциями, которые происходят в ответ на изменения микробного сообщества кишечника. Структурно–функциональные нейрокоммуникации пептидов влияют на психическое здоровье человека [15].
BIOCHEMICAL PATHWAY V
Рисунок 10. Биологически активные молекулы, происходящие из микробного метаболизма, модулируют эмоциональное поведение через несколько механизмов [15].
Желудочно–кишечный тракт и его центральная функция неразрывно связаны с кишечной микробиотой — экосистемой, которая развивалась совместно с хозяином для расширения своих биотрансформационных возможностей и взаимодействия с физиологическими процессами хозяина посредством продуктов его метаболизма. Аномалии в микробиоте–кишечно–мозговой оси появились в качестве ключевого компонента патофизиологии депрессии, что привело к более глубоким исследованиям, направленным на изучение нейроактивного потенциала продуктов микробного метаболизма кишечника. С приблизительно тремя–четырьмя миллионами различных генов в коллективных геномах микробиоты кишечника в микробиоме человека содержится примерно в 100–150 раз больше генетической информации, чем в человеческом геноме [15].
В головном мозге такие метаболиты могут активировать рецепторы на нейронах или глиях, модулировать нейрональную возбудимость и изменять паттерны экспрессии с помощью эпигенетических механизмов.
Помимо патологии ЦНС, у пациентов с депрессией также наблюдаются изменения в метаболической, иммунной и эндокринной системах. Существует все больше доказательств того, что микробиота кишечника ассоциируется с патофизиологией депрессии. В ряде таксономических ассоциативных исследований у людей наблюдались различия в составе фекальной микробиоты больных с психиатрическими заболеваниями по сравнению со здоровыми субъектами [16] и др.
Валлес-Коломер и его коллеги [17] использовали модульный аналитический подход к метагеномам фекалий для связи нейроактивной способности микробиоты с депрессивными симптомами. Это исследование показало положительную ассоциацию между показателями качества жизни и родами фекалибактерий и сопрококков, а также отрицательную ассоциацию между обилием сопрококков spp. и депрессией для контроля эффективности антидепрессантов.
Многочисленными исследованиями установлено, что многие из этих генов кодируют белки, выполняющие метаболические функции и продуцирующие метаболиты исключительно для микробиома. Хозяин сталкивается с этими метаболитами в кишечнике, где они могут оказывать местное воздействие в желудочно–кишечной среде или на стенке кишечника. Кроме того, эти микробные метаболиты могут быть поглощены, войти в системную циркуляцию и достичь отдаленных органов, в том числе головного мозга.
Таким образом, комбинированные и гибридные методы нейровизуализации в содружестве с технологиями искусственного интеллекта, позволяют понять и диагностировать неврологические расстройства и найти новые методы нейрореабилитации и медико-социального сопровождения, которые приведут к улучшению психического здоровья. Для восстановления циркадианной нейропластичности мозга предлагается мультимодальная схема: циркадианные очки, функциональное питание и физическая активность. Разработан и внедрен комбинированный и гибридный кластер в диагностике, лечении, профилактике и реабилитации когнитивных нарушений и когнитивных расстройств.
-
H. sapiens формируя и выполняя цели, может измерить и гордиться своими достижениями. Процесс постановки и достижения целей не только позволяет достичь большего и улучшить производительность, но и дает мозгу H. sapiens сосредоточиться при построении своей уверенности в себе и самооценки. А самооценка — это краеугольный камень для самоактуализации и самореализации личности (самооткрытие, саморазвитие, самообладание, самореализация) (Рисунок 11).
Циркадианный стресс и психические заболевания — являются дальнейшими перспективными исследованиями.
Циркадианный стресс вызывает нарушение сна и нейропсихиатрические расстройства с предполагаемой высокой распространенностью циркадной дисрегуляции.
Исследования, проведенные за последние несколько десятилетий, показали, что в нашем организме развился набор механизмов, называемых циркадными часами, которые внутренне управляют ритмами почти в каждой клетке. На деятельность циркадных часов влияют различные сигналы в клетках. Нарушение нормальных суточных циркадных ритмов связано с большей подверженностью расстройствам настроения, таким как тяжелая депрессия и биполярное расстройство в течение всей жизни. Эти нарушения внутренних часов организма, характеризующиеся повышенной активностью в периоды отдыха и / или бездействия в течение дня, а также связаны с нестабильностью настроения, более субъективным одиночеством, более низким уровнем счастья и удовлетворенности здоровьем, а также ухудшением когнитивных функций.
Рисунок 11. Краеугольный камень самооценки H. sapiens для самоактуализации и самореализации личности (самооткрытие, саморазвитие, самообладание, самореализация).
В исследованиях [5], циркадианные нарушения сна-бодрствования и хроническое циркадное рассогласование, часто наблюдаемые при психиатрических и нейродегенеративных заболеваниях, могут быть эффективными в нейрореабилитации когнитивных нарушений. Биоэлектромагнитизм света и нейронные сети мозга — это, адаптация и оптимизация условий внешнего и внутреннего освещения (тип, характер, длительность) для улучшения работы когнитивного мозга. Мозг H. sapiens работает в 24часовой биоэлектромагнитной среде. Свет является самым сильным синхронизирующим сигналом для циркадной системы, и поэтому сохраняет большинство биологических и психологических ритмов внутренне синхронизированными, что важно для оптимальной работы мозга H. sapiens .
Благотворное влияние на циркадианную синхронизацию, качества сна, настроение и когнитивные показатели — зависят от времени, интенсивности и спектрального состава светового воздействия. Мультидисциплинарное и мультимодальное взаимодействие в триаде «мозг–глаза–сосуды» позволяет выявить ранние биомаркеры как общего ускоренного и патологического старения, так и своевременно диагностировать нейродегенерацию, и провести эффективную нейрореабилитацию когнитивных нарушений. Контроль и лечение сосудистых факторов риска и эндокринных нарушений позволяет снизить распространенность длительной нетрудоспособности населения [5].
Выводы:
-
1. Краеугольный камень самооценки H. sapiens для самоактуализации и самореализации личности — это, самооткрытие, саморазвитие, самообладание, самореализация.
-
2. Нейропластичность — это внутреннее свойство и перепрограммирование мозга на протяжении всей его жизнедеятельности.
-
3. Депрессия — это разрушительный синдром, с аллостатической перегрузкой и транзиторной дизрегуляцией функций неврологического, метаболического и иммунологического статуса, а также перепрограммированием в гипоталамо-гипофизарно-надпочечниковой оси.
-
4. Здоровая биомикробиота и коммуникационные пути оси «микробиота-кишечник-мозг» играют решающую роль в нормальном развитии головного мозга, своевременном перепрограммировании и модуляции физиологических систем организма, важных при стрессовых расстройствах и профилактике депрессии.
-
5. Хроническая депрессия дестабилизирует работу «когнитивного и висцерального мозга».
-
6. Психонейроиммунологические коммуникации и нейроэндокринологические мультимодальные методы позволяют существенно увеличить продолжительность активной и качественной здоровой жизни человека.
-
7. Биоэлектромагнитизм света и нейронные сети мозга, циркадные нарушения сна-бодрствования и хроническое циркадианное рассогласование, часто наблюдаемые при психиатрических и нейродегенеративных заболеваниях, могут быть эффективными в нейрореабилитации когнитивных нарушений и профилактике депрессии.
Список литературы Мозг, депрессия, эпигенетика: новые данные
- Романчук П. И. Возраст и микробиота: эпигенетическая и диетическая защита, эндотелиальная и сосудистая реабилитация, новая управляемая здоровая биомикробиота // Бюллетень науки и практики. 2020. Т. 6. №2. С. 67-110. DOI: 10.33619/2414-2948/51/07
- Романчук П. И., Волобуев А. Н. Современные инструменты и методики эпигенетической защиты здорового старения и долголетия Homo sapiens // Бюллетень науки и практики. 2020. Т. 6. №1. С. 43-70. DOI: 10.33619/2414-2948/50/06
- Романчук Н. П., Романчук П. И. Нейрофизиология и нейрореабилитация когнитивных нарушений и расстройств // Бюллетень науки и практики. 2019. Т. 5. №11. С. 176-196. DOI: 10.33619/2414-2948/48/19
- Романчук Н. П., Пятин В. Ф. Мелатонин: нейрофизиологические и нейроэндокринные аспекты // Бюллетень науки и практики. 2019. Т. 5. №7. С. 71-85. DOI: 10.33619/2414-2948/44/08
- Пятин В. Ф., Романчук Н. П., Романчук П. И., Волобуев А. Н. Мозг, глаза, свет: биоэлектромагнитизм света и нейрореабилитация когнитивных нарушений // Бюллетень науки и практики. 2019. Т. 5. №12. С. 129-155. DOI: 10.33619/2414-2948/49/14
- Волобуев А. Н., Романчук П. И., Булгакова С. В. Нейросеть "мозг-микробиота": регуляция "висцерального" мозга и накопление когнитивной памяти // Бюллетень науки и практики. 2019. Т. 5. №2. С. 33-52.
- DOI: 10.33619/2414-2948/39/05
- Волобуев А. Н., Пятин В. Ф., Романчук Н. П., Булгакова С. В. Давыдкин И. Л. Когнитивная дисфункция при перевозбуждении структур головного мозга // Врач. 2018. T. 29. №9. С. 17-20.
- DOI: 10.29296/25877305-2018-09-04
- Nagpal R. et al. Gut microbiome and aging: Physiological and mechanistic insights // Nutrition and healthy aging. 2018. V. 4. №4. P. 267-285.
- DOI: 10.3233/NHA-170030
- Barrett L. F., Quigley K. S., Hamilton P. An active inference theory of allostasis and interoception in depression // Philosophical Transactions of the Royal Society B: Biological Sciences. 2016. V. 371. №1708. P. 20160011.
- DOI: 10.1098/rstb.2016.0011
- Saltiel P. F., Silvershein D. I. Major depressive disorder: mechanism-based prescribing for personalized medicine // Neuropsychiatric disease and treatment. 2015. V. 11. P. 875.
- DOI: 10.2147/NDT.S73261
- Strawbridge R., Young A. H., Cleare A. J. Biomarkers for depression: recent insights, current challenges and future prospects // Neuropsychiatric disease and treatment. 2017.
- DOI: 10.2147/NDT.S114542
- Rey R., Chauvet-Gelinier J. C., Suaud-Chagny M. F., Ragot S., Bonin B., d'Amato T., Teyssier J. R. Distinct expression pattern of epigenetic machinery genes in blood leucocytes and brain cortex of depressive patients // Molecular neurobiology. 2019. V. 56. №7. P. 4697-4707.
- DOI: 10.1007/s12035-018-1406-0
- Nestler E. J. Epigenetic mechanisms of depression // JAMA psychiatry. 2014. V. 71. №4. P. 454-456.
- DOI: 10.1001/jamapsychiatry.2013.4291
- Kuehner J. N., Bruggeman E. C., Wen Z., Yao B. Epigenetic regulations in neuropsychiatric disorders // Frontiers in genetics. 2019. V. 10. P. 268-268.
- DOI: 10.3389/fgene.2019.00268
- Caspani G., Kennedy S., Foster J. A., Swann J. Gut microbial metabolites in depression: understanding the biochemical mechanisms // Microbial Cell. 2019. V. 6. №10. P. 454.
- DOI: 10.15698/mic2019.10.693
- Chung Y. C. E., Chen H. C., Chou H. C. L., Chen I. M., Lee M. S., Chuang L. C., Huang M. C. et al. Exploration of microbiota targets for major depressive disorder and mood related traits // Journal of psychiatric research. 2019. V. 111. P. 74-82.
- DOI: 10.1016/j.jpsychires.2019.01.016
- Valles-Colomer M., Falony G., Darzi Y., Tigchelaar E. F., Wang J., Tito R. Y., Claes S. et al. The neuroactive potential of the human gut microbiota in quality of life and depression // Nature microbiology. 2019. V. 4. №4. P. 623-632.
- DOI: 10.1038/s41564-018-0337-x


