МРТ в диагностике рецидивов рака шейки матки после радикальной абдоминальной трахелэктомии
Автор: Рубцова Н.А., Новикова Е.Г., Антипов В.А., Новикова О.В., Пузаков К.Б.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 (47), 2011 года.
Бесплатный доступ
Исследование демонстрирует роль магнитно-резонансной томографии в принятии клинического решения при дина- мическом наблюдении за больными раком шейки матки после выполнения радикальной абдоминальной трахелэктомии. На основании результатов послеоперационного обследования 69 пациенток изучена частота и особенности развития рецидивов рака шейки матки после органосохраняющего лечения. Представлен анализ возможностей МРТ в выявлении рецидивов рака шейки матки после радикальной абдоминальной трахелэктомии в сопоставлении с результатами ультра- звукового исследования.
Мрт, рак шейки матки, радикальная абдоминальная трахелэктомия
Короткий адрес: https://sciup.org/14055945
IDR: 14055945 | УДК: 618.146-006.6-089-036.65]-073.756.8
Текст научной статьи МРТ в диагностике рецидивов рака шейки матки после радикальной абдоминальной трахелэктомии
Рак шейки матки (РШМ) остается одной из наиболее распространенных злокачественных опухолей у женщин, занимая 7-е место (9,8 %) в структуре женской онкологической заболеваемости и 3-е место среди новообразований органов репродуктивной системы после рака молочной железы и эндометрия [1, 11, 22]. Результаты многочисленных мировых статистических исследований свидетельствуют о неуклонном увеличении частоты выявления РШМ у молодых женщин в возрасте до 40 лет, что обусловливает актуальность разработки методов лечения с сохранением фертильности [14, 18, 28].
В России цервикальные неоплазии составляют 5,5 % от всех злокачественных опухолей у женщин, занимая 6-е ранговое место. Пик заболеваемости приходится на возраст старше 50 лет, однако у каждой пятой пациентки (21,3 %) опухоль выявляется в возрасте до 40 лет. За последние 10 лет прирост заболеваемости РШМ в возрастной группе до 40 лет составил 64,2 %, что определяет необходимость проведения собственных исследований, внедрения уже известных и разработки новых подходов к лечению РШМ с сохранением фертильности [2–5].
Радикальная трахелэктомия представляет собой особый вариант хирургического лечения начального инвазивного РШМ, позволяющий пациенткам сохранить репродуктивную функцию и впоследствии родить ребенка. Суть данного вмешательства заключается в удалении шейки матки с влагалищной манжетой, пара-метрэктомии, тазовой лимфодиссекции с сохранением тела матки, придатков и формировании маточно-влагалищного анастомоза. Впервые радикальную влагалищную трахелэктомию (РВТ) с лапароскопической подвздошно-обтураторной лимфаденэктомией выполнил французский хирург D. Dargent в декабре 1986 г. [9]. В настоящее время в мире наблюдаются более 600 пациенток после вагинальных трахелэктомий, и суммарно частота рецидивов не превышает 5 %, что свидетельствует о высокой онкологической эффективности метода, не уступающей классической радикальной гистерэктомии [12].
Альтернативным вариантом вагинальной трахелэктомии является использование абдоминального доступа. Впервые техника радикальной абдоминальной трахелэктомии (РАТ) была описана коллективом авторов из Великобритании, Венгрии и США в 1997 г. [31]. На сегодняшний день данных в отношении онкологических результатов РАТ в сравнении с РВТ значительно меньше, однако частота рецидивов также не превышает 5 % и сопоставима с радикальной гистерэктомией [8, 23, 32].
Низкая частота рецидивов после радикальной трахелэктомии тем не менее не исключает вероятность их возникновения. Пациентки после органосохраняющего лечения настроены на реализацию репродуктивной функции, а возникновение беременности на фоне развивающегося рецидива недопустимо. В связи с этим особую актуальность приобретает разработка алгоритма динамического контроля пациенток после радикальной трахелэктомии и совершенствование методов ранней диагностики рецидивов, чтобы избежать беременности на фоне прогрессирования опухоли.
Целью исследования являлось определение особенностей развития рецидивов РШМ после РАТ, а также изучение возможностей МРТ в мониторинге пациенток после лечения и диагностике возможных рецидивов.
Материал и методы
В МНИОИ им. П.А. Герцена в период с октября 2005 по июнь 2010 г. 69 пациенткам, в возрасте от 21 до 43 лет (в среднем – 33 года), выполнено хирургическое лечение инвазивного рака шейки матки в объеме РАТ с сохранением репродуктивного потенциала (табл. 1). Крите-
Таблица 1
Основные характеристики заболевания у пациенток, наблюдавшихся после радикальной абдоминальной трахелэктомии
|
Клинико-морфологические признаки |
Количество больных |
|
Cтадия процесса |
IA1 – 18 (26,1 %) IA2 – 15 (21,7 %) IB1 – 33 (47,8 %) IIA – 3 (4,4 %) |
|
Гистотип опухоли |
Плоскоклеточный рак – 55 (79,7 %) Аденокарцинома – 7 (10,1 %) Аденоплоскоклеточный рак – 3 (4,4 %) Светлоклеточная (мезонефральная) аденокарцинома – 4 (5,8 %) |
|
Степень дифференцировки опухоли |
G1 – 21 (30,4 %) G2 – 16 (23,2 %) G3 – 32 (46,4 %) |
|
Вовлечение лимфоваскулярного пространства |
30 (43,5 %) |
|
Глубина инвазии |
Менее 1/3 – 57 (82,6 %) Менее 2/3 – 8 (11,6 %) Более 2/3 – 4 (5,8 %) |
|
Число удаленных лимфоузлов (медиана, min, max) |
17 (6–44) |
|
Положительные лимфоузлы |
2* |
|
Дополнительное лечение |
1** |
Примечание: РЭМ – радикальная экстирпация матки; * – у 2 пациенток при плановой гистологии после РАТ микрометастазы в лимфоузле; ** – больной с аденокарциномой и микрометастазом в лимфоузле проведено 6 курсов адъювантной полихимиотерапии.
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2011. №5 (47)
риями отбора пациенток для выполнения РАТ являлись: стадия заболевания – IA1 с инвазией лимфо-васкулярного пространства, IA2, IB1, IIА; гистологические варианты – плоскоклеточный рак, аденокарцинома, аденоплоскокле-точный рак, светлоклеточная аденокарцинома; максимальный размер опухоли при стадии IB1 менее 3 см; отсутствие распространения опухоли на верхнюю треть цервикального канала по данным УЗИ, МРТ, цервикогистероскопии; отсутствие признаков метастатического поражения лимфатических узлов по данным УЗИ и МРТ; репродуктивный возраст и настойчивое желание пациентки реализовать в последующем репродуктивную функцию. Все пациентки оставались под наблюдением после операции и проходили регулярное обследование в институте, что позволило включить в настоящее исследование 69 больных.
Радикальная абдоминальная трахелэктомия выполнялась по разработанной в институте методике с сохранением восходящих ветвей маточных артерий – модифицированная РАТ (мРАТ) или в традиционном варианте с пересечением маточных сосудов. Объем удаляемых тканей при мРАТ и РАТ не отличался, что позволило объединить пациенток в одну группу для анализа частоты и особенностей развития рецидивов.
Плановое обследование после РАТ проводилось 1 раз в 3 мес в течение первых двух лет, далее 1 раз в 6 мес и включало осмотр, гинекологическое исследование, кольпоскопию, цитологическое исследование (Pap-тест), УЗИ органов брюшной полости, забрюшинного пространства, малого таза, паховых областей. МРТ малого таза проводили 1 раз в 6 мес. При выявлении признаков рецидива заболевания выполнялась пункционная биопсия с последующей морфологической и/или цитологической верификацией.
МР-исследование малого таза проводилось на 1.5Т МР-томографах Signa (GE) и Vantage Titan (Toshiba), с использованием 4-канальных гибких градиентных катушек. Протокол МР-исследования органов таза включал получение Т2 взвешенных избражений (ВИ) в сагиттальной проекции; Т1 и Т2 ВИ в аксиальной проекции; Т2 ВИ с подавлением жира (FatSat) в коронар- ной проекции; Т2 ВИ высокого разрешения в двух взаимно перпендикулярных плоскостях относительно оси влагалищно-маточного анастомоза. При необходимости проводили динамическую МРТ, старт которой совмещался с началом внутривенного введения контраста (Gd-DTPA) из расчета 0,1 ммоль/кг. Данная последовательность имела время насыщения 2 сек и повторялась через 2 сек. Во избежание вмешательства артефактов от перистальтирующих петель кишечника, не позднее 4 ч до исследования, пациентам рекомендовалось исключать или ограничивать прием пищи. В ряде случаев для снижения артефактов были использованы специальные ремни на область живота, ограничивающие амплитуду дыхательных движений передней брюшной стенки.
Для ультразвукового исследования использовали сканер Logic 9 (GE) с конвексными датчиками для трансабдоминальных и трансвагинальных исследований, с диапазоном частот 3–5 МГц и 5–6,5 МГц соответственно. В условиях динамического наблюдения при МРТ и УЗИ оценивалось состояние влагалищно-маточного анастомоза, матки, яичников, соседних органов, клетчатки и лимфатических узлов малого таза.
МР-исследование начинали с получения сагиттальных Т2 ВИ, дающих возможность оценить протяженность цервикального канала культи шейки матки и служащих ориентиром для планирования косых проекций, ось которых задавалась относительно анастомоза между маткой и влагалищем. Состояние парацервикальной и параметральной клетчатки оценивалось на Т2 ВИ, полученных в плоскостях параллельно и перпендикулярно к анастомозу. Для изучения состояния внутритазовых лимфоузлов исследовались все потенциально возможные зоны локорегионарного лимфооттока шейки матки, в частности по ходу подвздошных сосудов и обтураторные области. При выявлении увеличенных лимфатических узлов проводился их количественный и качественный анализ: оценка размеров, в том числе соотношение продольного и поперечного диаметров, и структуры.
Результаты и обсуждение
После завершения хирургического этапа лечения под наблюдением оставались 69 пациенток с сохраненным репродуктивным потен- циалом. При длительности наблюдения от 4 до 60 мес (медиана – 27 мес) у 3 (4,3 %) пациенток диагностированы рецидивы РШМ. Показатель 3-летней безрецидивной выживаемости составил 95 %.
У 2 больных рецидив заболевания был выявлен в течение первого года после операции, опухоль располагалась в зоне влагалищноматочного анастомоза и была диагностирована как при МРТ (рис. 1), так и по данным УЗИ. В одном из этих случаев местный рецидив сочетался с метастатическим поражением левого яичника, что было выявлено при МРТ, тогда как по данным УЗИ структурных изменений яичников не описано. У третьей пациентки опухолевые массы располагались в парацервикальной клетчатке слева, при этом в зоне влагалищноматочного анастомоза признаков опухолевого роста не определялось (рис. 2). Это наблюдение являлось также эхонегативным, рецидив диагностирован по результатам МРТ. Все случаи имели верификацию при послеоперационном гистологическом исследовании.
Рецидивы, локализовавшиеся в зоне влагалищно-маточного анастомоза, трактовались как образования неправильной формы, с нечеткими и бугристыми контурами, неоднородно повышенного МР-сигнала, относительно неизмененного миометрия на Т2 ВИ. В обоих случаях опухоль инфильтрировала окружающую клетчатку и интенсивно накапливала контраст, что проявлялось атипичным повы- шением МР-сигнала на постконтрастных Т1 изображениях. В случае рецидива, расположенного в параметральной клетчатке, опухолевый узел характеризовался неоднородно сниженной интенсивностью как на Т1, так и на Т2 ВИ на фоне неизмененного высокого МР-сигнала от жировой клетчатки и патологической васкуляризацией при динамическом контрастном усилении.
Мы попытались подробно проанализировать все случаи рецидивов рака шейки матки после РАТ. Следует отметить, что у всех больных исходно был плоскоклеточный рак шейки матки.
У пациентки М., 33 лет, через 2 года после лечения была выявлена рецидивная опухоль в параметрии слева. Объяснить причины возникновения рецидива данной локализации весьма трудно, так как при плановом морфологическом исследовании в удаленной парацервикальной клетчатке и лимфоузлах признаков опухолевого роста выявлено не было.
Рассмотрев имевшие место рецидивы и ретроспективно оценив исходные данные МРТ, в одном из трех случаев мы обнаружили предпосылки к неблагоприятному течению заболевания, которые по своей сути могут расцениваться как противопоказания к проведению РАТ. У больной Х., 32 лет, в течение 1 года после РАТ было выявлено синхронное развитие рецидива в области влагалищно-маточного анастомоза и метастазирование в яичник. На предоперационных МРТ отмечались следующие изменения: дефор-
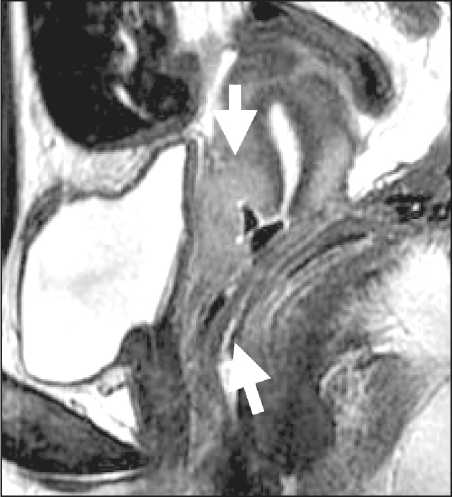
Рис. 1. ЯМР-томограмма Т2 ВИ малого таза в сагиттальной проекции. Стрелками указана рецидивная опухоль в зоне влагалищно-маточного анастомоза
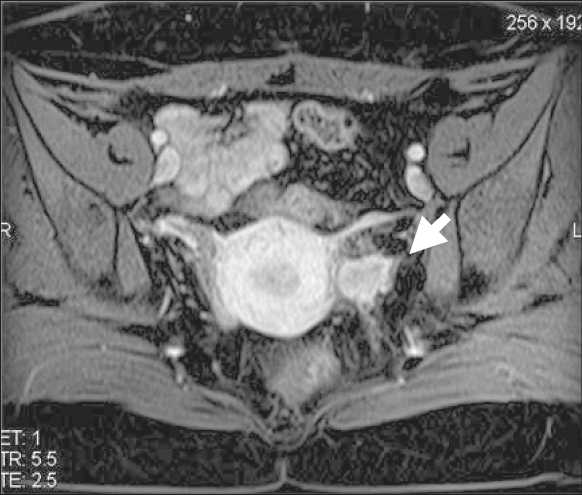
Рис. 2. ЯМР-томограмма Т2 ВИ малого таза в коронарных проекциях. Стрелкой указана рецидивная опухоль, возникшая через 2 года после РАТ
мация наружного зева; линейное циркулярное повышение МР-сигнала, распространяющееся до верхней трети цервикального канала; вокруг изменений эпителиальной выстилки эндоцер-викса выявлялась радиальная сеть расширенных сосудов (рис. 3). Причиной расширения просветов сосудов может быть наличие в них опухолевых микроэмболов. Безусловно, данная гипотеза может иметь место, однако для того, чтобы отнести к неблагоприятным фактором прогноза усиление сосудистой архитектоники вокруг цервикального канала в сочетании с расширением просветов визуализируемых сосудов, на фоне отсутствия убедительных признаков инвазивного роста опухоли, требуется дальнейшее изучение вопроса на большем количестве наблюдений.
Онкологические результаты настоящего исследования можно расценивать как более чем удовлетворительные. Установленная частота рецидивов после РАТ (4,3 %) не превысила соответствующих показателей других клиник (табл. 2), что, с одной стороны, закономерно, поскольку критерии отбора пациенток для органосохраняющего лечения принципиально не отличались. С другой стороны, исследование показало, что изменение техники операции РАТ в виде сохранения маточных артерий не оказало неблагоприятного влияния на безрецидивную выживаемость. Анализ собственных результатов и данных других исследователей позволяет заключить, что рецидивы РШМ после радикальной трахелэктомии имеют ряд особенностей.
Обращают на себя внимание сроки выявления рецидивов после радикальной трахелэкто-мии. В большинстве случаев они наблюдаются в первые 2 года после операции, однако в работах со значительной длительностью наблюдения рецидивы описаны через 6–7 лет после операции. В наблюдениях M.E. Beiner et al. [7] 3 из 5 рецидивов возникли в отдаленные сроки – через 44, 77 и 84 мес после РВТ. В работе P. Marchiole et al. [21] 1 из 7 рецидивов диагностирован спустя 93 мес после операции. Таким образом, нельзя исключить, что в исследованиях с небольшим сроком наблюдения общая частота рецидивов может быть несколько занижена.
В отношении локализации рецидивов по опубликованным на сегодняшний день данным можно сделать следующие выводы. Примерно в 40 % случаев рецидивы после радикальной трахелэктомии возникают в параметрии или по стенке таза, что может быть обусловлено недостаточным удалением параметральной клетчатки или наличием инвазии лимфо-васкулярного пространства. В 25 % случаев диагностируются метастазы в тазовые, парааортальные и/или надключичные лимфоузлы. Для сокращения риска таких рецидивов предлагается использовать интраоперационное определение сторожевых лимфоузлов [6]. Рецидивы в области маточновлагалищного анастомоза, шейки и тела матки принято объединять термином «центральные», которые чаще возникают при аденокарциноме шейки матки [10, 15]. Авторы объясняют возникновение центральных рецидивов при аде-
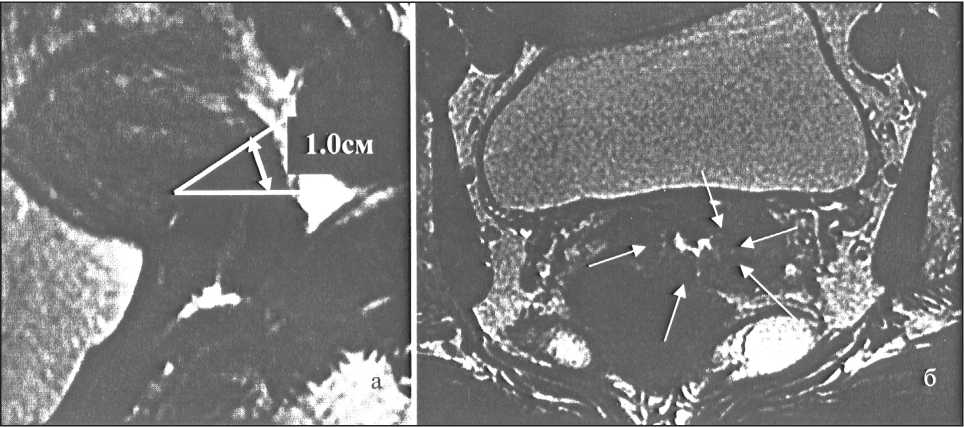
Рис. 3. ЯМР-томограмма малого таза: а) на Т2 ВИ в сагиттальной проекции стрелкой показана протяженность изменений эндоцервикса, в виде линейной зоны распространяющихся до в/3 цервикального канала, линией отмечен уровень внутреннего зева;
б) на Т2 ВИ в аксиальной проекции стрелками указаны расширенные сосуды, радиально расположенные вокруг измененного эндоцервикса
нокарциноме возможностью мультифокального роста этого типа РШМ.
В настоящем исследовании наблюдалось 3 рецидива, среди которых лишь один случай можно считать типичным для радикальной трахелэктомии по срокам возникновения и локализации. Он диагностирован через 30 мес после операции и располагался в параметрии. Причина рецидива, по-видимому, заключается в недостаточном объеме удаленной параметральной клетчатки. В исследовании P. Marchiole et al. [21], включавшем 118 случаев РВТ, 2 из 7 рецидивов возникли в параметрии через 7 и 18 мес после операции и сопровождались метаста- зами в легких и парааортальных лимфоузлах. По данным M. Plante et al. [25], после 72 операций РВТ 1 из 3 рецидивов возник в параметрии через 18 мес после лечения. Абдоминальный доступ позволяет удалять больший объем параметриев в сравнении с вагинальным, что теоретически должно снизить частоту подобных рецидивов при РАТ. Однако в исследовании H. Nishio et al. [23], выполнивших 61 РАТ, 2 из 6 рецидивов локализовались в параметриях.
Два других рецидива в настоящем исследовании не являются типичными для радикальной трахелэктомии. В одном случае при биопсии через 5 мес после операции уста-
Характеристика рецидивов после РАТ и РВТ
Таблица 2
|
Авторы |
Кол-во больных |
Тип операции |
Длительность наблюдения, медиана (мес) |
Рецидивы |
Характер рецидивов (период после операции, гистотип опухоли, локализация рецидивов) |
||
|
Plante M. et al., 2004 [25] |
72 |
РВТ |
60 (6–156) |
3 (4,2 %) |
9 мес 15 мес 18 мес |
НЭ АП ПК |
Легкие Брыжейка сигмовидной кишки Параметрий слева |
|
Marchiole P. et al., 2007 [21] |
118 |
РВТ |
95 (31–234) |
7 (5,9 %) |
7 мес 11 мес 18 мес 19 мес 20 мес 21 мес 93 мес |
ПК ПК ПК НЭ ПК АК/СК ПК |
Параметрий, легкие Парааортальные л/у Параметрий, парааортальные л/у Надпочечники, парааортальные л/у Стенка таза, печень, легкие, парааор-тальные л/у Стенка таза, легкие Стенка таза |
|
Hertel H. et al., 2006 [15] |
100 |
РВТ |
29 (1–128) |
4 (4 %) |
3 мес 7 мес 11 мес 34 мес |
АК ПК АК АК |
Тело матки Матка Стенка таза Шейка матки |
|
Beiner M.F. et al., 2008 [6] |
90 |
РВТ |
51 |
5 (5,5 %) |
10 мес 15 мес 44 мес 77 мес 84 мес |
АК АК ПК ПК ПК |
Легкие Брюшная полость Парааортальные л/у Парааортальные, надключичные л/у Стенка таза |
|
Ungar L. et al., 2005 [32] |
30 |
РАТ |
47 (14–75) |
- |
|||
|
Diaz J.P. et al., 2008 [10] |
40 |
РВТ/ РАТ |
44 (3–201) |
1 (2,5 %) |
19 мес |
АД |
Тело матки |
|
МНИОИ, 2010 |
69 |
РАТ |
27 (4–60) |
3 (4,3 %) |
4 мес 5 мес 30 мес |
ПК ПК ПК |
Маточно-влагалищный анастомоз, яичник Свод влагалища Параметрий |
Примечание: ПК – плоскоклеточный рак; АК – аденокарцинома; АП – аденоплоскоклеточный рак; НЭ – нейроэндокринный рак; СК – светлоклеточная аденокарцинома; л/у – лимфатические узлы.
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2011. №5 (47)
новлена карцинома in situ в своде влагалища. Поражение располагалось на расстоянии от маточно-влагалищного анастомоза, поэтому теоретически может быть не только вариантом продолженного роста РШМ, но и синхронным поражением влагалища на фоне инфекции ВПЧ. Тем не менее, принимая во внимание крайне низкую частоту синхронных опухолей шейки матки и влагалища – до 1 %, мы сочли необходимым расценить этот случай как рецидив РШМ.
Второй случай нетипичного для трахелэкто-мии рецидива заключался в крайне агрессивном течении заболевания. Пациентке с IB1 стадией выполнена мРАТ, и по данным планового гистологического исследования определялись микрофокусы рака с глубиной инвазии до 2 мм. Операции предшествовала ножевая ампутация шейки матки, где глубина инвазии достигала 6 мм и отмечен положительный край резекции. При небольших исходных размерах опухоли рецидив диагностирован уже через 4 мес после мРАТ, при этом, помимо узла в зоне маточно-влагалищного анастомоза, установлено метастатическое поражение яичника. Данное наблюдение свидетельствует о возможности быстрого прогрессирования РШМ после РАТ и необходимости комплексного обследования всех пациенток, начиная с первых визитов после радикальной операции.
Несмотря на более чем 20-летний опыт применения радикальной трахелэктомии, общепринятого алгоритма наблюдения больных после операции не выработано. Среди современных методов лучевой диагностики наиболее информативными и обладающими высокой тканевой визуализацией для оценки органов малого таза являются магнитно-резонансная томография и ультразвуковое исследование [16]. При отсутствии инвазивности и ионизирующего излучения эти методы позволяют адекватно оценивать зону влагалищно-маточного анастомоза после РАТ, состояние матки, клетчаточные пространства и органы малого таза. Отсутствие лучевой нагрузки при многократном применении в условиях динамического наблюдения особенно актуально у данной группы пациенток в связи с дальнейшей возможностью планирования беременности. Безусловно, каждый из двух методов диагностики имеет свои преимущества и ограничения, которые в сумме делают МРТ наиболее перспективным [17, 19, 20, 26, 29]. Оптимальная визуализация анатомических деталей при МРТ достигается с помощью соответствующей настройки оборудования и правильного выбора плоскостей сканирования. Изменение протоколов МР-исследования, т.е. изменение импульсных последовательностей и временных параметров, позволяет достигать высокого разрешения и контрастности, тем самым оптимизируя тканевую визуализацию [13].
На основании анализа собственных результатов и данных литературы [24, 27, 30] представляется целесообразным сформулировать следующие рекомендации. В течение первых 2 лет после операции обследование пациенток необходимо проводить каждые 3 мес, включая выполнение кольпоскопии, цитологического исследования, УЗИ органов брюшной полости и малого таза. В дальнейшем обследование рекомендуется выполнять каждые 6 мес в течение 2 лет и далее 1 раз в год. J.H. Shepherd [30] считает необходимым выполнение МРТ через 6, 12 и 24 мес после операции, однако результаты настоящего исследования указывают на необходимость МРТ при обследовании пациенток и в более поздние сроки после окончания лечения.
Вероятность возникновения рецидива после радикальной трахелэктомии зависит от сочетания определенных прогностических факторов, и в первую очередь от размера и гистотипа опухоли, что требует дифференцированного подхода к обследованию пациенток в зависимости от характеристик опухоли по результатам гистологического исследования. Необходимо отметить, что пациентки, которым проводится органосохраняющее лечение, представляют собой особую категорию больных с преобладанием мотивации на сохранение репродуктивной функции. При обнаружении при плановом гистологическом исследовании метастазов в лимфатических узлах или положительной границы резекции, т.е. при наличии показаний к дополнительному лечению, пациентки нередко отказываются от адъювантной лучевой терапии, чтобы сохранить шанс родить ребенка, даже несмотря на существующий риск рецидива онкологического заболевания. Эта категория больных, бесспорно, относится к группе высокого риска по развитию рецидивов и нуждается в индивидуализации плана наблюдения после завершения лечения, возможно, с сокращением интервалов между МРТ исследованиями.
Таким образом, результаты исследования показали преимущество МРТ в выявлении рецидивных опухолей у больных раком шейки матки после РАТ. Учитывая широкий спектр получения изображений, обеспечивающий МРТ высокую тканевую визуализацию, неинвазивность и безопасность многократного применения, метод можно рекомендовать как оптимальный для оценки результатов и динамического контроля у больных, которым была выполнена радикальная абдоминальная трахелэктомия. Необходимо продолжение исследований для совершенствования алгоритма обследования пациенток после радикальной трахелэктомии в зависимости от индивидуальных факторов прогноза, при этом актуальность практического применения уже полученных результатов не вызывает сомнений.


