МРТ в оценке эффективности химиолучевого лечения местнораспространенного рака шейки матки
Автор: Трухачва Наталия Геннадьевна, Фролова Ирина Георгиевна, Коломиец Лариса Александровна, Усова Анна Владимировна, Григорьев Евгений Геннадьевич, Величко Светлана Андреевна, Чуруксаева Ольга Николаевна, Шпилва Ольга Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 5 (71), 2015 года.
Бесплатный доступ
Цель исследования: оценка возможностей высокопольной МРТ в определении эффективности химиолучевого лечения у больных местнораспространенным раком шейки матки. Материал и методы. В исследование включено 43 пациентки. МР-томография выполнялась на МР-сканере MAGNETOM ESSENZA (SIEMENS, Германия) с напряженностью магнитного поля 1,5Т. для уточнения распространения опухоли, определения границ опухоли, уточнения ее структуры применялось внутривенное болюсное введение парамагнетика, с получением динамической серии срезов и отсроченных сканов в стандартной Т1-взвешенной последовательности. Результаты. При анализе диагностической ценности МРТ с применением болюсного контрастного усиления установлено, что методика является высокоинформативным методом, который может быть использован для мониторинга в процессе комбинированного химиолучевого лечения больных раком шейки матки. МРТ позволяет получать объективную информацию о динамике регрессии опухоли, степени изменения ее кровоснабжения и изменениях в метастатических регионарных лимфоузлах в процессе лечения.
Магнитно-резонансная томография, рак шейки матки, эффективность химиолучевой терапии
Короткий адрес: https://sciup.org/14056781
IDR: 14056781 | УДК: 618.146-006.6-08-07:615.28:615.849.1]-073.756.8
Текст научной статьи МРТ в оценке эффективности химиолучевого лечения местнораспространенного рака шейки матки
В последние годы отмечается рост заболеваемости РШМ среди молодых женщин в возрастной группе до 40 лет, особенно заметен прирост заболеваемости у женщин до 29 лет, составляющий около 7 % в год [1, 4, 5, 8, 12]. Почти половина женщин умирают в течение первого года с момента установления диагноза [6, 13–16]. Лучевая терапия считается стандартным методом для лечения местнораспространенных форм РШМ, но ее результаты остаются неудовлетворительными [1, 3, 9, 10]. В ведущих онкологических центрах мира проводятся клинические исследования по оценке эффективности химиолучевой терапии рака шейки матки у первично неоперабельных больных [3, 10]. В последние десятилетия отмечается повсеместный рост использования КТ и МРТ с целью определения эффективности лучевого и химиолучевого лечения, что обусловлено способностью этих методов, особенно МРТ, обеспечить адекватную оценку состояния анатомических структур таза, вовлекаемых в опухолевый процесс [7, 11, 15]. Установлено, что объем опухоли, распространение опухоли на тело матки, состояние тазовых и забрюшинных лимфоузлов, определяемые при
МРТ, являются независимыми факторами прогноза общей и безрецидивной выживаемости при местнораспространенном РШМ [7, 18, 22]. Возможность с помощью МРТ надежно исключить распространение опухоли на соседние тазовые органы, выявить уровень и определить причину обструкции мочеточников привела к уменьшению потребности в применении рентгенографических методов диагностики. МР-томограммы оказались полезными при планировании и подготовке к лучевому лечению [11, 17, 24].
Наличие метастазов в регионарных лимфоузлах – крайне неблагоприятный прогностический фактор, который существенно снижает выживаемость при РШМ. Однако возможности применения патоморфологического исследования для оценки состояния лимфоузлов существенно ограничены, поскольку многим больным РШМ не показано хирургическое лечение, в связи с чем становятся актуальными неинвазивные методы диагностики [23]. Кроме того. МРТ благодаря возможностям высокой тканевой контрастности позволяет регистрировать изменения, происходящие в процессе лечения как в первичной опухоли, так и в регионарных метастатических лимфоузлах. Однако на фоне реактивных изменений бывает крайне затруднительно определить остаточную опухоль, в связи с чем проведение МРТ с динамическим контрастным усилением дает возможность определять зоны патологической васкуляризации [24]. Анализ литературных данных свидетельствует о значительной вариабельности результатов МРТ, сложности интерпретации визуальной картины в мониторинге химиолучевого лечения с целью оценки его эффективности.
Целью исследования явилась оценка возможностей высокопольной МРТ в мониторинге химиолучевого лечения с целью определения эффективности терапии и выявления рецидивов РШМ.
Материал и методы
В исследование включены 43 больных местнораспространенным РШМ, IIА–IIIB стадий по классификации FIGO (2009), получивших хи-миолучевое лечение в Томском НИИ онкологии с 2008 по 2013 г. Средний возраст больных составил 44,7 ± 1,2 года. Морфологически у 34 (79 %) женщин диагностирован плоскоклеточный рак, у 9 (20,9 %) — аденокарцинома разной степени дифференцировки.
Все больные получили химиолучевое лечение, из них 31 (72,1 %) пациентке проведено 2 курса неоадъювантной химиотерапии по схеме гемзар + + цисплатин, с последующим курсом сочетанной лучевой терапии, включающим дистанционную гамма-терапию, СОД 46 Гр и внутриполостную ЛТ, СОД 50 Гр; 12 (27,9 %) больным проведен курс сочетанной лучевой терапии: дистанционная гамма-терапия, СОД 46 Гр + внутриполостная ЛТ, СОД 50 Гр с радиомодификацией цисплатином в разовой дозе – 40 мг/м2, суммарная доза – 300 мг.
Оценка эффективности химиолучевого лечения проводилась по критериям RECIST с помощью МРТ, которая выполнялась на МР-сканере MAGNETOM ESSENZA (SIEMENS, Германия) с напряженностью магнитного поля 1,5Т. Магнитнорезонансное исследование органов малого таза выполнялось в Т2-взвешенных изображениях (Т2-ВИ), Т1-взвешенных изображениях (Т1-ВИ) в аксиальной, коронарной, сагиттальной плоскостях. Основными в протоколе исследования являлись Т2-ВИ, полученные с помощью импульсных последовательностей турбо- или быстрого спинэхо (TSE, FSE), обеспечивающих хороший контраст между опухолью и окружающими тканями. На сагиттальных срезах оценивали распространение опухоли вдоль длинной оси матки, ее переход на тело, а также взаимоотношения между опухолью и задней стенкой мочевого пузыря и/или передней стенкой прямой кишки. Аксиальные и коронарные срезы использовались для оценки перехода опухоли на стенки таза и визуализации лимфоузлов. Наилучшая визуализация параметральной инвазии достигалась с помощью косых аксиальных срезов, ориентированных перпендикулярно длинной оси шейки матки. Обструкция мочеточников хорошо определялась с помощью методики МР-урографии (получение толстого среза в коронарной плоскости с сильной взвешенностью по Т2). Данная методика позволила в течение нескольких секунд, не прибегая к контрастированию, получить изображение мочевого пузыря и расширенных мочеточников. Хороший контраст между лимфоузлами и окружающей жировой клетчаткой обеспечивал режим Т1. При использовании Т2-ВИ-режима лимфоузлы лучше дифференцировались от скелетных мышц, яичников и сосудов. Преимуществом фронтальной плоскости являлась возможность исследовать забрюшинное пространство от лонного сочленения до уровня почечных сосудов. Для визуализации увеличенных парааортальных лимфоузлов были использованы сагиттальные изображения. Аксиальные срезы для адекватной оценки структуры лимфоузлов охватывали область от лонного сочленения до почечных сосудов.
При выполнении магнитно-резонансной томографии для уменьшения артефактов от перистальтики кишечника пациенткам было рекомендовано воздерживаться от приема пищи в течение 5–6 ч до исследования с применением вечером перед исследованием антиперистальтических препаратов. Артефакты от дыхательных движений передней брюшной стенки устранялись программными средствами (с помощью полосы сатурации) или механической компрессией живота эластичным поясом.
Для определения границ опухоли, уточнения ее распространенности и структуры применялось внутривенное болюсное введение парамагнетика (Омнискан) в дозе 2 мл/10 кг массы тела, с получением динамической серии срезов с интервалом 12–14 сек и отсроченных сканов в стандартной Т1-взвешенной последовательности. С целью оценки распространения опухоли за пределы шейки матки дополнительно проводилось исследование с программой «подавления» сигнала от жировой ткани (Т2-FatSat или TIRM). Во всех случаях выполнялась контрольная МРТ органов малого таза через 3, 6, 9 и 12 мес после лечения.
Статистический анализ данных проводился с использованием Microsoft Excel и пакета прикладных статистических программ SPSS 13.0. Данные представлены как абсолютные частоты и процентные доли.
Результаты исследования и обсуждение
Оценка эффективности лечения осуществлялась с учетом анализа изменений следующих параметров: размеров опухоли, степени инфильтрации парацервикальной клетчатки, вовлечения матки и смежных органов, характеристики накопления контрастного вещества тканью опухоли, состояния регионарных лимфоузлов. До лечения во всех слу-
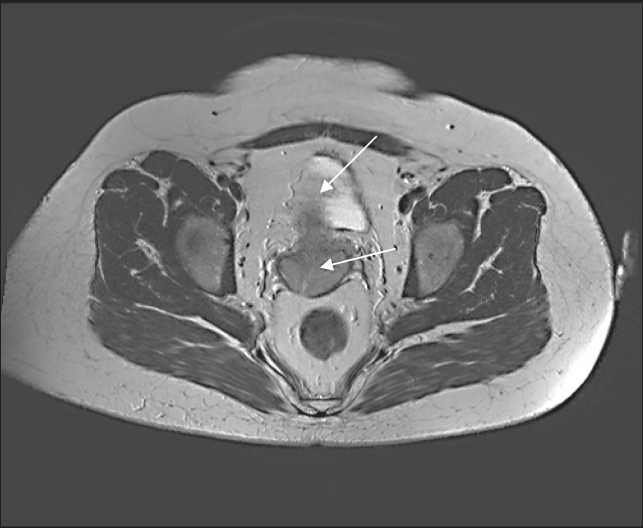
Рис. 1. МРТ органов малого таза. Пациентка И., 42 года. До начала лечения в области шейки матки визуализируется циркулярно расположенное мягкотканное опухолевое образование, инфильтрирующее все слои шейки, цервикальный канал и парацервикальную клетчатку. Эндоцервикс замещен опухолевой тканью, цервикальный канал не визуализируется, с признаками опухолевой инфильтрации на всем протяжении опухоли. Визуализируется нечеткость и прерывистость наружного слоя шейки матки в области передней губы, интенсивность парацервикальной клетчатки на этом уровне в Т2-режиме снижена
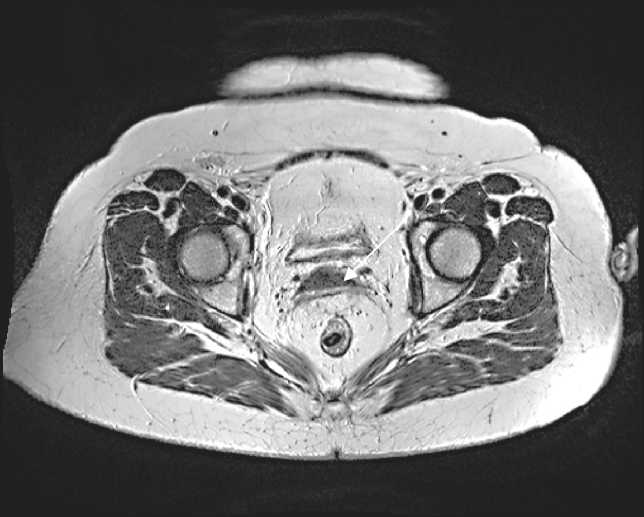
Рис. 2. МРТ органов малого таза. Пациентка И., 42 года.
Через 3 мес после химиолучевого лечения в области шейки матки опухолевое образование не визуализируется, шейка матки с фиброзными изменениями. Интенсивность сигнала от парацервикальной клетчатки не изменена
чаях имелось поражение стромы шейки матки, характеризующееся очагом повышения МР-сигнала на Т2-ВИ, разрывающим кольцо гипоинтенсивной стромы. Размеры опухоли варьировали от 5 до 60 мм, в среднем – 32 ± 3 мм. Переход опухоли шейки на тело матки определялся в 44,1 % случаев, при этом на томограммах визуализировалось распространение опухолевых масс через внутренний зев в полость матки с нарушением ее нормальной зональной анатомии с изменением интенсивности МР-сигнала на Т2-ВИ. Распространение опухоли на парацервикальную клетчатку отмечено в 60,4 %, что характеризовалось прерыванием целостности гипоинтенсивной полоски стромы шейки матки в сочетании с неровностью и размытостью контуров опухоли в этом месте (рис. 1). Распространение опухолевой инфильтрации на смежные органы (мочевой пузырь, прямую кишку) выявлено в 18,6 %. При проведении болюсного контрастного усиления в большинстве случаев (65,1 %) визуализировалось интенсивное неравномерное накопление контрастного вещества опухолью, что свидетельствовало о наличии развитой сети внутриопухолевых сосудов, в остальных случаях отмечалось умеренное и слабое накопление контрастного вещества тканью опухоли – 27,9 % и 7 % случаев соответственно. В 88,3 % при контрастном усилении было отмечено повышение четкости контуров опухоли, что позволило исключить или подтвердить наличие инфильтрации смежных органов.
При динамическом наблюдении через 3 мес после химиолучевого лечения в 21 % случаев по данным МРТ у больных исчезла инфильтрация стромы шейки матки. Размеры опухоли через 3 мес после лечения уменьшились в 88,3 % случаев. Частота выявления инфильтрации парацервикальной клетчатки уменьшалась с 60 до 32 % (рис. 2). Переход опухолевого процесса на тело матки сохранился в 34,8 % случаев и визуализировался в виде участка повышенной интенсивности на Т2-ВИ без четких контуров в области нижнего сегмента матки с нарушением ее нормальной зональной анатомии. У половины женщин с исходным распространением опухоли на смежные органы зафиксирована положительная динамика в виде уменьшения степени инфильтрации.
Через 6 и 9 мес после окончания лечения продолжали наблюдаться явления регрессии размеров опухоли (с 25 ± 3 мм до 15 ± 3 мм), уменьшения размеров инфильтрации парацервикальной клетчатки (у 9,3 % больных), переход опухолевого процесса на тело матки сохранился в 18 % и 11,6 % случаев соответственно.
Через 12 мес после лечения инфильтрация стромы шейки матки исчезла у 41,9 % больных (рис. 3). Распространение опухоли на парацервикс сохранилось в 9,3 % случаев. Частота перехода опухоли на тело матки уменьшилась с 34,8 до 11,6 % случаев. Уменьшение опухолевой инфильтрации на смежные
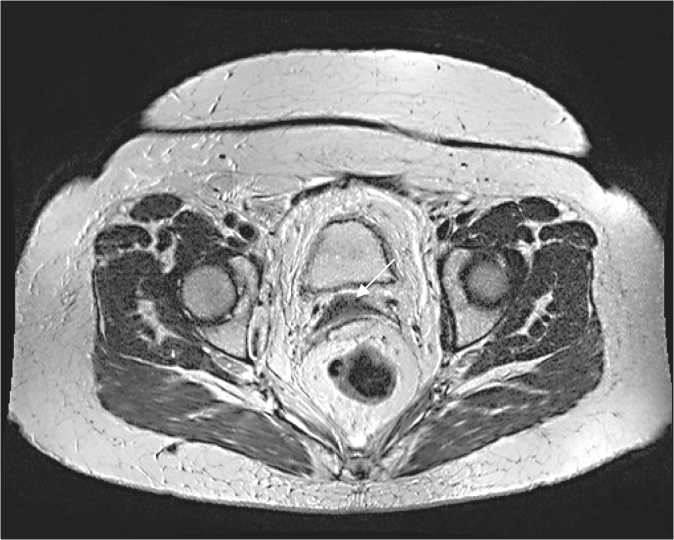
Рис. 3. МРТ органов малого таза. Пациентка И., 42 года.
Через 12 мес после химиолучевого лечения в области шейки матки опухолевое образование не визуализируется, шейка матки с фиброзными изменениями. Интенсивность сигнала от парацервикальной клетчатки не изменена органы зафиксировано в 7 % случаев. Динамика регрессии первичной опухоли в процессе химио-лучевого лечения представлена в табл. 1.
По данным МРТ-мониторинга у большей части пациенток отмечена значительная регрессия опухолевого процесса. При этом уменьшение размеров опухоли после химиолучевого лечения более 50 % отмечено у 21 (48,8 %), от 25 до 50 % – у 13 (30,2 %), менее 25 % – у 9 (20,9 %) больных, у 2 (4,6 %) пациенток на фоне лечения наблюдалась отрицательная динамика. Полная регрессия опухоли достигнута у 14 (32,5 %), частичная регрессия – у 7 (16,3 %), стабилизация процесса – у 13 (30,2 %) пациенток (табл. 2).
По нашим данным, в процессе и после окончания лечения определялось уменьшение степени инфильтративных изменений. Структура опухоли визуализировалась как неоднородная с наличием множественных Т1 и Т2-гиподенсных включений линейной формы или участка сниженной интенсивности, так называемой зоны инициального фиброза. У большинства больных уменьшение размеров опухоли в процессе комбинированного химиолучевого лечения происходило параллельно и пропорционально снижению степени накопления контрастного вещества, что свидетельствовало об уменьшении кровоснабжения опухоли. При полной ремиссии отмечалось восстановление нормальной анатомической структуры шейки матки и проксимального участка влагалища, что определялось картиной восстановления однородного сигнала низкой интенсивности от стромы, визуализацией ровной слизистой оболочки на фоне уменьшения в размерах шейки матки. При проведении болюсного контрастного усиления было установлено, что в проекции ранее определяемой опухоли (в зоне сохраняющегося умеренно повышенного МР-сигнала на Т2-ВИ) на постконтрастных Т1-ВИ отмечалось накопление контраста, визуально идентичное неизмененной строме.
Оценка состояния лимфоузлов также является одной из важнейших задач МР-исследования при РШМ. К сожалению, точность традиционной МРТ в диагностике метастатического поражения лимфо-
Таблица 1
Динамика регрессии первичной опухоли у больных местнораспространенным раком шейки матки
|
МР-локализация |
До лечения |
Сроки наблюдения после лечения |
|||
|
3 мес |
6 мес |
9 мес |
12 мес |
||
|
Строма шейки матки |
43 (100 %) |
34 (79 %) |
28 (65,1 %) |
25 (58,1 %) |
25 (58,1 %) |
|
Парацервикальная клетчатка |
26 (60,4 %) |
14 (32,5 %) |
9 (20,9 %) |
4 (9,3 %) |
4 (9,3 %) |
|
Тело матки |
19 (44,1 %) |
15 (34,8 %) |
8 (18,6 %) |
5 (11,6 %) |
5 (11,6 %) |
|
Смежные органы |
8 (18,6 %) |
4 (9,3 %) |
1(2,3 %) |
1(2,3 %) |
1(2,3 %) |
Таблица 2
Степень регрессии опухоли шейки матки через 12 мес после химиолучевого лечения в зависимости от стадии и размеров
|
Стадия РШМ |
Размеры опухоли |
Степень регрессии опухоли шейки матки |
||
|
<25 % |
≥25–50 % |
≥50–100 % |
||
|
IIB |
5–20 мм |
2 (4,6 %) |
2 (4,6 %) |
7 (16,3 %) |
|
21–30 мм |
1 (2,3 %) |
3 (6,9 %) |
4 (9,3 %) |
|
|
31–60 мм |
1 (2,3 %) |
1 (2,3 %) |
1 (2,3 %) |
|
|
IIIA |
5–20 мм |
- |
1 (2,3 %) |
2 (4,6 %) |
|
21–30 мм |
- |
1 (2,3 %) |
- |
|
|
31–60 мм |
2 (4,6 %) |
1 (2,3 %) |
- |
|
|
IIIB |
5–20 мм |
- |
- |
4 (9,3 %) |
|
21–30 мм |
- |
4 (9,3 %) |
3 (6,9 %) |
|
|
31–60 мм |
3 (6,9 %) |
- |
- |
|
|
Всего |
9 (20,9 %) |
13 (30,2 %) |
21 (48,8 %) |
|
Таблица 3
Динамика изменений размеров регионарных лимфоузлов у больных местнораспространенным раком шейки матки
Основным критерием оценки лимфоузлов с помощью любого томографического метода служит размер, причем предпочтение отдается поперечному размеру. В качестве точки разделения используют значения в интервале от 6 до 15 мм, но наиболее часто верхней границей нормы для тазового лимфоузла считают 10 мм. Минимальный диаметр более 10 мм служит наиболее достоверным критерием метастатического поражения лимфоузла, хотя некоторые авторы считают подозрительными тазовые лимфоузлы с максимальным размером, превышающим 10 мм [2, 20]. Кроме того, имеются данные о том, что при метастатическом поражении лимфоузла его форма округляется [21]. Поэтому в качестве косвенного признака метастатического поражения лимфоузла предлагается использовать критерий увеличения отношения меньшего к большему диаметра более 0,8 [19]. Однако даже мелкие лимфоузлы могут оказаться пораженными метастазами, а увеличенные лимфоузлы могут не содержать опухолевой ткани [19, 24]. Вместе с тем при выявлении больших конгломератов лимфоузлов (более 20 мм) с наличием в их структуре участков распада и кровоизлияний метастатический характер их поражения не вызывает сомнений. Есть данные о том, что наличие центрального некроза в лимфоузле может быть использовано для диагностики его метастатического поражения. Положительное прогностическое значение этого признака независимо от размера узла составляет 100 %. Некроз проявляется на МРТ сигналом, изоинтенсивным жидкости в режимах Т1 и Т2 [22].
Изменения, выявленные при МРТ в лимфатических узлах, позволили адекватно стратифицировать лимфогенное распространение процесса по критерию N системы TNM (табл. 3). При этом в 4,6 % случаев было обнаружено увеличение лимфоузлов больше чем на 10 мм в поперечнике в парацервикальной клетчатке, в 11,6 % – в параректальной клетчатке. Лимфоузлы по ходу наружных подвздошных сосудов были увеличенными в 86,0 %, по ходу внутренних подвздошных сосудов – в 25,5 %, по ходу общих подвздошных сосудов – в 53,4 % случаев; увеличение парааортальных лимфоузлов отмечалось в 39,5 %, паракавальных – в 11,6 %, паховых – в 39,5 % наблюдений. Контуры лимфоузлов были бугристыми в 82 %. В большинстве (74,2 %) случаев лимфоузлы подавали Т1- и Т2-гипоинтенсивный сигнал, их структура была неоднородной за счет наличия жидкостных включений в 16,6 %.
При контрольной МРТ через 3 мес после лечения было установлено, что лимфоузлы в парацервикальной клетчатке не визуализировались в 100 %, в параректальной клетчатке лимфоузлы сохранялись в 6,9 % случаев. Увеличение лимфоузлов по ходу наружных подвздошных сосудов сохранилось в 27,9 %, по ходу внутренних подвздошных сосудов – в 16,2 %, по ходу общих подвздошных сосудов – в 39,5 % случаев, увеличение парааортальных лимфоузлов продолжало определяться у 16,2 %, паракавальных – у 6,9 %, паховых – у 27,9 % больных.
Через 12 мес после лечения увеличение лимфоузлов по ходу наружных подвздошных сосудов наблюдалось в 20,9 %, по ходу внутренних подвздошных сосудов – в 6,9 %, по ходу общих подвздошных сосудов – в 27,9 % случаев; увеличение лимфоузлов парааортальной группы сохранилось у 13,9 %, паракавальной группы – у 4,6 %, паховой группы – у 16,2 % бльных. Контуры лимфоузлов сохранялись бугристыми в 43 %. В большинстве (87,2 %) случаев сохранялся Т1 и Т2-гипоинтен-сивный сигнал лимфоузлов, в 4,6 % случаев их структура оставалась неоднородной за счет наличия жидкостных включений.
Заключение
Таким образом, результаты исследования свидетельствуют о том, что МРТ с применением болюсного контрастного усиления является высокоинформативным диагностическим методом, который может быть использован для мониторинга при комбинированном химиолучевом лечении больных местнораспространенным раком шейки матки, позволяющим получать объективную информацию о динамике регресса размеров, степени изменения кровоснабжения опухоли и состоянии регионарных лимфоузлов.
Анализ динамики распространенности опухоли в процессе мониторинга показал, что максимальное уменьшение размеров новообразования было зафиксировано через 3 мес после лечения, уменьшение инфильтрации парацервикальной клетчатки и восстановление структуры стенок тела
Список литературы МРТ в оценке эффективности химиолучевого лечения местнораспространенного рака шейки матки
- Ашрафян Л.А., Антонова И.Б., Басова О.И., Ивашина С.В., Люстик А.В., Антошечкина М.А. Возможные пути реорганизации первичной медико-санитарной помощи в гинекологии в аспекте эффективной ранней диагностики рака репродуктивных органов//Опухоли женской репродуктивной системы. 2008. № 4. С. 57-63
- Березовская Т.П. Магнитно-резонансная томография в стадировании рака шейки матки//Вопросы онкологии. 2003. Т. 49, № 2. С. 227-231
- Канаев С.В. Принципы обоснования химиолучевого лечения злокачественных опухолей//Практическая онкология. 2008. Т. 9, № 1. С. 1-8
- Козаченко В.П. Современные возможности предупреждения рака шейки матки//Опухоли женской репродуктивной системы. 2007. № 3. С. 47-48
- Коломиец Л.А., Чуруксаева О.Н., Шпилева О.В., Уразова Л.Н., Родичева Н.В. Особенности распространения различных типов вирусов папилломы человека (ВПЧ) у пациенток с цервикальными неоплазиями и раком шейки матки в г. Томске//Сибирский онкологический журнал. 2012. № 3. С. 41-45
- Практическая онкогинекология: избранные лекции/Под ред. А.Ф. Урманчеевой, С.А. Тюляндина, В.М. Моисеенко. СПб., 2008. С. 168-180
- Рубцова Н.А., Новикова Е.Г., Синицын В.Е. Возможности МРТвпредоперационной оценке местной распространенности рака шейки матки//Акушерство, гинекология, репродукция. 2012. Т. 6, № 3. С. 6-13
- Статистика злокачественных новообразований в России и странах СНГ в 2012 г./Под ред. М.И. Давыдова, Е.М. Аксель. М., 2014
- Танривердиева Э.К., Захарова Т.И., Баринов В.В., Жорданиа К.И., Приходько Е.В., Мамедова Л.Т. Сравнительный анализ клинико-прогностических факторов железисто-плоскоклеточного рака шейки матки 1В и IIA стадии после хирургического и комбинированного метода лечения//Паллиативная медицина и реабилитация. 2012. № 4. С. 18-22
- Титова В.А, Харченко Н.В., Добровольская Н.Ю., Крейнина Ю.М. Стратегия и тактика современной лучевой терапии рака шейки и тела матки//Вопросы онкологии. 2009. № 4. С. 471-473
- Трухачёва Н.Г., Фролова И.Г., Коломиец Л.А. Усова А.В., Григорьев Е.Г., Величко С.А., Чернышова А.Л., Чуруксаева О.Н. Оценка распространенности рака шейки матки при использовании МРТ//Сибирский онкологический журнал. 2015. № 2. С. 64-69
- Чойнзонов Е.Л., Писарева Л.Ф., Бояркина А.П., Одинцова И.Н., Тахауов Р.М. Онкологическая заболеваемость населения Томской области. Томск: Изд-во Том. ун-та, 2004. 253 с
- Чойнзонов Е.Л., Писарева Л.Ф., Жуйкова Л.Д. Злокачественные новообразования в Томской области в 2004-2009 г.г. Оценка качества диагностики//Сибирский онкологический журнал. 2011. № 3. С. 29-34
- Чуруксаева О.Н., Коломиец Л.А. Неоадъювантная химиотерапия при лечении местнораспространенных форм рака шейки матки//Сибирский онкологический журнал. 2013. № 2. С. 18-24
- Шавладзе З.Н., Березовская Т.П., Прошин А.А. Клиникодиагностические аспекты магнитно-резонансного стадирования рака шейки матки//Медицинская визуализация. 2009. № 5. С. 80-90
- Allen D., Narayan K. Managing advanced stage cervical cancer//Best Pract. Res. Clin. Obstet. Gynaecol. 2005. Vol. 19 (4). P. 591-609
- Chiang S.H., Quek S.T. Carcinoma of the cervix: role of MR imaging//Ann. Acad. Med. Singapore. 2003. Vol. 32 (4). P. 550-556
- Choi H.J., Roh J.W., Seo S.S., Lee S., Kim J.Y., Kim S.K., Kang K.W., Lee J.S., Jeong J.Y., Park S.Y. Comparison of theaccuracy of magnetic resonance imaging and positronemission tomography/computed tomography in the presurgical detection of lymph node metastases inpatients with uterine cervical carcinoma//Cancer. 2006. Vol. 106 (4). P. 914-922 DOI: 10.1002/cncr.21641
- Hong K.S., Ju W., Choi H.J., Kim J.K., Kim M.H., Cho K.S. Differential Diagnostic Performance of Magnetic Resonance Imaging in the Detection of Lymph Node MetastasesAccording to the Tumor Size in Early Stage Cervical Cancer Patients//Int. J. Gynecol. Cancer. 2010. Vol. 20 (5). P. 841-846 DOI: 10.1111/IGC.0b013e3181db5140
- Hricak H., Brenner D.J., Adelstein S.J., Frush D.P., Hall E.J., Howell R.W., McCollough C.H., Mettler F.A., Pearce M.S., Suleiman O.H., Thrall J.H., Wagner L.K. Managing radiation use in medical imaging: al multifaceted challenge//Radiology. 2011. Vol. 258 (3). P. 889-905 DOI: 10.1148/radiol.10101157
- Mitchell D.G., Snyder B., Coakley F., Reinhold C., Thomas G., Amendola M.A., Schwartz L.H., Woodward P., Pannu H., Atri M., Hricak H. Early invasive cervical cancer: MRI and CT preditors of lymphatic metastases in the ACRIN 6651/GOG 183 intergroup study//Gynecol. Oncol. 2009. Vol. 112 (1). P. 95-103 DOI: 10.1016/j.ygyno.2008.10.005
- Naroyan K., Fisher R.J., Bernshaw D. Patterns of failureand prognostic factor analyses in locally advanced cervical cancer patients staged by magnetic resonance imaging and treated with curative intent//Int. J. Gynecol. Cancer. 2008. Vol. 18 (3). P. 525-533 DOI: 10.1111/j.15251438.2007.01050.x
- Parker K., Gallop-Evans E., Hanna L., Adams M. Five-year experience treating locally advanced cervical cancer with concurrent chemoradiotherapy and high-dose-rate brachytherapy: results from a single institution//Int. J. Radiat. Oncol. Biol Phys. 2009. Vol. 74 (1). P. 140-146 DOI: 10.1016/j.ijrobp.2008.06.1920
- Zand K.R., Reinhold C., Abe H., Maheshwari S., Mohamed A., Upegui D. Magnetic resonance imaging of the cervix//Cancer Imag. 2007. Vol. 28 (7). P. 69-76 DOI: 10.1102/1470-7330.2007.0011


