Мультицентровое рандомизированное исследование пролонгированной антибиотикопрофилактики при цистэктомии в клиниках, работающих по протоколу раннего послеоперационного восстановления (ERAS)
Автор: Беркут М.В., Беляев А.М., Галунова Т.Ю., Тяпкин Н.И., Рева С.А., Носов А.К.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S1 т.14, 2024 года.
Бесплатный доступ
Стандартная 24‑часовая антибиотикопрофилактика (АП) широко используется для минимизации риска осложнений с инфекцией в течение 30 дней после радикальной цистэктомии (РЦЭ). Однако значительное разнообразие протоколов, комбинаций антибактериальных препаратов и продолжительность назначения не предотвращают высокий уровень инфекционных осложнений после операции, частота которых может достигать 37–67 %. Целью настоящего исследования является оценка риска развития инфекционных осложнений в период 30 дней после РЦЭ в хирургическом стационаре, работающем по протоколу ERAS при сравнении стандартного 24‑часового режима АП в сравнении с 120‑часовым (пролонгированный режим). Материалы и методы: 92 пациента были рандомизированы в соотношении 1:1 на стандартный 24‑часовой режим антибиотиков (стандартная АП) и пролонгированный режим с применением меропенема в течении 120 часов. В данной работе были рассмотрены вторичные конечные точки — динамика биомаркеров системного воспалительного ответа и частота развития приобретенных карбапенемаз на фоне пролонгированной АП. Результаты: Исходные и периоперационные характеристики были сбалансированы между группами. Анализ системного воспаления не выявил значимых изменений уровня системного воспалительного ответа в динамике на 1‑е и 14‑е сутки после операции (р = 0,791 и р = 0,219). При этом динамика уровня СРБ была менее интенсивная в группе пролонгированной АП, особенно на 1‑е сутки после операции (р = 0,020). Чаще всего выявлялись карбопенемазы классов B и D, ассоциированные с повышенным риском инфекционных осложнений. Кроме того, в группе пролонгированной АП отмечено снижение встречаемости карбопенем‑продуцирующих штаммов (p = 0,111), где регрессионный анализ показал связь между выявлением карбопенемаз и развитием инфекционных осложнений (ОР 2,73, p = 0,024). Выводы: Данное проспективное рандомизированное исследование демонстрирует, что пролонгированная антибиотикопрофилактика эффективно снижает 30‑дневные послеоперационные осложнения после радикальной цистэктомии, при этом обеспечивая менее выраженный подъем С‑реактивного белка и не увеличивая частоту антибиотикорезистентности, что открывает новые горизонты для обновления протоколов в онкохирургии.
Рак мочевого пузыря, радикальная цистэктомия, антибиотикопрофилактика, инфекционные осложнения, ERAS протокол
Короткий адрес: https://sciup.org/140307170
IDR: 140307170 | DOI: 10.18027/2224-5057-2024-14-3s1-63-71
Текст научной статьи Мультицентровое рандомизированное исследование пролонгированной антибиотикопрофилактики при цистэктомии в клиниках, работающих по протоколу раннего послеоперационного восстановления (ERAS)
В современной онкоурологии радикальная цистэктомия (РЦЭ) с разнообразными методами деривации мочи представляет собой лидирующий подход к лечению мышечно-неинвазивного рака мочевого пузыря с высоким риском прогрессирования (МНИРМП), а также неметаста- тического мышечно-инвазивного рака (МИРМП) [1]. Этот метод лечения нередко ассоциируется со значительным числом периоперационных и отдаленных осложнений, среди которых лидирующее положение занимают инфекции мочевыводящих путей или хирургического доступа [2–5]. Одним из подходов к уменьшению данных осложнений может послужить применение протокола раннего послеоперационного восстановления (ERAS) [6–8]. Кроме того, для уменьшения риска инфекционных осложнений активно используется антибиотикопрофилактика [9,10].
Профилактика инфекций, связанных с оказанием медицинской помощи, входит в число ключевых направлений внутреннего контроля за качеством и безопасностью медицинской деятельности. Антибактериальная профилактика (АП) представляет собой одну из ведущих стратегий контроля антимикробной терапии в стационарных условиях, цель которой заключается в снижении риска развития послеоперационной или послепроцедурной локальной или системной инфекции за счет использования системных антибиотиков в периоперационном периоде. В соответствии с критериями оценки риска инфекционных осложнений на основе классификации Altemeier W.A. (1972), радикальная цистэктомия относится к категории плановых условно-чистых хирургических вмешательств (более двух баллов) и потому требует проведения антибактериальной профилактики [11].
В рамках современной концепции адекватной периоперационной АП, основанной на принципах доказательной медицины и клинических рекомендациях, необходимо ввести первую дозу антибиотика за 30–60 минут до начала операции. Временные рамки применения антибиотика ограничены 24 часами после завершения хирургического вмешательства [10]. Однако, в работе Атдуева В.А. и соавт. (2019) была продемонстрирована смена парадигмы РЦЭ на «высоко-контаминированную» операцию за счет доказательства высокого риска интраоперационного инфицирования брюшной полости в 3,4 раза с развитием пареза кишечника, инфекционных осложнений в раннем послеоперационном периоде (p < 0,001) [11]. Полученные данные ставят под сомнение современный выбор антибактериальных препаратов (АБП), режим и продолжительность введения АБП только в течение 24 часов после РЦЭ. С учетом удручающей статистики развития инфекционных осложнений, которые достигаю 63% — поиск оптимального АБП препарата и продолжительности АП представляет собой практический интерес до сих пор.
Указанные выше факты подчеркивают необходимость проспективного исследования эффективности режимов АП при РЦЭ. Поэтому целью настоящего исследования является оценка риска развития инфекционных осложнений в период 30 дней после РЦЭ в хирургическом стационаре, работающем по протоколу ERAS при сравнении стандартного 24-часового режима АП в сравнении с 120-часовым (пролонгированный режим).
МАТЕРИАЛЫ И МЕТОДЫ
Данное исследование является проспективным рандомизированным многоцентровым исследованием третьей фазы, оценивающим эффективность пролонгированной антибиотикопрофилактики (120 часов) в качестве меры снижения частоты развития инфекционных послеоперационных осложнений (инфекции мочевыводящих путей, инфекция области хирургического вмешательства, сепсис и т. п.) в период 30 дней после РЦЭ. Работа получила одобрение Локального этического комитета № 1/129 от 28.04.2022 года. Критерии включения и исключения опубликованы на сайте ClinicalTrials. gov (идентификатор NCT05392634) и подробно представлены в протоколе исследования [12].
Исследование MACS проходило в трех клинических центрах г. Санкт-Петербурга, работающих по протоколу ERAS, где в период с 30.05.2022 г. по 29.03.2024 г. были включены 92 пациента мужского (n = 84) и женского (n = 8) полов с морфологически подтвержденным диагнозом уротелиального рака МНИРМП (сT1NoMo) высокого риска прогрессирования без/после БЦЖ терапии, а также пациенты с подтвержденным МИРМП (сT2–4NxM0–1), которым планировалось выполнение РЦЭ. Стратификация пациентов осуществлена по факту проведения неоадъювантной терапии и варианту уродеривации мочи при планировании хирургического лечения (ортотопическая; гетеротопическая). Все пациенты, удовлетворяющие критериям включения и исключения, подписавшие информированное согласие, получили оперативное лечение с применением малоинвазивных технологий по основному онкологическому заболеванию в объеме радикальной цистэктомии с уродеривацией.
Рандомизация происходила 1:1 в две группы лечения до операции. Первая группа стандартной антибиотико-профилактики (АП), где назначение антибактериального препарата (АБП) выполнялось в соответствии с Федеральными клиническими рекомендациями и Национальной ассоциации специалистов по контролю инфекций, связанных с оказанием медицинской помощи [8,9]. В данной группе АБП (амоксициллин/клавулановая кислота 1,2 г или цефуроксим 1,5 г) вводился парентерально за 30 минут до разреза и общей продолжительностью профилактики не более 24 часов. При продолжительности операции более 4 часов или интраоперационной кровопотере более 1,5 литров выполнялось интраоперационное введение дополнительной дозы АБП. Длительность периоперационной АП в данной группе было не более 24 часов. Продление терапии в данной группе не допускалось. Во второй группе пролонгированной антибиотикопро-филактики в качестве АБП использовался АБП из группы карбопенемов (меропенем по 1 г каждые 8 часов) и длительность АП составляла 120 часов. Дополнительное назначение АБП разрешено было в случае возникновения осложнения, требовавшего антибактериальную терапию (рис. 1).
Первичными конечными точками исследования были частота развития инфекционных осложнений в период 30 дней после РЦЭ и время до их развития. Результаты представлены в предшествующих публикациях [13,14]. В качестве вторичной конечной точки исследована динамика биомаркеров системного воспалительного ответа и частота развития приобретенных карбапенемаз на фоне пролонгированной АП, которые представлены в настоящем анализе.
МУЛЬТИЦЕНТРОВОЕ РАНДОМИЗИРОВАННОЕ ИССЛЕДОВАНИЕ ПРОЛОНГИРОВАННОЙ АНТИБИОТИКОПРОФИЛАКТИКИ
ПРИ ЦИСТЭКТОМИИ В КЛИНИКАХ, РАБОТАЮЩИХ ПО ПРОТОКОЛУ РАННЕГО ПОСЛЕОПЕРАЦИОННОГО ВОССТАНОВЛЕНИЯ (ERAS)

Включено на этап скрининга (n = 116)
Исключено (n = 38)
-
• Не соответствовали критериям включения (n = 28)
-
• Отказались от участия (n = 2)
-
• Другие причины (n = 8)

Группа стандартной антибиотикопрофилактики (n = 46)
• Получили НТ* (n = 29)
• Распределены (intent-to-treat)
– для гетеротопической
УД** (n = 40)
– для ортотопической
УД (n = 6)
Рандомизировано (n = 92)
Группа стандартной антибиотикопрофилактики (n = 46)
-
• Получили НТ* (n = 30)
-
• Распределены:
– для гетеротопической
УД (n = 39)
– для ортотопической
УД (n = 7)

Выполнена
• гетеротопическая
УД (n = 33)
• ортотопическая УД (n = 6)
• нефростомия (n = 6)
Выполнена
-
• гетеротопическая
УД (n = 35)
-
• ортотопическая УД (n = 6)
-
• нефростомия (n = 5)

Проанализировано (n = 46)
Проанализировано (n = 46)
НТ — неоадъювантная терапия.
** УД — уродеривация мочи.
Рисунок 1. Дизайн исследования рандомизированного исследования (диаграмма CONSORT)
В качестве аналитических измерений выполнен посев мочи на наличие микроорганизмов (БП1) интраоперационно в стерильных условиях до разреза кожи. Второй забор биологического материала (БП2) выполнен после полного удаления мочеточниковых интубаторов/уретрального катетера (в случае ортотопической уродеривации). Третий анализ (БП3) выполнялся только в случае развития инфекционного осложнения. Результат расценивался, как позитивный при микробиологическом титре ≥10 5 KOE/l. С целью определения устойчивости изолированной бактериальной колонии к антибиотикам группы карбапенемов был выполнен иммунохроматографический анализ (ИХА) методом экспресс-теста “NG-Test CARBA 5” (NG Biotech Z.A., Франция), который позволяет выявить карбапенемазы КРС, ОХА, VIM, IMP и NDM в бактериальной колонии из культуры, выделенной во время забора БП1–3 [15].
Для определения изменений системного иммуно-воспалительного ответа, который развивается после РЦЭ, выполнялся контроль показателей общего анализа крови в 1-е сутки после операции и на 14-е сутки пребывания в стационаре и уровень С-реактивного белка (мг/л) в 1, 3 и 9-е сутки. SII — cистемный индекс иммунного воспаления — в работе был определен, как количество тромбоцитов × (количество нейтрофилов/количество лимфоцитов)
Статистический анализ
Расчет статистической выборки осуществлен на основе литературной оценки частоты развития инфекционных осложнений в период 30–90 дней- 63% (RR1 = 0,63). Ожидаемое снижение риска развития осложнений в группе В составит 32% (RR2 = 0,32). Расчеты выполнены в электронном калькуляторе, где число пациентов, необходимое для включения в исследование, составляет 92 человека [16,17]. Статистическая ошибка первого типа составляет 5%, ошибка второго типа — 20%. Сбор данных из исследовательских центров, а также процесс рандомизации, выполнен при помощи аггрегатора REDCap 12.2.3 Vanderbilt University, США. Статистический анализ проводился с использованием программы StatTech v. 4.0.5 (разработчик — ООО «Статтех», Россия).
Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка (при числе исследуемых менее 50) или критерия Колмогорова-Смирнова (при числе исследуемых более 50). Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3).
Категориальные данные описывались с указанием абсолютных значений и процентных долей.
Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью критерия хи-квадрат Пирсона, точного критерия Фишера. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна-Уитни.
Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода, применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена.
РЕЗУЛЬТАТЫ
Группы были сбалансированы по полу, возрасту, ИМТ, проводимому предшествующему лекарственному лечению, наличию ранее установленных дренажей. В каждой группе более 65,0% пациентов получили неоадъювантную лекарственную терапию в случае выявленного МИРМП, при этом превалировало назначение цисплатин-содержащей схемы лекарственного лечения. В качестве второго стратификационного фактора использован был тип уродеривации, который планировался в момент подписания пациентом
согласия на оперативное лечение (intent-to-treat): в группе стандартной АП в большинстве случаев — 40 (87,0%) планировалась гетеротопическая уродеривация, у 6 (13,0%) пациентов ортотопическая; в группе пролонгированной АП наблюдались аналогичные показатели — гетеротопическая уродериваций запланирована была у 39 (84,8%) пациентов, ортотопическая в 7 случаях (15,2%). Группы были сбалансированы (точный критерий Фишера р = 1,0).
При оценке послеоперационных показателей (as treated) нам не удалось установить статистически значимых различий между выполненными вариантами уродеривации (p = 0,822, Хи-квадрат Пирсона) в зависимости от группы АП, несмотря на то что у 12 пациентов операция была завершена наложением нефростомического дренажа. Подробно базовая характеристика пациентов представлена в табл. 1.
Таблица 1. Базовая характеристика включенных пациентов
|
Параметр |
Стандартная АБ, n = 46 |
Пролонгированная АБ, n = 46 |
Р value |
|
|
Пол мужской, abs, (%) |
42 (91,3) |
42 (91,3) |
1,0 |
|
|
Возраст, М ± SD (95% CI), лет |
63,4 ± 8,8 (60,8–66,0) |
66,7 ± 8,3 (64,2–69,2) |
0,067 |
|
|
BMI, Me (Q1–Q3) |
26,9 (24,2–30,0) |
26,2 ± (24,0–29,2) |
0,475 |
|
|
ECOG статус, abs, (%) — 0 — 1 |
40 (87,0) 6 (13,0) |
40 (87,0) 6 (13,0) |
1,0 |
|
|
Наличие дренажей 1 , abs, (%) |
7 (41,2) |
10 (58,8) |
0,592 |
|
|
Неоадъювантная терапия 2 , abs, (%)
|
30 (65,2) 26 (56,5) 2 (4,3) 2 (4,3) |
30 (65,2) 28 (60,9) 0 (0,0) 2 (4,3) |
1,0 0,672 0,495 1,0 |
|
|
Уродеривация (intent-to-treat) — гетеротопическая, abs, (%) — ототопическая, abs, (%) |
40 (87,0) 6 (13,0) |
39 (84,8) 7 (15,2) |
1,0 |
|
|
Уродеривация (as-treated) — гетеротопическая, abs, (%) — ототопическая, abs, (%) Нефростомия, abs, (%) |
33 (71,7) 6 (13,0) 7 (15,2) |
35 (76,1) 6 (13,0) 5 (10,9) |
0,822 |
|
|
Лапароскопический доступ, abs, (%) |
44 (95,7) |
43 (93,5) |
1,0 |
|
|
Дополнительное дренирование брюшной полости после РЦЭ, abs, (%) |
11 (23,9) |
13 (28,3) |
0,635 |
|
|
Удаление мочеточниковых стентов, Me (Q1–Q3), дней |
9,0 (7,0–11,0) |
10,0 (8,0–12,0) |
0,162 |
|
|
Удаление уретрального катетера 3 , М ± SD (95% CI), дней |
21,8 ± 12,7 (6,1–37,6) |
20,2 ± 8,0 (10,4–30,0) |
0,817 |
|
|
Дополнительное назначения антибактериальной терапии, abs. (%) |
22 (47,8) |
8 (17,4) |
0,002 |
|
|
Продолжительность госпитализации Me (Q1–Q3), дней |
19,0 (13,0–22,0) |
17,0 (14,0–21,8) |
0,398 |
|
|
30-дневная летальность, аbs. (%) |
2 (4,3) |
1 (2,2) |
1,0 |
|
|
Маркерный анализ |
||||
|
ИВИ 1 сутки, Me (Q1–Q3) |
531,05 (292,25–1311,97) |
557,50 (295,73 –1115,53) |
0,791 |
|
|
ИВИ 14 сутки, Me (Q1–Q3) |
1139,40 (865,80–1637,88) |
983,10 (608,12–1596,03) |
0,219 |
|
|
СРБ 1 сутки, Me (Q1-Q3), мг/мл |
89,60 (74,58–119,30) |
54,05 (39,60–99,11) |
0,020 |
|
|
СРБ 3 сутки, Me (Q1–Q3), мг/мл |
172,25 (136,44–278,68) |
143,74 (97,75–219,47) |
0,067 |
|
|
СРБ 9 сутки, Me (Q1–Q3), мг/мл |
60,05 (34,65–77,36) |
47,31 (18,01–103,55) |
0,352 |
|
|
БП1 4 (есть рост), abs. (%) |
16 (34,8) |
18 (39,1) |
0,666 |
|
|
БП2 (есть рост), abs. (%) |
22 (47,8) |
14 (30,4) |
0,087 |
|
|
БП3 (есть рост), abs. (%) |
11 (23,9) |
4 (8,7) |
0,088 |
|
|
Карбапенемазы в БП1, abs. (%) |
1 (2.2) |
1 (2.2) |
0,111 |
|
|
Карбапенемазы в БП2–3, abs. (%) |
6 (13.0) |
1 (2.2) |
||
|
Тип карбапенемазы |
OXA 48, NDM |
7 (15,2) |
1 (2,2) |
0,050 |
|
VIM, NDM |
0 (0.0) |
1 (2,2) |
||
МУЛЬТИЦЕНТРОВОЕ РАНДОМИЗИРОВАННОЕ ИССЛЕДОВАНИЕ ПРОЛОНГИРОВАННОЙ АНТИБИОТИКОПРОФИЛАКТИКИ
ПРИ ЦИСТЭКТОМИИ В КЛИНИКАХ, РАБОТАЮЩИХ ПО ПРОТОКОЛУ РАННЕГО ПОСЛЕОПЕРАЦИОННОГО ВОССТАНОВЛЕНИЯ (ERAS)
Маркерный анализ показателей системного воспаления не выявил значимых различий в динамике уровня системного ИВИ на 1-е и 14-е сутки после операции (р = 0,791 и р = 0,219, соответственно). Показатели представлены в таблице 1. При анализе уровня СРБ на 1-е, 3-е и 9-е сутки после РЦЭ во всех случаях отмечено значимое отклонение от верхней границы нормы (> 5 мг/л). При этом отмечено повышение СРБ до 100,57 (73,99–132,25) г / л с первых суток у категории пациентов, у которых впоследствии развивались любые осложнения (p < 0,001). В то же время, в группе пролонгированной АП подъем уровня СРБ на 1-е сутки был менее выраженным: 54,05 мг/л против 89,6 мг/л (р = 0,020), однако на 3–9 сутки значимой разницы между группами установить не удалось.
Вероятность развития любого инфекционного осложнения после РЦЭ в зависимости от уровня СРБ была оценена с помощью ROC-анализа (рис. 2,3). На 1-е сутки после РЦЭ площадь под ROC-кривой (AUC) составила 0,75 ± 0,05 (95% ДИ: 0,65–0,86; p < 0,001), что указывает на умеренную точность модели. Чувствительность и специфичность модели составили 62,5% и 78,9% соответственно, а пороговое значение уровня СРБ в точке cut-off, соответствующее наивысшему индексу Юдена, было равно 89,60 мг/л. Оценка СРБ на 3-и сутки также продемонстрировала статистически значимую модель (AUC0,72 ± 0,06; 95% ДИ: 0,61–0,83; p < 0,001). Чувствительность и специфичность составили 77,5% и 63,2%, а пороговое значение СРБ в точке cut-off достигло 148,80 мг/л. Модель, построенная на основе данных СРБ, взятых на 9-е сутки, была статистически не значима.
При ИХА экспресс-тестом “NG-Test Carba 5» не выявлено значимого повышения штамм-продуцентов карбо-пенемаз при проведении пролонгированной АП (р = 0,111). Однако, было выявлено несколько особенностей. Во-первых, карбапенемазы в 3,95 раза реже встречались в группе пролонгированной АП, где в качестве АБП использовался меропенем, чем в стандартной группе: 15,2% (7/46 случаев) против 4,3% (2/46 случаев). Во-вторых, при регрессионном анализе установлена значимая зависимость между выявлением любой карбапенемазы и развитием события, представляющего клинический интерес (раневая инфекция, пиелонефрит, сепсис) в послеоперационном периоде: ОР 2,73 (1,14–5,62 р = 0,024.) В-третьих, чаще выявлялись карбапенемазы В и D классов (8,7%) — OXA 48, NDM, которые значимо были ассоциированы с риском развития инфекционных осложнений независимо от варианта АП: ОР 2,75 (1,15–6,58, p = 0,023).
ОБСУЖДЕНИЕ
Радикальная цистэктомия с деривацией мочи в сегмент кишечника сопряжена с высоким риском развития инфекционных осложнений в ранний послеоперационный период. Согласно данным крупнейшего наблюдательного эпидемиологического исследования Hemelrijck M. et al., включающего анализ 7608 операций, частота развития инфекции мочевых путей составляет 90,4 на 1000 человеко-лет, что характеризует РЦЭ как операцию высокого риска [16]. В другом исследовании, проведенном Clifford T.G. в 2018 году, из 1133 выполненных операций в объеме цистэктомии у 123 пациентов была выявлена инфекция мочевыводящих путей, и у 25 (20,3%) из них она была диагностирована на стадии уросепсиса [17]. В недавней работе Pellegrino F. (2024), при стандартизации методологии сбора данных о послеоперационных осложнениях при роботизированной РЦЭ, частота осложнений показала еще более высокий уровень — 225 пациентов из 246 операций (91,0%). Наиболее распространенными осложнениями были инфекционные (72,0%) и связанные с мочевыводя-
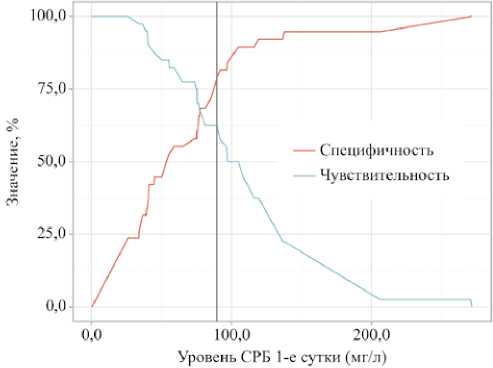
Рисунок 2. Анализ чувствительности и специфичности модели в зависимости от пороговых значений СРБ в 1-е сутки после радикальной цистэктомии (пороговое значение СРБ 89,600 мг/л, чувствительность 62,5% и специфичность 78,9%)
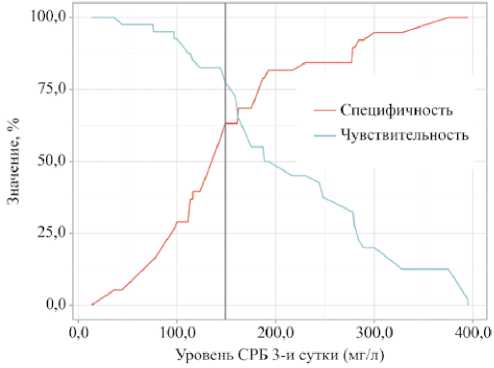
Рисунок 3. Анализ чувствительности и специфичности модели в зависимости от пороговых значений СРБ на 3-и сутки после радикальной цистэктомии (пороговое значение СРБ 148,8 мг/л, чувствительность 77,5% и специфичность 63,2 %)
щими путями (35,0%), причем половина из них возникала в первые 10 дней после операции [18].
Ключевым методом профилактики послеоперационных осложнений при РЦЭ, согласно рекомендациям Европейской ассоциации урологов, является применение мультимодальной программы ранней реабилитации (протокол ERAS), которая может улучшить состояние здоровья пациента перед операцией и снизить частоту послеоперационных осложнений [19]. Однако, доказательная база по этому вопросу ограничена из-за небольшого количества рандомизированных контролируемых исследований. В России в рамках первого многоцентрового исследования по анализу эффективности протокола ERAS при цистэктомии (всего выполнено 134 операции) было установлено, что несмотря на различия в применении пунктов протокола ERAS между клиниками, результаты по осложнениям, летальности и времени пребывания в стационаре были сопоставимы. Результаты факторного анализа показали, что отсутствие стандартизированной антибактериальной профилактики (ОР 0,44, p = 0,015), наличие ишемической болезни сердца в анамнезе (ОР 1,47, p = 0,025) и возраст пациентов старше 75 лет (ОР 2,66, p = 0,053) являются основными предикторами увеличения частоты осложнений в 90-дневном послеоперационном периоде [6]. Эти данные подчеркивают необходимость проведения проспективных исследований эффективности режимов антибактериальной профилактики при радикальной цистэктомии, в том числе в клиниках, работающих по протоколу ERAS.
В настоящее время при поддержке Фонда научных исследований в онкологии и Российского общества клинической онкологии проведено проспективное рандомизированное исследование (NCT05392634) по оценке риска развития инфекционных осложнений в течение 30 дней после РЦЭ в хирургическом стационаре, работающем по протоколу ERAS, с учетом сравнения стандартного и пролонгированного режимов антибиотикопрофилактики [12]. В исследовании MACS установлено, что в течение 30 дней после операции осложнения возникли у 45 пациентов (48,9%). Из ниху 11 пациентов (12,0%) была выявлена инфекция мочевыводящих путей, а в 6 случаях (6,5%) — раневая инфекция. При этом риск развития любого нежелательного события оказался на 45,0% ниже в группе пролонгированного режима (ОР = 0,55; 95% ДИ 0,35–0,87; p = 0,005). Количество осложнений, представляющих клинический интерес, также было выше в группе стандартной АП по сравнению с пролонгированным режимом: 47,8% (22 из 46) против 17,4% (8 из 46) соответственно (p = 0,002). При анализе влияния режима АПФ на частоту инфекций мочевых путей выявлено значительное преимущество пролонгированного режима (ОР = 0,10; 95% ДИ 0,01–0,75; p = 0,012), что подтвердило гипотезу исследования [14].
В данной работе представлен детальный анализ вторичных конечных точек, обусловленный значительным интересом медицинского сообщества к использованию карбапенемов в качестве препарата для антибиотико-профилактики. Проблема устойчивости микроорганизмов к карбапенемам является одной из наиболее актуальных в здравоохранении. Основной механизм резистентности грамотрицательных патогенов к этим антибиотикам — это продукция карбапенемаз. Гены, ответственные за синтез карбапенемаз, часто распространяются между микроорганизмами через плазмиды, что способствует быстрому появлению фенотипа множественной лекарственной устойчивости [20]. Одновременно отмечается необходимость пересмотра классификации ряда хирургических вмешательств (в том числе радикальная цистэктомия) с «условно контаминированных» на «высоко-контаминированные» ввиду доказанной связи между интраоперационным инфицированием брюшной полости и развитием инфекционных осложнений, таких как парез кишечника, инфекции области хирургического вмешательства. Современные исследования показали, что карбапенемы позволяют преодолеть проблемы неадекватности антибиотикотерапии, особенно в контексте выбора и длительности применения антибактериальных препаратов [11,21].
Говоря об устойчивости к карбапенемам, важно отметить, что она опосредована несколькими механизмами. К ним относятся потеря поринов внешней мембраны, что снижает проницаемость клетки для антибиотиков, а также активный вывод антибактериальных препаратов из бактериальной клетки с помощью эффлюксных насосов. Однако наиболее распространённым механизмом является продукция карбапенемаз — ферментов, разрушающих карбапенемы и тем самым нейтрализующих их действие. Этот механизм является основным фактором развития устойчивости к карбапенемам среди грамотрицательных бактерий [22].
Согласно классификации Амблера, сериновые карба-пенемазы включают классы A, C и D, а цинк-зависимые — класс B. Наиболее распространены карбапенемазы классов B (IMP-, VIM- и NDM-типы), класса A (KPC-тип) и класса D (OXA-тип) [23]. Распространенность карбапенемазо-продуцирующих штаммов в стационарах России составляет около 9,9% среди всех протестированных изолятов Enterobacterales. В большинстве случаев (около 7,7%) это сериновые карбапенемазы типа OXA-48, а 1,9% приходится на металло-бета-лактамазы типа NDM [24]. Кроме того, отмечаются региональные различия: в Санкт-Петербурге преобладают штаммы K. pneumoniae с геном NDM-бета-лактамазы, тогда как в Екатеринбурге более половины штаммов продуцируют OXA-48. В Москве наиболее часто встречаются штаммы с беталактамазой OXA-48 [20,24].
В данной работе при иммунохроматографическом анализе было выявлено 9 случаев (9,8%) наличия карбапене-маз. У 2 пациентов (2,2%) карбапенемазы были обнаружены при заборе первой бактериологической пробы в момент операции, а остальные 7 случаев — в БП2–3 после проведённого хирургического лечения. Чаще всего выявлялись карбапенемазы классов В и D, такие как OXA-48 и NDM, которые были зарегистрированы в 8 случаях (8,7%). Наличие этих ферментов было значимо связано с повышенным риском развития инфекционных осложнений, независимо от варианта антибиотикопрофилактики (ОР 2,75; 95% ДИ: 1,15–6,58; p = 0,023). Все случаи выявленных карба-
МУЛЬТИЦЕНТРОВОЕ РАНДОМИЗИРОВАННОЕ ИССЛЕДОВАНИЕ ПРОЛОНГИРОВАННОЙ АНТИБИОТИКОПРОФИЛАКТИКИ
ПРИ ЦИСТЭКТОМИИ В КЛИНИКАХ, РАБОТАЮЩИХ ПО ПРОТОКОЛУ РАННЕГО ПОСЛЕОПЕРАЦИОННОГО ВОССТАНОВЛЕНИЯ (ERAS)
пенемаз были ассоциированы с ростом таких микроорганизмов, как E. coli, E. faecalis, E. faecium и K. pneumoniae, что также соответствует результатам других аналогичных исследований. Кроме того, в работе не было отмечено увеличения частоты выявления карбапенемаз в группе пролонгированной АП: было зафиксировано всего 2 случая против 7 в группе стандартной профилактики (p = 0,050). Эти данные косвенно свидетельствуют в пользу пролонгированной АП, что она не приводит к повышению риска развития антибиотикорезистентности.
При оценке изменений системного иммуно-воспалительного ответа удалось выявить разницу между группами АП только по степени интенсивности подъема уровня СРБ в 1-е сутки котрая составила 35,55 мг/мл (р = 0,020) и разницу между при уровне СРБ на 3-и сутки 28,51 мг/мл (р = 0,067). Дополнительно в исследовании была проанализирована вероятность возникновения любого из инфекционных осложнений после РЦЭ на основе уровня СРБ в ранний послеоперационный период на основе ROC-анализа. Уровень СРБ на 1-е и 3-и сутки после РЦЭ является важным предиктором риска развития инфекционных осложнений, что подчеркивает необходимость его мониторинга в раннем постоперационном периоде. В то время, как данные, полученные на 9-е сутки, не показали статистической значимости, что может свидетельствовать о снижении прогностической ценности уровня СРБ на поздних этапах послеоперационного периода.
В аналогичных работах также была подчеркнута роль СРБ в качестве важного предиктора для выявления инфекционных осложнений после больших хирургических операций, включая РЦЭ. Исследования показывают, что динамика уровня СРБ может помочь в ранней диагностике послеоперационных осложнений, таких как инфекции или несостоятельность анастомоза, особенно в первые 3–7 дней после операции. Например, в двух смежных хирургических работах установлено, что уровни СРБ именно на 3-и сутки после операции могут с высокой точ- ностью предсказать развитие инфекционных осложнений, что делает его полезным инструментом для клинического мониторинга и принятия решений о дальнейшей диагностике или лечении [25,26]. В работе Straatman J. и соавт. (2015) было выявлено два критически важных пороговых значения СРБ для прогнозирования серьезных послеоперационных осложнений, таких как перитонит и сепсис. Уровень СРБ ниже 75 мг/л имел отрицательную прогностическую ценность 97,2%, что позволяло безопасно выписать пациента. Однако при уровне СРБ 215 мг/л вероятность осложнений возрастала до 20%, и пациентам рекомендовалось срочное проведение дополнительной КТ-визуализации для исключения или подтверждения осложнений [27]. Таким образом, использование СРБ как предиктивного маркера в клинической практике значительно улучшает возможности ранней диагностики инфекционных осложнений и оптимизирует лечение пациентов после хирургических вмешательств.
ВЫВОДЫ
Данное проспективное рандомизированное исследование является позитивной работой, подчеркивающей потенциальные преимущества пролонгированного режима антибиотикопрофилактики для снижения 30-дневных послеоперационных осложнений после радикальной цистэктомии. При оценке вторичных конечных точек, нам удалось установить менее интенсивный подъем С-реактивного белка в группе пролонгированной анти-биотикопрофилактики, а также продемонстрировать предиктивное значение уровня белка при выявлении осложнений. Важно отметить, что данный режим не увеличивал частоту антибиотикорезистентности, несмотря на выявление карбапенемаз, что делает его перспективным для обновления протоколов антибиотикопрофилак-тики в онкохирургии.
Список литературы Мультицентровое рандомизированное исследование пролонгированной антибиотикопрофилактики при цистэктомии в клиниках, работающих по протоколу раннего послеоперационного восстановления (ERAS)
- Witjes J.A., Bruins H.M., Cathomas R. et.al. European Association of Urology Guidelines on Muscle-invasive and Metastatic Bladder Cancer: Summary of the 2020 Guidelines. Eur Urol 2021;79(1):82-104. https://doi.org/10.1016/j.eururo.2020.03.055
- Hautmann R.E., de Petriconi R.C., Volkmer B.G. Lessons learned from 1,000 neobladders: the 90-day complication rate. J Urol 2010;184(3):990-1235. https://doi.org/10.1016/j.juro.2010.05.037
- Даренков С.П., Кривобородов Г.Г., Котов С.В. Осложнения радикальной цистэктомии с орто- и гетеротопической кишечной пластикой (обзор литературы). Вестник РГМУ 2013;4:49-53.
- Lawrentschuk N., Colombo R., Hakenberg O.W., et al. Prevention and management of complications following radical cystectomy for bladder cancer. Eur Urol 2010;57(6):983-1001. https://doi.org/10.1016/j.eururo.2010.02.024
- Носов А.К., Рева С.А., Джалилов И.Б., Петров С.Б. Радикальная цистэктомия при раке мочевого пузыря: сравнение ранних хирургических осложнений при лапароскопической, открытой и видеоассистированyой операции. Онкоурология 2015;11(3):71-78. https://doi.org/10.17650/1726-9776-2015-11-3-71-78
- Котов С.В., Хачатрян А.Л., Котова Д.П. и соавт. Анализ результатов применения протокола ERAS в реальной клинической практике при радикальной цистэктомии (первое проспективное мультицентровое исследование в России). Урология 2019;6:60-66. https://doi.org/10.18565/urology.2019.6.60-66
- Peerbocus M., Wang Z.J. Enhanced Recovery After Surgery and Radical Cystectomy: A Systematic Review and Meta-Analysis. Res Rep Urol 2021;13:535-547. https://doi.org/10.2147/RRU.S307385
- Профилактика инфекций области хирургического вмешательства. Клинические рекомендации под редакцией Брико Н.И., Божкова С.А., Брусина Е.Б. и соавт. Н. Новгород: Изд-во «Ремедиум Приволжье» 2018:72
- Асланов Б.И., Зуева Л.П., Колосовская Е.Н. и соавт. Принципы организации периоперационной антибиотикопрофилактики в учреждениях здравоохранения. Федеральные клинические рекомендации. М; 2014:42
- Altemeier W.A., Burke J.F., Pruitt B.A.Jr., Sanduskiy W.R. Manual on control of infection in surgical patients. Philadelphia: Lippincott 1972:20-32
- Атдуев В.А., Гасраталиев В.Э., Ледяев Д.С., Шевелев И.С., Бельский В.А. Предикторы послеоперационных осложнений радикальной цистэктоми. Онкология, Журнал им. П.А. Герцена 2019;8(5):348-357. https://doi.org/10-17116/onkolog20198051348
- Беркут М. В, Мамижев Э.М., Галунова Т.Ю. и соавт. Клиническое исследование: мультицентровое исследование по использованию превентивной антибиотикотерапии при цистэктомии в условиях раннего послеоперационного восстановления (исследование MACS). Вопросы онкологии 2023;69(3):415-421. https://doi.org/10.37469/0507-3758-2023-69-3-415-421
- Berkut M.V., Belyaev A.M., Galunova T.Yu., et al. Effectiveness of Prolonged Antibiotic Prophylaxis in Radical Cystectomy: Preliminary Analysis of the MACS Randomized Clinical Trial. Bladder Cancer 2024;1-12. https://doi.org/10.3233/BLC-240012
- Berkut M.V., Belyaev A.M., Galunova T.Y. et.al. Prolonged 120-h meropenem antibiotic prophylaxis in radical cystectomy compared to 24h standard antibiotic prophylaxis: Final analysis of the randomized clinical trial. Arab J Urol 2024;22(4):235-242. https://doi.org/10.1080/20905998.2024.2373399
- Volland H., Girlich D., Laguide M., et al. Improvement of the Immunochromatographic NG-Test Carba 5 Assay for the Detection of IMP Variants Previously Undetected. Antimicrob Agents Chemother 2019;64(1):e01940-19. https://doi.org/10.1128/AAC.01940-19
- Van Hemelrijck M., Thorstenson A., Smith P. et.al. Risk of in-hospital complications after radical cystectomy for urinary bladder carcinoma: population-based follow-up study of 7608 patients. BJU Int 2013;112(8):1113-1120. https://doi.org/110.1111/bju.12239
- Clifford T.G., Katebian B., Van Horn C.M., et al. Urinary tract infections following radical cystectomy and urinary diversion: a review of 1133 patients. World J Urol 2018;36(5):775-781. https://doi.org/10.1007/s00345-018-2181-2
- Pellegrino F., Leni R., Basile G., et al. Peri- and post-operative outcomes of robot-assisted radical cystectomy after the implementation of the EAU guidelines recommendations for collecting and reporting complications at a high-volume referral center. World J Urol 2024;42(1):270. https://doi.org/10.1007/s00345-024-04970-x
- Williams S.B., Cumberbatch M.G.K., Kamat A.M., et al. Reporting Radical Cystectomy Outcomes Following Implementation of Enhanced Recovery After Surgery Protocols: A Systematic Review and Individual Patient Data Meta-analysis. Eur Urol 2020;78(5):719-730. https://doi.org/10.1016/j.eururo.2020.06.039
- Черненькая Т.В., Борисова Л.А., Воробьева Т.Ю. и соавт. Карбапенемазы, продуцируемые полирезистентными штаммами Klebsiella pneumoniae, выделенными от пациентов реанимационного профиля. Журнал им. Н.В. Склифосовского Неотложная медицинская помощь 2024;13(1):22-28. https://doi.org/10.23934/2223-9022-2024-13-1-22-28
- Radko M, Guzek A, Syryło T, Rybicki Z, Zieliński H. Preliminary trial of 24 vs 72 hour perioperative meropenem in patients with ESBL-producing Enterobacterales bacteriuria scheduled for urological procedures. Cent European J Urol 2022;75(2):209-215. https://doi.org/10.5173/ceju.2022.0109
- Невежина А.В. Карбапенемазы как фактор устойчивости к антибактериальным препаратам. Acta biomedica scientifica 2020;5(6):95-105. https://doi.org/10.29413/ABS.2020-5.6.11
- Полищук А.Г., Якубович Е.И., Полухина О.В. и соавт. Карбапенемаза-продуцирующие грамотрицательные бактерии в специализированном стационаре Санкт-Петербурга. Инфекция и иммунитет 2017;7(2):181-192. https://doi.org/10.15789/2220-7619-2017-2-181-192
- Эйдельштейн М.В., Шайдуллина Э.Р., Иванчик Н.В. и соавт. Антибиотикорезистентность клинических изолятов Klebsiella pneumoniae и Escherichia coli в стационарах России: результаты многоцентрового эпидемиологического исследования. Клиническая микробиология и антимикробная химиотерапия 2024;26(1):67-78. https://doi.org/10.36488/cmac.2024.1.67-78
- Platt, J.J., Ramanathan, M.L., Crosbie, R.A., et al. C-reactive protein as a predictor of postoperative infective complications after curative resection in patients with colorectal cancer. Ann Surg Oncol 2012;19(13):4168-4177. https://doi.org/10.1245/s10434-012-2498-9
- Charbonneau J., Brind ’Amour A., Sideris L., et al. Predictive Value of C-Reactive Protein for Infectious Complications After Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy: A Single-Center Prospective Study. Ann Surg Oncol 2024. https://doi.org/10.1245/s10434-024-15986-3
- Straatman J., Harmsen A.M.K., Cuesta M.A. et.al. Predictive Value of C-Reactive Protein for Major Complications after Major Abdominal Surgery: A Systematic Review and Pooled-Analysis. PLoS One 2015;10(7):e0132995. https://doi.org/10.1371/journal.pone.0132995


