Мультимодальный подход к дифференциальной диагностике метастатического поражения при раке молочной железы: описание клинического случая
Автор: Колядина Ирина В., Абдуллаев Амир Г., Танишина Нина Б., Перфильев Илья Б., Долгушин Михаил Б., Оджарова Акгуль А., Козлов Николай А., Ганьшина Инна П., Чистякова Ольга В., Поддубная Ирина В., Павликова Ольга А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Диагностика и лечение опухолей. Оригинальные статьи
Статья в выпуске: 3 (24), 2017 года.
Бесплатный доступ
Современная комплексная диагностика и качественный морфологический диагноз являются важными условиями выработки оптимального лечебного алгоритма при подозрении на рецидив рака молочной железы. На собственном клиническом примере показана важность мультимодального подхода к дифференциальной диагностике вторичного опухолевого поражения. Благодаря современной клинико-рентгенологической диагностике, интервенционным технологиям, качественному морфологическому анализу и тесному взаимодействию всех членов мультидисциплинарной команды у пациентки с подозрением на рецидив рака молочной железы удалось верифицировать поражение неопухолевого генеза (саркоидоз) и спланировать правильную тактику лечения.
Рецидив рака молочной железы, саркоидоз лимфоузлов средостения, дифференциальная диагностика опухолевого поражения, пэт/кт с 18f-фдг, пэт/кт с 18f-фторэстрадиолом (фэс), транспищеводная биопсия лимфоузлов средостения
Короткий адрес: https://sciup.org/140223342
IDR: 140223342 | DOI: 10.18027/2224-5057-2017-7-3-31-36
Текст научной статьи Мультимодальный подход к дифференциальной диагностике метастатического поражения при раке молочной железы: описание клинического случая
В основе современной стратегии лечения распространенного рака молочной железы (РМЖ) лежит не только тщательная оценка клинических факторов и распространенности опухолевого процесса, но и анализ биологических характеристик рецидивной опухоли. Согласно современным международным и отечественным рекомендациям (NCCN 2.2017, AGO 2016, ESMO-ESO-ABC-3, RUSSCO 2016) персонифицированный подход к терапии предполагает инвазивную верификацию метастатического поражения как минимум из первого рецидива РМЖ [1–4]. В рутинной клинической практике онкологи часто планируют лечебный алгоритм на основании данных только клинического и рентгенологического исследования и пренебрегают возможностью повторной верификации диагноза, особенно при внутригрудных и внутри-брюшных локализациях метастазов РМЖ. Между тем, вероятность обнаружения гетерогенного клона опухоли достаточно высока: по данным NCCN, расхождение в рецепторном статусе между первичной опухолью молочной железы и ее рецидивом достигает 60% по статусу рецепторов эстрогена (ER) и 11% по статусу HER2, что может кардинальным образом изменить лекарственный подход и переломить фатальности ситуации [1]. Важно, что под «маской» метастатического поражения при РМЖ могут скрываться и неопухолевые заболевания, такие как саркоидоз; следствием ошибки в интерпретации данных будет необоснованная смена лекарственного режима или назначение ненужного токсического лечения [5, 6]. Только комплексный мультимодальный подход с привлечением специалистов различного профиля позволяет провести качественную дифференциальную диагностику, верифицировать диагноз и спланировать оптимальный алгоритм лечения. Важность такого подхода в рутинной практике представляем на собственном примере лечения пациентки.
Клинический пример
Пациентка Ш., 53-х лет, в менопаузе, находится на динамическом наблюдении в ФГБУ «РОНЦ им. Н. Н. Блохина» с 2010 г.
Анамнез заболевания: в 2010 г. в возрасте 46 лет по поводу рака левой молочной железы Т2N0M0 II A стадии больной проведено комплексное лечение: органосохраняющая операция, 6 циклов адъювантной полихимиотерапии по схеме CAF, лучевая терапия на оставшуюся часть левой молочной железы, с 2010 г. пациентка получает эн-докринотерапию тамоксифеном 20 мг в сутки. По данным планового морфологического исследования первичной опухоли: опухоль молочной железы имеет строение инвазивного слизистого рака 2 степени злокачественности, ER (+) PR (+) HER21+, в регионарных лимфоузлах – без метастатического поражения. Медико-генетическое консультирование в РОНЦ: при исследовании ДНК, выделенной из лимфоцитов периферической крови, значимых герминальных мутаций генов BRCA1, BRCA2 и CHEK2 не выявлено. При исследовании ДНК, выделенной из лимфоцитов периферической крови полиморфных вариантов, в гене цитохрома CYP2D6 не выявлено; особенности ге-
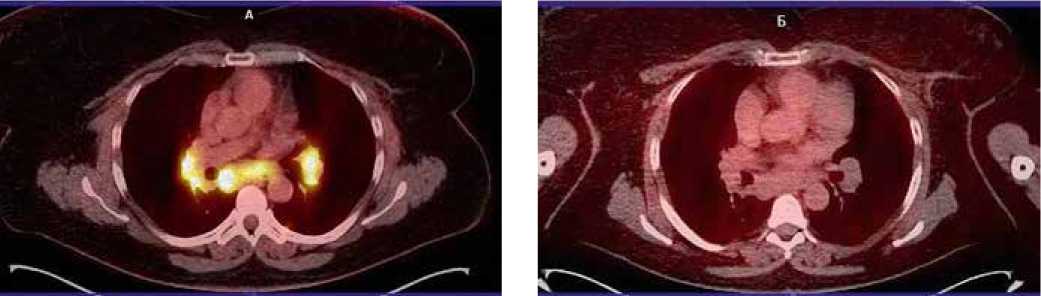
Рисунок 1. ПЭТ/КТ картина увеличения внутригрудных лимфоузлов: А – с патологическим включением 18F-ФДГ; Б – отсутствие патологического включения 18F-ФЭС
нотипа не предполагают снижения чувствительности к тамоксифену.
С января 2017 г. на фоне адъювантной эндокрино-терапии тамоксифеном у пациентки появились жалобы на кашель при физической нагрузке. При рентгенографическом исследовании органов грудной клетки выявлено расширение корней легких. При КТ-исследовании в средостении определяются увеличенные лимфатические узлы: паравазальные – до 0,4 см, цепочка передних паратрахеальных – до 0,7 см, на уровне дуги аорты - до 1 см, трахеобронхиальный справа - 1,2 х 0,8 см, бифуркационный - 2,3 х 1,1см, в корнях обоих легких – множественные лимфатические узлы от 1,1 до 1,6 см. В S5 правого легкого определяется очаг округлой формы с нечеткими контурами, размерами 0,3 х 0,4 см. В субплевральных отделах S10 левого легкого – очаг до 0,4 см. Заключение: Метастатическое поражение внутригрудных лимфатических узлов? Единичные очаговые образования в легких доброкачественного характера (постлучевые изменения). Анализ крови: РЭА – 1,68 нг/ мл, СА15.3 – 34,46 Е/мл. Других проявлений прогрессирования опухолевого процесса не отмечено, локальный статус – без особенностей.
С целью уточнения распространенности и активности опухолевого процесса больной выполнено ПЭТ/КТ в марте 2017 г. с 18F-ФДГ; отмечено повышенное накопление 18F-ФДГ воспалительного (реактивного) характера в одиночном яремном лимфоузле верхней трети шеи справа (макс. SUV 3,56 до 0,5 см), паратрахеальном лимфоузле справа (макс. SUV 3,03 до 1,2 см), в аорто-легочном окне (макс. SUV 2,02 до 1,0 см), бифуркационном (макс. SUV 2,72 до 2,2 х 1,0 см), корнях легких (справа макс. SUV 2,90 и слева SUV 2,86 до 1,5 см). В легких – без явных «свежих» очаговых и инфильтративных изменений. Заключение: убедительные данные о наличии опухолевой ткани с гиперметаболической активностью РФП не получены.
С учетом данных рентгенологического исследования для исключения прогрессирования гормонопозитивного
РМЖ на фоне адъювантной эндокринотерапии тамоксифеном больной запланировано ПЭТ/КТ с 18F-фторэ-страдиолом (18F-ФЭС); за 2 месяца до предполагаемой даты исследования тамоксифен был отменен. На фоне отмены тамоксифена появления каких-либо новых жалоб не отмечено. При выполнении повторной ПЭТ/КТ с 18F-ФДГ от 14.06.2017 (на фоне отмены тамоксифена в течение двух месяцев) отмечена отрицательная динамика в виде появления метаболической активности и увеличения размеров выявленных изменений: в яремном лимфоузле верхней трети шеи справа макс. SUV 4,00 (ранее был 3,56) до 0,7 см, паратрахеальном лимфоузле справа – макс. SUV 5,84 (ранее 3,03) до 1,6 см, в аорто-легочном окне – макс. SUV 6,07 (ранее 2,02) до 1,0 см, в области бифуркации трахеи – макс. SUV 15,02 (ранее 2,72) до 2,1 х 5,0 см, корнях легких справа – макс. SUV 15,36 (ранее 2,90) до 4,0 см и слева – SUV 12,74 (ранее 2,86) до 3,5 см. В легких инфильтративных изменений не выявлено, в прикорневых отделах правого легкого отмечаются очаги накопления до 0,4 см: в верхней доле – с макс. SUV до 2,56, в средней доле – с макс. SUV до 1,91, в нижней доле – с макс. SUV до 5,09. Слева в прикорневой зоне нижней доли S10 – очаг 0,6 см с макс. SUV до 2,96. Заключение: получены данные о наличии патологической ткани в указанных лимфоузлах с гиперметаболической активностью 18F-ФДГ (рис. 1А). Однако при выполнении ПЭТ/КТ с 18F-ФЭС от 08.06.2017 очагов повышенного накопления 18F-фторэстрадиола не определялось, что говорит об отсутствии данных о наличии ER+ опухолевой ткани в контрольных лимфоузлах (рис. 1Б).
С учетом изначального гормонопозитивного статуса первичной опухоли, положительного результата ПЭТ/КТ с 18F-ФДГ и отрицательного результата ПЭТ/КТ с 18F-Ф-ЭС можно предполагать, что увеличение внутригрудных лимфоузлов у данной пациентки не связано с основным диагнозом или возможно расхождение в рецепторном статусе между первичной опухолью молочной железы и ее рецидивом.
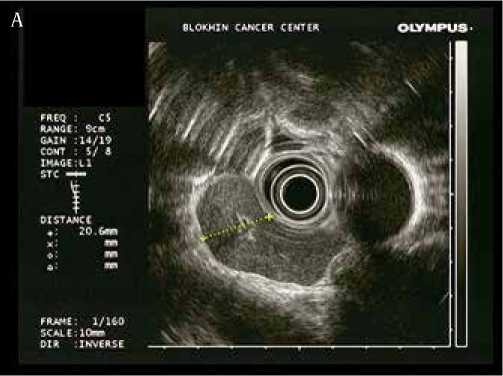
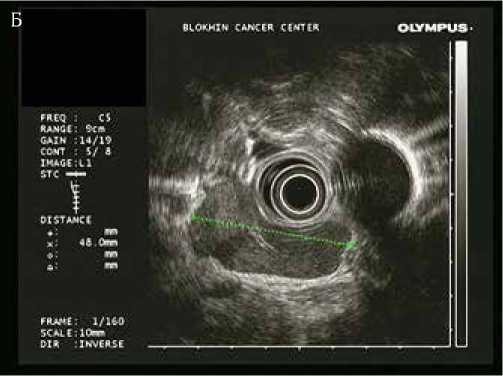
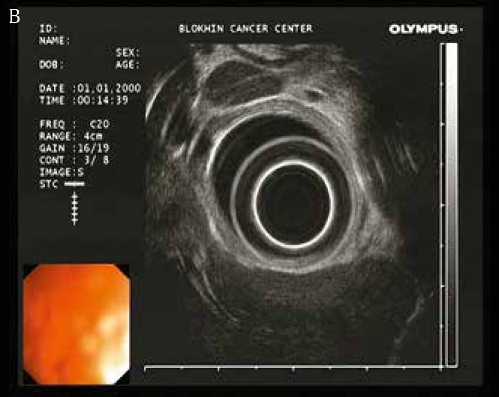
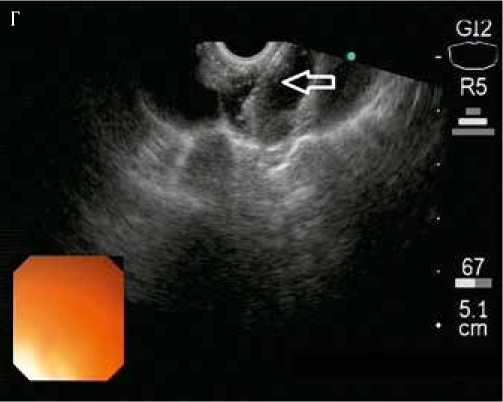
Рисунок 2. Эндосонографическая картина измененных лимфоузлов средостения (А – В) и транспищеводной пункционной биопсии под эндосонографическим контролем (Г)
Выполнена транспищеводная эндосонография средостения. При сканировании визуализируются увеличенные лимфатические узлы средостения 8, 7, 6 и 4L групп (IASLC lymph node map 2009). Измененные лимфатические узлы овальной и полициклической формы размерами до 48 x 20 мм (П/ПЗ>2). Структура лимфатических узлов гипоэхогенная, однородная, капсула не утолщена, хорошо дифференцируется. Экстракапсулярного распространения не выявлено. Лимфоузлы тесно прилежат к пищеводу, без признаков врастания. Под контролем ЭУС выполнена транспищеводная пункционная биопсия лимфатического узла 8 группы, материал направлен на морфологическое исследование.
При цитологическом исследовании пунктата лимфоузлов средостения выявленные изменения соответствуют гранулематозному лимфадениту, необходимо исключить специфический характер поражения – саркоидоз.
При гистологическом исследовании морфологическая картина соответствует саркоидозу: полосовидные кусочки фиброзной ткани с множественными эпителиоидно-
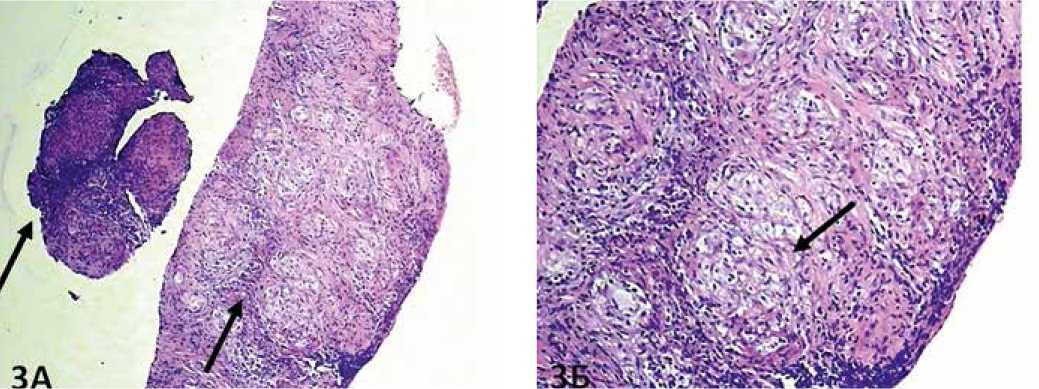
Рисунок 3. Морфологическое исследование биоптата лимфоузлов средостения: гистологическое исследование (А, Б)
клеточными гранулемами (указаны стрелками, рис. 3А), разделенными лимфоидным инфильтратом, без очагов некроза, гематоксилин-эозин, х 50; рис. 3Б - некротизирующиеся мономорфные эпителиоидноклеточные гранулемы (указаны стрелкой) – гистологическая картина саркоидоза, гематоксилин-эозин, х 100.
С учетом полученной морфологической верификации саркоидоза лимфоузлов средостения пациентка направлена на консультацию в специализированный стационар, рекомендована дальнейшая эндокринотерапия тамоксифеном 20 мг/сутки.
Заключение
Современный персонифицированный подход в лечении рака молочной железы основывается на комплексной мультимодальной диагностике, позволяющей добиться максимальной продуктивности работы всей мультидис-циплинарной команды. Благодаря современной рентгенологической диагностике и активным интервенционным вмешательствам удается получить качественный материал для полноценного морфологического исследования, что крайне важно для верификации опухолевого поражения и исключения патологии неопухолевого генеза.
Информация об авторах
Ирина В. Колядина , д. м. н., с. н. с. Научно-исследовательского центра, профессор кафедры онкологии ФГБОУ ДПО РМАНПО на базе
Амир Г. Абдуллаев , д. м. н., и. о. заведующего хирургическим отделением диагностики опухолей ФГБУ «РОНЦ им. Н. Н. Блохина» Минздрава РФ
Нина Б. Танишина , к. м. н., м. н. с. отделения позитронной эмиссионной томографии НИИ клинической и экспериментальной радиологии ФГБУ «РОНЦ им. Н. Н. Блохина» Минздрава РФ
Илья Б. Перфильев , к. м. н., и. о. заведующего эндоскопического отделения ФГБУ «РОНЦ им. Н. Н. Блохина» Минздрава РФ
Михаил Б. Долгушин , д. м. н., зав. отделением позитронной эмиссионной томографии НИИ клинической и экспериментальной радиологии
ФГБУ «РОНЦ им. Н. Н. Блохина» Минздрава РФ
Акгуль А. Оджарова , к. м. н., с. н. с. отделения позитронной эмиссионной томографии НИИ клинической и экспериментальной радиологии ФГБУ «РОНЦ им. Н. Н. Блохина» Минздрава РФ
Николай А. Козлов , к. м. н., врач-патологоанатом отдела патологической анатомии человека ФГБУ «РОНЦ им. Н. Н. Блохина» Минздрава РФ
Инна П. Ганьшина , к. м. н., в. н. с. отделения химиотерапии и комбинированного лечения злокачественных опухолей ФГБУ «РОНЦ им. Н. Н. Блохина» Минздрава РФ
Ольга В. Чистякова , к. м. н., в. н. с. лаборатории клинической цитологии ФГБУ «РОНЦ им. Н. Н. Блохина» Минздрава РФ
Ирина В. Поддубная , д. м. н., профессор, академик РАН, зав. кафедрой онкологии ФГБОУ ДПО РМАНПО на базе ФГБУ
«РОНЦ им. Н. Н. Блохина» Минздрава РФ
Ольга А. Павликова , аспирант кафедры онкологии ФГБОУ ДПО РМАНПО на базе ФГБУ «РОНЦ им. Н. Н. Блохина» Минздрава РФ
Multimodal approach to differential diagnosis of breast cancer metastatic lesions: case report
I. V. Kolyadina1, 2, A. G. Abdullaev2, N. B. Tanishina2, I. B. Perfiliev2, M. B. Dolgushin2, A. A. Odzharova2, N. A. Kozlov2, O. V. Chistyakova2, I. P. Ganshina2, O. V. Chistyakova2, I. V. Poddubnaya1, 2, O. A. Pavlikova1, 2
-
1 Russian Medical Academy of Continuing Professional Education of the Ministry of Health of the Russian Federation, Moscow, Russia
-
2 N. N. Blokhin Russian Cancer Research Center of the Ministry of Health of the Russian Federation, Moscow, Russia


