Мультиплексная аналитическая система для определения ДНК методом ПЦР в реальном времени
Автор: Наволоцкий Д.В., Крисько А.В., Арнаутов В.А., Гейбо Д.С., Ганеев А.А., Сляднев Максим Николаевич
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Исследования, приборы, методики
Статья в выпуске: 1 т.20, 2010 года.
Бесплатный доступ
Разработана микрочиповая аналитическая система для проведения полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) с одновременным детектированием флуоресценции двух красителей, которая позволяет проводить несколько ПЦР-РВ в одном микрореакторе (мультиплексная ПЦР-РВ). Микрочип выполнен в виде пластины из теплопроводного материала и содержит 16 или 30 микрореакторов объемом 1-2 мкл, покрываемых слоем герметизирующей жидкости, что обеспечивает возможность прямого ввода проб в микрореакторы. Разработана методика модификации поверхности микрочипов, выполненных из кремния и алюминия, для создания гидрофильной зоны внутри микрореакторов и гидрофобной зоны за их границами, что позволяет надежно удерживать пробу внутри микрореакторов при термоциклировании, предотвращает ингибирование ПЦР и взаимное перемешивание проб. Продемонстрированы аналитические возможности созданной микрочиповой системы с использованием коммерчески доступных мультиплексных ПЦР-РВ-тест-систем на примере определения ДНК генетически-модифицированных организмов (ГМО) и показаны ее преимущества для создания системы экспрессного скрининга ГМО, обладающей высоким быстродействием (20 мин для выявления наличия или отсутствия ГМО), низким расходом реагентов ПЦР-тест-системы (1-2 мкл смеси, что в 15-30 раз меньше стандартных пробирок), малым числом операций при вводе проб в микрореакторы и повышенной надежностью результатов ПЦР-анализа за счет использования мультиплексных тест-систем с внутренним контролем, что делает систему привлекательной для широкого применения на практике.
Микрочип, пцр в реальном времени, мультиплексная пцр, днк
Короткий адрес: https://sciup.org/14264633
IDR: 14264633 | УДК: 543.42;
Текст научной статьи Мультиплексная аналитическая система для определения ДНК методом ПЦР в реальном времени
Миниатюризация аналитических систем открывает новые горизонты в химическом анализе. Она позволяет не только повысить экспрессность анализа и уменьшить расход реагентов, но и получить качественно новые характеристики и свойства системы [1]. Одним из вариантов миниатюрных аналитических систем являются микрочиповые системы, в которых аналитические реакции проводятся в микроканалах и микрореакторах в точно контролируемых условиях. Микрочиповые системы также используются для автоматизации процедуры анализа и объединяют несколько стадий анализа в одном микрочиповом устройстве [2–4]. Преимущества микрочиповых систем были продемонстрированы для систем анализа, реализующих электрокинетические и хроматографические методы разделения, методы жидкостно-жидкостной и твердофазной экстракции, электрохимические методы, а также биохимические и иммуно-ферментные методы [5].
Особый интерес был проявлен к молекулярногенетическому анализу нуклеиновых кислот (ДНК/РНК) методом полимеразно-цепной реакции
(ПЦР) [6, 7], и в ряде работ исследователи продемонстрировали возможность полного анализа различных биологических образцов в единой микро-чиповой системе — от стадии пробоподготовки до получения количественного результата определения содержания ДНК методом ПЦР-РВ [8]. Проведение ПЦР в микрочиповой системе, кроме уже указанных преимуществ, позволяет повысить селективность и эффективность реакции за счет увеличения скорости термоциклирования [9]. Однако, хотя предложенные микрочиповые системы полного анализа и обладают преимуществами над традиционными системами, они не лишены таких недостатков как сложность ввода проб в микрочип для анализа, высокие требования к технологиям изготовления и высокая стоимость микрочипа, объединяющего несколько стадий анализа [2]. Кроме того, до сих не продемонстрированы результаты систематических исследований мультиплексной ПЦР-РВ в микрочиповых аналитических системах с высоким быстродействием, которая является общепринятым стандартом при экспрессной ПЦР-диагностике. Эти недостатки ограничивают широкое применение существующих микро-чиповых систем ПЦР-анализа для задач клиниче- ской диагностики, судебной медицины, контроля качества пищевых продуктов, таможенного контроля и обеспечения биологической безопасности.
Для широкого применения микрочиповая аналитическая система ПЦР-анализа должна быть устойчива к изменениям свойств анализируемых образцов, удобна в эксплуатации, не требовать высокой квалификации персонала, иметь низкую себестоимость расходных материалов. Как правило, микрофлюидные чипы не позволяют сбалансировать все перечисленные требования, и их использование ограничивается применением в научных лабораториях и крупных исследовательских центрах. Одним из вариантов решения данной задачи может служить применение микрочиповых систем с так называемыми открытыми микрореакторами, которые сочетают функциональность ячеек многолуночного микропланшета [10–12] и экспресс-ность микрочиповых систем.
Несмотря на то что разработкам подобных систем посвящено много работ, оптимального решения существующих проблем предложено не было [13–15]. Основные усилия разработчиков направлены на достижение сочетания надежной локализации растворов проб внутри микрореакторов и обеспечении быстрого обмена тепла между нагревательным элементом и раствором пробы. Коммерческое распространение получили системы, в которых реализована только одна из указанных задач. Прибор компании BioTrove [16] проводит анализ одной или нескольких проб во множестве микрореакторов, содержащих разные наборы праймеров, в то время как прибор компании Advalytix [17] после проведения ПЦР осуществляет регистрацию продуктов методом гель-электрофореза или путем гибридизации продуктов с синтезированными на поверхности олигонуклеотидами в том же микрореакторе. Увеличением количества получаемой информации за счет большого количества одновременных реакций эти системы компенсируют низкие скорости термоциклирования и, следовательно, большое время анализа. В работе [18] показана реализация ПЦР-РВ при быстром термоциклировании, однако малое число анализируемых проб, детектирование только одного красителя и низкая надежность удержания проб в зоне термоциклирования не позволяют такой системе достичь широкого распространения.
ПЦР-РВ-тест-системы, коммерчески доступные для клинической медицинской диагностики и анализа генетически-модифицированных организмов (ГМО), как правило, рассчитаны на проведение мультиплексной ПЦР и в основном содержат два набора реагентов с двумя зондами, меченными разными флуоресцентными красителями [19]. Первый набор используется для определения наличия интересующей последовательности ДНК (специфичный набор), второй используется в ка- честве внутреннего контроля (ВК) для достоверной интерпретации отрицательного результата ПЦР-РВ на канале специфичного зонда. Для возможности использования таких ПЦР-РВ-тест-систем микрочиповая аналитическая система должна обеспечить проведение мультиплексной ПЦР в каждом микрореакторе с одновременным детектированием как минимум двух красителей: для специфичного зонда и зонда ВК.
Данная работа посвящена разработке быстродействующей микрочиповой аналитической системы для проведения мультиплексной ПЦР-РВ с одновременным детектированием флуоресценции двух красителей — 5(6)-карбоксифлуоресцеин (FAM) и 5(6)-карбокси-Х-родамин (ROX). В разработанной системе предложено использование микрочипа, который представляет собой пластину с прямоугольными углублениями (микрореакторами), покрытую слоем герметизирующей жидкости. Конструкция такого микрочипа позволяет осуществлять удобный ручной или автоматизированный ввод анализируемого раствора в микрореакторы, использовать существующие ПЦР мультиплексные тест-системы с двумя красителями, а также проводить дополнительные методологические операции: иммобилизация реактивов, высушивание раствора пробы внутри микрореакторов или извлечение реакционной смеси из микрореактора для дальнейших операций (гель-электро-фореза, гибридизации, клонирования). В работе были разработаны микрочипы с 16 и 30 микрореакторами из кремния и алюминия — материалов, обладающих высокой теплопроводностью. Проведена оптимизация методик модификации поверхности кремния и алюминия внутри микрореакторов с целью обеспечения защиты от ингибирования, а также поверхности снаружи микрореакторов с целью предотвращения смешивания проб между собой. Оптимизирована система термоциклирования, которая обеспечивает быстрое и точное динамическое управление температурой реакционной смеси в микрореакторах. Разработана система флуоресцентного детектирования на основе ПЗС-матрицы, светодиодов и интерференционных светофильтров, не содержащая подвижных элементов и позволяющая детектировать сигналы от флуоресцентных красителей в двух диапазонах длин волн. Исследованы аналитические характеристики предложенной системы на примере определения фрагмента ДНК, соответствующего промотору 35S, присутствующему в ГМО растительного происхождения [20] и показаны ее преимущества для создания системы экспрессного скрининга ГМО, обладающей высоким быстродействием (20 мин для выявления наличия или отсутствия ГМО), низким расходом реагентов ПЦР-тест-системы (1–2 мкл смеси, что в 15–30 раз меньше стандартных пробирок), низкими трудозатратами при вводе проб в микрореакторы (5 минут) и повышенной надежностью результатов ПЦР-анализа за счет использования мультиплексных тест-систем с внутренним контролем.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изготовление микрочипа
Микрочипы изготавливались из кремниевых пластин толщиной 600 мкм по технологии, аналогичной описанной в работах [21–22]. На микроре-акторной пластине размером 25 × 28 мм были размещены в виде матрицы 4 × 4 16 микрореакторов, представляющих собой усеченные пирамиды с параметрами: 2 × 2 мм (верхнее основание), 1.4 × 1.4 мм (нижнее основание), 0.4 мм (глубина). Микрореакторы в микрочипе из кремния изготавливались по технологии жидкостного анизотропного травления [23]. После травления поверхность микрочипа термически окислялась, так что на ней образовался слой оксида кремния толщиной 150 ±20 нм. Перед проведением модификации поверхность кремниевого микрочипа гидратировалась обработкой смесью 1:1 концентрированной серной кислоты и пероксида водорода 30 % в течение 15 мин, затем дважды промывалась дистиллированной водой.
Для создания микрочипа из алюминия использовались пластины алюминия марки АД-31 толщиной 0.5 мм. Микрореакторы создавались путем изотропного травления в смеси фосфорной и соляной кислоты (3:1) с использованием маски из полимерной самоклеящейся пленки (641M, Oracal), изготовленной методом плоттерной резки. Маска содержала 16 квадратных отверстий, размещенных в виде матрицы 4×4 с размерами 2×2 мм, или 30 квадратных отверстий, размещенных в виде матрицы 5×6 с размерами 1.3×1.3 мм. Средние размеры образующихся микрореакторов, представляющих собой лунки, которые по форме повторяли контуры исходной маски, составили 2.4×2.4×0.2 мм и 1.7×1.7×0.2 мм соответственно . После травления поверхность микрочипа осветлялась в 10 % азотной кислоте, промывалась дистиллированной водой. Нанесение слоя оксида кремния проводилось через газовую фазу на воздухе при помощи тетрахлорида кремния (Acros Organics, New Jersey, USA), толщина слоя SiO 2 контролировалась по интерференционному окрашиванию, а затем микрочип промывался дистиллированной водой.
После промывания дистиллированной водой микрочипы из кремния и алюминия модифицировались для создания гидрофильных зон внутри микрореакторов и гидрофобных зон между реакторами.
Модификация поверхности
На поверхность кремниевых и алюминиевых чипов между реакторами при помощи штампа с впитывающим материалом наносился слой полиметилметоксисилоксана (ПММС) ("Пента-107", Пента-Север, Санкт-Петербург, Россия) и высушивался 20 мин при комнатной температуре.
Для обработки поверхности внутри микроректоров они заполнялись [3-(2,3-эпоксипропокси)-пропил]-триметоксисиланом (Merck Schuchardt OHG, Hohenbrunn, Germany) и выдерживались 1 час при температуре 70 ° C. Затем метоксисилан удалялся насосом, микрореакторы заполнялись этиленгликольдиметиловым эфиром (Sigma-Aldrich Chemie GmbH, Steinheim, Germany) и выдерживались 1 час при температуре 70 ° C. В завершение микрочип трижды промывался дистиллированной водой. В результате модификации поверхность между микрореакторами приобретала гидрофобные свойства, а внутри микрореакторов — гидрофильные свойства.
Экспериментальная установка
Для детектирования в двух спектральных диапазонах использовалась эпифлуоресцентная оптическая схема, не содержащая механически перемещающихся компонентов и позволяющая детектировать красители на основе флуоресцеина (FAM, канал 1) и родамина (ROX, канал 2). Спектральное разделение диапазонов длин волн, в которых происходило возбуждение и регистрация соответствующего красителя, осуществлялось при помощи набора интерференционных светофильтров и дихроичного зеркала XF-52 (Omega Optical). Возбуждение флуоресценции осуществлялось поочередным включением двух светодиодов, излу- чающих в диапазоне 450÷470 нм (XR7090BL, Cree XLamp) и 500÷540 нм (XR7090GR, Cree XLamp) по полуширине спектра излучения. Детектирование флуоресценции проводилось ПЗС-матрицей цифровой камеры (MultiBlue, PerkinElmer).
Реактивы
Для проведения ПЦР-РВ использовали тест-систему "35S" (ЗАО "Синтол", Россия). Для про- ведения мультиплексной ПЦР-РВ был использован набор реактивов "ФЛАНК-ГЕН" (НПФ "ДНК-Технология", Россия). Положительные контрольные образцы с известной концентрацией, содержащие плазмиды со вставкой целевого фрагмента ДНК, входили в состав наборов. После смешивания ПЦР-тест-системы и контрольных образцов, согласно рекомендациям производителя, растворы вводились в микрореакторы кремниевых
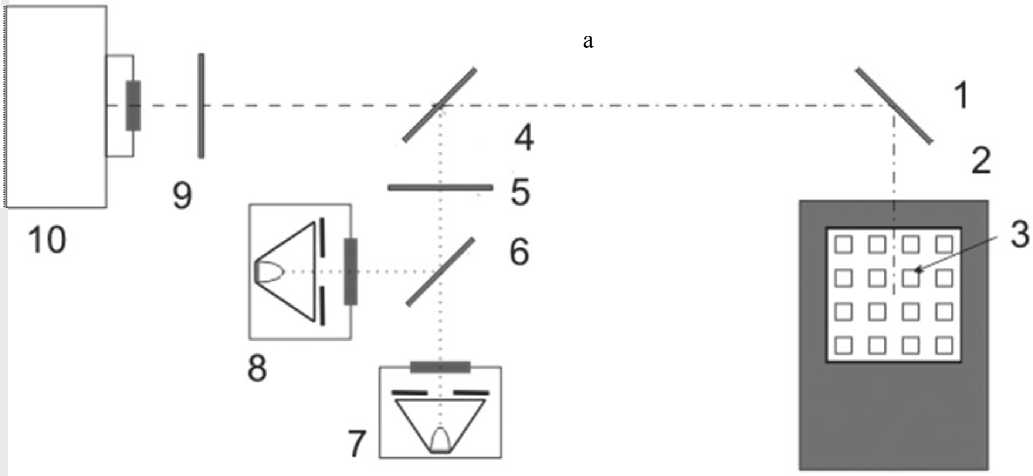
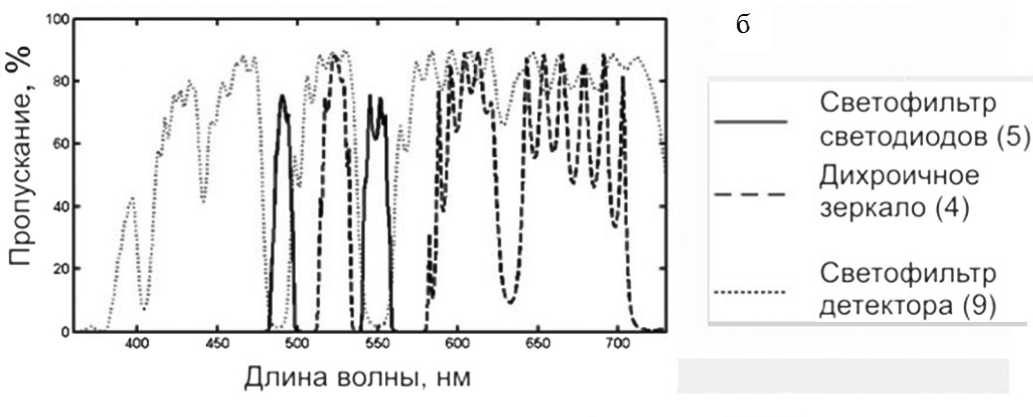
Рис. 1. Блок-схема экспериментальной установки микрочиповой аналитической системы ПЦР-РВ (а) и спектральные характеристики ее оптических элементов (б).
1 — зеркало; 2 — микрочип;, 3 — микрореакторы; 4, 6 — дихроичные зеркала; 5 — светофильтр детектора;
7, 8 — светодиоды; 9 — светофильтр детектора; 10 — ПЗС-камера с объективом
или алюминиевых микрочипов при помощи одноканального дозатора под слой герметизирующей жидкости (Пента-400, "Пента-Север"). Объем вводимого в каждый микрореактор раствора составлял 2 мкл и 1 мкл для микрочипа с 16 и 30 микрореакторами соответственно.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Модификация поверхности микрочипа
Вследствие высокой чувствительности ПЦР-анализа важным условием для широкого применения ПЦР является предотвращение смешивания между собой разных образцов в процессе ввода проб и проведения ПЦР. С нашей точки зрения, наиболее оптимальным способом ввода ПЦР-сме-си в микрочип является вариант, позволяющий сочетать ввод под слой герметизирующей жидкости с образованием прямого контакта ПЦР-смеси с поверхностью микрочипа за счет высокой гидрофильности внутренней поверхности микрореактора. Локализация растворов внутри микрореакторов осуществляется за счет гидрофобности зон снаружи микрореакторов, обусловленной ПММС-по-крытием. Контактный угол смачивания этой поверхности дистиллированной водой составил 133°.
Поверхность кремниевого микрочипа, предложенного в настоящей статье, была покрыта слоем оксида кремния, который предотвращает ингибирование ПЦР материалом микрочипа [25] и служит основой для дальнейшей модификации поверхности. Гидратированный слой оксида кремния не обладает достаточной стабильностью гидрофильных свойств при хранении на воздухе [26]. Использование сильно полярных гидрофильных группировок для создания необходимой гидрофильности приводит к сорбции молекул ДНК и олигонуклеотидов или к сорбции полимеразы [27], поэтому гидрофильный слой должен быть элек-тронейтральным. Нами была выбрана методика модификации поверхности окисленного кремния в две стадии с помощью глицидопропилтримето-ксисилана и этиленгликольдиметилового эфира [28], в результате которой поверхность покрывается спиртовыми группировками, обеспечивающими необходимую электронейтральность и желаемую гидрофильность поверхности (контактный угол 39°). Замена связи Si-OH на термодинамически более стабильную C-OH привела к увеличению стабильности гидрофильных свойств поверхности, при этом срок хранения модифицированных микрочипов с сохранением желаемой гидрофильности поверхности внутри микрореакторов составил 6 месяцев.
В качестве материалов для микрочипов перспективно использовать не только кремний, но и другие высокотеплопроводные материалы, кото- рые могут обеспечивать быструю передачу тепла между нагревательным элементом и раствором ПЦР-реагентов [30]. Одним из таких материалов является алюминий, из которого были изготовлены образцы микрочипов с 16 и 30 микрореакторами. Поскольку первичным слоем при модификации поверхности предложенного нами кремниевого микрочипа является оксид кремния, он может быть нанесен на разнообразные поверхности через газовую фазу с использованием SiCl4 [29]. Слой оксида кремния предотвращает ингибирование реакции алюминием и продуктами взаимодействия алюминия с компонентами ПЦР-смеси. Образованный таким образом слой SiO2 служит основой для дальнейшей модификации поверхности аналогично процессу в кремниевом микрочипе. Подготовленные по предложенной методике микрочипы из алюминия обеспечивали высокую гидрофильность поверхности внутри микрореакторов (контактный угол 40°).
Система термоциклирования
ПЦР является температурно-зависимой реакцией, и эффективность амплификации определяется как точностью поддержания температуры внутри микрореактора, так и скоростью термоциклирования [31]. Высокие скорости термоциклирования приводят к увеличению селективности и эффективности реакции [6-7, 9]. Быстрое снижение температуры раствора до температуры гибридизации праймеров приводит к тому, что гибридизация ампликонов и праймеров будет определяться кинетическими факторами, что в итоге приводит к увеличению эффективности реакции.
Увеличение скорости термоциклирования в предлагаемой системе осуществляется за счет использования элемента Пельтье в качестве нагревательного элемента, управление которым проводится по пропорционально-интегрально-дифференциальному (ПИД) алгоритму [21, 22, 24]. Использование в качестве материала микрочипа кремния и алюминия обеспечило эффективную передачу тепла между нагревательным элементом и раствором в микрореакторе чипа, что в итоге позволило получить высокие скорости термоциклирования, которые в 3-7 раз превышают скорости термоциклирования, достижимые для коммерчески доступного оборудования [32, 33].
Селективность ПЦР определяется точностью поддержания температуры на стадии гибридизации праймеров. В разрабатываемой микрочиповой системе термоциклирования для косвенного определения температуры внутри микрореактора использовалась авторегрессионная модель с внешним воздействием (ARX-модель) [34], которая позволяет учесть различие между температурой внутри микрореактора и показаниями термодатчика
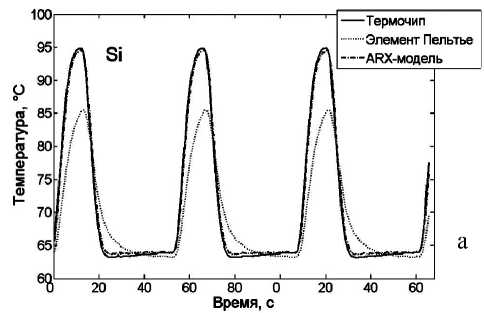
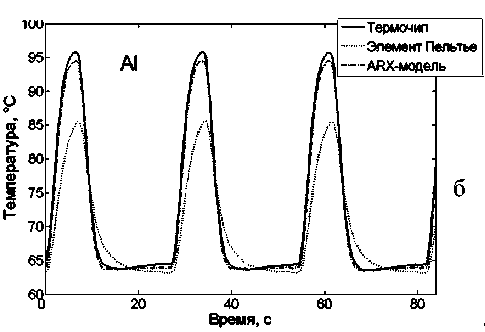
Рис. 2. Динамика изменения температуры при управлении системой термоциклирования с учетом ARX-модели.
Показания термодатчика на элементе Пельтье, термочипа и рассчитанная по ARX-модели температура в микрореакторе для микрочипов из Si (а) и Al (б)
на поверхности Пельтье элемента и проводить управление термоциклированием по температуре в микрореакторе, рассчитанной по задерживающимся во времени показаниям термодатчика. Нами была применена ARX-модель, предсказывающая температуру внутри микрореактора по формуле y n =c + a 1 X y n _ 1 +b 1 X x n +b 2 X x n _ 1 , где xn и xn -1 — текущие и предшествующие показания термодатчика на поверхности элемента Пельтье соответственно; y n и y n – 1 — текущие и предшествующие рассчитанные температуры в микрореакторе соответственно. Определение параметров a , b 1 , b 2 и c проводилось на основе сопоставления показаний термодатчика, встроенного в микрореактор микрочипа, и термодатчика на поверхности элемента Пельтье.
Полученные профили температур при термоциклировании кремниевого и алюминиевого микрочипов представлены на рис. 2. При этом наблюдаемая ошибка измерений температуры с коррек- цией по ARX-модели составила 0.3°С по данным из серии 5 измерений, что достаточно для обеспечения необходимой селективности ПЦР-РВ [33].
Достигнуты максимальные скорости нагрева и охлаждения 9.5 и 9.9 ºС/с для кремниевого микрочипа соответственно и 9.7 и 10.3 ºС/с для алюминиевого микрочипа. По полученным характеристикам микрочипы, выполненные из алюминия, не уступают кремниевым микрочипам, а по технологичности изготовления превосходят, поэтому они потенциально более привлекательны для широкого внедрения в практику ПЦР-анализа.
Система флуоресцентного детектирования
Применение ПЗС-матрицы в качестве детектора флуоресценции позволяет получить двумерное изображение микрочипа и выделить аналитический сигнал одновременно во всех микрореакторах. Такой принцип детектирования позволяет гибко настраивать систему детектирования при изменении топологии микрочипа.
Использование двух источников излучения позволяет проводить более эффективное возбуждение флуоресценции по сравнению с использованием одного источника и, следовательно, увеличивает чувствительность детектирования. Использование двух источников возбуждения также позволяет провести раздельное детектирование двух красителей вследствие различной эффективности возбуждения флуоресценции. Измерение интенсивности флуоресценции в двух спектральных диапазонах позволяет составить систему двух линейных уравнений и определить вклад каждого красителя в измеренную интенсивность флуоресценции [35]. На рис. 3 представлены ПЦР-кривые при измерении интенсивности флуоресценции до и после математической обработки. Из рисунка видно, что математическая обработка сигналов позволяет устранить взаимное влияние красителей, что проявляется как исчезновение первого максимума производной интенсивности флуоресценции по номеру цикла.
Для определения начального количества ДНК в образце в момент проведения анализа, т. е. до построения всей ПЦР-кривой, используется величина порогового цикла ( C t ), которая отражает начало экспоненциального роста кривой ПЦР [36]. Определенная таким образом величина порогового цикла для различных микрореакторов зависит от равномерности распределения интенсивности возбуждающего излучения по поверхности микрочипа.
Для учета неравномерности освещения микрореакторов был применен алгоритм нормировки детектируемой интенсивности флуоресценции в соответствии с профилем освещения микрочипа светодиодом 1 и светодиодом 2, функционально аналогичный описанному ранее [19, 20, 23] с тем
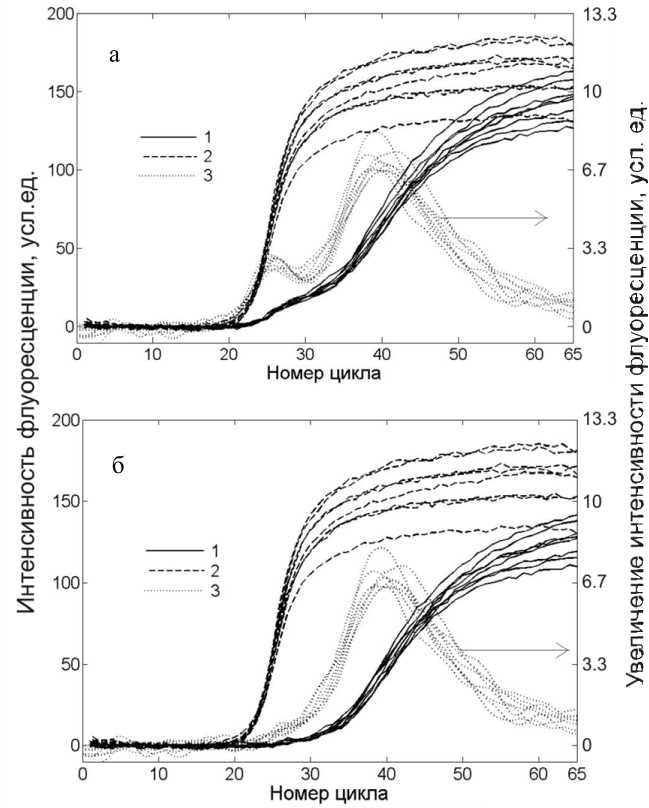
Рис. 3. ПЦР-кривые до (а) и после (б) математической обработки.
Кривые: 1 — интенсивность флуоресценции на канале ROX; 2 — интенсивность флуоресценции на канале FAM; 3 — первая производная интенсивности флуоресценции на канале FAM по номеру цикла
различием, что в настоящей работе для каждого из спектральных каналов детектирования применялся не кадр, а матрица выравнивания (4 × 4 или 5 × 6, по числу микрореакторов), что значительно снизило вычислительную нагрузку на систему детектирования. При анализе одной пробы в различных микрореакторах одного чипа с использованием алгоритма выравнивания и без него доверительный интервал порогового цикла ( C t = 27/92) уменьшается с ±0.47 до ±0.27 при использовании алгоритма выравнивания.
Пределы обнаружения красителей, оцененные по измерениям индивидуальных растворов FAM и ROX в микрореакторах, составили 1.2·10-9 М и 2.5·10-9 М при времени экспозиции 1 с.
Таким образом, разработанная экспериментальная установка микрочиповой аналитической системы ПЦР-РВ позволяет проводить мультиплексное определение ДНК в микрореакторах кремниевого или алюминиевого микрочипа с использованием быстродействующей системы тер- моциклирования и двухканальной системы флуоресцентного детектирования. Полученные в совокупности аналитические характеристики систем термоциклирования и детектирования превышают таковые у большинства ПЦР-анализаторов, что обеспечивает конкурентные преимущества и широкую область применения разработанной микро-чиповой системы при использовании коммерчески доступных мультиплексных тест-систем ПЦР-РВ.
ПЦР-анализ
Реализация ПЦР в микрочиповых системах позволяет снизить время анализа и расход реагентов. Увеличение скорости термоциклирования приводит к снижению времени протекания реакции в неоптимальных условиях, что сокращает общее время анализа. Однако время, необходимое на проведение элонгации праймеров, ограничивается скоростью синтеза комплементарной последовательности полимеразой и различно для ампликонов
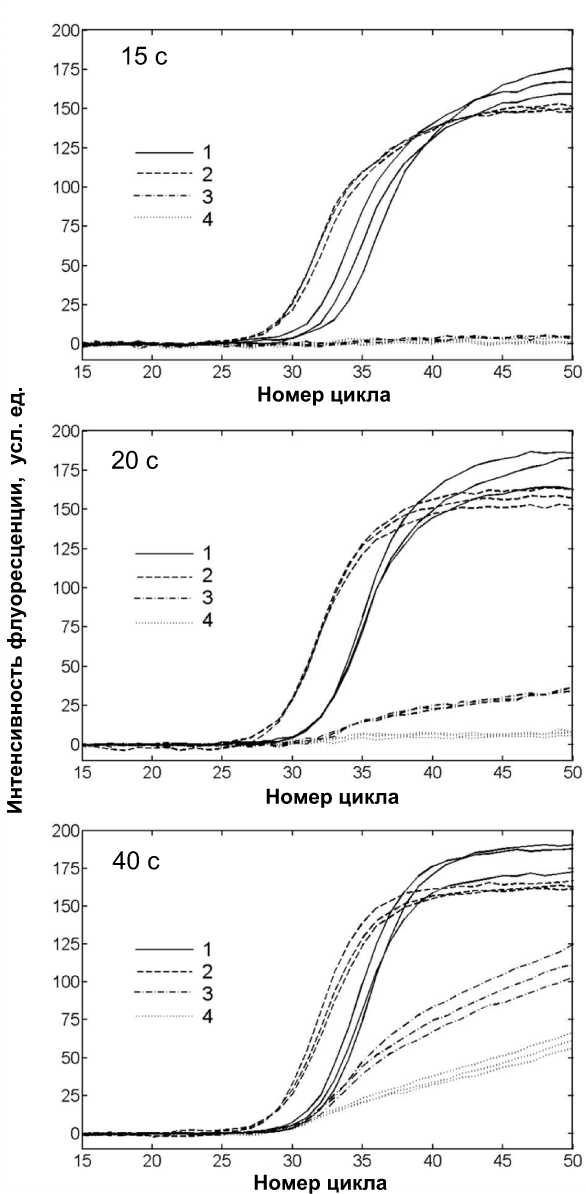
Рис. 4. Результаты проведения мультиплексной ПЦР-РВ двух образцов (А и Б) с разной продолжительностью стадии элонгации (15 , 20 и 40 с).
Кривые: 1 — интенсивность флуоресценции, зарегистрированная при анализе образца А на канале FAM; 2 — образца А на канале ROX; 3 — образца Б на канале FAM; 4 — образца Б на канале ROX разной длины [37]. Соответственно, для мультиплексной ПЦР оптимальное время элонгации ограничено ПЦР-тест-системой, содержащей самый длинный ампликон. На рис. 4 приведены ПЦР-кривые, полученные при анализе проб, содержа- щих разное количество специфической последовательности ДНК и одинаковое количество последовательности ВК, при различных временных режимах термоциклирования. При снижении времени элонгации происходит последовательное сниже- ние эффективности амплификации ВК при сохранении эффективности амплификации специфической последовательности, что обусловлено различием в длинах этих последовательностей, т. к. фрагмент ВК имеет большую длину, чем фрагмент специфичного участка ДНК.
Увеличение быстродействия анализа с использованной в настоящей работе тест-системой возможно за счет уменьшения длины ампликонов ПЦР-РВ-тест-систем ВК, что требует изменения праймеров и зондов тест-системы ВК. При использовании существующих коммерчески доступных мультиплексных ПЦР-тест-систем в предлагаемой микрочиповой аналитической системе необходимо учитывать различия в длинах амплифи-цируемых участков ДНК, которые ограничивают возможности по снижению времени анализа. Для получения максимального быстродействия необходимо выбирать ПЦР-РВ-тест-системы, в которых амплифицируемые участки специфичного фрагмента и фрагмента ВКО как можно короче по длине и близки по размеру между собой (до 100– 150 п.о.). Также положительного влияния на быстродействие анализа можно достичь, применяя в тест-системах полимеразы с увеличенной процес-сивностью, разработанные для применения в ПЦР-анализаторах с высокими скоростями термоциклирования. Указанные рекомендации могут быть применены для разработки новых ПЦР-РВ-тест-систем, предназначенных для широкого внедрения микрочипового ПЦР-анализатора в практику молекулярно-генетического анализа.
ВЫВОДЫ
В работе проведена разработка экспрессной микрочиповой аналитической системы для проведения мультиплексной ПЦР в режиме реального времени. Количество одновременно анализируемых проб (16 или 30) и возможность прямого ручного ввода реакционной смеси в микрореактор делает привлекательной предложенную систему как для разработки методик ПЦР-анализа, так и для рутинных анализов. Использование в качестве материала микрочипа кремния или алюминия обеспечивает технологическую возможность серийного производства больших партий микрочипов, что особенно справедливо для алюминиевых чипов, т. к. возможно их массовое изготовление методами штамповки при небольших затратах. Разработанная система флуоресцентного детектирования двух красителей не содержит подвижных элементов, что повышает ее надежность. Система термоциклирования, построенная с использованием элемента Пельтье, демонстрирует высокие скорости нагрева и охлаждения (9.7 и 10.3 °С/с соответственно), а точность управления температурой внутри реактора по алгоритму ARX составляет 0.3 ºC.
Время качественного ПЦР-анализа с использованием микрочиповой системы составляет 20 мин, что при малом числе операций при вводе проб в микрореакторы является существенным преимуществом для тех областей ДНК-диагностики, где требуется высокое быстродействие и удобство эксплуатации. Кроме того, при использовании 30-микрореакторного чипа также достигается значительная производительность анализа, соизмеримая с производительностью стандартных ПЦР-РВ-ана-лизаторов с 96 пробирками или 96-луночным планшетом.
Таким образом, совокупность высоких аналитических характеристик и надежности конструкции микрочиповой аналитической системы для мультиплексного ПЦР-РВ-анализа, удобного для пользователя микрочипа, а также возможности использования существующих коммерческих тест-систем и методик пробоподготовки обеспечивают привлекательность разработанной системы для широкого применения в практике молекулярногенетического анализа.


