Мутационный профиль мышечно-инвазивной уротелиальной карциномы и его взаимосвязь с течением опухолевого процесса
Автор: Хмелькова Д.Н., Волкова М.И., Гриднева Я.В., Благодатских К.А., Миронова И.В., Семенова А.Б., Вещевайлов А.А., Бабкина А.В., Бондарев С.А., Галкин В.Н.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.15, 2025 года.
Бесплатный доступ
Цель исследования: Первичной целью исследования являлась оценка мутационного профиля мышечно-инвазивной уротелиальной карциномы (МИУК) с помощью секвенирования нового поколения (next generation sequencing, NGS). Вторичная цель заключалась в выделении мутаций, обеспечивающих потенциальные мишени противоопухолевой терапии, исследовательская цель — в выявлении взаимосвязей мутационного профиля с течением опухолевого процесса. Материал: в исследовании использованы опухолевая ткань и медицинские данные 50 пациентов с МИУК мочевого пузыря (48 (96,0 %)) или почечной лоханки (2 (4,0 %)). В клетках, выделенных из опухоли с гистологически подтвержденной инвазивной УК, изучались альтерации в ДНК и РНК путем проведения NGS с использованием панели из 523 генов. Результаты: медиана возраста — 72 (51–87) года, мужчин — 43 (86,0 %). У всех больных верифицирована МИУК, выявленная de novo (Т2–Т4а — 32 (64,0 %) пациента, включая 2 (4,0 %) больных раком почечной лоханки) или развившаяся вследствие опухолевой прогрессии немышечно-инвазивного рака мочевого пузыря (Тis-T1–18 (36,0 %) пациентов). Регионарные метастазы диагностированы у 8 (16,0 %), отдаленные — у 5 (10,0 %) больных. В 44 (88,0 %) образцов верифицирована УК high grade (в том числе, сопутствующая carcinoma in situ — в 4 (8,0 %) случаях). Медиана мутационной нагрузки (tumor mutational burden, TMB) составила 10,9 (0,0–49,6) мут / Мб (высокая TMB (≥ 10 мут / Мб) — 30 (60,0 %) из 50 случаев). Во всех образцах уровень микросателлитной нестабильности был низким. В 50 образцах выявлено 244 терапевтически значимых и онкогенных мутации в 84 генах (медиана — 5 (1–11) мутаций в образце). Патогенные мутации 1–2 уровня обнаружены в 13 генах 29 (58,0 %) образцов (в ≥ 1 гене — в 13 (26,0 %)), с частотой ≥ 10 % — в генах FGFR3 (9 (18,0 %)), TSC1 (9 (18,0 %)), PIK3CA (7 (14,0 %)), ERBB2 (6 (12,0 %)). Мутации 3–4 уровня выделены в 12 генах 33 (66,0 %) образцов (в ≥ 1 гене — в 15 (10,0 %)), с частотой ≥ 10 % — в генах KDM6A (19 (38,0 %)), ARID1A (12 (24,0 %)) и MDM2 (7 (14,0 %)). Онкогенные мутации выявлены в 63 генах 46 (92,0 %) образцов (в ≥ 1 гене — в 37 (74,0 %)), с частотой ≥ 10 % — в генах TP53 (25 (50,0 %)), FGF4 (5 (10,0 %)), RB1 (6 (12,0 %)), CDKN1A, STAG2, FGF3, CCND1 (по 5 (10,0 %) образцов с мутациями каждый). Инвазивная УК de novo по сравнению с рецидивной ассоциирована с большей частотой высокой TMB (71,9 % vs. 38,9 %, р = 0,024) и большей частотой мутаций генов сигнального пути PI3K (46,8 % vs. 16,7 %, р = 0,031). Заключение: МИУК характеризуется высокой TMB и низкой частотой микросателлитной нестабильности. Самыми частыми мутациями, предоставляющими потенциальные терапевтические мишени, являются альтерации генов FGFR3, TSC1, PIK3CA и ERBB2. МИУК de novo ассоциирована с большей частотой высокой TMB и увеличением частоты мутаций генов сигнального пути PI3K по сравнению с инвазивными рецидивами немышечно-инвазивной УК.
Мышечно-инвазивная уротелиальная карцинома, секвенирование нового поколения, мутационный профиль
Короткий адрес: https://sciup.org/140312604
IDR: 140312604 | DOI: 10.18027/2224-5057-2025-054
Текст научной статьи Мутационный профиль мышечно-инвазивной уротелиальной карциномы и его взаимосвязь с течением опухолевого процесса
Уротелиальная карцинома (УК) способна развиваться из уротелия всех локализаций и склонна к опухолевой прогрессии с формированием мышечно-инвазивных опухолей, характеризующихся агрессивным течением, быстрым местно- распространенным ростом и метаста- зированием. Неметастатическая мышечно-инвазивная УК (МИУК) является показанием к хирургической и лучевой эрадикации опухоли в сочетании с химиотерапией (ХТ). Метод выбора для лечения метастатической МИУК — ХТ, основанная на препаратах платины, альтернативой ХТ служит иммунотерапия (ИТ). Несмотря на использование стандартных методов лечения МИУК, его результаты существенно расходятся даже в однородных по клиникорадиологическим характеристикам подгруппах пациентов, что свидетельствует о необходимости индивидуального подхода к формированию лечебного плана.
Для разработки персонализированной тактики ведения этой тяжелой категории больных проводятся многочисленные исследования, направленные на выявление факторов прогноза и предикторов ответа на терапию противоопухолевыми препаратами. Одним из наиболее перспективных направлений является изучение молекулярно-генетических характеристик МИУК, способных прогнозировать течение заболевания и потенциал стандартного противоопухолевого лечения, а также направленных на выявление терапевтических мишеней в опухоли.
МАТЕРИАЛ И МЕТОДЫ
Первичной целью проспективного исследования являлась оценка мутационного профиля МИУК путем выявления альтераций в дезоксирибонуклеиновой (ДНК) и рибонуклеиновой (РНК) кислотах с помощью метода секвенирования нового поколения (next generation sequencing, NGS) с использованием панели из 523 генов. Вторичной целью было выделение потенциальных мишеней для противоопухолевой терапии УК. Эксплоративные точки включали анализ взаимосвязей выявленных альтераций с морфологическими характеристиками, распространенностью и результатами лечения МИУК.
В исследовании использованы опухолевая ткань и медицинские данные 50 пациентов с МИУК. В опухолевых образцах с гистологически подтвержденной МИУК изучались альтерации в ДНК и РНК с помощью метода NGS с использованием панели из 523 генов, позволяющей выявлять однонуклеотидные замены (single nucleotide variants, SNV), малые инсерции и делеции (insertions and deletions, indels), вариации числа копий ДНК, включая крупные делеции и амплификации (copy number variations, CNV), транслокации (fusions), а также оценивать комплексные молекулярные биомаркеры — мутационную нагрузку (tumor mutational burden, TMB) и микросателлитную нестабильность (microsatellite instability, MSI).
В качестве биоматериала использованы образцы опухоли, фиксированные в формалине и залитые в парафин (парафиновые блоки). С парафиновых блоков сделаны гистологические срезы толщиной 5–10 мкм, из которых произведено выделение ДНК с помощью набора GeneJET FFPE DNA Purification Kit (ThermoFisher) и РНК с помощью набора RNeasy Mini Kit (Qiagen).Для проведения NGS отбирали образцы с концентрацией ДНК ≥ 0,5 нг / мкл, измеренной с помощью набора Qubit™ dsDNA Quantitation, High Sensitivity (ThermoFisher), и с концентрацией РНК ≥ 4 нг / мкл, измеренной с помощью набора Qubit™ RNA High Sensitivity (HS) (ThermoFisher). Библиотеки для секвенирования готовили с помощью набора Illumina TruSight Oncology 500. Длину фрагментов готовых библиотек измеряли,используя Tapestation High Sensitivity DNA
ScreenTape Analysis (Agilent). Концентрацию библиотек оценивали с помощью набора Qubit™ dsDNA Quantitation, High Sensitivity (ThermoFisher). Секвенирование производили на приборах Illumina Novaseq 6 0 0 0 и Illumina NextSeq 550.
Для биоинформатической обработки «сырых» данных секвенирования использовали программное обеспечение, предоставленное производителем [1]. Фильтрацию выявленных точечных генетических вариантов по каждому образцу осуществляли по следующим параметрам: 1) частота в контрольной популяционной выборке (gnomad v. 2.1.1 [2]) не более 5 %; 2) расположение варианта в кодирующей части гена или в каноническом сайте сплайсинга (кроме вариантов, аннотированных в базе данных ClinVar [3] как патогенные или вероятно патогенные); 3) синонимичные замены исключали из анализа, за исключением патогенных и вероятно патогенных вариантов согласно ClinVar; 4) при фильтрации исключали варианты, аннотированные в ClinVar как доброкачественные или вероятно доброкачественные. Клиническую интерпретацию проводили в соответствии с международными клиническими рекомендациями по интерпретации данных NGS в онкологии [4]. Для оценки терапевтической значимости и категоризации нуклеотидных вариантов использовали онкологическую базу данных OncoKB (MSK’s Precision Oncology Knowledge Base). К 1 уровню терапевтической значимости относили мутации, для которых имеются данные клинических исследований, подтверждающие их ассоциацию с ответом на терапию; ко 2 уровню — мутации, для которых существует достаточный объем доказательств их взаимосвязи с терапией вне рамок формальных клинических испытаний к 3 уровню — мутации, характеризующиеся определенным, но недостаточным набором клинических доказательств их терапевтической значимости в отношении того или иного препарата; к 4 уровню — мутации, в отношении которых есть только биологические свидетельства их возможной связи с ответом на терапию. В отдельный класс онкогенных мутаций выделяли патогенные и вероятно патогенные варианты, не имеющие на данный момент терапевтического значения, в генах, ассоциированных с процессами канцерогенеза [5].
Результаты NGS и клиническая информация были формализованы в виде электронных таблиц с помощью специально созданного кодификатора и подвергнуты статистической обработке с применением блока статистических программ IBM SPSS Statistics.
РЕЗУЛЬТАТЫ
У 48 (96,0 %) пациентов опухоль локализовалась в мочевом пузыре,у 2 (4,0 %)— в почечной лоханке.Ме-диана возраста — 72 (51–87) года, мужчин — 43 (86,0 %), женщин — 7 (14,0 %). Курильщиков — 16 (32,0 %). У всех больных верифицирована МИУК, выявленная de novo (Т2– Т4а — 32 (64,0 %) пациента, включая 2 (4,0 %) больных раком почечной лоханки) или развившаяся вследствие опухолевой прогрессии первичного немышечно-инвазив-ного рака мочевого пузыря (Тis-T1–18 (36,0 %) пациентов). Категория N расценена как N+ в 8 (16,0 %) наблюдениях. Отдаленные метастазы диагностированы у 5 (10,0%) больных. В 6 (12,0 %) образцах верифицирована УК low grade, в 44 (88,0 %) — УК high grade. Сопутствующая carcinoma in situ (CIS) имела место в 4 (8,0 %) случаях (табл. 1).
Таблица 1. Характеристика и лечение больных уротелиальной карциномой Table 1. Characteristics and treatment of patients with urothelial carcinoma
|
Параметр |
Количество пациентов |
|
|
N |
||
|
Медиана возраста (разброс), годы |
72 (51 |
–87) |
|
Пол |
||
|
Мужской |
43 |
86,0 |
|
Женский |
7 |
14,0 |
|
Первичная локализация опухоли |
||
|
Мочевой пузырь |
48 |
96,0 |
|
Почечная лоханка |
2 |
4,0 |
|
Чистая уротелиальная карцинома |
50 |
100,0 |
|
Грейд |
||
|
Low |
6 |
12,0 |
|
High |
44 |
88,0 |
|
Категория Т |
||
|
Tis |
1 |
2,0 |
|
Ta |
3 |
6,0 |
|
T1 |
14 |
28,0 |
|
T2 |
27 |
54,0 |
|
T3 |
4 |
8,0 |
|
T4a |
1 |
2,0 |
|
Категория N |
||
|
N0 |
42 |
84,0 |
|
N1 |
4 |
8,0 |
|
N2 |
2 |
4,0 |
|
N3 |
2 |
4,0 |
|
Категория М |
||
|
М0 |
45 |
90,0 |
|
М1 |
5 |
10,0 |
|
Лечение |
||
|
Радикальная нефруретерэктомия |
2 |
4,0 |
|
Радикальная цистэктомия |
25 |
50,0 |
|
Неоадъювантная химиотерапия |
14 |
28,0 |
|
Адъювантная химиотерапия |
2 |
4,0 |
|
Адъювантная иммунотерапия |
1 |
2,0 |
|
Радикальная дистанционная лучевая терапия |
9 |
18,0 |
|
Радиомодифицирующая химиотерапия |
3 |
6,0 |
|
Противоопухолевая терапия |
12 |
24,0 |
|
Химиотерапия + поддерживающая иммунотерапия |
4 |
8,0 |
|
Химиотерапия |
3 |
6,0 |
|
Иммунотерапия |
6 |
12,0 |
|
Симптоматическое |
2 |
4,0 |
Результаты NGS
Медиана мутационной нагрузки (TMB) в изученных образцах составила 10,9 (0,0–49,6) мутаций на 1 мегабазу генома (мут/Мб), при этом низкая TMB (< 10 мут/Мб) выявлена в 20 (40,0 %), высокая (≥ 10 мут/ Мб) — в 30 (60,0%) из 50 случаев.
Во всех 50 (100,0%) образцах уровень микросателлитной нестабильности оказался низким.
В 50 образцах выявлено 244 терапевтически значимых и онкогенных мутации в 84 генах (медиана — 5 (1–11) мутаций в образце). В структуре мутаций доминировали SNV — 142 (58,2%), при этом наибольшую частоту имели нуклеотидные замены С > T — 45 (31,7%) из 142 и G > A — 26 (18,3%) из 142. Также выявлено 58 (23,8 %) indel-мутаций, 42 (17,2 %) амплификации в 15 генах и 2 (0,8%) транслокации с образованием фьюжн-генов RPS6KB1-VMP1 и TMPRSS2-ERG . Наиболее частые амплификации наблюдались в генах MDM2 (7 образцов (14%)), CCND1 , ERBB2 , FGF3 и FGF4 (по 5 образцов (10 %)), реже встречались амплификации в FGF19 , MYCL (по 3 образца (6%)) и CCNE1 (2 образца (4 %)). Амплификации в генах ALK , AR , CDK4 , FGF8 , FGFR1 , FGFR4 и RAF1 встретились в 1 (2 %) образце каждая.
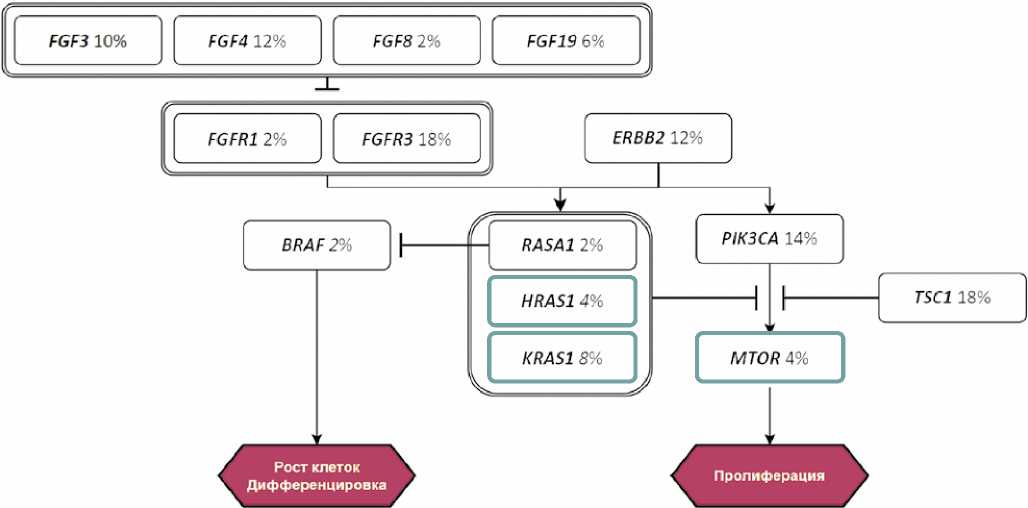
Мутации в генах сигнального пути р53 ( ATRX , CCND1 , CCNE1 , CDK4 , CDKN1A , CDKN1B , CDKN2A , EP300 , MDM2 , RB1 , TP53 ) обнаружены в 39 (78,0 %) (рис. 1), сигнального пути FGF/FGFR ( FGF3 /4 /8 /19 , FGFR1 / 3 /4 ) — в 18 (36,0%) (рис. 2), сигнального пути PI3K ( MTOR , PIK3CA , TSC1 ) — в 18 (36,0 %) (рис. 2), сигнального пути ERBB ( BRAF , ERBB2 , HRAS , KRAS ,
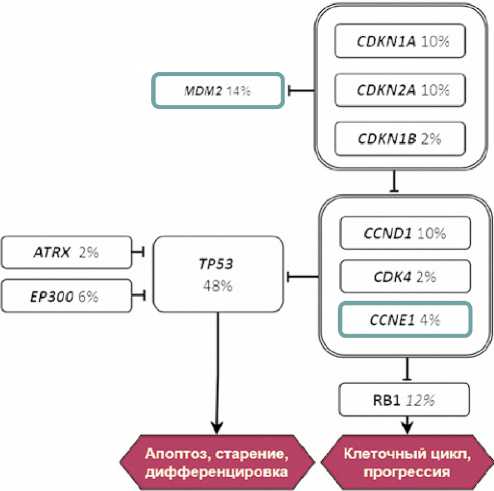
Рисунок 1. Частота генетических альтераций сигнального пути p53 (черная рамка — онкогенные мутации, зеленая рамка — мутации 3–4 уровня терапевтической значимости)
Figure 1. Frequency ofgenetic alterations in the p53 signaling pathway (black frame — oncogenic mutations, blue frame — mutations of 3-4 levels of therapeutic significance)
RASA1 ) — в 12 (24,0%) (рис. 2), сигнального пути STAG2/IRF2 — в 6 (12,0 %) образцах.
Патогенные мутации 1–2 уровня, обеспечивающие терапевтические мишени, были обнаружены в 29 (58,0%) из 50 образцов и включали альтерации 13 генов (в 1 гене — 17 (34,0%), в 2 генах — 9 (20,0 %), в 3 генах — 3 (6,0 %) образца). Наиболее часто (> 5 % образцов) встречались мутации в генах FGFR3 (9 (18,0 %) образцов с мутациями), TSC1 (9 (18,0 %)), PIK3CA (7 (14,0 %)), ERBB2 (6 (12,0 %)) и CHEK2 (3 (6,0 %)) (рис. 3).
Мутации 3–4 уровня были выявлены в 33 (66,0%) образцах и включали альтерации 12 генов (в 1 гене — 18 (36,0 %), в 2 генах — 10 (20,0%), в 3 генах — 5 (10,0%)). Наиболее часто (> 5% образцов) встречались мутации в генах KDM6A (19 (38,0 %) образцов с мутациями), ARID1A (12 (24,0%)), MDM2 (7 (14,0%)) и KRAS (4 (8,0%)) (рис. 3).
Онкогенные драйверные мутации, не обеспечивающие терапевтическую мишень, выявлены в 46 (92,0 %) образцах и включали альтерации 63 генов (в 1 гене — 9 (18%), в 2 — 10 (20%), в 3 — 13 (26%), в 4 генах — 5 (10%), в 5 генах — 8 (16%), в 7 генах — 1 (2,0%) образец). Наиболее часто (> 5% образцов) встречались мутации в генах TP53 (25 (50,0%)), RB1 (6 (12,0%)), CCND1 , CDKN1A , FGF3 , FGF4 , STAG2 (по 5 (10,0%) образцов с мутациями каждый), CTNNB1 , FAT1 , FGF19 , EP300 , MYCL , PRKDC , RBM10 и TERT (по 3 (6,0%) образца с мутациями каждый) (рис. 3).
Результаты лечения
На этапе появления мышечной инвазии всем пациентам с раком мочевого пузыря выполнена трансуретральная резекция мочевого пузыря (ТУР МП). Из 50 больных 25 (50,0 %) подвергнуты радикальной цистэктомии (РЦЭ) (с неоадъювантной химиотерапией (НХТ) — 14 (28,0 %), адъювантной химиотерапией (АХТ) — 2 (4,0 %), адъювантной ИТ — 1 (2,0 %)), 2 (4,0 %) пациента — радикальной нефр-уретерэктомии, 9 (18,0%) больных получали дистанционную лучевую терапию (ДЛТ) по радикальной программе (с радиомодифицирующей ХТ — 3 (6,0 %)), в 12 (24,0 %) случаях проводилась системная противоопухолевая терапия (ХТ с / без поддерживающей ИТ — 7 (14,0 %), ИТ — 6 (12,0 %)), в 2 (4,0 %) наблюдениях противоопухолевое лечение не применялось (табл. 1).
Медиана наблюдения за всеми больными — 16,0 (1,0 – 290,0) месяцев. Частота полных патоморфологических ответов (pT0) после НХТ составила 35,7 % (5 из 14 пациентов), частота полных ответов на ДЛТ — 66,7 % (6 из 9 пациентов), частота объективных ответов (ЧОО) на НХТ или самостоятельную ХТ — 42,9 % (9 из 21 пациента). Рецидивы развились у 7 (21,2 %) пациентов, получивших радикальное лечение. Умерли 7 (14,0 %) больных, в том числе от УК — 4 (8,0%) пациента. Однолетняя безрецидив-ная выживаемость (БРВ) оперированных больных составила 77,7 %, облученных пациентов — 53,3 % . Медиана беспрогрессивной выживаемости (БПВ) 12 пациентов на 1 линии самостоятельной противоопухолевой терапии
Рост клеток Дифференцировка
FGFR1 2%
FGFR3 18%
MTOR 4%
FGF3 10%
FGF4 12%
FGF8 2%
FGF19 6%
RASA1 2%
HRAS1 4%
KRAS1 8%
TSC1 18%
BRAF2% [
ERBB2 12%
PIK3CA 14%
Пролиферация
Рисунок 2. Частота генетических альтераций сигнальных путей FGF/FGFR, PI3K и ERBB2 (черная рамка — онкогенные мутации и мутации 1–2 уровня терапевтической значимости, зеленая рамка — мутации 3–4 уровня терапевтической значимости)
Figure 2. Frequency ofgenetic alterations in the FGF/FGFK, PI3K and FPBB2 signaling pathways (black frame — oncogenic mutations and mutations of 1-2 levels of therapeutic significance, blue frame — mutations of 3-4 levels of therapeutic significance)
равнялась 8,4 месяца. Однолетняя опухоль- специфическая выживаемость (ОСВ) всех больных составила 65,8 %.
Взаимосвязь мутационного статуса и течения опухолевого процесса
Проведен анализ потенциальной взаимосвязи TMB, частоты альтераций, выявленных в генах сигнальных путей (p53, ERBB, PI3K, FGF/FGFR и STAG2 /IRF), мутаций, выявленных в ≥ 10 % образцов (в генах FGFR3 , TSC1 , PIK3CA , ERBB2 , TP53 , FGF4 , RB1 , KDM6A , ARID1A и MDM2 ), с локализацией, первичной глубиной инвазии УК, ее грейдом, наличием CIS, появлением любых метастазов, а также эффективностью лечения (частота pT0 после НХТ, ЧОО на ХТ, выживаемость).
По сравнению с рецидивной МИУК опухоли с инвазией, выявленной de novo, характеризовались большей частотой высокой TMB (71,9 % против 38,9 % соответственно, р = 0,024). При этом, среди больных первичной МИУК отмечена большая доля пациентов с мутациями генов сигнального пути PI3K (46,8 % против 16,7 %, р = 0,031), в том числе — гена TSC1 (25,0 % против 5,6%, р = 0,087). При МИУК de novo по сравнению с рецидивным мышечно-инва- зивным раком мочевого пузыря также отмечена большая частота амплификаций FGF4 (1,8% против 0,0%, р = 0,057) и CCND1 (15,6 % против 0,0 %, р = 0,095). Значимых различий структуры мутаций 1–2 уровня и 3 –4 уровня между образцами МИУК de novo и рецидивной МИУК не выявлено (p > 0,05 для всех генов).
Отмечена тенденция к увеличению частоты мутаций генов сигнального пути FGF/FGFR при МИУК high grade по сравнению с МИУК low grade (40,5 % против 0,0 % , р = 0,060), преимущественно, за счет большей частоты альтераций FGF4 .
При опухолях с сопутствующей CIS частота мутаций RB1 составила 50,0% по сравнению с 8,7 % при отсутствии CIS (р = 0,066).
Отмечена тенденция к большей частоте амплификаций гена MDM2 при МИУК с метастазами по сравнению с неметастатическими опухолями (37,5 % против 9,5 % соответственно, р = 0,071).
При TMB ≥ 10 мут / МБ отмечена тенденция к снижению частоты pT0 после НХТ (с 66,7 % до 12,5%, р = 0,063) и ЧОО на ХТ (с 60,0 % до 21,4 %, р = 0,067). Аналогично, при опухолях с мутациями генов сигнального пути PI3K частота
Клинически значимые мутации
Тип мутации
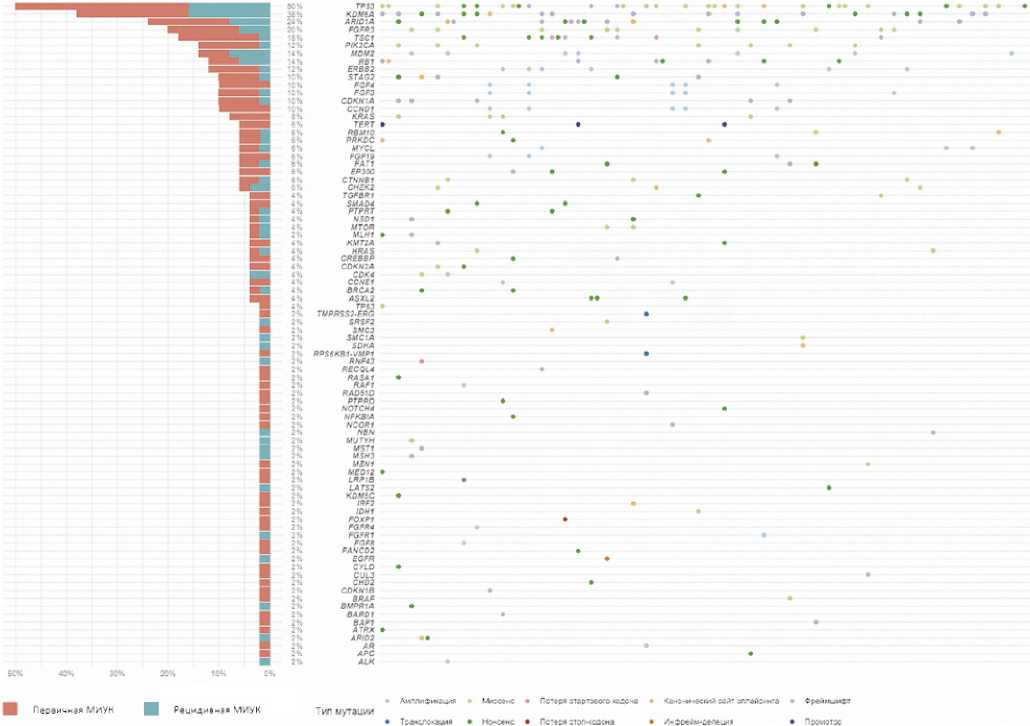
Рисунок 3. Частота и вид патогенных мутаций в 50 образцах мышечно-инвазивной УК
Figure 3. Frequency and type ofpathogenic mutations in 50 samples of muscle-invasive UC
pT0 и ЧОО оказались ниже, чем при отсутствии данных мутаций (0,0 % против 55,6 % соответственно, р = 0,063).
ОСВ больных с патогенными мутациями ERBB2 1–2 уровня оказалась значимо ниже, чем у больных с диким вариантом данного гена (медиана 9,8 месяца против не достигнута, р = 0,044). Независимая значимость признака не подтверждена многофакторным анализом (р = 0,542).
Других взаимосвязей между мутационным статусом и течением МИУК не выделено.
ДИСКУССИЯ
В последние годы несколько крупномасштабных исследований на основе секвенирования полного экзома, а также ряд транскриптомных анализов позволили получить информацию о молекулярных изменениях и сигнальных путях, играющих роль в развитии УК, прокладывая путь для прецизионного лечения [6,7]. На основании полученных данных были выделены молекулярно-генетические классы УК, имеющие специфические морфологические характеристики и ассоциированные с различным прогнозом течения заболевания [8]. Кроме того, был выявлен ряд клинически значимых мутаций и разработана сигнатура APOBEC, отражающая ранние стадии онкогенеза УК [9]. Однако большинство исследований проводилось при НМИУК, в то время как распространенные формы заболевания, являющиеся основной причиной смерти пациентов с УК, остаются недостаточно изученными. Поскольку молекулярные характеристики меняются по мере прогрессирования опухолевого процесса, геномный ландшафт НМИУК может не соответствовать спектру генетических альтераций МИУК. Данные о генетическом профиле УК, находящейся на разных этапах естественного течения, могут способствовать оптимизации лечебных подходов. По некоторым данным, использование целенаправленной терапии, назначенной в соответствии с мишенями, выявленными с помощью метода NGS у тяжело предлеченных больных распространенной УК, позволяет добиться удовлетворительных результатов [10].
Мы провели исследование образцов первичной (64,0%) и рецидивной (36,0%) МИУК 50 больных с использованием метода NGS с помощью панели на 523 гена. Среди изученных опухолей доминировала МИУК high grade (88,0 %), с первичной локализацией опухоли в мочевом пузыре (96,0 %), без метастазов (84,0 %).
Медиана TMB, отражающей общее количество мутаций в опухолевых клетках, составила 10,9 мут / Мб, что соответствует высокой мутационной нагрузке и полностью согласуется с ранее опубликованными данными анализа результатов NGS 199 образцов МИУК [11]. Высокая TMB ассоциирована с большим разнообразием неоантигенов в опухоли, создающим условия для активации противоопухолевого иммунного ответа и, как следствие, служащим возможным предиктором высокой эффективности ингибиторов иммунных контрольных точек [12]. В ряде исследований отмечено значимое преимущество ИТ по сравнению с ХТ, основанной на препаратах платины, в отношении БПВ у больных распространенной УК с высокой TMB [13,14]. В нашей серии наблюдений при TMB ≥ 10 мут / МБ отмечена тенденция к снижению частоты pT0 после НХТ (р = 0,063) и ЧОО на ХТ (р = 0,067). Это позволяет предположить, что высокая TMB является потенциальным предиктором низкой эффективности ХТ. Данный факт требует дальнейшего изучения.
Во всех наших образцах уровень микросателлитной нестабильности УК был низким, что соответствует ранее опубликованным данным [15].
Мутационный профиль инвазивной УК оказался очень разнообразным: мы выявили генетические альтерации, имеющие потенциальное клиническое значение, во всех изученных образцах, при этом выявлено 244 патогенных и онкогенных мутации в 84 генах (медиана — 5мутаций в образце). Отмечена высокая частота альтераций генов, участвующих в регуляции клеточного цикла ( TP53 , TSC1 , CDKN1A ), альтераций, инактивирующих гены-супрессоры ( KDM6A , ARID1A ) и активирующих онкогены ( FGF / FGFR , PIK3CA , ERBB2 , KRAS ), а также мутаций генов, кодирующих белки, вовлеченные в апоптоз ( TP53 , RB1 ), модификацию и регуляцию хроматина ( STAG2 , EP300 , TERT , CCND1 , KDM6A , ARID1A ), транскрипцию ( MYCL ) и репарацию ДНК ( BRCA2 , CHEK2 ), а также генов, участвующих в клеточной адгезии ( CTNNB1 , FAT1 ) [6].
В нашей серии наблюдений выделены некоторые особенности генетического профиля отдельных групп опухолей. Так, отмечена большая насыщенность группы с первичной МИУК опухолями с высокой TMB (р = 0,024), альтерациями сигнального пути PI3K (р = 0,031) (в том числе — мутациями TSC1 ; р = 0,087), а также амплификациями FGF4 (р = 0,057) и CCND1 (р = 0,095) по сравнению с первичной НМИУК с опухолевой прогрессией в инвазивный рак. Выявлена тенденция к увеличению частоты мутаций генов сигнального пути FGF/FGFR при МИУК high grade по сравнению с low grade (40,5 % против 0,0 %, р = 0,060), преимущественно, за счет большей частоты амплификаций FGF4 . Следует отметить, что частота мутаций FGFR3 , по данным большинства авторов, снижается по мере увеличения категории Т и степени УК [16].Воз-можно, нам не удалось проследить данную закономерность в связи с ожидаемо низкой долей МИУК low grade, а первичные НМИУК могли изменить свой мутационный профиль в процессе прогрессирования в инвазивный рак. Отмечена тенденция кувеличению доли образцов с мутациями RB1 в опухолях с сопутствующей CIS (р = 0,0 66). Амплификации MDM2 были ассоциированы с большей частотой метастатических форм УК по сравнению с диким вариантом данного гена (р = 0,071). Полученные данные требуют дальнейшего изучения и подтверждения в крупных исследованиях.
Выявленные нами мутации приводят к нарушениям передачи сигнала по ряду канонических путей. Цепь регуляции клеточного цикла р53 оказалась инактивирована в 78 % наблюдений с частотой мутаций гена TP53, достигшей 48 %, и гена RB1, составившей 12 %. Несколько реже, с частотой 10 %, выявлялись мутации CDKN1A и СCND1. Также в < 10 % образцов выявлены патогенные мутации других генов данного сигнального пути, включая CDKN2A, CDK4, CCNE1, ATRX, EP300. Амплификации MDM2, являющегося антагонистом TP53, выявлены в 14% образцов (рисунок 2).
Наши данные согласуются с результатами NGS при МИУК, полученными другими исследователями. Согласно опубликованным данным, альтерации пути р53 регистрируются у 89% больных МИУК [7]. Ключевые инактивирующие мутации генов опухолевой супрессии TP53 и RB1 являются частым событием при распространенной УК и встречаются с частотой 44–57 % и 17–26 % соответственно [6,7,11,17]. Мутации генов опухолевой супрессии CDKN1A/1B / 2A выявляются в 9–23 % образцов МИУК [7,17], гена-регулятора клеточного цикла CCND1 — в клетках 10 % всех УК [18].
Мутации пути регуляции клеточного цикла р53 имеют негативное влияние на прогноз заболевания [11]. На данный момент альтерации генов сигнального пути р53 не предоставляют терапевтической мишени, но потенциально могут влиять на выбор терапевтических подходов.Так, в небольшом ретроспективном исследовании Jindal T. (n = 29) при наличии патогенных мутаций TP53 и MDM2 отмечено увеличение ЧОО на терапию конъюгатом энфортумабом ведотином, имеющим доказанную эффективность при мультирезистентной УК [19]. Амплификация CCND1 в исследовании I/II фазы оказалась ассоциирована с увеличением частоты pT0 у пациентов с МИУК, получавших ингибитор CDK4 / 6 абемациклиб в неоадъювантном режиме [20].
Альтерации генов сигнального пути фактора роста фибробластов (FGF), задействованного в клеточной пролиферации, дифференцировке, миграции и ангиогенезе, характерны для УК, при этом МИУК характеризуется меньшей частотой мутаций FGF / FGFR (36 % наших образцов) по сравнению с НМИУК (62–81 %) [21–23]. Мы выявили мутации генов лигандов ( FGF3 / 4 / 8 / 19 ) и рецепторов FGF ( FGFR1 / 3 / 4 ), при этом чаще всего регистрировались альтерации FGFR3 (18%), FGF4 (12%) и FGF3 (10 %). Другие альтерации имели место в < 10 % образцов. Это согласуется с ранее опубликованными данными. Так, в мета-анализе результатов NGS УК (n = 916) частота мутаций FGFR3 составила 11,5% [16]. В исследовании 126 образцов УК альтерации FGFR1 были выявлены в 7 % случаев [24]. Активирующие таргетные альтерации гена FGFR3 , вызывающие лиганд-не-зависимую димеризацию рецептора и активацию передачи сигнала клеточной пролиферации и выживания, включают SNV FGFR3 (R248C, S249C, G370C, Y373C), составляющие до 90 % всех точечных мутаций, и транслокации/ химеры FGFR3:TACC3 , FGFR3:BAIAP2L1 , FGFR2:CASP7 и FGFR2:BICC1 , составляющие 2–8% всех аберраций FGFR3 . Таргетные мутации предоставляют мишень для терапии FGFR -ингибитором эрдафитинибом, имеющем доказанную эффективность при УК, резистентной к ИТ [25]. В нашей серии таргетная альтерация FGFR3 обнаружена в 8 (16 %) образцах.
Сигнальный путь FGF/FGFR наряду с ERBB2 активирует цепь передачи RAS- MAPK, и, возможно, PI3K / AKT [26]. Альтерации взаимосвязанных сигнальных путей PI3K и ERBB2 выявлены в 36 % и 20 % образцов МИУК наших пациентов. При этом самыми частыми являлись мутации TSC1 (18%), PIK3CA (14 %) и ERBB2 (12 %); мутации других генов (RASA1, BRAF, MTOR) выявлялись с частотой < 5 %. Также зарегистрированы мутации 3–4 уровней генов KRAS (8%) и HRAS (4 %) (рис. 3).
Полученные нами результаты соответствуют опубликованным данным. Частота мутаций гена опухолевой супрессии TSC1 в серии из 412 образцов МИУК составила 14 % [7]. Инактивирующие мутации TSC1 потенциально могут быть ассоциированы с повышенной чувствительностью к ингибиторам mTOR, что пока не находит убедительного подтверждения. В корзинном исследовании эверолимуса при злокачественных опухолях с мутациями генов пути mTOR у 1 пациента из 6 с УК был зарегистрирован объективный ответ [27]. В другом исследовании (n = 41) ингибитор mTOR1/2 сапасертиб оказался неэффективен при УК с таргетными мутациями [28].
PIK3CA кодирует каталитически активную субъединицу фосфатидилинозитол-3-киназы (PI3K) и является ключевым звеном пути PI3K, который регулирует ряд важнейших клеточных функций, включая клеточный рост, пролиферацию, дифференцировку, подвижность и выживание [29]. Активирующие мутации PIK3CA выявляют в 20 –25% случаев всех УК [30]. Частота мутаций PIK3CA в образцах 218 УК с метастазами, изученных в коллаборативном исследовании Bladder Cancer Advocacy Network, составила 14% [6], в серии из 35 МИУК, описанной Ross J. S. (2014), — 26 % [17]. Активирующие мутации PIK3CA потенциально могут служить предиктором эффективности ингибиторов PI3K и белков нисходящего сигнального пути (mTOR / AKT). В настоящее время проводятся исследования ингибиторов mTOR второго поколения,а также анти-PI3K и AKT агентов при УК.
Нельзя исключить негативное влияние альтераций сигнальной цепи PI3K на эффективность ХТ. В нашей серии наблюдений при опухолях с патогенными мутациями генов сигнального пути PI3K частота pT0 и ЧОО на ХТ оказались ниже, чем при отсутствии данных мутаций (р = 0,063). Напротив, Patel V. G. (2016) не удалось однозначно доказать негативное влияние мутационного статуса PIK3CA на прогноз больных МИУК, получавших НХТ перед радикальной цистэктомией [31]. В объединенном анализе 5 рандомизированных исследований рака молочной железы (n = 967, HER2 + ) отмечено значимое снижение частоты pT0 после НХТ при опухолях с мутантным PIK3CA по сравнению с опухолями дикого типа [32]. Необходимо дальнейшее изучение предиктивной и прогностической роли мутационного статуса сигнального пути PI3K при УК.
В когорте из 4069 пациентов с УК мутации ERBB2 были выявлены в 9,2 % случаев. Частота альтераций была выше у мужчин (p < 0,001), а также при локализации первичной опухоли в мочевом пузыре (р = 0,04). Наиболее распространенными мутациями ERBB2 были S310F / Y (51,4 %) и I767M [33]. ERBB2 кодирует рецепторную тирозинкиназу HER2 . Гиперэкспрессия и/или амплификация ERBB2 при УК связана с неблагоприятными морфологическими характеристиками опухоли и плохим прогнозом [34]. В нашей серии наблюдений ОСВ больных с патогенными мутациями
ERBB2 оказалась ниже, чем у больных с диким вариантом этого гена. Патогенные мутации ERBB2 предоставляют мишень для HER2-таргетной терапии. Конъюгат антитела и HER2-таргетного препарата трастузумаб дерукстекан в когорте УК (n = 41) корзинного исследования продемонстрировал высокую ЧОО у пациентов с резистентными опухолями, имеющими иммуногистохимически подтвержденную гиперэкспрессию HER2 (3+ и 2+) [35]. В другом исследовании трастузумаб дерукстекан в комбинации с ниволумабом показал обнадеживающую эффективность при HER2-позитивной УК [36]. Данных о влиянии мутационного статуса на эффективность HER2-таргет-ной терапии УК нет. В ряде исследований подтверждена прямая корреляция HER2-статуса и мутационного статуса ERBB2 в образцах УК, но в ходе дальнейших исследований надо принимать во внимание расхождения результатов иммуногистохимических и цитогенетических данных [37].
В нашей серии наблюдений частым событием являлись альтерации генов-регуляторов хроматина KDM6A (38 %) и ARID1A (24 %), возможно, обладающих супрессивным действием на УК. Некоторые исследователи отмечали, что данные мутации являются взаимоисключающими [17], что не нашло подтверждения в нашей работе. Инактивирующие мутации ARID1A присутствуют примерно в 20 % УК и потенциально могут служить критерием селекции кандидатов для противоопухолевой терапии. Гистонметилтранс-фераза EZH2- онкоген-активатор PI3 K, функционально противостоящий ARID1A . In vitro и in vivo продемонстрировано повышение чувствительности УК с мутантным геном ARID1A к ингибитору EZH2 с или без ингибитора PI3K [38]. Исследования ингибиторов EZH2 при УК продолжаются.
По некоторым данным, мутации KDM6A ассоциированы с благоприятными морфологическими характеристиками
УК [39]. В нескольких исследованиях продемонстрировано, что мутации KDM6A ассоциированы со снижением инфильтрации опухоли Т-клетками, что может свидетельствовать о потенциальном снижении эффективности ИТ при УК с инактивирующими мутациями данного гена [40,41]. Утрата функции KDM6A индуцирует эпигенетическую стимуляцию роста опухоли, обусловленную ATF3 (активирующим транскрипционным фактором 3), что создает потенциальную терапевтическую мишень, нуждающуюся в дальнейшем изучении [42].
ВЫВОД
Подводя итог, можно сказать, что выявление потенциальных мишеней и разработка целенаправленной противоопухолевой терапии при распространенной УК представляет большой научный и практический интерес. Геномное профилирование с диагностическим анализом характеристик УК на основе NGS позволило выявить большое разнообразие генетических альтераций, связанных с закономерностями естественного течения опухолевого процесса, позволяющих прогнозировать эффективность универсальных подходов к лечению, а также предоставляющих терапевтические мишени для таргетных препаратов с различным механизмом действия, включая агенты с доказанной эффективностью при УК, других злокачественных опухолях, а также находящихся на разных этапах клинической разработки.
Исследование проводится в рамках проекта Московского центра инновационных технологий в здравоохранении №2002–32 / 23.


