Mycobacterium abscessus как возбудитель перипротезной инфекции
Автор: Касимова А.Р., Кочиш А.А., Гордина Е.М., Артюх В.А., Рукина А.Н., Божкова С.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Случай из практики
Статья в выпуске: 5 т.29, 2023 года.
Бесплатный доступ
Введение. Вид Mycobacterium abscessus относится к группе нетуберкулезных микобактерий, ответственных за хронические инфекции у лиц с ослабленным иммунитетом. M. abscessus способны колонизировать искусственные поверхности, в том числе медицинские и хирургические инструменты/устройства. В связи с низкой частотой встречаемости M. abscessus как возбудителя ортопедической инфекции он представляет несомненный интерес для практикующих врачей. Данный инфекционный агент является редким возбудителем, в отношении которого отсутствует отработанный лечебный алгоритм.Цель. Представить способ достижения успешного результата лечения пациента с перипротезной инфекцией, вызванной M. abscessus.Материалы и методы. Из историй болезни и выписных документов известно, что пациентке Х. по месту жительства выполнено тотальное эндопротезирование тазобедренного сустава. В раннем послеоперационном периоде манифестировали признаки острой инфекции послеоперационной раны.Результаты. Спустя три месяца пациентка госпитализирована в профильное учреждение с диагнозом хроническая глубокая перипротезная инфекция. При дообследовании установлена этиология процесса. Пациентке в две госпитализации последовательно выполнены 4 санирующие операции (в том числе мышечная пластика и установка антимикробного спейсера) и проводилась массивная парентеральная антибактериальная терапия в течение 8 месяцев, в том числе на амбулаторном этапе, с применением минимум 3-х антибактериальных средств. Спустя 4 года пациентка не предъявляет жалоб со стороны очага инфекционного процесса. Послеоперационный рубец 45 см без особенностей. Оставшееся укорочение правой нижней конечности 3 см компенсируется ортопедической обувью.Обсуждение. Лечение инфекции, вызванной M. abscessus, является сложной задачей вследствие природной устойчивости возбудителя к широкому спектру антибактериальных лекарственных средств. В литературе описаны единичные случаи ортопедической инфекции, вызванной данным патогеном. Все авторы сходятся в том, что залогом успешного лечения является комбинация радикальной хирургической санации и антибактериальной терапии с применением минимум трех антимикробных препаратов.Заключение. Длительная агрессивная антибиотикотерапия в комбинации с этапным хирургическим лечением позволила добиться успеха при лечении пациента с перипротезной инфекцией, вызванной Mycobacterium abscessus, после первичного эндопротезирования тазобедренного сустава.
Ортопедическая инфекция, перипротезная инфекция, нетуберкулезные микобактерии, mycobacterium abscessus, антибактериальная терапия
Короткий адрес: https://sciup.org/142239037
IDR: 142239037 | УДК: 579.873.21-089.227.843-77-089.168.1-002 | DOI: 10.18019/1028-4427-2023-29-5-557-564
Текст научной статьи Mycobacterium abscessus как возбудитель перипротезной инфекции
Вид Mycobacterium abscessus относится к группе нетуберкулезных микобактерий (НТМБ), ответственных за хронические инфекции у лиц с ослабленным иммунитетом или муковисцидозом, и включает 3 подвида: M. abscessus subsp. abscessus, M. abscessus subsp. bolletti и M. abscessus subsp. massiliense [1]. Несмотря на то, что M. abscessus традиционно рассматривают как условно-патогенный микроорганизм, последние исследования показывают эволюцию патогенного потенциала M. abscessus. Способность данного вида вызывать развитие патологических процессов обусловлена значительным набором факторов вирулентности,
включающим две группы агентов (микобактериальные и немикобактериальные), которые обеспечивают взаимодействие M. abscessus с макроорганизмом [2].
M. abscessus существуют в различных экологических нишах [1] и способны колонизировать искусственные поверхности, фомиты, медицинские и хирургические инструменты/устройства [3]. M. abscessus могут поражать кожу, мягкие ткани, кости, суставы, лимфатические узлы, внутренние органы [4] и образовывать характерные гранулемы, уклоняясь от фагосомных защитных механизмов, индуцируя выработку воспалительных цитокинов и рекрутируя В- и Т-лимфоциты в очаг инфекции [5]. Сухожильные влагалища, суставы и кости могут быть инфицированы в результате различных травм, оперативных вмешательств, инвазивных процедур или глубокой пункции кожи [3, 5]. Кроме того, факторами риска развития инфекции, вызванной M. abscessus, являются перенесенные хирургические вмешательства с установкой имплантатов, использование иммунодепрессантов, гематологические злокачественные новообразования и терминальная стадия почечной недостаточности [6].
В современной научной литературе опубликовано лишь несколько подтвержденных случаев ортопедической инфекции, вызванной M. abscessus [3]. В связи с низкой частотой встречаемости M. abscessus как возбудителя ортопедической инфекции несомненный интерес для практикующих врачей (ортопедов-травматологов, инфекционистов, терапевтов) представляет редкий клинический случай перипротезной инфекции, вызванной M. abscessus . Особенностью данного случая стала сложность и длительность антибиотикотерапии, направленной на купирование инфекционного процесса.
Цель – представить способ достижения успешного результата лечения пациента с перипротезной инфекцией, вызванной M. abscessus .
МАТЕРИАЛЫ И МЕТОДЫ
Из данных историй болезни и выписных документов известно, что пациентке Х. 1957 г. р. (180 см, 68 кг) с двухсторонним идиопатическим коксартрозом 3 стадии в июне 2018 г. по месту жительства выполнено тотальное бесцементное эндопротезирование левого тазобедренного сустава (ТБС). Послеоперационный период протекал без особенностей. В октябре того же года пациентке выполнено тотальное бесцементное эндопротезирование правого ТБС в том же стационаре. В раннем послеоперационном периоде манифестировали признаки острой инфекции послеоперационной раны. На фоне консервативного лечения признаки воспаления были купированы, пациентка выписана на амбулаторное лечение.
Через 3 недели после тотального эндопротезирования правого ТБС развились отёк, покраснение области послеоперационных рубцов правого бедра, открылся свищ с обильным гнойно-геморрагическим отделяе- мым. Пациентке была рекомендована госпитализация в гнойное хирургическое отделение с диагнозом: флегмона области правого бедра. В ноябре 2018 г. выполнена санация, ревизия флегмоны правого бедра, бактериологический анализ содержимого не выявил возбудителя. За время госпитализации получала системную антибактериальную терапию: ванкомицин, моксифлоксацин, линезолид. На момент выписки отмечали улучшение состояния, снижение количества отделяемого и изменение характера в пользу серозного. Для дальнейшего хирургического лечения пациентке было рекомендовано обратиться в профильное учреждение.
В работе использованы клинические, лабораторные, инструментальные методы диагностики. Пациентка при поступлении подписала информированное добровольное согласие на использование результатов лечения для образовательных и научных целей.
РЕЗУЛЬТАТЫ
В середине января 2019 г. пациентка госпитализирована в Федеральный центр. Диагноз при поступлении: хроническая глубокая перипротезная инфекция правого ТБС, обострение, свищевая форма (рис. 1, а). Местно при поступлении – гранулирующая рана 2 × 3 см в верхней трети послеоперационного рубца и 2 свищевых хода дистальнее рубца. Диагноз подтвержден фистулографи-ей (рис. 1, б). Сопутствующая патология: артериальная гипертензия 2 степени, 2 стадии, риск сердечно-сосудистых осложнений 3, хронический поверхностный гастродуоденит, гастроэзофагальня рефлюксная болезнь. В анамнезе – аппендэктомия, 3 кесаревых сечения.
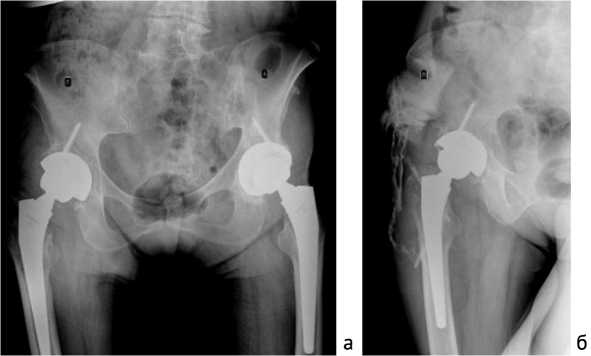
Рис. 1. Рентгенография таза при поступлении в Федеральный Центр: а – обзорный рентгеновский снимок таза; б – фистулография правого ТБС, распространение контрастного вещества в полость сустава
Лабораторно выявлены признаки инфекционного процесса: WBC – 8,3 × 109/л (токсикогенная зернистость нейтрофилов ++), СОЭ – 120 мм/час, СРБ – 81 мг/л, гипохромная анемия: Hgb – 74 г/л, RBC – 3,06 × 1012/л, железо сывороточное 3,7 мкмоль/л. В перевязочном кабинете выполнено взятие через свищевой ход 2-х тканевых биоптатов из глубины раны. Для подготовки к операции проводили коррекцию анемии и белковой недостаточности.
16.01.2019 г. выполнена радикальная хирургическая обработка раны с установкой блоковидного спей-сера (рис. 2, а), импрегнированного ванкомицином (10 масс. %). Интраоперационно выявлены признаки острого целлюлита, дефект фасции на протяжении 10 см, фасциит, миозит, затеки кзади и кпереди от бедренной кости. При удалении бедренного компонента произошёл перелом бедренной кости, потребовавший остеосинтеза серкляжной проволокой. Проводили промывание раны растворами антисептиком в объеме 6 литров. Операцию завершили дренированием раны по Редону.
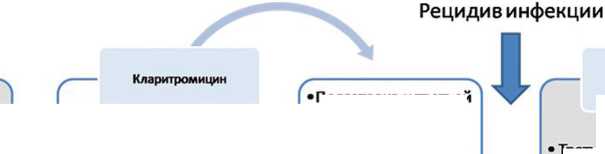
Со дня операции пациентка получала стандартную, принятую в центре, эмпирическую антибиотикотера-пию ванкомицином и цефоперазоном/сульбактамом (рис. 3). После получения на 2-е сутки предварительных результатов микробиологического исследования дооперационного материала – рост Fusobacterium varium , была осуществлена смена антибактериальных препаратов на амикацин и левофлоксацин. На пятые сутки после операции были получены окончательные результаты исследования – из дооперационного материала выделен панрезистентный штамм M. abscessus (табл. 1). К антибактериальной терапии был добавлен кларитромицин. На этом фоне отметили обильное намокание повязки раневым отделяемым, которое оставалось значительным к 7 суткам после операции.
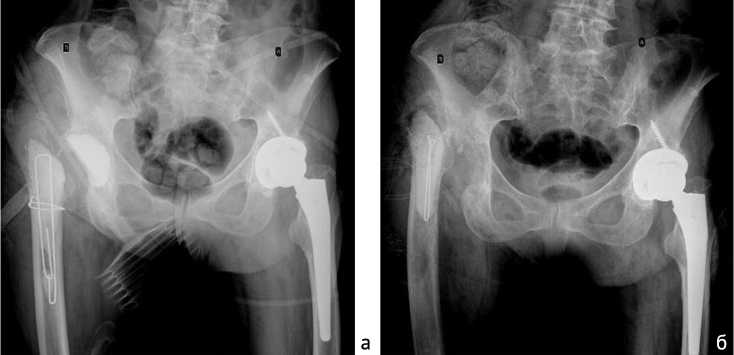
Рис. 2. Рентгенография таза после проведения санации с установкой антимикробного спейсе-ра: а – рентгенограмма после установки первого спейсера правого ТБС; б – рентгенограмма после установки второго спей-сера правого ТБС
Рецидив инфекции
Первая санирующая операция (16.01.19)
Амикацин Левофлоксацин Кларитромицин
Выделение
М. abscessus из тканевых биоптатов
(21.01.19)
Выделение
М. abscessus и Staphylococcus sp. из тканевых биоптатов и МК (28.01.19)
Амикацин Тигециклин Кларитромицин Ципрофлоксацин
Подготовка к второй хирургической санации (03.02.19)
Ванкомицин Цефо пераэо н/сул ьб а ктам


Амикацин Линезолид Тигециклин
Вторая санирующая операция (07.02.19)
Амикацин Тигециклин Кларитромицин
•Жалобы на тошноту и рвоту (19.02.19), постепенная отмена
Подготовка к третьей хирургической санации (26.02.19)
Амикацин Тигециклин Кларитромицин Ципрофлоксацин

Третья санирующая операция (07.03.2019)
Симптоматическая

Рис. 3. Коррекция антибактериальной терапии при первой госпитализации
Таблица 1
Чувствительность выделенного штамма M. abscessus к антибактериальным препаратам
|
Mycobacterium abscessus |
||
|
Антибиотикограмма |
Чувствительность |
МПК |
|
Амоксициллин/Клавулановая кислота |
R |
> 64/32 |
|
Доксициклин |
R |
> 16 |
|
Имипенем |
R |
> 64 |
|
Кларитромицин |
R |
> 64 |
|
Линезолид |
R |
> 64 |
|
Миноциклин |
R |
> 8 |
|
Моксифлоксацин |
R |
> 8 |
|
Тигециклин |
– |
4 |
|
Тобрамицин |
R |
> 16 |
|
Триметоприм/сульфометаксозол |
R |
> 8/152 |
|
Цефепим |
R |
> 3 |
|
Цефокситин |
R |
> 128 |
|
Цефтриаксон |
R |
> 64 |
|
Ципрофлоксацин |
R |
> 16 |
МПК – минимальная подавляющая концентрация, мг/л.
Рост M. abscessus был также получен из интраоперационных тканевых биоптатов и компонентов эндопротеза на 12-е сутки после операции, кроме того, был получен рост неверифицированного штамма Staphylococcus sp. На фоне отрицательной клиниколабораторной динамики сняты швы на всю глубину раны и проведена коррекция АБ-терапии на амикацин, линезолид и тигециклин. На 15-е сутки после первой операции было принято решение о выполнении повторной ревизионной операции. В связи с окончательной верификацией этиологии инфекции, вызванной M. abscessus , пациентка осмотрена хирургом-фтизиатром. По его заключению, пациентка эпидемически неопасна и не требовала изоляции. Рекомендовано после повторной санации продолжить массивную комбинированную антибактериальную терапию (рис. 4). На 19-е сутки после операции с целью подготовки к оперативному вмешательству, с учетом устойчивости выделенного штамма M. abscessus ко всем тестируемым антибиотикам и отсутствия роста Staphylococcus sp., линезолид был отменен, продолжены амикацин, ти-гециклин и дополнительно назначены кларитромицин и ципрофлоксацин.
07.02.2019 г. (21-е сутки после первой операции) выполнена повторная радикальная хирургическая обработка очага инфекции с переустановкой блоковидного антимикробного спейсера, импрегнированного амикацином (10 масс. %) (рис. 3, б). В ходе операции выявлен острый инфекционный процесс с вовлечени- ем фасции и мышц. Перед установкой нового спей-сера рану обработали пульсирующей струей физиологического раствора с добавлением амикацина (2,0 г на 500 мл) с эффектом кавитации аппаратом Sonoca 300 (Söring, Германия). Принимая во внимание острое течение рецидивирующего инфекционного процесса, были наложены наводящие швы на фасцию и кожу.
В послеоперационном периоде проводили помимо антибактериальной и симптоматическую терапию: обезболивание, коррекцию анемии и белковой недостаточности, витаминотерапию. С целью локальной АБТ по установленным дренажам вводили раствор 0,5 % диоксидина 20 мл однократно в течение 5 дней. Послеоперационная рана заживала вторичным натяжением.
На 12-е сутки после второй операции пациентку стала беспокоить тошнота и рвота, связанные с введением антибиотиков, в связи с чем назначили противо-рвотные препараты и начали сокращать количество получаемых АБ-препаратов. Сначала отменили амикацин и ципрофлоксацин, однако жалобы на тошноту, рвоту сохранялись, через трое суток отменили кларитромицин, еще через сутки – тигециклин, после чего пациентку перестали беспокоить тошнота и рвота. Однако на фоне отмены АБ-терапии развился второй рецидив инфекции с расхождением краев раны, и 26.02.2019 г. (19-е сутки после второй операции) принято решение о проведении третьей санирующей операции. Начата подготовка к выполнению хирургического вмешательства: коррекция анемии и белковой недостаточности. С учетом предшествующих жалоб на фоне проведения АБ-терапии со дня хирургического лечения были назначены амикацин, тигециклин, кларитромицин.
07.03.2019 г. выполнена третья санирующая операция (рис. 5, а) с повторной переустановкой блоковидного антимикробного спейсера, дополнительно импрегниро-ванного меропенемом (10 масс. %). Послеоперационная рана ушита с формированием фистулы. В послеоперационном периоде рана зажила на всем протяжении, кроме фистулы в нижнем углу. 21.03.19 г. пациентка выписана на амбулаторное лечение с рекомендацией продолжить системную антибактериальную терапию в дневном стационаре по месту жительства (рис. 4).
В период с 26.03.2019 г. по 18.06.19 г. пациентка находилась на консервативном лечении по месту жительства, где получила амикацин, тигециклин, моксифлоксацин, кларитромицин, метронидазол. На всем протяжении АБТ выполняли лабораторный контроль с целью выявления нежелательных лекарственных реакций. С момента выписки и до поступления в Федеральный центр принимала моксифлоксацин, метронидазол, кларитромицин.
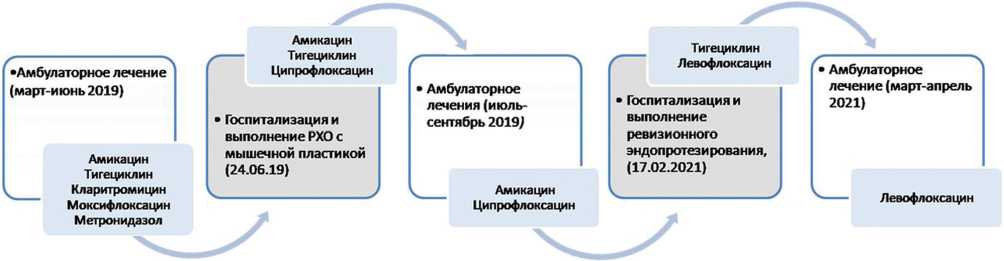
Рис. 4. Коррекция антибактериальной терапии при второй госпитализации
24.06.2019 г. пациентка повторно поступила в отделение гнойной хирургии для выполнения этапного хирургического лечения. Диагноз при поступлении: хроническая рецидивирующая глубокая перипротез-ная инфекция правого ТБС, обострение, свищевая форма. Хронический остеомиелит правой бедренной и тазовой кости, 4 (B), l, обострение. Местно при осмотре: послеоперационный рубец 20 см в области правого ТБС, в нижнем углу функционирующая фистула с обильным серозно-гнойным отделяемым.
Лабораторно определены следующие показатели: WBC – 5,4 × 109/л, СОЭ – 48 мм/час, СРБ – 5,1 мг/л, а также диагностирована гипохромная анемия: Hgb – 107 г/л, RBC – 3,42 × 1012/л.
26.06.2019 г. выполнена операция в объеме: радикальная хирургическая обработка раны, удаление блоковидного спейсера и замещение дефекта несвободным мышечным лоскутом из латеральной широкой мышцы бедра (ЛШМБ) (рис. 5, б). Со дня операции пациентка переведена на парентеральную АБТ: амикацин, тигециклин, ципрофлоксацин.
Рана заживала первичным натяжением, дренажи удалены на 5-е сутки после операции. В послеоперационном периоде проводили симптоматическую терапию. Рост микроорганизмов из интраоперационных тканевых биоптатов и удаленной конструкции не получен. Антибактериальную терапию продолжали до 14-х суток после операции. На 15-е сутки после операции пациентка выписана на амбулаторное лечение с рекомендацией продолжить АБТ в объеме: амикацин, ципрофлоксацин в течение 8 недель.
Через год (17.02.2021 г.) пациентка поступила для выполнения ревизионного эндопротезирования с диагнозом: хроническая рецидивирующая глубокая пе-рипротезная инфекция правого ТБС, ремиссия. Хронический остеомиелит правой бедренной и тазовой кости, 4 (B), l, ремиссия. В аспирате из правого ТБС рост микроорганизмов не получен. Status localis: послеоперационный рубец 45 см в области правого бедра без признаков острого воспаления. Укорочение правой нижней конечности – 5 см. Лабораторные признаки обострения инфекционного процесса отсутствовали: WBC – 5,1 × 109/л, СОЭ – 11 мм/час, СРБ – 1,13 мг/л.
Выполнено ревизионное эндопротезирование правого ТБС при помощи эндопротеза бесцементной фиксации (Zimmer Biomet, США) (рис. 6). Послеоперационная рана зажила первичным натяжением. Со дня операции получала системную АБТ: тигециклин, левофлоксацин. На 7-е сутки получены результаты интраоперационных посевов, в 1 из 5 биоптатов выявлен рост MSSE. АБТ продолжена до 14-х суток после операции. На амбулаторном этапе пациентке рекомендовано продолжить прием левофлоксацина 0,5 г 2 раза в сутки в течение 1 месяца.
В ходе заочной консультации в феврале 2023 г. пациентка не предъявляет жалоб со стороны очага инфекционного процесса. Послеоперационный рубец 45 см без особенностей. Оставшееся укорочение правой нижней конечности 3 см компенсируется ортопедической обувью. Лабораторные показатели в пределах нормы: WBC – 4,09 × 109/л, СОЭ – 15 мм/час, СРБ – 4,9 мг/л, а также Hgb – 138 г/л, RBC – 4,20 × 1012/л. На контрольных рентгенограммах визуализируется стабильный эндопротез правого ТБС (рис. 7).
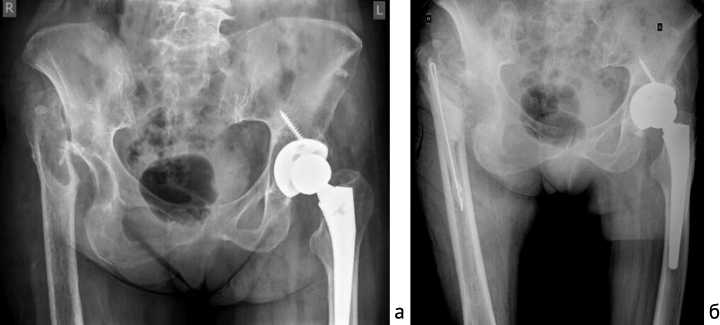
Рис. 5. Рентгенография таза после проведения повторных санаций: а – рентгенограмма таза после установки третьего спейсера правого ТБС; б – рентгенограмма таза после несвободной мышечной пластики из ЛШМБ
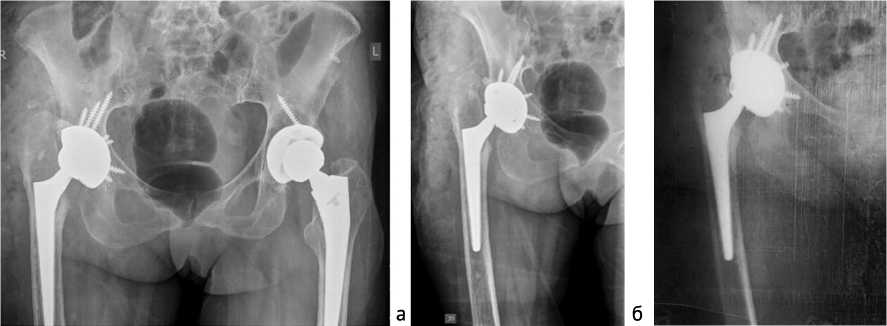
Рис. 6. Рентгенография таза после выполнения ревизионного эндопротезирования пра- Рис. 7. Рентгенография правого вого ТБС: а – обзорный рентгеновский снимок таза; б – рентгенограмма правого ТБС ТБС через два года после реэндопротезирования
ОБСУЖДЕНИЕ
Лечение инфекции, вызванной M. abscessus , является сложной задачей вследствие природной устойчивости возбудителя к широкому спектру антибактериальных лекарственных средств. Как правило, необходимо назначение минимум трех антибиотиков, активных в отношении возбудителя [7].
Случаи перипротезной инфекции, вызванной M. abscessus , в мировой литературе описаны в виде единичных клинических наблюдений. В одном из них, у пожилого пациента 78 лет развился острый двусторонний инфекционный процесс через 5 недель после билатерального эндопротезирования коленных суставов [8]. Курс эмпирической противотуберкулезной терапии (рифампицин, изониазид, пиразинамид и этамбутол), а также санация суставов с заменой модульных компонентов не привели к успеху. После первого рецидива выполнена двусторонняя установка антимикробных спейсеров. Для лечения второго рецидива выполнен артродез правого коленного сустава аппаратом Илизарова и двухэтапное лечение левого коленного сустава на фоне комбинации рифабутина, кларитромицина и амикацина. В результате 1,5 лет лечения и 7 операций удалось купировать инфекционный процесс, вызванный M. abscessus .
Известен случай полиорганного поражения M. abscessus у пациента с хронической болью в спине с узловым поражением правой голени, без лихорадки, озноба, сыпи, одышки или кашля. Лабораторные данные показали умеренный лейкоцитоз. На компьютерной томографии грудной клетки выявлены двусторонние кавитационные узелки. В биоптатах кожи, мокроте и посевах крови обнаружены M. abscessus и назначена терапия ме-ропенемом, тигециклином и амикацином. Пациент был повторно госпитализирован с усилением болей в пояснице. При магнитно-резонансной томографии поясничного отдела позвоночника выявлены деструктивные изменения тел L4 и L5 позвонков на фоне остеомиелита. Посев крови и биопсия кости снова выявили M. abscessus. Выполнена эхокардиограмма в связи со стойкой бактериемией, которая выявила крупные вегетации на трикуспидальном клапане и мелкие вегетации на митральном клапане. Терапия была изменена на курс амикацина с це-фокситином в течение 8 недель и имипенем на двенадцать месяцев [9]. Кроме того, описана внутрибольничная вспышка септического артрита, вызванная НТМБ, после инъекций кортикостероидов [10]. Авторы отмечают, что клинические врачи должны иметь в виду, что микобактериальные инфекции, включая M. abscessus, являются одним из дифференциальных диагнозов у пациентов с подострым артритом и инфекцией мягких тканей [6]. Несмотря на длительную комбинированную антибактериальную терапию, лечение инфекций, вызванных M. abscessus, часто оказывается безуспешным, что приводит к прогрессирующему заболеванию и, в итоге, к летальному исходу [7]. Fukui с соавторами описали летальный случай при инфекции, вызванной M. abscessus, у пациента, получавшего в течение 17 лет кортикостероиды. На рентгенограмме правого локтевого сустава регистрировали остеолиз, магнитно-резонанс- ная томография выявила жидкость в правом локтевом суставе. Рост M. abscessus регистрировали из суставной жидкости и в посевах крови. Пациенту было проведено антимикробное лечение кларитромицином, амикацином и имипенемом/циластатином в сочетании с хирургической обработкой раны и, несмотря на то, что через 1 неделю посев крови и суставной жидкости был отрицательным, пациент умер через 6 недель после начала антимикробного лечения [6]. В нашем случае суммарная длительность АБТ составила 8 месяцев, пациентка получала, в том числе, амикацин, тигециклин, ципрофлоксацин, кларитромицин.
В другом клиническом наблюдении у 84-летнего пациента развилась перипротезная инфекция коленного сустава и сепсис через 8 недель после операции [3]. Две последовательных ревизии с заменой модульных компонентов оказались безуспешны. В ходе двухэтапного лечения удалось купировать инфекционный процесс. В качестве антибактериальных препаратов были задействованы ванкомицин, азитромицин, амикацин, тигециклин, це-фокситин, ципрофлоксацин и линезолид. Общий срок лечения составил 84 недели (более 1,5 лет), в ходе которого выполнены 4 операции на коленном суставе.
Существуют описанные случаи других локализаций ортопедической инфекции, вызванной M. abscessus . Wong и соавторы описывают два случая инфекции стопы после открытых переломо-вывихов. В одном случае пациентку лечили кларитромицином и доксициклином, во втором – цефокситином, кларитромицином и доксициклином. Через 10 месяцев после санации инфекция была купирована [11]. M. abscessus также может быть причиной остеомиелита грудного отдела позвоночника [12-14], разрыва сухожилия сгибателя кисти [15], постинъекционного септического артрита [16].
В представленном нами случае хронической рецидивирующей перипротезной инфекции потребовалось 5 хирургических вмешательств, длительная комбинированная антибиотикотерапия и два года комплексного лечения для купирования инфекционного процесса, вызванного M. abscessus . Остаточное укорочение правой нижней конечности на 3 см стало следствием длительно текущего инфекционного процесса и множества оперативных вмешательств, которые привели к контрагированию мышц бедра при относительной сохранности костей, образующих ТБС. В настоящий момент пациентка использует ортопедическую обувь для компенсации неравенства длины конечностей, что позволяет ей двигаться без дополнительной опоры.
Врачи при назначении таргентной терапии могут ориентироваться только на результаты антибиотико-чувствительности конкретного изолята M. abscessus, однако, из-за особенностей бактериологического диагностики НТМБ, корректные результаты будут получены не ранее, чем через 5 дней после взятия материала (для медленно растущих микобактерий – от 7 дней). Кроме того, данный вид НТМБ характеризуется экстремальным профилем резистентности к антибиотикам. В рамках персонализированной медицины можно также расширить терапевтические подходы этиотропной терапии за счет генно-инженерных бактериофагов или подобранных комбинаций препаратов в соответствии с определением их синергидной антимикробной активности против конкретного изолята. Экспериментально установлена эффективность новых ингибиторов бета-лактамаз, в том числе авибактама, против M. abscessus [17]. Показан синергетический эффект комбинаций противомикробных препаратов ван-комицин/кларитромицин и двойной бета-лактамной терапии, что предполагает их возможное использование в схемах лечения с несколькими препаратами [18, 19]. Кроме того, бактериофаготерапия оказалась эффективной в тяжелом случае диссеминированной инфекции M. abscessus [20]. Несмотря на то, что многие из этих экспериментальных терапевтических средств демонстрируют активность in vitro в отношении M. abscessus, большинство из них не имеют в настоящее время доказательной базы об их эффективности при клиническом применении для лечения инфекций, вызванных данным возбудителем.
ЗАКЛЮЧЕНИЕ
Длительная агрессивная антибиотикотерапия в комбинации с этапным хирургическим лечением позволяет добиться успеха. Для этого необходима слаженная работа бактериологов, ортопедов, клинических фармакологов и инфекционистов. Прак- тикующим врачам необходимо знать о возможности развития нетуберкулезной микобактериальной ортопедической инфекции и корректно выполнять дифференциальную диагностику с другими инфекционными патологиями.
Список литературы Mycobacterium abscessus как возбудитель перипротезной инфекции
- Abdelaal HFM, Chan ED, Young L, et al. Mycobacterium abscessus: It's Complex. Microorganisms. 2022;10(7):1454. doi: 10.3390/ microorganisms10071454
- Ferrell KC, Johansen MD, Triccas JA, Counoupas C. Virulence Mechanisms of Mycobacterium abscessus: Current Knowledge and Implications for Vaccine Design. Front Microbiol. 2022;13:842017. doi: 10.3389/fmicb.2022.842017
- Nengue L, Diaz MAA, Sherman CE, et al. Mycobacterium abscessus Prosthetic Joint Infections of the Knee. J Bone Jt Infect. 2019;4(5):223-226. doi: 10.7150/jbji.36286
- Rampacci E, Stefanetti V, Passamonti F, Henao-Tamayo M. Preclinical Models of Nontuberculous Mycobacteria Infection for Early Drug Discovery and Vaccine Research. Pathogens. 2020 6;9(8):641. doi: 10.3390/pathogens9080641
- Vietor FI, Nelson TB. Difficulty in diagnosis and management of musculoskeletal nontuberculous mycobacterial infections. IDCases. 2022;29:e01527. doi: 10.1016/j.idcr.2022.e01527
- Fukui S, Sekiya N, Takizawa Y, et al. Disseminated Mycobacterium abscessus Infection Following Septic Arthritis: A Case Report and Review of the Literature. Medicine (Baltimore). 2015;94(21):e861. doi: 10.1097/MD.0000000000000861
- Meir M, Barkan D. Alternative and Experimental Therapies of Mycobacterium abscessus Infections. Int J Mol Sci. 2020;21(18):6793. doi: 10.3390/ ijms21186793
- Malhotra R, Bala K, Gautam D, et al. Mycobacterium abscessus Periprosthetic joint infection following bilateral Total Knee arthroplasty. IDCases. 2019;17:e00542. doi: 10.1016/j.idcr.2019.e00542
- Rahi MS, Reyes SP, Parekh J, et al. Disseminated Mycobacterium abscessus infection and native valve endocarditis. Respir Med Case Rep. 2021;32:101331. doi: 10.1016/j.rmcr.2020.101331
- Jung SY, Kim BG, Kwon D, et al. An outbreak of joint and cutaneous infections caused by non-tuberculous mycobacteria after corticosteroid injection. Int J Infect Dis. 2015;36:62-9. doi: 10.1016/j.ijid.2015.05.018
- Wong KP, Tang ZH, Tan GM. Mycobacterium fortuitum and Mycobacterium abscessus infections in the foot and ankle in two immunocompetent patients. Biomedicine (Taipei). 2020;10(4):52-56. doi: 10.37796/2211-8039.1021
- Kadota N, Shinohara T, Hino H, et al. Mycobacterium abscessus ssp. abscessus infection progressing to empyema from vertebral osteomyelitis in an immunocompetent patient without pulmonary disease: a case report. BMC Pulm Med. 2019;19(1):100. doi: 10.1186/s12890-019-0860-4
- Farid F, Nakamae T, Kamei N, et al. Vertebral osteomyelitis due to Mycobacterium abscessus subsp. massiliense with paravertebral abscess: A case report and review. J Infect Chemother. 2023:S1341-321X(23)00134-4. doi: 10.1016/j.jiac.2023.05.020
- Omori K, Kitagawa H, Tadera K, et al. Vertebral osteomyelitis caused by Mycobacteroides abscessus subsp. abscessus resulting in spinal cord injury due to vertebral body fractures. J Infect Chemother. 2022;28(2):290-294. doi: 10.1016/j.jiac.2021.09.013
- Tomori Y, Mochizuki T, Ohno H, et al. Purulent Flexor Tendon Rupture of the Hand due to Mycobacterium abscessus Infection: A Case Report and Review of the Literature. J Nippon Med Sch. 2022;89(3):347-354. doi: 10.1272/jnms.JNMS.2022_89-110
- Lee BI, Jang BW, Choi HS, et al. Arthroscopic treatment of Mycobacterium massiliense septic arthritis outbreak after intra-articular injection: A case-series report and literature review. Medicine (Baltimore). 2021;100(5):e23839. doi: 10.1097/MD.0000000000023839
- Kaushik A, Ammerman NC, Lee J, et al. In Vitro Activity of the New ß-Lactamase Inhibitors Relebactam and Vaborbactam in Combination with ß-Lactams against Mycobacterium abscessus Complex Clinical Isolates. Antimicrob Agents Chemother. 2019;63(3):e02623-18. doi: 10.1128/ AAC.02623-18
- Mukherjee D, Wu ML, Teo JWP, Dick T. Vancomycin and Clarithromycin Show Synergy against Mycobacterium abscessus In Vitro. Antimicrob Agents Chemother. 2017;61(12):e01298-17. doi: 10.1128/AAC.01298-17
- Story-Roller E, Maggioncalda EC, Lamichhane G. Select ß-Lactam Combinations Exhibit Synergy against Mycobacterium abscessus In Vitro. Antimicrob Agents Chemother. 2019;63(4):e02613-18. doi: 10.1128/AAC.02613-18
- Dedrick RM, Guerrero-Bustamante CA, Garlena RA, et al. Engineered bacteriophages for treatment of a patient with a disseminated drug-resistant Mycobacterium abscessus. Nat Med. 2019;25(5):730-733. doi: 10.1038/s41591-019-0437-z


