Наблюдение особенностей температурного поведения спектральных линий ЯМР 13C как метод изучения полигидроксилированного фуллерена C6O(OH)W
Автор: Карпунин А.Е., Мазур А.С., Проскурина О.В., Герасимов В.И., Плешаков И.В., Фофанов Яков Андреевич, Кузьмин Ю.И.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Физика приборостроения
Статья в выпуске: 2 т.28, 2018 года.
Бесплатный доступ
В работе показано, что в спектрах ядерного магнитного резонанса 13С, наблюдавшегося в полигидроксилированном фуллерене С60(ОН)п (фуллереноле), регистрируются особенности, отражающие существование изомеров данного соединения, а исследование температурного поведения пиков, соответствующих этим особенностям, может рассматриваться как метод качественного определения соотношения, в котором изомеры присутствуют в составе фуллеренола. Установлено, что в определенном режиме изменяя температуру, можно управлять изомерным составом образцов.
Ядерный магнитный резонанс, фуллеренол, спектры ямр углерода
Короткий адрес: https://sciup.org/142214855
IDR: 142214855 | УДК: 548.736.1:
Текст научной статьи Наблюдение особенностей температурного поведения спектральных линий ЯМР 13C как метод изучения полигидроксилированного фуллерена C6O(OH)W
ВВЕДЕНИЕ полученного фуллеренола, и выяснения того, ка кие данные могут быть извлечены из температур-
Изучение водорастворимых форм углеродных материалов привлекает внимание исследователей в связи с тем, что эти соединения обладают необычными и с точки зрения многих возможных применений полезными свойствами. К числу таких соединений следует отнести и т. н. фуллере-нолы, для которых существуют различные предложения по их биомедицинскому использованию. Кроме этого, они имеют характеристики, интересные для целого ряда других областей [1, 2].
Полигидроксилированные фуллерены (фулле-ренолы) имеют общую формулу С 60 (ОН) n , в структурном отношении они представляют собой углеродный каркас в виде молекулы фуллерена С 60 , окруженный оболочкой из OH-групп, обеспечивающих высокую растворимость вещества. Величина n зависит от того, каким образом вещество было синтезировано, причем известно, что технология может определять и более тонкие особенности строения, связанные с распределением гидроксильных групп на поверхности каркаса. Для изучения деталей формирования рассматриваемой системы требуется привлечение различных физических и физико-химических методов, среди которых важное место занимает ядерный магнитный резонанс (ЯМР), дающий полезную информацию о расположении молекулярных функциональных групп.
В настоящей работе рассмотрено применение ЯМР для характеризации специальным образом ного поведения его спектра.
ОБРАЗЦЫ
Материал был синтезирован по рассмотренной в [3, 4] схеме. Из сажи, полученной в электрической дуге эрозией графитовых электродов, выделялась смесь фуллеренов, из которой на хроматографической колонке отделялось соединение С 60 . Затем выполнялась его многоступенчатая очистка с использованием углеродного сорбента, причем состав необходимого продукта на каждом этапе контролировался методом жидкостной хроматографии. В итоге был получен фуллерен С 60 с чистотой 99.9 масс. % без примесей высших фуллеренов и содержанием С 60 О не более 0.1 %. Далее синтезировался фуллеренол, для чего в отфильтрованный бензольный раствор С60 при интенсивном перемешивании добавлялся концентрированный раствор NaOH, и в качестве катализатора раствор гидроксида тетрабутиламмония. После прохождения реакции щелочь удалялась, и образец высушивался в вакууме.
Качественный анализ, проведенный методами рентгеновской фотоэлектронной и инфракрасной спектроскопии, подтвердил получение соединения C 60 (OH) n , которому по результатам комплексного термического и элементного анализа наилучшим образом соответствует значение n ≈ 46–50.
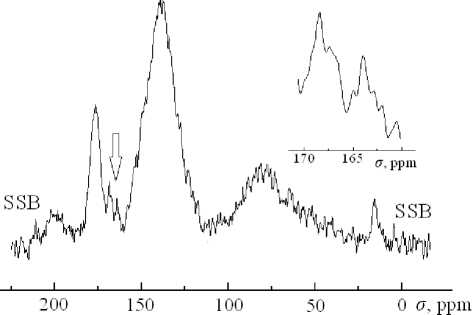
Рис. 1. Спектр ЯМР 13С при T = 50 ºC.
Стрелкой отмечен расщепленный пик; SSB — вращательные артефакты; на вставке — область расщепления в увеличенном масштабе
МЕТОДИКА ИЗМЕРЕНИЙ
На синтезированных описанным выше способом образцах был изучен ЯМР 13C. Сигналы наблюдались на радиоспектрометре Bruker Avance III 400 WB по методике твердотельного ЯМР с использованием вращения образцов под магическим углом. Частота вращения составляла 20 кГц. При определении химических сдвигов σ в качестве стандарта использовался тетраметилси-лан. Для регистрации спектров применялась одно-импульсная возбуждающая последовательность с периодом повторения 5 с, длительностью импульса 2.6 мкс и несущей частотой 100.613 МГц. Кроме того, использовалась последовательность с кросс-поляризацией (CP), имеющая период повторения 5 с, с длительностью контакта 2 мс. Измерительная система позволяла проводить эксперименты с изменением температуры образца T от комнатной до 90 ºC.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ И ОБСУЖДЕНИЕ
Полученные нами спектры ЯМР в основных чертах не отличались от обычных для данного соединения [5–7]. Рис. 1 демонстрирует один из них (поскольку в работе использовался нагрев образцов, для примера приведен результат измерения при температуре выше комнатной). Главные резонансные линии, отнесение которых к различным атомным группам можно найти, например, в [6], были воспроизведены и у нас, однако, кроме этого, была обнаружена ранее не отмечавшаяся особенность: пик, соответствующий одновалентной карбоксильной группе О=С–О с σ ≈ 165 ppm, оказался расщепленным на два, расположенных друг относительно друга с небольшим сдвигом (4– 6 ppm). Она сохранялась практически при всех Т (только при Т = 70 K сигнал был соизмерим с шумами), причем положение пиков оставалось неизменным. Такой эффект характерен для изомеров, наличие которых мы и предполагаем в нашем образце.
Спектры ЯМР были сняты при температурах от комнатной до 90 ºС. Их участки, относящиеся к карбоксильной группе (интервал 162 < σ < 171 ppm), приведены на рис. 2, 3. При обработке экспериментальных данных предполагалось, что форма резонансных кривых описывается функцией Гаусса
f(°)=^expC-(° °0), p^2n L 2P _ где σ0 — центральное значение (математическое ожидание) химического сдвига, p — параметр
σ , ppm
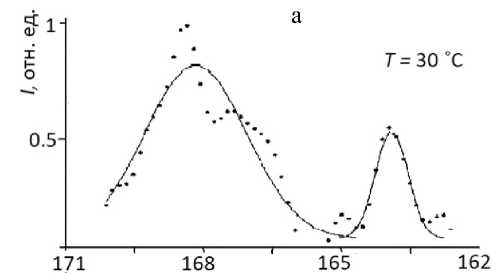
Рис. 2. Участки спектров ЯМР 13С при нагреве T = 30 (а) и T = 50 ºС (б) и последующем охлаждении образца. На рисунке — экспериментальные точки и линии аппроксимации пиков функцией Гаусса
б
σ , ppm
σ , ppm
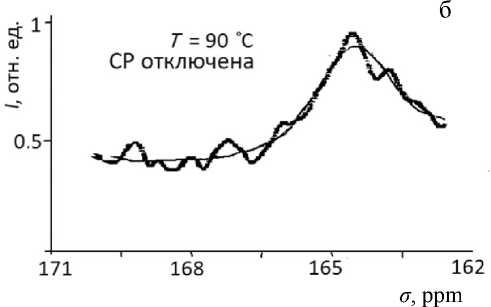
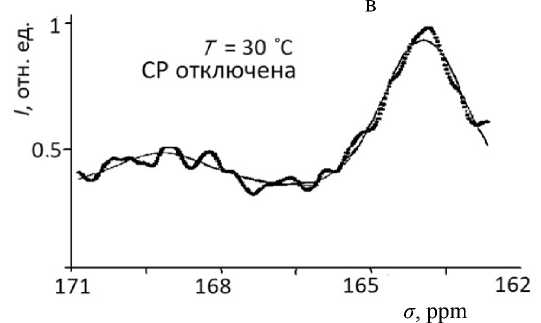
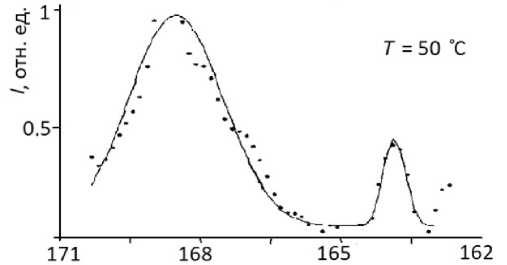
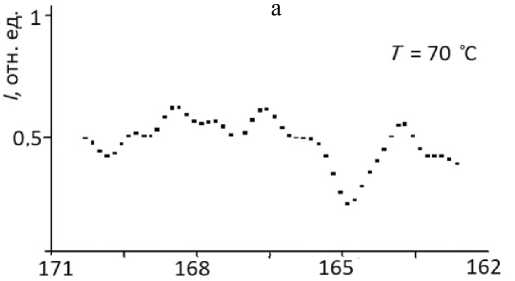
Рис. 3. Участки спектров ЯМР 13С при нагреве T = 70 (а), T = 90 (б) и T = = 30 ºС (в) и последующем охлаждении образца.
На рисунке — экспериментальные точки и линии аппроксимации пиков функцией Гаусса ширины пика (среднеквадратичное отклонение). Подгоночные функции на рис. 2, 3 показаны сплошными линиями. Видно, что избранная функция, характерная для неоднородно уширенного спектра, вполне удовлетворительно описывает резонансы.
Известно [8], что углеродный каркас фуллере-нола (т. е. молекула фуллерена C 60 ) может образовывать изомеры, и возможно, что некоторый вклад в наблюдавшееся расщепление связан с существованием разных форм этой части структуры. Нами, однако, обнаружена сильная зависимость компонентов расщепленного пика от температуры (см. рис. 2, 3), что более типично для изменчивой гидратной оболочки. Можно предположить, что в эксперименте в основном регистрируются изомеры, отвечающие разным способам присоединения OH-групп к каркасу C 60 с формированием карбоксильного фрагмента. Исследование температурного поведения спектров выявляет еще одно свойство резонанса в этой частотной области, заключающееся в том, что при нагреве и последующем охлаждении образца происходит противоположным образом направленное изменение интенсивностей компонент расщепленного пика. Это
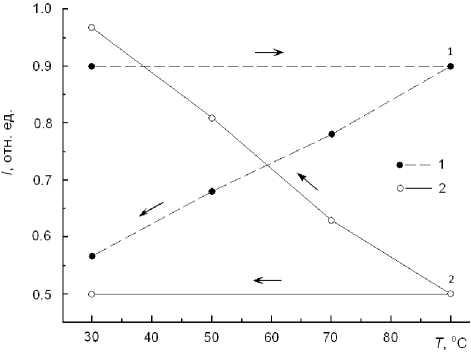
Рис. 4. Изменение относительных интенсивностей компонентов расщепленного пика в зависимости от температуры (1 — σ ≈ 164 ppm, 2 — σ ≈ 169 ppm)
показано на рис. 4, где приводятся зависимости амплитуд сигналов ЯМР (определенных из под-
гонки гауссовой функции к экспериментальным данным) от T . Видно, что в конце цикла "нагрев— охлаждение" отношение интенсивностей пиков с σ ≈ 169 ppm и σ ≈ 164 ppm изменилось более, чем в 3 раза. Следовательно, то, в какой пропорции содержатся в веществе предполагаемые изомеры, зависит от предварительной температурной обработки вещества, причем это соотношение достаточно точно устанавливается методом ЯМР.
ЗАКЛЮЧЕНИЕ
При исследовании спектров ЯМР фуллеренола методом твердотельного ЯМР обнаружена особенность в области пика, отвечающего карбоксильной группе. Высказано предположение, что она связана с существованием изомеров данного соединения, присутствие которых обеспечено, по всей видимости, применением описанной в работе технологии. Показано, что ЯМР может использоваться как метод определения соотношения, в котором изомеры присутствуют в веществе, причем это соотношение регулируется нагревом образцов.
Авторы благодарят ресурсный центр СПбГУ за предоставление возможности для проведения экспериментов и Ю.М. Жукова за характеризацию образцов методом рентгеновской фотоэлектронной спектроскопии.
Работа выполнена при поддержке ФАНО России по теме ИАП РАН гос. рег. № АААА-А16-116041110125-9 и при частичной поддержке Программы повышения конкурентоспособности ФГАОУ ВО СПбПУ № 5-1002020.
Список литературы Наблюдение особенностей температурного поведения спектральных линий ЯМР 13C как метод изучения полигидроксилированного фуллерена C6O(OH)W
- Андреев С.М., Башкатова Е.Н., Пургина Д.Д., Шершакова Н.Н., Хаитов М.Р. Фуллерены: биомедицинский аспект//Иммунология. 2015. Т. 36, № 1. С. 5761.
- Andrievsky G.V., Klochkov V.K., Bordyuh A.B., Dovbeshko G.I. Comparative analysis of two aqueous-colloidal solutions of C60 fullerene with help of FTIR reflectance and UV-Vis spectroscopy//Chemical Physics Letters. 2002. Vol. 364, no. 1-2. P. 8-17.
- Li J., Takeuchi A., Ozawa M., Li X., Saigo K., Kitazawa K.J. C60 fullerol formation catalysed by quaternary ammonium hydroxides//Chem. Soc., Chem. Commun. 1993. Vol. 23. P. 1784-1785.
- Семенов К.Н., Летенко Д.Г., Чарыков Н.А., Никитин В.А., Матузенко М.Ю., Кескинов В.А., Постнов В.Н., Копырин А.А. Синтез и идентификация фуллеренола, полученного методом прямого окисления//Журнал прикладной химии. 2010. Т. 83, № 12. С. 1948-1952.
- Chiang L.Y., Upasani R.B., Swirczewski J.W. Evidence of hemiketals incorporated in the structure of fullerols derived from aqueous acid chemistry//J. Am. Chem. Soc. 1993. Vol. 115, no. 13. P. 5453-5457.
- Wang Z., Chang X., Lu Z., Gu M., Zhao Y., Gao X. A precision structural model for fullerenols//Chemical Science. 2014. Vol. 5, no. 8. P. 2940-2948.
- Andreeva D.V., Ratnikova O.V., Melenevskaya E.Yu., Gribanov A.V. The regioselectivity of fullerenols C60(OH)x determined by high-resolution solid-state 13C and ^H NMR analysis//International Journal of Polymer Analysis and Characterization. 2007. Vol. 12. P. 105-113.
- Gerasimov V.I., Trofimov A., Proskurina O. Isomers of fullerene C60//Materials Physics and Mechanics. 2014. Vol. 20, no. 1. P. 25-32.


