Набухание ионитов в растворах сильных полиэлектролитов
Автор: Платонов Александр Петрович, Ковчур Сергей Григорьевич
Журнал: Вестник Витебского государственного технологического университета @vestnik-vstu
Рубрика: Химическая технология и экология
Статья в выпуске: 2 (17), 2009 года.
Бесплатный доступ
Изучена сорбция воды слабосшитыми ионитами из растворов полистиролсульфокислоты и хлорида поливинилбензилтриметиламмония. Из полученных данных можно определить набухание ионитов как функцию активности воды. Разработана методика исследования набухания ионитов в воде.
Исследование набухания ионов, полистиролсульфокислота, хлорид поливинилбензилтриметиламмония, вода, слабосшитые иониты, набухание ионитов, полиэлектролиты, растворы полиэлектролитов, сорбция воды, весовая сорбция
Короткий адрес: https://sciup.org/142184584
IDR: 142184584
Текст научной статьи Набухание ионитов в растворах сильных полиэлектролитов
Исследование набухания ионитов в растворах полиэлектролитов необходимо для построения зависимости сорбции воды низкосетчатыми ионитами от её активности в области, близкой к насыщению, что найдёт применение для практических расчётов в термодинамике ионообменных процессов [1]. В этой области чрезвычайно трудно получить достоверные экспериментальные данные с помощью изопиестики. Знание этой зависимости необходимо для расчёта коэффициентов активности моноионных форм ионитов. Применение полиэлектролитов для исследования сорбции воды низкосетчатыми ионитами оправдано тем, что полиэлектролиты, полиион которых заряжен одноименно с матрицей ионитов, практически ими не поглощаются [2].
В работе использовались следующие полиэлектролиты:
полистиролсульфокислота (НР) и хлорид поливинилбензилтриметиламмония (ClP).
Полистиролсульфокислота получена сульфированием полистирола с мольными массами 80000, 120000, 200000. Степень сульфирования составила 98 %. Очистка НР осуществлялась с помощью диализа через целлофановую мембрану, а также пропусканием через катионит КРС-4n в Н+–форме. При хранении вязкость раствора НР уменьшается, что обусловлено её частичной деструкцией. Вискозиметрические определения растворов полиэлектролитов не дают возможности точно определить их мольную массу, поскольку для таких растворов отсутствуют калибровочные кривые. Поэтому в качестве характеристики НР целесообразно использовать её вязкость. Вязкость стабилизированной НР не меняется со временем. Полиэлектролит ClP получен хлорметилированием полистирола монохлорметиловым эфиром и аминированием водным раствором триметиламина. Степень аминирования составила 97 %. Мольные массы полистирола: 80000, 120000, 200000. Очистка и стабилизация ClP осуществлялась так же, как и НР. Концентрирование растворов полиэлектролитов проводилось их упариванием при 50 ° С.
Методика исследования набухания ионитов в воде заключается в следующем. В мерный цилиндр, установленный строго вертикально, с ценой деления 5 - 10 -5 л, насыпается слой сухого ионита, занимающий объём V 1 , и заливается избытком дистиллированной воды. После достижения равновесия, при 25 ° С, определяется объём слоя набухшего ионита V 2 и рассчитывается коэффициент набухания:
K = V/ <1)
Весовая сорбция воды g ионитом предварительно определялась с помощью центрифугирования. Метод центрифугирования для определения набухания ионитов в растворах полиэлектролитов применить нельзя, так как растворы обладают высокой вязкостью и при центрифугировании не достигается полнота разделения фаз раствора и ионита.
Для определения величины сорбции воды из раствора полиэлектролита коэффициент набухания К определялся как описано выше. Для этого навеска сухого ионита заливается точно отмеренным объёмом раствора Vp 1 известной концентрации Сp 1 полиэлектролита. После достижения равновесия измеряется объём слоя набухшего ионита Vp 2 и определяется величина К. По графику K = f ( g ) с помощью интерполяции определялось набухание ионитов в растворе полиэлектролита, полагая, что связь между величиной весовой сорбции и коэффициентом набухания ионита в воде и в растворах полиэлектролитов идентична. Установлено, что набухание ионитов из растворов полиэлектролита относительно высоких концентраций (0,4-0,5 н.) происходит медленно. При набухании ионита в 0,05-0,08 н. растворе полиэлектролита, как и в случае набухания ионита в воде, равновесие устанавливается в течение 8-10 минут, без перемешивания ионита. В более концентрированных растворах на границе полиэлектролит-ионит образуется промежуточный слой, препятствующий проникновению воды в ионит. Например, при набухании ионита КРСх1 в 0,4 н. растворе НР даже через час не было достигнуто состояние равновесия. Поэтому для получения достоверных результатов в этих случаях необходимо перемешивание.
Между весовой сорбцией ионитов в растворах полиэлектролита и её концентрацией существует прямолинейная зависимость (рис. 1, 2).
Рисунок 1 – Зависимость весовой сорбции ионитов КРС от концентрации НР
Между весовой сорбцией ионитов в растворах полиэлектролита и его концентрацией существует прямолинейная зависимость, причём сорбция ионитов со степенью сшивки в 4 % дивинилбензола и выше в растворах полиэлектролита практически равна сорбции этих ионитов в воде. Угол наклона сильно уменьшается с ростом сетчатости ионита и при 4 % дивинилбензола зависимость набухания от концентрации практически не наблюдается. Набухание низкосетчатых ионитов сильно зависит от концентрации полиэлектролита. Это обстоятельство необходимо принимать во внимание при расчёте концентрационных констант обмена из растворов полиэлектролитов.
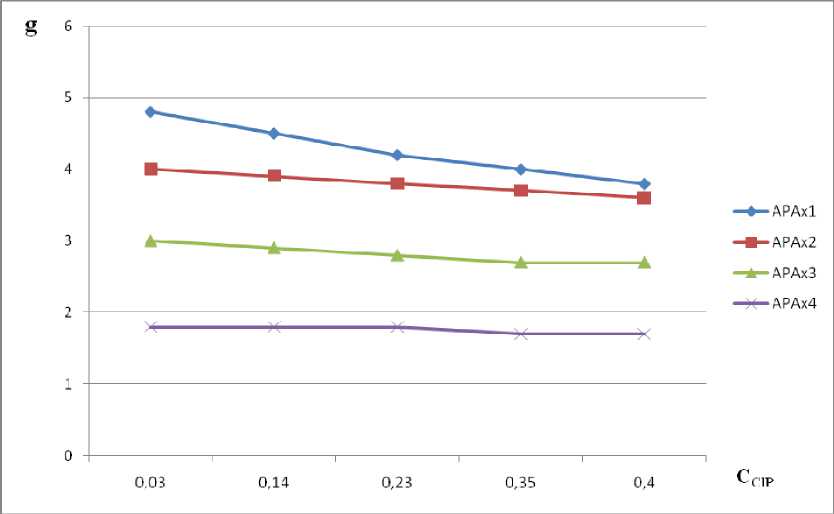
Рисунок 2 – Зависимость весовой сорбции ионитов АРА от концентрации ClP
Найдены эмпирические уравнения, связывающие величины весовой сорбции воды от концентрации полиэлектролита и сетчатости ионитов. Из рис. 1 следует, что угол наклона k зависимости набухания ионитов от концентрации НР является функцией степени сшивки, а следовательно, и сорбции воды ионитами при СНР = 0. Эта функция описывается эмпирическим уравнением k=-0,442-g 0,406.(2)
С другой стороны, зависимость g=g (CHP) выражается уравнением прямой gC = g0 + k - CHP .
После подстановки (2) в (3) получаем уравнение, описывающее зависимость сорбции воды в растворах НР для всего семейства сульфостирольных ионитов gc = g0 - 0,442 - g0,406 - Chp .(4)
Уравнение (4) описывает экспериментальные данные с погрешностью, не превышающей погрешность эксперимента.
Принято считать, что полиэлектролиты практически не поглощаются ионитами. Это полагается справедливым для сорбции полиэлектролитов, полиион которых заряжен одноимённо с матрицей ионита, что вызывает эффект доннановского исключения. Однако, есть две причины, которые могут привести к существенной сорбции полиэлектролита ионитом: низкая осмотическая активность полииона и наличие в ионите полостей макроскопических размеров, заполненных равновесным раствором. Для определения возможной сорбции полиэлектролитов ионитами проводился следующий эксперимент. Навеска ионита приводилась в контакт с раствором полиэлектролита известной концентрации и её набухание определялось, как описано выше, по увеличению объёма слоя ионита. В результате набухания ионита концентрация полиэлектролита в растворе может изменяться за счёт ухода части воды в ионит и ухода части полиэлектролита в ионит. Уравнение массообмена
V -C =V -С -vV • с
* р 1 Pip 1 у р2 P2p2 + n n n^n , где CP1 и CP2 – концентрация полиэлектролита до и после установления равновесия; VP1 – объём раствора полиэлектролита с концентрацией CP1 ; VP2 – объём слоя набухшего ионита; Cn – концентрация полиэлектролита в воде набухания ионита; Vn – объём раствора, находящийся в ионите:
Vn = g • P
v =v -V
VP2 VP1 Vn, где p – навеска сухого ионита.
Следовательно,
Достоверные данные о концентрации полиэлектролита в фазе ионита оказалось возможным получить только для слабосетчатых ионитов с 1-3 % дивинилбензола. В табл. 1 и 2 приведены концентрации полиэлектролитов в воде набухания ионитов.
Таблица 1 – Концентрация НР в воде набухания ионита моль кгводы
|
Ионит |
CP 2 = 0,055 |
CP 2 = 0,168 |
CP 2 = 0,396 |
||||||
|
C n |
A C n |
m H + |
C n |
A C n |
m H + |
C n |
A C n |
m H + |
|
|
КРСх1 |
0,014 |
0,003 |
0,381 |
0,041 |
0,008 |
0,425 |
0,043 |
0,016 |
0,724 |
|
КРСх2 |
0,013 |
0,004 |
0,587 |
0,023 |
0,008 |
0,671 |
0,034 |
0,017 |
0,886 |
|
КРСх3 |
0,010 |
0,005 |
1,093 |
0,014 |
0,009 |
1,171 |
0,020 |
0,019 |
1,577 |
При изучении зависимости концентрации полиэлектролита в ионите от активности растворителя необходимо учитывать величины сорбции полистиролсульфокислоты низкосетчатыми ионитами, поскольку они составляют 510 % от концентрации сетчатого полиэлектролита ( m H + ) .
Таблица 2 – Концентрация ClP в воде набухания ионита моль кгводы
|
Ионит |
CP 2 = 0,030 |
CP 2 = 0,138 |
CP 2 = 0,286 |
CP 2 = 0,450 |
||||||||
|
C n |
A C n |
ma |
C n |
A C n |
ma |
C n |
A C n |
ma |
C n |
A C n |
ma |
|
|
АРАх2 |
0,006 |
0,003 |
1,057 |
0,018 |
0,006 |
1,138 |
0,030 |
0,010 |
1,256 |
0,041 |
0,015 |
1,421 |
|
АРАх3 |
0,005 |
0,004 |
1,381 |
0,012 |
0,007 |
1,447 |
0,026 |
0,012 |
1,546 |
0,032 |
0,016 |
1,632 |
Из данных таблицы 2 следует, что С является поправкой к величине т.- , не n Cl превышающей 2-3 %. Следовательно, основной причиной уменьшения набухания ионитов с ростом концентрации ClP является уменьшение активности растворителя в растворе. Последняя величина может быть рассчитана из осмотического коэффициента ф растворов полиэлектролитов [3]:
lg aW =-0,00782 • ф- m,
где m – моляльность равновесного раствора полиэлектролита.
Определив величину весовой сорбции воды низкосетчатым ионитом в растворах полиэлектролита, можно построить зависимость g = f ( a W ) в области a W ^ 1 , где чрезвычайно трудно получить достоверные экспериментальные данные для слабосшитых ионитов. Знание этой зависимости необходимо для расчёта коэффициентов активности моноионных форм ионитов.
Список литературы Набухание ионитов в растворах сильных полиэлектролитов
- Солдатов, В. С. Простые ионообменные равновесия/В. С. Солдатов. -Минск: Наука и техника, 1972. -224 с.
- Полянский, Н. Г. Методы исследования ионитов/Н. Г. Полянский, Г. В. Горбунов, Н. Л. Полянская. -Москва: Химия, 1976. -208 с.
- Платонов, А. П. Исследование ионообменных процессов в растворах полиэлектролитов/А. П. Платонов, С. Г. Ковчур. -Витебск: УО «ВГТУ», 2005. -117 с.


