Накопление фотосинтетических пигментов и вторичных метаболитов в листьях галеги (Galega orientalis Lam.) сорта гале в зависимости от возраста травостоя и агротехнологии при интродукции в зоне средней тайги Западной Сибири
Автор: Моисеева Е.А., Кравченко И.В., Шепелева Л.Ф., Бордей Р.Х.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Нетрадиционные кормовые культуры
Статья в выпуске: 1 т.57, 2022 года.
Бесплатный доступ
Продуктивность растений и накопление биологически активных веществе определяются комплексом сложных взаимодействий физиолого-биохимических процессов, экологических факторов и применяемых агротехнологий. Возможности широкого использования галеги восточной во многом обусловлены ее исключительной приспособляемостью к различным условиям окружающей среды и большим потенциалом урожайности. Несмотря на достаточно длительную историю интродукции G. orientalis как кормовой культуры в разных регионах мира и в России, сведения об аккумуляции в ее зеленой массе фотосинтетических пигментов, витамина С и флавоноидов при адаптации к новым условиям произрастания немногочисленны, а для севера России полностью отсутствуют. Ранее мы впервые описали фенологические, эко-морфологические особенности и оценили фотосинтетический потенциал, продуктивность зеленой массы и семян у галеги восточной при выращивании в зоне Средней тайги Западной Сибири. В настоящей работе систематизированы полученные нами впервые данные о накоплении фотосинтетических пигментов, витамина С и флавоноидов в растениях галеги восточной в пункте интродукции. Цель исследования - охарактеризовать содержание этих соединений при адаптации к новым экологическим условиям при разных агротехнических приемах и в зависимости от возраста травостоя. Интродукционные исследования проводили в 2013-2015 годах на экспериментальном участке в поселке Барсово (Ханты-Мансийский автономный округ - Югра, Сургутский р-н, 61°15′00″ с.ш., 73°25′00″ в.д.) на сорте Гале. Растения выращивали с использованием гороха в качестве покровной культуры, в монокультуре с предпосевной обработкой семян микробиологическим препаратом Байкал-ЭМ1 (ООО НПО «ЭМ-Центр», Россия) и в монокультуре без обработки. Эффект сравниваемых агротехнических приемов (монокультура, монокультура с предпосевной обработкой семян микробиопрепаратом Байкал-ЭМ1, смешанный посев с горохом) при сравнении суммарного содержания хлорофиллов (Chl a + Chl b) в листьях проявился со 2-го года жизни растений. При обработке микробиопрепаратом в течение 2-го и 3-го года этот показатель был выше, чем в контроле (по фазам развития на 19-22 % и на 16-18 %), в смешанном посеве - снижался в конце 2-го года, но к концу 3-го года превысил контрольные значения на 33 %. В контроле содержание Chl a в листьях галеги восточной в год посева, на 2-й и 3-й годы жизни в среднем за вегетационный сезон составило 1,23±0,10; 1,29±0,12 и 1,32±0,14 мг/г сухой массы. В среднем за 2-й год при применении удобрения Байкал-ЭМ1 содержание Chl a в листьях возросло на 15 % в сравнении с контролем, при совместном посеве с горохом - оставалось в пределах контрольных значений (1,20±0,23 мг/г) (р≤£ 0,05). В среднем за 3 года при применении микробиологического препарата значение Chl a/Chl b в листьях достоверно (р≤£ 0,05) снизилось, что может указывать на повышение адаптивного потенциала растений, в бинарных посевах - осталось в пределах контрольных значений. Доля хлорофиллов (Chl a + Chl b), локализованных в светособирающих комплексах листьев, варьировала от 20 до 90 % от фенологи-ческой фазы, возраста травостоя и варианта опыта. В контроле, при инокуляии микробиопре-паратом и в смешанном посеве корреляция между Chl a/Chl b и долей хлорофиллов (Chl a + Chl b), локализованных в ССК, составила соответственно r = -0,83; r = -0,93 и r = -0,65. Сравниваемые агротехнические приемы не привели к статистически значимому изменению показателя Chl/Car у интродуцента. Тем не менее при инокуляции препаратом Байкал-ЭМ1 и в смешанном посеве с горохом накопление каротиноидов в листьях галеги восточной превышало таковое в контроле. В среднем за годы исследования по всем вариантам опыта накопление всех пигментов в листьях прямо коррелировало с ГТК. Содержание Chl b и каротиноидов оказалось слабее связано с температурным режимом региона, при этом первый показатель прямо коррелировал с количеством осадков за сезон, а для второго отмечали отрицательную корреляцию. При инокуляции препаратом Байкал-ЭМ1 содержание витамина С в листьях в 1-й и 2-й год жизни растений повышалось относительно контроля, к 3-му году - практически сравнялось с контрольными значениями, в бинарном посеве на 3-й год снижалось относительно контроля. Содержание флавоноидов в листьях при при-менении микробиопрепарата и в контроле на 3-й год (когда растения перешли к генеративному развитию) резко снизилось, тогда как в посеве с покровной культурой, где продолжалась виргинильная стадия - резкое возросло (в 1,6 раза по сравнению с предыдущими годами). В целом полученные данные свидетельствуют, что применение микробиологического препарата Байкал-ЭМ1 в большей степени способствовало адаптации растений галеги восточной 2-го и 3-го годов жизни к новым экологическим условиям.
Пигменты фотосинтеза, витамин с, флавоноиды, galega orientalis lam, галега восточная, сорт гале, интродукция, байкал-эм1
Короткий адрес: https://sciup.org/142234468
IDR: 142234468 | УДК: 633.39:581.1
Текст научной статьи Накопление фотосинтетических пигментов и вторичных метаболитов в листьях галеги (Galega orientalis Lam.) сорта гале в зависимости от возраста травостоя и агротехнологии при интродукции в зоне средней тайги Западной Сибири
В странах Европейского Союза, особенно в Центральной и Северной Европе, в течение многих лет отмечается дефицит кормового белка, что в первую очередь связывают с неблагоприятными климатическими условиями, в частности коротким периодом вегетации растений и участившимися засухами. Потенциал многолетних зернобобовых культур, значительная часть которых устойчивы к засухе, все еще не реализован, хотя урожайность белка у них часто в 2 раза выше, чем у однолетних культур (1). Этим обусловлено внимание к альтернативным многолетним бобовым культурам, способным обеспечивать более стабильные урожаи зеленой массы с высокой кормовой ценностью.
В таком качестве все активнее используется галега восточная, или козлятник восточный, ( Galega orientalis Lam . ) — многолетнее кормовой бобовое растение (сем. Fabaceae ) , которое обладает комплексом ценных свойств: зимостойкостью, засухоустойчивостью, высокой эффективностью использования весенних запасов влаги; ранним отрастанием весной и быстрым ростом, значительной облиственностью (60-70 %) и стабильностью семеноводства (урожайность семян до 6 ц/га и более); долголетием (10-15 лет и более); высокой продуктивностью (за 2 укоса можно получить зеленой массы до 60-70, сена — 10-15 т/га) и питательной ценностью (в 1 корм. ед. содержится 150-270 г переваримого протеина) (2, 3).
Возможности широкого использования галеги восточной во многом обусловлены ее биологическими особенностями, и в частности большим потенциалом урожайности и исключительной приспособляемостью к различным условиям окружающей среды (4). Естественная территория произрастания галеги восточной — Северный Кавказ и Закавказье (5). Евразийский Кавказский регион считается географическим центром происхождения этого вида (6). Однако в настоящее время он существенно расширил ареал, в том числе вследствие интродукции (5, 7). В качестве кормового растения галега восточная культивируется на Украине, в Белоруссии, Эстонии, Китае, в странах Западной Европы — Австрии, Франции, где также отмечается натурализация вида (7), в Австрии, странах Балтии, в Чехословакии, Казахстане (5), Молдове (8), Канаде (здесь продуктивность сравнивали в географических координатах 45-56° с.ш. и от 52-120° з.д.) (9), Японии (10).
В России исследования по интродукции галеги восточной выполнены во многих регионах, в частности в Центрально-Черноземной зоне (11), Поволжье (12, 13), на Среднем Урале (14), в Сибири (15, 16). На основе полученных данных разрабатываются и оптимизируются региональные технологии выращивания галеги восточной с учетом сроков и норм высева семян, эффективности покровных культур, применения микробиологических препаратов, числа укосов, влияния на почву, длительности хозяйственного использования посевов, семенной продуктивности. Авторы этих работ в основном оценивали фотосинтетический потенциал, продуктивность культуры, содержание в зеленой массе сухого вещества, белка, аминокислот в течение сезона вегетации и в зависимости от способа культивирования. Однако в зеленой массе галеги присутствуют и другие компоненты, характеризующие ее кормовые достоинства и качество, — клетчатка, пектины, хлорофиллы, вторичные метаболиты (витамин С, флавоноиды, каротиноиды), а также антипитательные вещества, например, танины (17-19), ухудшающие переваримость белка и придающие растениям горький вкус, что нежелательно в кормовых культурах. Количество и соотношение таких компонентов тоже может изменяться в онтогенезе растений и под влиянием экологических условий и технологий возделывания.
Физиологическая роль хлорофиллов, каротиноидов, витамина С и флавоноидов многообразна. Это сильные природные антиоксиданты (2022), защитные свойства которых обусловлены способностью предотвращать или замедлять окислительное повреждение клеток, вызванное физиологическими окислителями, включая активные формы кислорода, азота и свободные радикалы (23). Кроме того, каротиноиды играют важную роль в обмене веществ (витамин А — производное бета-каротина) (24). Наряду с антиоксидантным действием хорошо известна противовоспалительная, гепа-топротекторная, антибактериальная, противовирусная и противораковая активность флавоноидов (22). Хлорофиллы и каротиноиды — пигменты, участвующие в процессе фотосинтеза. Они входят в состав основных пиг-мент-белковых комплексов фотосинтетического аппарата (25). Фотосинтетический аппарат способен к перестройкам, которые в непрерывно меняющихся условиях освещения обеспечивают успешный рост и развитие растений. Ключевые компоненты фотосинтетического аппарата — пигмент-бел-ковые комплексы — характеризуются постоянством состава и структуры, а адаптивные перестройки осуществляются посредством изменения их числа и соотношения в мембранах тилакоидов (25). Аскорбиновая кислота (АК) — низкомолекулярный антиоксидант, наиболее распространенный в растениях, где он вовлечен в разнообразные метаболические процессы, в том числе в реакции, определяющие устойчивость к стрессам и адаптивный ответ на воздействия внешней среды (26). Известна роль аскорбиновой кислоты в поддержании фотосинтеза и защите фотосинтетического аппарата от активных форм кислорода и фотоингибирования (26, 27). Аскорбиновая кислота способна быть донором электронов, обеспечивающим полноценное функционирование фотосинтетической электрон-транспортной цепи (28-30). Флавоноиды — вторичные метаболиты растений, обладающие высокой биологической активностью, в частности они могут прямо или косвенно ослаблять либо предупреждать клеточные повреждения, вызываемые свободными радикалами (22, 31). Флавоноиды выполняют чрезвычайно важную функциональную роль во взаимодействиях растений и окружающей среды. Они участвуют в регуляции транспорта ауксина, создавая его градиенты. Это приводит к формированию фенотипов с различными морфо-анатомическими особенностями, что может иметь огромное значение в индуцированных стрессом морфогенных реакциях растений (22).
Несмотря на достаточно длительную историю интродукции G. orien-talis как кормовой культуры в разных регионах мира и в России, сведения об аккумуляции фотосинтетических пигментов, витамина С и флавоноидов в растениях галеги при адаптации к новым условиям произрастания немногочисленны (4, 17-19, 32, 33), а для севера России отсутствуют.
Ранее мы впервые описали фенологические, эко-морфологические особенности и оценили фотосинтетический потенциал, продуктивность зеленой массы и семян (34-36) у галеги восточной и перспективы при выращивании в зоне Средней тайги Западной Сибири (37-39). В настоящей работе систематизированы полученные нами впервые данные о накоплении 46
фотосинтетических пигментов, витамина С и флавоноидов в растениях га-леги восточной в пункте интродукции.
Цель исследования — охарактеризовать содержание хлорофиллов, каротиноидов, витамина С и флавоноидов в растениях галеги восточной ( Galega orientalis Lam.) при адаптации к новым экологическим условиям возделывания при разных агротехнических приемах (предпосевная подготовка семян, использование гороха в качестве покровной культуры) и в зависимости от возраста травостоя.
Методика . Интродукционные исследования G. orientalis проводили в 2013-2015 годах на экспериментальном участке в поселке Барсово (Ханты-Мансийский автономный округ — Югра, Сургутский р-н, 61 ° 15 ‘ 00 " с.ш., 73 ° 25 ‘ 00 " в.д.) на сорте Гале (включен в Государственный реестр селекционных достижений, допущенных к использованию, в 1988 году). Семена приобретены в 2013 году в ООО АФ «Семена Приобья» (г. Новосибирск, категория РС1 — первая репродукция).
Почва опытного участка песчаная подзолистая, окультуренная, содержание массовой доли органического вещества 5,63 %, рН сол. — 5,21, сумма поглощенных оснований — 4,7 ммоль/100 г почвы, N-NH 4 — 3,85 мг/кг почвы, N-NO 3 — 129 мг/кг почвы, P 2 O 5 — 396,1 мг/кг почвы, К 2 O — 66,5 мг/кг почвы (36). Вегетационный период 2013 года был засушливым, сумма среднесуточных температур составила 1751 ° С, количество осадков — 252,7 мм, ГТК (гидротермический коэффициент) = 1,4 (при среднемноголетнем значении ГТК = 1,7). В теплые периоды 2014 и 2015 годов суммы среднесуточных температур равнялись соответственно 1546 и 1579 ° С с избыточным накоплением влаги — соответственно 356 и 458 мм (при норме 1648,6 ° С и 287 мм), ГТК = 2,3 в 2014 году, ГТК = 2,9 в 2015 году (36). В течение вегетационных сезонов происходили резкие колебания основных метеорологических показателей, в целом неблагоприятные для роста и развития галеги восточной. Мониторинг погодных условий в пункте интродукции осуществляли на основании данных метеостанции г. Сургута.
Для оценки влияния метеорологических факторов вегетационных периодов были заложены микроделяночные полевые опыты: посев в 2013 году с учетом в 2013-2015 годах (травостой 1-3-го годов жизни); посев в 2014 году с учетом в 2014-2015 годах (травостой 1-2-го годов жизни); посев в 2015 году с учетом в 2015 году (травостой 1-го жизни). Растения выращивали в трех вариантах: в одновидовом посеве без обработки семян (контроль); в одновидовом посеве с предварительной обработкой семян микробиологическим препаратом Байкал-ЭМ1 (ООО НПО «ЭМ-Центр», г. Улан-Удэ, Россия) в соответствии с рекомендациями производителя (разведение 1:1000, замачивание на 3060 мин; препарат содержит комплекс молочнокислых, фотосинтезирующих, азотофиксирующих бактерий, сахаромицетов); в смешанном посеве с горохом как покровной культурой без предпосевной бактериальной инокуляции семян галеги. Норма высева галеги восточной 2,8 млн семян на 1 га, гороха — 1 млн семян на 1 га. Прополку сорной растительности не проводили. В конце вегетации травостой галеги восточной не скашивали. Биологическая повторность в каждом варианте 4-кратная, размещение участков рандомизированное (40), площадь каждой учетной делянки 1,5 м2, общая учетная площадь для каждого года посева 18 м2. Проводили фенологические наблюдения (41), регистрировали фазы онтогенеза, учитывали формирование морфологических структур (42-46). В каждую фенофазу развития и по завершении вегетации (41) отбирали для анализа функционально зрелые листья с 20 растений галеги восточной и формировали объединенную пробу (общее число проб — 372). Пробы высушивали до воздушно-сухого состояния и измельчали.
Для определения количества фотосинтетических пигментов — хлорофиллов а и b (Chl a, Chl b) и каротиноидов (Car) навеску массой 0,050,08 г экстрагировали 96 % этиловым спиртом с добавлением СаСО 3 и фильтровали до бесцветного состояния. Оптическую плотность экстракта определяли при λ = 665 нм (хлорофилл а), λ = 649 нм (хлорофилл b) и λ = 470 нм (каротиноиды) (СФ-56, ООО «Люмэкс», Россия) (контроль — 96 % этиловый спирт) (47). Долю хлорофиллов в светособирающих комплексах (ССК) рассчитывали, как (Chl b + 1,2 Chl b)/(Chl a + Chl b), принимая, что весь Chl b находится в ССК фотосистемы (ФС) II, а соотношение Chl a/Chl b в этом комплексе равно примерно 1,2 (48, 49). Определяли соотношения Chl a/Chl b и (Chl a + Chl b)/Сar.
Количество АК определяли по методике E.J. Hewitt и G.J. Dickes (50) в модификации Г.Н. Чупахиной (51). Навеску растительного сырья (0,3 г) заливали 5 % метафосфорной кислотой, растирали и экстрагировали в течение 10 мин при 4 ° С и 20 мин в термостате при 100 ° С. Переносили в ледяную баню и через 1 ч фотометрировали при λ = 520 нм (СФ-56, ООО «Люмэкс», Россия) (контроль — 5 % метафосфорная кислота).
Содержание флавоноидов определяли в соответствии с рекомендацией (52) в цветной реакции с хлоридом алюминия. Навеску массой 0,25 г экстрагировали 70 % этиловым спиртом в течении 30 мин с нагреванием на водяной бане. Оптическую плотность определяли при λ = 410 нм (СФ-56, ООО «Люмэкс», Россия) (в сопоставлении со стандартом — раствором рутина).
Статистическую обработку данных проводили с помощью пакета программ Microsoft Office Excel 2016 и программы Statistica 6.0 «StatSoft, Inc.», США). Вычисляли средние арифметические значения ( М) и стандартные ошибки средних (±SEM). Достоверность различий оценивали по критерию существенности различий ( t -критерию Стьюдента) при уровне значимости p = 0,05. Для оценки взаимосвязей изучаемых параметров применяли парный корреляционный анализ Пирсона.
Результаты . Продуктивность растений и накопление биологически активных веществ определяются комплексом сложных взаимодействий физиолого-биохимических процессов, экологических факторов и применяемых агротехнологий. Интродукцию растений в северных широтах ограничивают неблагоприятные почвенные и погодные условия. В Средней тайге Западной Сибири это холодный климат, резкие суточные колебания температуры, заморозки, увеличение продолжительности светового дня в первой половине вегетационного периода, короткий вегетационный период, низкое плодородие и высокая кислотность почвы. Ранее мы показали, что галега восточная сорта Гале в условиях Сургутского района Ханты-Мансийского автономного округа (61°15 ‘ 00 " с.ш., 73°25 ‘ 00 " в.д.) формировала продуктивность зеленой массы с 1 га в среднем за 3 года в контроле 243,0 ц, при применении удобрения Байкал-ЭМ1 — 280,0 ц и в смешанном посеве с горохом 66,7 ц (сбор сухого вещества — соответственно 68,8; 76,4 и 19,9 ц/га) (35).
Фотосинтетические пигменты. При выращивании галеги восточной статистически значимо (p < 0,05) эффект сравниваемых приемов в отношении суммы хлорофиллов в листьях по фазам развития растений проявился со 2-го года жизни (табл. 1). Так, при инокуляции микробиологическим препаратом на 2-й и 3-й годы жизни в фазу всходов сумма зеленых пигментов была выше соответственно на 22 и 16 %, в фазу кущения — на 26 и 19 %, ветвления стебля — на 19 и 18 %, чем в контроле. В смешанном посеве галеги с горохом у растений 2-го и 3-го годов жизни сумма хлорофиллов в листьях статистически значимо (p ≤ 0,05) увеличивалась в фазу всходов на 19,4 %, в фазу кущения на 24,0 %, в фазу ветвления стебля на 18,7 %, но в конце 2-го года жизни снижалась на 53,0 % по сравнению с контролем. На 3-й год в посеве с покровной культурой в фазы кущения и ветвления стебля суммарное содержание хлорофиллов, наоборот, сначала снижалось (на 46 и 21 %), а в конце сезона вегетации оказалось на 33 % выше, чем в контроле.
-
1. Содержание фотосинтетических пигментов (мг/г сухого вещества) в листьях галеги ( Galega orientalis Lam.) сорта Гале в зависимости от возраста травостоя и агротехнологии при интродукции (п. Барсово, Ханты-Мансийский автономный округ — Югра, Сургутский р-н)
Chl a
Chl b
Chl a + Chl b
Car
Chl a + Chl b + Car
M ±SEM 1
Cv , %
M ±SEM 1
Cv , %
M ±SEM 1 Cv , %
M ±SEM| Cv , %
M ±SEM |
Cv , %
1-
й год жизни
Монокультура, неинокулированн
ые семена (контроль)
Посев 2013 года
1
1,28±0,02
17,0
0,33±0,04
37,0
1,61±0,05
14,0
1,28±0,12
16,8
2,89±0,02
18,3
2
1,55±0,02
14,3
0,42±0,04
54,0
1,97±0,03
16,2
1,12±0,10
14,5
3,04±0,02
15,0
3
1,76±0,07
15,6
0,54±0,08
24,7
2,30±0,05
15,0
0,92±0,14
18,0
3,22±0,08
17,4
7
0,21±0,05
18,2
0,10±0,06
22,0
0,31±0,09
16,0
0,49±0,09
15,3
0,80±0,05
20,3
Посев 2014 года
1
1,30±0,03
24,1
0,18±0,12
32,4
1,48±0,04
22,3
1,18±0,10
17,4
2,66±0,09
19,4
2
1,62±0,09
19,0
0,42±0,10
50,1
2,04±0,03
18,7
1,09±0,14
19,2
3,13±0,07
17,0
3
1,88±0,02
17,3
0,46±0,05
48,0
2,34±0,10
15,6
0,83±0,10
16,4
3,17±0,05
15,8
7
0,20±0,03
15,0
0,55±0,07
32,0
0,73±0,07
27,3
0,42±0,09
15,0
1,15±0,06
16,4
Посев 2015 года
1
1,34±0,05
16,3
1,29±0,05
27,6
2,63±0,06
19,2
1,22±0,08
14,8
3,85±0,07
15,0
2
1,53±0,07
21,0
1,47±0,03
25,3
3,00±0,04
20,0
1,18±0,10
19,2
4,18±0,08
14,8
3
1,75±0,05
12,0
1,57±0,09
52,0
3,32±0,06
24,5
0,85±0,13
19,0
4,17±0,10
22,3
7
0,20±0,08
12,7
0,11±0,07
47,3
0,30±0,07
19,3
0,33±0,09
14,3
0,63±0,09
17,5
Среднее по фенофазе (2013-2015 годы)
1
1,30±0,02
12,0
0,61±0,35
54,8
1,91±0,36
33,0
1,23±0,03
18,0
3,29±0,29
15,2
2
1,53±0,06
16,0
0,77±0,35
41,0
2,34±0,33
24,6
1,13±0,03
14,0
3,47±0,36
17,8
3
1,80±0,04
14,3
0,86±0,36
39,2
2,65±0,33
21,8
0,87±0,03
15,0
3,52±0,33
16,0
7
0,20±0,03
13,7
0,25±0,15
40,0
0,86±0,15
31,0
0,41±0,05
19,0
0,86±0,15
30,8
Среднее за вегетационный сезон
(2013-2015 годы)
1,22±0,18
52,5
0,62±0,15
84,0
1,84±0,29
54,0
0,91±0,09
37,0
2,75±0,36
25,3
Монокультура, пр
едпосевная
обработка семян
микробиол
о г и ч е
с к им препаратом Байкал-ЭМ1
Посев 2013 года
1
1,37±0,07
15,4
0,21±0,03
41,3
1,58±0,10
22,1
1,20±0,02
17,3
2,78±0,07
15,3
2
1,42±0,12
14,0
0,38±0,05
52,0
1,80±,005
15,4
1,13±0,01
11,7
2,93±0,05
17,8
3
1,64±0,09
19,2
0,43±0,05
37,8
2,07±0,09
15,0
1,00±0,03
15,6
3,07±0,09
21,0
7
0,21±0,10
23,0
0,12±0,09
50,3
0,33±0,07
15,8
0,51±0,03
22,0
0,84±0,05
14,0
Посев 2014 года
1
1,37±0,05
20,2
0,48±0,12
48,6
1,85±0,08
16,7
1,17±0,03
24,2
3,02±0,12
19,1
2
1,72±0,05
17,1
0,51±0,10
470
2,23±0,10
21,0
1,08±0,05
19,4
3,31±0,10
18,0
3
2,00±0,03
18,3
0,58±0,08
34,2
2,58±0,13
19,3
0,84±0,04
17,6
3,42±0,09
23,0
7
0,16±0,10
16,0
0,07±0,03
51,0
0,23±0,15
27,4
0,42±0,02
19,0
0,65±0,07
20,0
Посев 2015 года
1
1,37±0,07
14,3
1,21±0,08
36,8
2,58±0,15
19,5
1,21±0,02
20,0
3,79±0,05
15,7
2
1,42±0,10
24,1
1,34±0,05
45,9
2,76±0,09
18,0
0,97±0,05
18,3
3,73±0,07
14,2
3
1,72±0,12
18,0
1,75±0,05
37,4
3,47±0,06
20,3
0,80±0,09
24,5
4,27±0,21
20,0
7
0,19±0,05
16,0
0,10±0,09
28,4
0,29±0,10
17,8
0,42±0,01
30,0
0,67±0,08
23,7
Среднее по фенофазе (2013-2015 годы)
1
1,37±0,09
13,2
0,63±0,29
31,0
1,99±0,30
26,1
1,19±0,01
33,0
3,20±0,30
16,5
2
1,50±0,10
12,7
0,74±0,30
25,8
2,26±0,35
24,6
1,06±0,05
24,6
3,32±0,23
12,0
3
1,79±0,11
11,3
0,92±0,42
35,0
2,71±0,41
26,2
0,88±0,06
21,8
3,59±0,36
17,2
7
0,19±0,02
15,0
0,09±0,01
43,0
0,72±0,06
14,5
0,45±0,03
21,0
0,72±0,60
14,5
Среднее за вегетационный сезон
(2013-2015 годы)
1,22±0,19
54,0
0,60±0,12
31,0
1,84±0,30
57,9
0,89±0,09
33,0
2,71±0,37
27,0
См е ш
анная культура
с горохом
Посев 2013 года
1
1,25±0,03
16,2
0,48±0,08
42,4
1,73±0,12
20,0
1,25±0,05
17,8
2,98±0,09
20,0
2
1,70±0,01
15,0
0,57±0,13
38,0
2,27±0,09
19,2
1,17±0,08
14,5
3,44±0,15
31,3
3
1,70±0,05
17,3
0,64±0,19
27,4
1,77±0,08
15,6
0,98±0,08
16,0
2,75±0,10
27,8
7
0,71±0,03
14,5
0,36±0,05
30,0
1,07±0,12
17,3
0,61±0,07
21,8
1,68±0,08
21,0
Посев 2014 года
1
1,25±0,04
23,0
0,53±0,07 49,0 1,78±0,10 18,0 1,22±0,05
13,0
3,0±0,16
15,3
2
1,53±0,09
20,0
0,18±0,05 41,3 1,71±0,09 21,3 0,93±0,04
15,0
2,64±0,21
18,9
3
1,92±0,12
16,7
0,34±0,07 36,5 2,26±0,19 18,3 0,83±,09
18,4
3,09±0,09
20,0
7
0,21±0,06
15,0
0,14±,12 31,3 0,35±0,23 20,0 0,36±,03
Посев 2015 года
20,0
0,71±0,10
16,8
1
1,28±0,14
22,0
1,32±0,06 28,4 2,60±0,07 14,6 1,24±0,13
18,7
3,84±0,07
22,0
2
1,64±0,09
14,8
1,64±0,05 28,0 3,28±0,09 18,0 1,17±0,05
14,8
4,45±0,06
19,3
3
1,83±0,15
18,2
1,98±0,09 37,6 3,81±0,10 17,5 0,97±0,05
15,2
4,78±0,03
24,8
7
0,21±0,08*
19,0
0,14±,10 37,0 0,35±0,16 20,1 0,28±0,09
Среднее по фенофазе (2013-2015 годы)
16,0
0,63±,05
16,0
1
1,26±0,01
14,0
0,78±0,27 28,4 2,04±0,28 23,9 1,24±0,01
12,0
3,27±0,28
14,9
2
1,62±0,05
15,7
0,80±0,43 42,0 2,42±0,46 32,8 1,09±0,08
13,0
3,51±0,53
25,8
3
1,82±0,06
16,3
0,99±0,50 37,6 2,61±0,61 40,8 0,93±0,05
19,0
3,54±0,63
30,7
7
0,38±0,17
16,0
0,21±0,07 26,0 1,00±0,34 58,1 0,42±0,1
Среднее за вегетационный сезон (2013-2015 годы)
41,0
1,01±0,34
38,0
1,27±0,17 46,7 0,69±0,18 39,0 1,92±0,3 54,3 0,92±0,09 37,0 2,83±0,38
2-й год жизни
Монокультура, неинокулированные семена (контроль) Посев 2013 года
46,0
1
1,32±0,06
14,0
0,27±0,04 17,0 1,59±0,16 18,0 1,12±0,18
12,5
2,71±0,05
20,0
2
1,43±0,06
16,3
0,31±0,09 21,0 1,74±0,22 16,3 1,10±0,05
14,8
1,93±0,03
23,7
3
1,57±0,03
15,2
0,35±0,12 14,5 1,92±0,19 14,7 0,83±0,05
25,0
2,75±0,07
28,1
7
0,62±0,08
14,8
0,34±0,09 16,0 0,96±0,07 16,0 0,66±0,09
Посев 2014 года
19,1
1,62±0,07
28,0
1
1,42±0,04
24,0
0,30±0,07 22,0 1,72±0,07 25,7 0,19±0,07
10,0
1,91±0,05
14,6
2
1,52±0,05
16,3
0,34±0,05 16,3 1,86±0,10 22,1 0,79±0,12
24,6
2,65±0,09
23,0
3
1,74±0,07
14,0
0,34±0,05 20,0 1,92±0,11 20,8 0,68±0,15
27,5
2,60±0,08
18,4
7
0,25±0,01
16,0
0,15±0,08 19,7 0,40±0,08 23,5 0,30±0,10
Среднее по фенофазе (2014-2015 годы)
13,0
0,70±0,05
29,0
1
1,37±0,04
15,0
0,29±0,02 10,0 2,25±0,19 21,3 0,94±0,27
18,0
2,31±0,40
24,5
2
1,48±0,03
14,0
0,33±0,11 17,0 2,30±0,16 17,2 0,64±0,07
15,0
2,29±0,36
22,0
3
1,64±0,05
16,0
0,36±0,01 15,6 2,69±0,05 14,2 0,75±0,06
16,0
2,68±0,08
13,9
7
0,42±0,11
13,0
0,27±0,05 30,0 1,17±0,21 43,0 0,49±0,07
Среднее за вегетационный сезон (2014-2015 годы)
30,0
1,16±0,46
56,0
1,23±0,18
42,0 0,30±0,02 23,0 1,50±0,19 36,2 0,71±0,12 47,0
Монокультура, предпосевная обработка семян микробиологическим препаратом Байкал-ЭМ1
Посев 2013 года
2,10±0,25
34,0
1
1,40±0,12
17,3
0,43±0,02 24,0 1,83±0,07 14,0 1,00±0,05
20,0
2,83±0,03
12,3
2
1,63±0,10
19,2
0,47±0,03 22,0 2,10±0,07 16,0 0,87±0,08
17,8
2,97±0,03
17,8
3
1,90±0,10
23,4
0,52±0,05 18,4 2,42±0,09 16,3 0,82±0,13
14,5
3,24±0,09
16,0
7
0,57±0,09
14,5
0,29±0,08 15,3 0,86±0,12 22,0 0,73±0,10
Посев 2014 года
18,0
1,59±0,05
19,0
1
1,38±0,50
18,0
0,43±0,02 17,0 1,84±0,05 15,4 1,14±0,09
16,4
2,95±0,03
25,4
2
1,85±0,13
12,8
0,48±0,07 21,0 2,33±0,07 14,0 0,97±0,14
22,0
3,30±0,02
15,6
3
2,30±0,08
14,0
0,52±0,05 23,2 2,82±0,05 27,0 0,72±0,10
13,8
3,54±0,07
16,0
7
0,48±0,02
16,3
0,29±0,03 15,7 0,77±,010 18,4 0,50±0,08
Среднее по фенофазе (2014-2015 годы)
14,0
1,27±0,05
20,0
1
1,39±0,02
19,0
0,43±0,01 18,3 2,89±0,03* 17,0 1,04±0,05
11,0
2,89±0,06
12,8
2
1,80±0,07*
18,0
0,48±0,01 16,1 3,10±0,08* 16,2 0,92±0,02
14,0
3,14±0,17
17,4
3
2,14±0,12*
12,0
0,53±0,02 17,4 3,12±0,07* 14,9 0,80±0,05
13,0
3,29±0,15
16,2
7
0,53±0,02
18,0
0,29±0,01 20,3 1,42±0,08* 12,6 0,66±0,06
Среднее за вегетационный сезон (2014-2015 годы)
19,0
1,43±0,16
15,8
1,44±0,23*
44,3
0,43±0,03 22,0 1,90±0,26 38,9 0,84±0,07
Смешанная культура с горохом Посев 2013 года
24,0
2,71±0,29
34,0
1
1,27±0,05
15,0
0,32±0,10 17,0 1,59±0,05 16,8 1,20±0,12
19,2
2,79±0,02
11,0
2
1,78±0,07
17,0
0,10±0,05 16,2 1,88±0,07 17,2 1,15±0,08
20,0
3,03±0,02
16,0
3
1,53±0,05
14,5
0,08±0,03 15,4 1,61±0,03 21,3 0,81±0,06
27,3
2,42±0,02
13,7
7
0,19±0,03
12,3
0,09±0,03 14,5 0,28±0,03 17,0 0,35±0,04
Посев 2014 года
15,0
0,63±0,05
14,2
1
1,33±0,04
14,0
0,62±0,08 14,0 1,95±0,03 14,3 0,93±0,05
19,0
2,88±0,08
19,2
2
1,78±0,05
13,5
1,28±0,12 17,3 2,76±0,07 15,0 0,76±0,05
18,2
3,52±0,07
18,0
3
1,53±0,08
15,0
1,35±0,07 15,2 3,08±0,05 19,0 0,52±0,08
16,3
3,60±0,05
20,0
7
0,19±0,12
15,7
0,11±0,05 20,3 0,28±0,04 16,4 0,18±0,06
Среднее по фенофазе (2014-2015 годы)
14,0
0,46±0,03
13,7
1
1,30±0,03
14,0
0,51±0,07* 19,0 2,79±0,05* 18,2 1,10±0,08
14,0
2,84±0,06
12,4
2
1,78±0,01*
19,0
0,77±0,30* 16,8 3,04±0,12* 15,2 0,96±0,09
20,0
3,28±0,25
10,6
3
1,51±0,01
14,0
0,93±0,29* 15,0 3,31±0,26* 20,8 0,70±0,07
19,0
3,01±0,59
27,7
7
0,19±0,01*
19,0
0,11±0,01* 12,0 0,55±0,05* 19,5 0,28±0,04
Среднее за вегетационный сезон (2014-2015 годы)
26,0
0,55±0,09
22,0
1,20±0,23
52,0
0,53±0,18* 44,0 1,70±0,36 60,3 0,74±0,13
50,0
2,41±0,43
50,1
3-й год жизни
|
Монокультура, неино ку л иро в анн ы е семена (контроль) Посев 2013 года |
||||||
|
1 |
1,40±0,04 |
18,2 |
0,40±0,05 17,3 1,78±0,08 15,8 1,40±0,05 |
17,3 |
2,93±0,07 |
25,0 |
|
2 |
1,60±0,05 |
17,4 |
0,43±0,08 15,0 1,99±0,12 18,1 0,83±0,08 |
15,6 |
2,92±0,04 |
30,0 |
|
3 |
1,70±0,03 |
15,3 |
0,45±0,08 18,0 2,13±0,09 12,9 0,93±0,06 |
20,0 |
2,99±0,07 |
24,8 |
|
4 |
2,50±0,08 |
12,8 |
0,32±0,03 22,0 2,82±0,17 12,3 1,35±0,10 |
14,3 |
4,17±0,03 |
29,0 |
|
5 |
1,90±0,05 |
14,3 |
0,23±0,09 27,0 2,10±0,10 14,3 0,92±0,12 |
12,8 |
3,02±0,05 |
25,0 |
|
6 |
0,52±0,07 |
19,0 |
0,16±0,05 19,8 0,68±0,09 15,4 0,73±0,08 |
14,0 |
1,41±0,02 |
30,4 |
|
7 |
0,50±0,12 |
19,2 |
0,27±0,07 23,0 0,73±0,14 18,2 0,63±0,08 Среднее за вегетационный сезон (2015 год) |
16,0 |
1,36±0,07 |
27,8 |
|
1,45±0,27 |
50,0 0,32±0,04 34,0 1,75±0,29 44,6 0,94±0,09 26,0 Монокультура, предпосевная обработка семян микробиологическим препаратом Байкал-ЭМ1 Посев 2013 года |
2,68±0,38 |
37,0 |
|||
|
1 |
1,43±0,04 |
16,0 |
0,69±0,03 14,5 2,13±0,08* 19,8 1,56±0,07 |
16,0 |
3,68±0,07 |
29,0 |
|
2 |
1,57±0,07 |
15,4 |
0,72±0,05 16,1 2,45±0,03* 12,9 1,10±0,05 |
22,3 |
3,39±0,09 |
24,5 |
|
3 |
1,91±0,05 |
20,0 |
0,75±0,04 17,0 2,63±0,02* 12,4 1,25±0,09 |
17,4 |
3,91±0,05 |
28,3 |
|
4 |
2,30±0,03 |
17,2 |
0,48±0,10 17,3 2,74±0,03* 12,9 1,42±0,07 |
16,5 |
4,20±0,06 |
27,1 |
|
5 |
1,42±0,05* |
14,9 |
0,35±0,04 14,6 1,69±0,10* 18,7 0,83±0,05 |
14,3 |
2,60±0,08 |
30,0 |
|
6 |
0,70±0,02* |
16,1 |
0,27±0,08 18,2 0,92±0,01* 13,0 0,74±0,08 |
16,0 |
1,67±0,09 |
32,1 |
|
7 |
0,60±0,05 |
17,0 |
0,55±0,04 18,0 0,74±0,03* 18,4 0,54±0,10 Среднее за вегетационный сезон (2015 год) |
18,2 |
1,32±0,05 |
18,6 |
|
1,42±0,23 |
43,0 |
0,54±0,07* 35,0 1,90±0,30 41,6 1,06±0,14 Смешанная культура с горохом Посев 2013 года |
35,0 |
2,97±0,43 |
38,0 |
|
|
1 |
1,40±0,07 |
20,0 |
0,55±0,05 18,0 1,92±0,02 12,8 1,35±0,09 |
15,7 |
3,29±0,09 |
19,0 |
|
2 |
0,80±0,10* |
14,7 |
0,34±0,05 16,1 1,07±0,02* 13,9 0,56±0,05 |
16,8 |
1,65±0,10 |
25,7 |
|
3 |
0,50±0,08* |
16,2 |
0,18±0,08* 15,8 0,63±0,03* 12,9 0,81±0,13 |
18,0 |
1,48±0,09 |
29,0 |
|
7 |
0,42±0,04 |
16,0 |
0,35±0,09 16,0 1,05±0,02* 13,5 0,86±0,10 Среднее за вегетационный сезон (2015 год) |
17,2 |
1,93±0,15 |
32,4 |
|
0,86±0,19* |
45,0 |
0,36±0,06 43,0 1,20±0,27 44,8 0,89±0,16 В среднем за годы исследования Монокультура, неинокулированные семена (контроль) |
37,0 |
2,09±0,24 |
39,0 |
|
|
1,28±0,12 47,9 045±0,07 36,5 1,78±0,16 47,2 0,86±0,06 37,0 2,54±0,2 Монокультура, предпосевная обработка семян микробиологическим препаратом Байкал-ЭМ1 |
41,2 |
|||||
|
1,33±0,12 |
46,5 |
0,53±0,07 32,0 1,9±0,29 46,9 0,92±0,06 Смешанная культура с горохом |
32,0 |
2,78±0,2 |
38,9 |
|
|
1,18±0,12 |
49,0 |
0,58±0,10 45,0 1,72±0,19 56,6 0,84±0,07 В среднем за 1-й год жизни |
40,0 |
2,57±0,25 |
46,6 |
|
|
1,23±0,10 |
49,5 |
0,64±0,09 52,3 1,88±0,18 55,9 0,91±0,05 В среднем за 2-й год жизни |
35,0 |
2,76±0,21 |
44,6 |
|
|
1,29±0,12 |
45,5 |
0,42±0,07** 48,0 1,68±0,15 44,7 0,76±0,06 В среднем за 3-й год жизни |
39,0 |
2,41±0,19 |
38,9 |
|
|
1,32±0,14 |
48,4 |
0,40±0,04 43,0 1,69±0,17 43,0 0,98±0,07 |
32,0 |
2,66±0,19 |
38,2 |
|
|
Примечание. |
ФР — |
фаза развития растений; 1 — всходы (2-й и 3-й годы — |
отрастание), 2 — кущение, |
|||
3 — ветвление стебля, 4 — бутонизация, 5 — цветение, 6 — плодоношение, 7 — окончание вегетации; Chl a,
Chl b, Car — хлорофиллы и каротиноиды.
* Различия с контролем статистически значимы при р ≤ 0,05.
** Различия с показателем в предшествующем году статистически значимы при р ≤ 0,05.
Количественные и качественные изменения пигментного комплекса отражают состояние фотосинтетического аппарата растений и их физиологический статус в целом (53, 54). При количественных изменениях в пигментном аппарате листьев растений (содержание Сhl a, Сhl b, Chl a + Chl b, соотношение Сhl a/Chl b, содержание каротинодов и соотношение Chl/Car) в ответ на условия внешней среды основным фактором выступает свет, но определенное влияние оказывают и другие условия — температура и влажность (55). При адаптации к новым экологическим условиям количественные изменения могут затрагивать пигментный комплекс (56) и ССК (57). Если собираемый растением световой поток не ограничивает фотосинтез, количество ССК уменьшается, а соотношение Сhl a/Chl b увеличивается (57). В высоких широтах в спектре рассеянной радиации возрастает процентное содержание сине-фиолетовых лучей, поглощаемых каротиноидами, и в профиле фотосинтетических пигментов наблюдается увеличение доли каротиноидов. Это указывает на повышение их защитной роли с продвижением на север (53).
Содержание Chl a . В нашем опыте содержание Chl а (см. табл. 1) в листьях галеги восточной в год посева, на 2-й и 3-й годы жизни составило в среднем 1,23±0,10; 1,29±0,12 и 1,32±0,14 мг/г сухой массы (контрольные значения). При применение микробиологического удобрения этот показатель на 2-й год жизни достоверно (р ≤ 0,05) повышался относительно контроля (на 18 % в фазу кущения и на 24 % в фазу ветвления стебля). В бинарном посеве на 2-й год жизни максимальное содержание Chl a отмечали в фазу кущения (1,78±0,01 мг/г) с достоверным (р ≤ 0,05) превышением контрольного значения на 17 % и последующим снижением до 1,51 мг/г в фазу ветвления стебля и до 0,19 мг/г — к концу вегетации. В среднем за 2-й год при применении удобрения Байкал-ЭМ1 содержание Chl a в листьях (р < 0,05) возросло на 15 % в сравнении с контролем, при совместном посеве с горохом — оставалось в пределах контрольных значений (1,20±0,23 мг/г).
На 3-й год вегетации отмечали постепенное увеличение содержание Chl a в листьях в первых двух вариантах опыта (контроль и инокуляция), начиная с фазы отрастания до бутонизации (с 1,40 до 2,50 мг/г сухого вещества). В конце вегетации содержание Chl a снижалось до 0,50-0,60 мг/г сухого вещества. При инокуляции содержание Chl a было достоверно ниже, чем в контроле (на 25 %) в период цветения, и выше контрольного (на 26 %) — в фазу плодоношения. В смешанном посеве максимальное содержание Chl a в листьях отмечали в период отрастания и в конце вегетации.
Соотношение Chl a / Chl b . Соотношение Chl a/Chl b (табл. 2) в листьях галеги восточной колебалось от 2,78 до 4,41 в зависимости от возраста растений. Анализируемый показатель на 2-й год жизни достоверно возрастал на 37 % относительно такового у растений 1-го года жизни, по достижении растениями генеративного возраста (на 3-й год жизни) — достоверно снижался до 3,44.
2. Соотношение фотосинтетических пигментов и доля хлорофиллов в светособирающих комплексах в листьях галеги ( Galega orientalis Lam.) сорта Гале в зависимости от возраста травостоя и агротехнологии при интродукции (п. Барсово, Ханты-Мансийский автономный округ — Югра, Сургутский р-н)
|
ФР |
Chl a/Chl b |
(Chl a + Chl b)/Car |
Доля Chl a + Chl b в |
ССК, % |
||
|
M ±SEM |
1 Cv , % |
M ±SEM I Cv , % |
M ±SEM 1 |
Cv , % |
||
|
1-й год жизн |
и |
|||||
|
Моно ку л |
ь тура, неинокулированн |
ые семена (контроль) |
||||
|
Посев 2013 года |
||||||
|
1 |
3,88±0,02 |
17,0 |
1,28±0,07 |
22,4 |
52,0±4,12 |
45,0 |
|
2 |
3,69±0,02 |
12,8 |
1,78±0,05 |
18,3 |
57,3±5,00 |
37,4 |
|
3 |
3,26±0,05 |
19,4 |
2,50±0,05 |
18,0 |
60,2±6,18 |
40,3 |
|
7 |
2,10±0,03 |
21,0 |
0,63±0,02 |
17,4 |
71,7±3,48 |
42,0 |
|
Посев 2014 года |
||||||
|
1 |
7,22±0,08 |
12,6 |
1,25±0,03 |
14,0 |
27,8±6,52 |
58,2 |
|
2 |
3,86±0,03 |
14,0 |
1,87±0,10 |
19,0 |
60,0±5,30 |
32,4 |
|
3 |
4,09±0,03 |
13,0 |
2,82±0,04 |
18,2 |
53,6±5,00 |
29,5 |
|
7 |
2,00±0,06 |
12,7 |
0,71±0,02 |
22,0 |
96,4±7,24 |
40,3 |
|
Посев 2015 года |
||||||
|
1 |
1,04±0,07 |
15,0 |
2,16±0,06 |
19,3 |
75,3±6,32 |
48,2 |
|
2 |
1,04±0,03 |
13,4 |
2,54±0,04 |
13,4 |
60,0±8,00 |
36,0 |
|
3 |
1,11±0,04 |
19,5 |
3,91±0,07 |
12,4 |
70,2±5,41 |
34,3 |
|
7 |
1,82±0,02 |
20,0 |
0,94±0,12 |
13,7 |
81,3±3,87 |
52,0 |
|
Средн |
ее по фенофазе (2013 |
2015 год |
ы) |
|||
|
1 |
4,05±1,79 |
12,7 |
1,56±0,29 |
33,0 |
50,2±6,00 |
47,2 |
|
2 |
2,86±0,91 |
19,0 |
2,06±0,24 |
20,0 |
60,7±5,09 |
32,4 |
|
3 |
2,82±0,89 |
19,3 |
3,08±0,43 |
24,0 |
60,3±4,70 |
36,0 |
|
7 |
1,97±0,08 |
18,0 |
0,76±0,09 |
21,0 |
70,2±7,12 |
38,1 |
|
Среднее за вегетационный сезон |
(2013-2015 годы) |
|||||
|
2,96±0,52 |
61,0 |
1,87±0,28 |
51,0 |
74,8±11,6 |
28,7 |
|
Продолжение таблицы 2
Монокультура, предпосевная обработка семян микробиологическим препаратом Байкал-ЭМ1
Посев 2013 года
|
1 |
6,52±0,04 |
21,0 |
1,32±0,09 |
14,0 |
29,4±7,10 |
40,0 |
|
2 |
3,74±0,07 |
11,4 |
1,59±0,08 |
19,3 |
48,3±5,00 |
48,0 |
|
3 |
3,85±0,08 |
18,3 |
2,07±0,06 |
22,4 |
50,4±6,41 |
35,7 |
|
7 |
1,75±0,03 |
22,0 |
0,65±0,04 |
20,0 |
80,1±7,00 |
29,3 |
|
Посев 2014 года |
||||||
|
1 |
2,85±0,21 |
14,7 |
1,58±0,12 |
24,1 |
57,2±6,42 |
50,0 |
|
2 |
3,37±0,19 |
21,2 |
2,06±0,15 |
20,6 |
60,0±6,00 |
34,1 |
|
3 |
3,45±0,24 |
24,0 |
3,07±0,22 |
15,7 |
62,7±8,34 |
29,0 |
|
7 |
2,28±0,18 |
19,3 |
0,55±0,09 |
17,0 |
67,0±5,42 |
35,7 |
|
Посев 2015 года |
||||||
|
1 |
1,13±0,14 |
20,5 |
2,13±0,04 |
14,3 |
62,0±6,70 |
32,4 |
|
2 |
1,06±0,22 |
15,7 |
2,84±0,07 |
12,8 |
70,0±9,10 |
35,0 |
|
3 |
0,98±0,15 |
11,8 |
4,34±0,09 |
18,0 |
69,7±4,35 |
31,0 |
|
7 |
1,97±0,20 |
28,0 |
0,76±0,13 |
21,4 |
76,0±7,12 |
28,7 |
|
Среднее по фенофазе (2013-2015 годы) |
||||||
|
1 |
3,50±1,59 |
49,0 |
1,68±0,29 |
25,0 |
50,3±5,43 |
36,4 |
|
2 |
2,72±0,84 |
53,0 |
2,16±0,36 |
29,0 |
60,8±9,12 |
30,5 |
|
3 |
2,76±0,89 |
56,2 |
3,16±0,66 |
36,0 |
60,0±8,00 |
29,0 |
|
7 |
2,03±0,18 |
16,7 |
0,65±0,06 |
16,0 |
70,4±5,21 |
32,7 |
|
Среднее за вегетационный сезон |
(2013-2015 годы) |
|||||
|
2,76±0,46 |
57,0 |
1,91±0,32 |
58,0 |
68,4±7,83 |
24,6 |
|
|
Смешан |
ная ку льтур а |
с горохом |
||||
|
Посев 2013 года |
||||||
|
1 |
2,60±0,18 |
14,3 |
1,38±0,09 |
14,1 |
61,0±8,00 |
21,5 |
|
2 |
2,98±0,24 |
18,2 |
1,94±0,09 |
10,8 |
75,4±4,68 |
29,4 |
|
3 |
1,77±0,21 |
12,4 |
1,81±0,05 |
14,0 |
80,0±7,39 |
32,3 |
|
7 |
1,97±0,17 |
19,0 |
1,75±0,14 |
12,3 |
74,4±8,22 |
24,5 |
|
Посев 2014 года |
||||||
|
1 |
2,36±0,08 |
19,4 |
1,46±0,08 |
14,5 |
66,3±6,00 |
21,3 |
|
2 |
8,50±0,08 |
15,6 |
1,84±0,15 |
16,0 |
63,0±8,00 |
27,8 |
|
3 |
5,65±0,12 |
23,0 |
2,73±0,18 |
13,5 |
55,0±7,84 |
30,0 |
|
7 |
1,50±0,15 |
21,0 |
0,97±0,12 |
20,0 |
88,0±9,37 |
29,5 |
|
Посев 2015 года |
||||||
|
1 |
0,97±0,09 |
16,4 |
2,10±0,24 |
22,1 |
45,2±5,46 |
19,7 |
|
2 |
1,00±0,12 |
17,3 |
2,80±0,09 |
18,4 |
70,4±7,00 |
32,4 |
|
3 |
0,92±0,12 |
15,2 |
3,93±0,02 |
15,3 |
73,2±6,21 |
25,3 |
|
7 |
1,50±0,14 |
16,3 |
1,25±0,28 |
27,0 |
88,8±4,78 |
29,2 |
|
Среднее по фенофазе (2013-2015 годы) |
||||||
|
1 |
1,98±0,51 |
45,2 |
1,65±0,23 |
24,0 |
60,2±3,42 |
30,0 |
|
2 |
4,16±2,24 |
52,0 |
2,19±0,34 |
21,0 |
70,6±7,55 |
24,8 |
|
3 |
2,78±1,46 |
34,0 |
2,82±0,61 |
38,0 |
70,7±5,00 |
26,0 |
|
7 |
1,66±0,16 |
16,4 |
1,32±0,23* |
30,0 |
80,50±,31 |
21,3 |
|
Среднее за вегетационный сезон |
(2013-2015 годы) |
|||||
|
2,64±0,65 |
48,2 |
2,00±0,24 |
41,2 |
75,30±8,5 |
28,7 |
|
|
2-й год жизни |
||||||
|
Монокультура, неинокулированн |
ые семени |
: (контроль) |
||||
|
Посев 2013 года |
||||||
|
1 |
4,8±0,07 |
18,8 |
1,42±0,04 |
21,0 |
37,1±4,45 |
32,0 |
|
2 |
4,6±0,06 |
12,6 |
1,58±0,04 |
14,5 |
39,6±7,00 |
30,0 |
|
3 |
4,5±0,12 |
14,0 |
2,31±0,08 |
20,0 |
40,8±5,60 |
24,8 |
|
7 |
1,8±0,09 |
12,3 |
1,45±0,05 |
15,8 |
78,2±4,89 |
26,2 |
|
Посев 2014 года |
||||||
|
1 |
4,7±0,03 |
12,0 |
1,05±0,13 |
17,3 |
66,4±8,00 |
27,3 |
|
2 |
4,4±0,05 |
18,8 |
2,35±0,09 |
22,3 |
75,8±9,17 |
32,0 |
|
3 |
4,7±0,03 |
16,7 |
3,1±0,10 |
18,3 |
74,6±5,00 |
19,8 |
|
7 |
1,7±0,08 |
19,3 |
1,33±0,18 |
15,6 |
33,2±4,04 |
25,3 |
|
Среднее по фенофазе (2014-2015 годы) |
||||||
|
1 |
4,73±0,09 |
13,0 |
1,29±0,08 |
13,0 |
50,1±8,15 |
27,0 |
|
2 |
4,5±0,1 |
13,0 |
1,93±0,22 |
23,0 |
50,6±9,03 |
25,0 |
|
3 |
4,6±0,1 |
13,0 |
2,74±0,19 |
14,0 |
60,4±7,14 |
30,0 |
|
7 |
1,75±0,05 |
14,0 |
1,4±0,03 |
14,0 |
70,5±5,08 |
28,3 |
|
Среднее за вегетационный сезон |
(2014-2015 годы) |
|||||
|
3,9±0,47 |
34,0 |
1,82±0,07 |
38,0 |
56,1±7,3 |
30,0 |
|
|
Монокультура, |
предпосевная |
обработк |
а семян |
|||
|
м и |
кробиологическим препаратом Байкал-ЭМ1 |
|||||
|
Посев 2013 года |
||||||
|
1 |
3,26±0,09 |
14,4 |
1,83±0,07 |
19,3 |
52,2±6,31 |
29,0 |
|
2 |
3,16±0,08 |
18,0 |
2,44±0,12 |
13,7 |
49,3±8,00 |
27,6 |
|
3 |
3,65±0,10 |
22,3 |
2,95±0,08 |
22,0 |
47,4±5,78 |
28,4 |
|
7 |
1,97±0,12 |
15,7 |
1,18±0,15 |
18,0 |
74,6±9,10 |
39,5 |
Посев 2014 года
|
1 |
3,21±0,07 |
17,0 |
1,59±0,07 |
16,4 |
52,7±10,2 |
32,4 |
|
2 |
3,85±0,07 |
14,6 |
2,40±0,06 |
21,0 |
45,9±7,06 |
24,3 |
|
3 |
4,42±004 |
18,0 |
3,92±0,08 |
14,7 |
41,4±5,00 |
28,5 |
|
7 |
1,66±0,03 |
15,4 |
1,54±0,04 |
17,0 |
83,0±6,33 |
34,2 |
|
Среднее по фенофазе (2014-2015 годы) |
||||||
|
1 |
3,25±0,03 |
15,0 |
1,68±0,08* |
19,0 |
50,0±4,89 |
24,6 |
|
2 |
3,66±0,19 |
17,0 |
2,42±0,02* |
16,0 |
60,5±8,00 |
28,0 |
|
3 |
4,04±0,38 |
14,0 |
3,44±0,29* |
17,0 |
70,6±5,30 |
38,4 |
|
7 |
1,82±0,16 |
12,0 |
1,37±0,12 |
17,0 |
80,40±4,01 |
36,2 |
|
Среднее за вегетационный сезон |
(2014-2015 годы) |
|||||
|
3,18±0,33 |
25,0 |
2,23±0,32 |
40,0 |
55,40±5,27 |
42,0 |
|
|
Смеш |
анная культура |
с горохом |
||||
|
Посев 2013 года |
||||||
|
1 |
3,97±0,08 |
19,3 |
1,33±0,12 |
18,2 |
44,50±6,00 |
30,0 |
|
2 |
17,80±0,10 |
12,4 |
1,63±0,21 |
15,7 |
37,30±7,42 |
32,7 |
|
3 |
19,13±0,07 |
18,5 |
1,99±0,09 |
18,0 |
11,80±5,65 |
30,0 |
|
7 |
2,10±0,05 |
14,0 |
0,80±0,25 |
22,0 |
71,30±4,85 |
28,4 |
|
Посев 2014 года |
||||||
|
1 |
2,15±0,08 |
18,3 |
2,10±0,30 |
19,3 |
70,60±9,36 |
25,6 |
|
2 |
1,16±0,09 |
20,0 |
3,63±0,15 |
14,8 |
56,20±8,00 |
32,4 |
|
3 |
1,28±0,08 |
22,0 |
5,92±0,24 |
41,0 |
96,10±7,15 |
30,1 |
|
7 |
1,55±0,05 |
30,4 |
1,56±0,17 |
21,0 |
89,00±5,10 |
36,3 |
|
Среднее по фенофазе (2014-2015 годы) |
||||||
|
1 |
3,05±0,48 |
32,0 |
1,74±0,19* |
24,0 |
40,70±8,04 |
28,7 |
|
2 |
9,48±0,60 |
28,7 |
2,59±0,56* |
37,0 |
50,20±11,02 |
38,0 |
|
3 |
10,21±0,54* |
25,6 |
3,65±1,03* |
40,0 |
40,40±7,30 |
29,0 |
|
7 |
1,83±0,28 |
22,0 |
1,18±0,24* |
66,0 |
60,30±5,80 |
35,4 |
|
Среднее за вегетационный сезон |
(2014-2015 годы) |
|||||
|
6,14±2,71* |
45,0 |
2,73±0,58* |
22,7 |
61,88±12,70 |
27,4 |
|
|
3-й год жизни |
||||||
|
Моно ку Л |
ь тура, неинокулированн |
ые семена (контроль) |
||||
|
Посев 2013 года |
||||||
|
1 |
3,50±0,03 |
17,4 |
1,59±0,04 |
22,0 |
50,20±8,34 |
35,1 |
|
2 |
3,72±0,05 |
17,4 |
2,18±0,09 |
19,3 |
50,40±6,00 |
28,4 |
|
3 |
3,78±0,03 |
21,0 |
2,50±0,03 |
19,8 |
50,30±4,78 |
26,3 |
|
4 |
7,82±0,18 |
15,2 |
2,09±0,04 |
18,3 |
30,40±9,01 |
38,4 |
|
5 |
8,26±0,09 |
14,5 |
2,32±0,04 |
14,0 |
20,40±5,06 |
40,2 |
|
6 |
2,60±0,12 |
18,0 |
0,98±0,05 |
15,6 |
50,00±7,12 |
21,8 |
|
7 |
2,50±0,09 |
13,3 |
1,11±0,04 |
18,4 |
60,20±5,00 |
33,5 |
|
Среднее за вегетационный сезон (2015 год) |
||||||
|
4,60±0,91 |
52,0 |
1,83±0,23 |
19,0 |
44,30±5,28 |
22,0 |
|
|
Монокультура, предпосевная |
обработка семян |
|||||
|
микробиологическим препаратом Байкал-ЭМ1 |
||||||
|
Посев 2013 года |
||||||
|
1 |
2,07±0,06* |
15,0 |
1,36±0,09 |
23,2 |
70,04±8,36 |
27,8 |
|
2 |
2,18±0,07* |
25,0 |
2,08±0,09 |
25,0 |
70,12±7,01 |
40,3 |
|
3 |
2,55±0,12* |
22,3 |
2,30±0,05 |
22,1 |
60,1±9,12 |
30,3 |
|
4 |
4,79±0,05* |
16,8 |
1,96±0,03 |
19,0 |
40,4±8,00 |
40,2 |
|
5 |
4,06±0,05* |
15,7 |
2,13±0,04 |
19,0 |
40,0±6,32 |
39,0 |
|
6 |
2,59±0,08* |
18,0 |
1,31±0,07* |
19,2 |
60,0±5,00 |
35,4 |
|
7 |
1,50±0,13* |
12,3 |
1,85±0,05* |
13,4 |
90,3±7,31 |
28,6 |
|
Среднее за вегетационный сезон (2015 год) |
||||||
|
2,82±0,44* |
42,0 |
1,82±0,13 |
19,0 |
61,40±4,78 |
30,1 |
|
|
Смеш |
анная культура |
с горохом |
||||
|
Посев 2013 года |
||||||
|
1 |
2,55±0,09* |
20,0 |
1,44±0,13 |
23,0 |
60,4±5,10 |
32,5 |
|
2 |
2,35±0,07 |
23,0 |
2,04±0,07 |
18,7 |
60,2±6,23 |
40,0 |
|
3 |
2,78±0,09* |
18,1 |
0,84±0,08* |
23,4 |
70,0±4,57 |
42,5 |
|
7 |
2,40±0,10* |
21,0 |
1,19±0,05 |
25,0 |
80,3±6,00 |
30,7 |
|
Среднее за вегетационный сезон (2015 год) |
||||||
|
2,52±0,09* |
38,0 |
1,34±0,26* |
37,0 |
67,5±4,79 |
26,7 |
|
|
В сред |
нем за годы исследования |
|||||
|
Монокультура, неинокулированные семена (контроль) |
||||||
|
3,65±0,37 |
53,2 |
1,85±0,16 |
37,0 |
61,3±6,13 |
38,4 |
|
|
Монокультура, предпосевная обработка семян микробиологическим препаратом Байкал-ЭМ1 |
||||||
|
2,90±0,25* |
44,0 |
1,99±0,17 |
45,0 |
62,7±4,20 |
40,0 |
|
|
Смешанная культура с горохом |
||||||
|
3,79±0,98* |
47,0 |
2,02±0,23 |
56,0 |
69,50±6,00 |
29,8 |
|
|
В с |
реднем за 1-й го |
д жизни |
||||
|
2,78±0,31 |
66,0 |
1,93±0,15 |
49,0 |
73,00±5,30 |
37,5 |
|
|
В с |
реднем за 2-й го |
д жизни |
||||
|
4,41±0,92** |
58,0 |
2,14±0,23 |
53,0 |
57,8±5,00** |
49,2 |
|
В среднем за 3-й год жизни 3,44±0,44** 54,0 1,73±0,12* 29,0 56,1±4,05 41,3
Примечание. ФР — фаза развития растений, ССК — светособирающий комплекс; 1 — всходы (2-й и 3-й годы — отрастание), 2 — кущение, 3 — ветвление стебля, 4 — бутонизация, 5 — цветение, 6 — плодоношение, 7 — окончание вегетации; Chl a, Chl b, Car —хлорофиллы и каротиноиды.
-
* Различия с контролем статистически значимы при р ≤ 0,05.
-
* * Различия с показателем в предшествующем году статистически значимы при р ≤ 0,05.
При совместном посеве галеги с горохом на 2-й и 3-й годы жизни отмечали статистически значимые различия по величине Chl a/Chl b в листьях по фазам развития растений (см. табл. 2). На 2-й год значение Chl a/Chl b достоверно снижалось на 36 % в фазу отрастания и возрастало в 2 раза в фазу кущения и ветвления стебля относительно контроля (соответственно 4,73±0,09; 4,50±0,10; 4,60±0,10). На 3-й год жизни отмечали статистически значимое уменьшение анализируемого показателя на 27 % в фазу отрастания, на 37 % — в фазу кущения и на 26 % в фазу ветвления стебля (показатели в контроле — 3,50±0,07; 3,72±0,09 и 3,78±0,08). При предпосевной инокуляции семян препаратом Байкал-ЭМ1 соотношение Chl a/Chl b статистически значимо изменялось только на 3-й год жизни (по всем фазам развития в среднем были ниже на 33-51 % по сравнению с контрольным вариантом).
В среднем за 3 года исследований в смешанных посевах показатель Chl a/Chl b остался в пределах контрольных значений и составил 3,79±0,98, при применении микробиологического препарата — достоверно снизился на 21 % (до 2,90±0,25; в контроле Chl a/Chl b = 3,65±0,37). Снижение величины Chl a/Chl b может свидетельствовать о повышении адаптивного потенциала растений в условиях стресса и быть показателем их устойчивости (57-59).
Сообщалось, что у растений природной флоры таежной зоны европейского северо-востока России на долю антенных (светособирающих) хлорофиллов приходится 55-65 % фонда зеленых пигментов (53). В нашем опыте доля хлорофиллов, локализованных в ССК листьев (см. табл. 2), варьировала от 20 до 90 % в зависимости от фенологической фазы растений, возраста травостоя и технологического приема (контроль, инокуляция, смешанный посев). Между величиной Chl a/Chl b и долей хлорофиллов (Chl a + Chl b), локализованных в ССК, проявилась сильная отрицательная корреляция: в целом по опыту чем ниже был показатель Chl a/Chl b (х), тем выше доля хлорофиллов ССК ( r = - 0,83; R2 = 0,666, у = - 7,698х + 84,994). Корреляционная зависимость в контроле ( r = - 0,80; R2 = 0,694, y = - 6,2859х + 79,81) была ниже, чем при применении микробиологического препарата Байкал-ЭМ1 ( r = - 0,93; R2 = 0,856, y = - 12,971x + 98,602), но выше, чем в бинарных посевах ( r = - 0,65; R2 = 0,429, y = - 2,3476x + 76,206). На то же указывали корреляционные зависимости между накоплением в листьях суммы зеленых пигментов и содержанием Chl b. Коэффициенты корреляции между величиной (Chl a + Chl b) и содержанием Chl b по вариантам опыта (контроль, предпосевная обработка микробиологическим препаратом, бинарный посев) составили r = 0,57; r = 0,55 и r = 0,89 (р < 0,05 для всех r ).
Содержание каротиноидов . Достаточно высокое накопление каротиноидов в листьях галеги восточной в нашем опыте (см. табл. 1) вполне ожидаемо. Как известно, в высоких широтах в спектре рассеянной радиации увеличивается процентное содержание сине-фиолетовых лучей, поглощаемых каротиноидами. Каротиноиды могут дополнительно осуществлять светособирающую функцию в период белых ночей (53). Благодаря каротиноидам растения могут использовать энергию света в синей области спектра
-
(54). Кроме того, они защищают хлорофилл и другие компоненты фотосистем от светового перевозбуждения (54). Отмеченное в наших опытах накопление каротиноидов мы рассматриваем как адаптивную реакцию фотосинтетического аппарата к условиям высоких географических широт (60, 61).
В среднем в опыте показатель Chl/Car в год посева составил 1,93±0,16, на 2-й год повысился до 2,44±0,36, но статистически значимо возрос (на 19 %) только на 3-й год жизни растений (см. табл. 2). Значения Chl/Car в пределах 2,0-3,9 соответствуют высокому содержанию каротиноидов относительно зеленых пигментов (53). Сообщалось, что у растений Приполярного Урала, среди которых высока доля арктических и арктоальпийских видов, величина Chl/Car равнялась 3 (53), что указывает на повышение роли каротиноидов с продвижением на север.
Во все годы наблюдений в контроле, при инокуляции и в смешанном посеве соотношение Chl/Car снижалось до минимальных значений в осенний период (0,76-1,85) в сравнении с весенне-летний периодом (2,303,65), когда происходит интенсивный линейный рост (см. табл. 2).
Сравниваемые нами агротехнические приемы не привели к статистически значимому изменению соотношения Chl/Car у интродуцента. Тем не менее при инокуляции препаратом Байкал-ЭМ1 и выращивании совместно с горохом накопление каротиноидов в листьях галеги восточной мы отмечали превышение этого показателя относительно контроля (см. табл. 2).
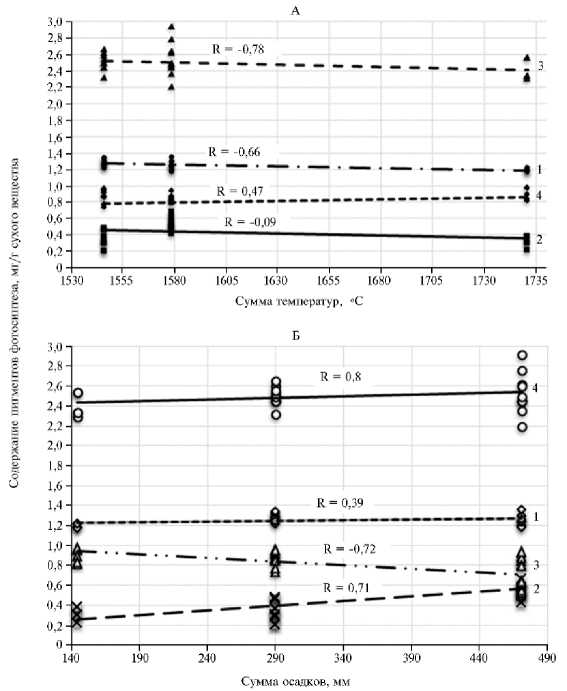
Рис. 1. Накопление фотосинтетических пигментов в листьях галеги восточной ( Galega orientalis Lam.) сорта Гале в зависимости от суммы активных температур > 10 °С (А) и суммы осадков (Б) : 1 —
Сhl a, 2 — CHl b, 3 — Car, 4 — сумма пигментов (Ханты-Мансийский автономный округ — Югра, Сургутский р-н, 6145 ’ 00 " с.ш., 73°25 ‘ 00 " в.д., 2013-2015 годы).
В целом в нашем опыте отмечалось широкое варьирование соотношения Chl/Car, что, по нашему мнению, может быть использовано при селекции культуры по признакам продуктивности и адаптированности к условиям Средней тайги Западной Сибири.
Гидротермические условия, и содержание пигментов . В среднем за годы исследования по всем вариантам опыта накопление пигментов в листьях галеги восточной прямо коррелировало с ГТК (x) ( r = 0,90; R 2 = 0,839, y = 0,804x + 0,5586). При этом содержание пигментов снижалось с ростом суммы активных температур за вегетационный период (рис. 1). Содержание Chl a в листьях галеги восточной находилось в обратной зависимости от среднесуточной температуры воздуха. Содержание Chl b и каротиноидов оказалось в меньшей степени связано с температурным режимом региона (см. рис. 1).
Галега восточная, как и все бобовые культуры, требовательна к количеству влаги, с чем согласуется высокая корреляционная связь между содержанием всех фотосинтетических пигментов в листьях растений и количеством выпавших за вегетационный сезон осадков ( r = 0,80; р < 0,05) (см. рис. 1). Содержание Chl b прямо коррелировало с количеством выпавших осадков за вегетационный сезон ( r = 0,71), тогда как для каротиноидов отмечали обратную зависимость ( r = - 0,72) (р < 0,05 для всех r ).
Содержание витамина С. Хотя большинство млекопитающих способны синтезировать аскорбиновую кислоту, ее количества может быть недостаточно для полноценного роста и обеспечения высокой продуктивности животных либо при стрессах, в связи с чем для обогащения кормов используются добавки, содержащие АК (62-65). По имеющимся сообщениям, в кормовой массе галеги восточной содержится от 136,2 до 522,1 мг АК на 100 г сухого вещества, в начале сезона вегетации этот показатель может составлять 800-900 мг% (66). Ранее мы показали, что растительная масса Galega orientalis Lam. является источником аскорбиновой кислоты после вступления растений в генеративную фазу развития с преимущественной (96 %) локализацией витамина в листьях (67), что ожидаемо с учетом роли аскорбиновой кислоты в фотосинтезе (27). В нашем опыте концентрация АК в среднем за период наблюдений возрастала от 37 мг% у растений 1-го года жизни до 60 мг% на 3-й год жизни (67). При этом в листовой массе галеги восточной 3-го года жизни содержание аскорбиновой кислоты (60 мг%) превышало в 1,6 раза аналогичные показатели 1-го и 2-го годов вегетации (соответственно 37 и 39 мг%). При инокуляции препаратом Бай-кал-ЭМ1 в год посева накопление АК в растительной массе была на 20 % выше (41 мг%, р ≤ 0,05), на 2-й год — на 26 % (31,0 мг%, р ≤ 0,05) ниже контроля, на 3-й год — находилось на уровне контрольных значений (6162 мг%). В смешанном посеве галеги восточной с горохом на 3-й год жизни травостоя отмечали достоверно значимое (р ≤ 0,05) снижение этого показателя до 56,0 мг%, что на 6 мг% меньше показателя в контроле.
Мы не выявили зависимости между накоплением АК и водообеспе-ченностью (данные не приведены). С понижением среднесуточной температуры воздуха (х) содержание витамина С в растительной массе повышалось ( r = - 0,69; R2 = 0,47; y = - 8,0838х + 133,73). Сильную отрицательную корреляцию отмечали между содержанием АК в листьях и величиной удельной листовой поверхности ( r от - 0,83 до - 0,88) (67).
Содержание флавоноидов. По данным В.И. Филатова с соавт. (68), при интродукции галеги восточной в условиях Восточной Сибири в фазу ветвления сумма флавоноидов составляла 0,40 %, в фазу бутонизации — 0,35 %, цветения – 0,27 %, плодоношения – 0,25 % к сухому веществу. В нашем опыте в среднем за годы исследования по всем вариантам опыта содержание флавоноидов в надземной биомассе галеги варьировало от 0,7 до 3,2 %. При инокуляции препаратом Байкал-ЭМ1 максимальное количество флавоноидов в надземной биомассе отмечали в 1-й год вегетации (2,4 % при 1,9 % в контроле); на 2-й год жизни как при инокуляции микробиологическим препаратом, так и в контроле содержание флавоноидов повысилось еще на 0,3 %, на 3-й год — резко снизилось (до 0,7 %), но при этом существенно не отличалось от показателя в контроле. У растений под покровом гороха в 1-й и на 2-й год жизни содержание флавоноидов в надземной биомассе составило 2,1-2,4 %, на 3-й год — резко возросло (до 3,2 %), существенно превысив показатели в двух других вариантах опыта.
В целом в нашем опыте содержание флавоноидов в листьях растений галеги было выше, чем в стеблях, и варьировало от 0,3 до 2,8 % (в стеблях — 0,2-0,5 %).
В 1-й год вегетации существенных различий в содержании флавоноидов в листьях по вариантам опыта мы не выявили (значения составили 1,6-1,9 %). На 2-й год в контроле и при инокуляции препаратом Байкал-ЭМ1 анализируемый показатель повысился на 0,5 %, в смешанном посеве — остался таким же, как в 1-й год жизни (1,7 %). На 3-й год в содержание флавоноидов в листьях резко снизилось в контроле (до 0,05 % — по сравнению с 1-м годом в 3 раза, по сравнению со 2-м годом в 5 раз) и при применении микробиопрепарата (соответственно в 6 и 8 раз), тогда как в посевах с горохом — резкое возросло и превысило показатели предыдущих лет в 1,6 раза (2,8 % против соответственно 1,8 и 1,7 %). Резкое снижение содержания флавоноидов на 3-й год жизни в контроле и при применении микробиопрепарата мы связываем с переходом растений к генеративному развитию и вступлением в фазы цветения и плодоношения (в отличие от бинарного посева, где продолжалась виргинильная стадия). При этом применение микробиопрепарата способствовало более интенсивному росту вегетативных органов в прегенеративный период, образованию большего числа цветоносов и плодообразованию. Отметим, что в исследованиях на разных видах растений описаны как аналогичные (69, 70), так и обратные (71) закономерности.
Один из факторов, с которым в нашем опыте было связано содержание флавоноидов в период интенсивного вегетативного роста, — сумма выпавших осадков (х) ( r = 0,79, R2 = 0,63; y = 0,0046х + 0,5037).
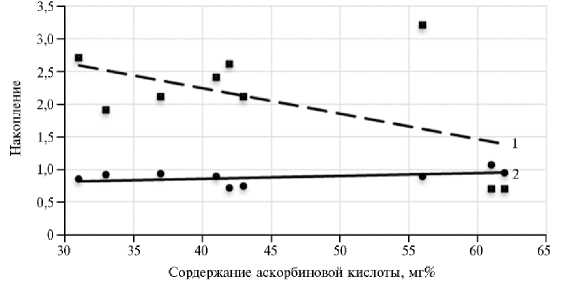
Рис. 2. Накопление флавоноидов, % (1) и каротиноидов, мг/г сухого вещества (2) в листьях галеги восточной ( Galega orientalis Lam.) сорта Гале в зависимости от содержания аскорбиновой кислоты (Ханты-Мансийский автономный округ — Югра, Сургутский р-н, 6145 ’ 00 " с.ш., 73°25 ‘ 00 " в.д., 2013-2015 годы).
У галеги восточной мы также выявили тесную обратную корреляцию между содержанием витамина С, с одной стороны, и накоплением флавоноидов и каротиноидов — с другой (для всех возрастов травостоя и вариантам опыта) (рис. 2).
Полученные нами результаты позволяют заключить, что галега восточная сорта Гале успешно адаптируется к природно-климатическим факторам зоны Средней тайги Западной Сибири и перспективна в качестве кормовой культуры. Температура и влагообеспеченность в пункте интродукции оказались достаточны для работы фотосинтетического аппарата, формируемого растениями галеги восточной в световых условиях региона (интенсивность и спектральный состав солнечного излучения, продолжительность светового дня) в сезон вегетации. В результате продуктивность травостоя составила 23-35 т/га. Для обеспечения высокой и стабильной урожайности, наибольшего содержания белка и высокой питательной ценности корма целесообразно совершенствовать элементы технологий выращивания культуры, в том числе с помощью подбора микробиопрепаратов, регуляторов роста (72), эффективных покровных культур (4). В качестве дополнительного резерва рассматривается оптимизация приемов сбора урожая посредством фракционирования его элементов (листья и стебли галеги) (1).
Детальное изучение биохимического состава зеленой массы галеги восточной, включающего также вещества, которые относят к антипитатель-ным, — ингибиторы трипсина, лектины (2), кумарины, сапонины, танины, алкалоиды (19), и, что не менее важно, понимание физиолого-биохимических механизмов их накопления в растении важны как в вопросах кормления, так и в перспективе при селекционном улучшении культуры. Например, в клинической практике уже используются препараты на основе кумаринов, и многие кумарины и их производные рассматриваются в качестве потенциальных лекарственных средств (73), но в сладком клевере (доннике) содержится кумарин, который в сене под действием плесневых грибов превращается в дикумарол (3,3-метилен-бис-4-оксикумарин), препятствующий свертыванию крови, вследствие чего могут возникать болезненные кровотечения у крупного рогатого скота (74). Танины и сапонины в высоких концентрациях считаются антипитательными веществами, однако в кормах танины служат консервантом, а у сапонинов известен иммуномодулирующий эффект (75). Сапонины могут способствовать оздоровлению кишечника у кур (76). Сообщалось, что алкалоиды, танины и сапонины способны влиять на пищевое поведение крупного рогатого скота и овец (77).
Подлежит оценке влияние удобрений и накопление микро- и макроэлементов, тяжелых металлов в биомассе галеги (78, 79), также в качестве перспективных направлений выделяют изучение свойств корневой системы галеги восточной, позволяющих растениям лучше использовать питательные вещества, исследование влияния галеги как предшественника на урожайность сельскохозяйственных растений и определение ее пригодности в системе экстенсивного органического земледелия (3, 4).
Наконец, крайне важен экологический аспект интродукции галеги. Бобовые — одни из лидеров по вредным последствиям инвазии растений (7, 80). В Средней России бобовые занимают пятое место по числу чужеродных видов. Агрессивность бобовых культур связывают с их массовым использованием в качестве кормовых трав и «зеленых удобрений». G. orientalis — один из наиболее агрессивных инвазивных видов бобовых (80). При инвазиях изменения происходят на уровне экосистемы, поэтому даже полное удаление инвайдеров не возвращает сообществу его первоначальный статус (80).
Таким образом, при интродукции галеги восточной сорта Гале на севере России (61°15‘00" с.ш., 73°25‘00" в.д.) эффект изученных агротехнических приемов (монокультура, монокультура с предпосевной обработкой семян микробиопрепаратом Байкал-ЭМ1, смешанная культура с горохом) при сравнении суммарного содержания хлорофиллов (Chl a + Chl b) в листьях проявился со 2-го года жизни растений. При обработке микробиопрепаратом на 2-й и 3-й годы жизни этот показатель был выше, чем в контроле (по фазам развития на 19-22 % и на 16-18 %), в смешанном посеве — снижался в конце 2-го года, но к концу 3-го года превысил контрольные значения на 33 %. В контроле содержание Chl a в листьях галеги восточной в год посева, на 2-й и 3-й годы жизни в среднем за вегетационный сезон составило 1,23±0,10; 1,29±0,12 и 1,32±0,14 мг/г сухой массы. В среднем за 2-й год при применении удобрения Байкал-ЭМ1 содержание Chl а в листьях возросло на 15 % в сравнении с контролем, при совместном посеве с горохом — оставалось в пределах контрольных значений (1,20±0,23 мг/г). В среднем за 3 года при применении микробиологического препарата значение Chl a/Chl b в листьях достоверно (р < 0,05) снизилось, что может указывать на повышение адаптивного потенциала растений, в смешанных посевах — осталось в пределах контрольных значений. Доля хлорофиллов (Chl a + Chl b), локализованных в светособирающих комплексах листьев, варьировала от 20 до 90 % в зависимости от фенологической фазы развития, возраста травостоя и варианта опыта. В контроле, при инокуляии микробиопрепаратом и в смешанном посеве корреляция между Chl a/Chl b и долей хлорофиллов (Chl a + Chl b), локализованных в ССК, составила соответственно r = -0,83; r = -0,93 и r = -0,65 (р < 0,05). Сравниваемые агротехнические приемы не привели к статистически значимому изменению показателя Chl/Car у интродуцента. Тем не менее при инокуляции препаратом Байкал-ЭМ1 и в смешанном посеве с горохом накопление каротиноидов в листьях галеги восточной превышало таковое в контроле. В среднем за годы исследования по всем вариантам опыта накопление всех пигментов в листьях прямо коррелировало с ГТК. Содержание Chl b и каротиноидов оказалось слабее связано с температурным режимом региона, при этом первый показатель прямо коррелировал с количеством осадков за сезон, а для второго отмечали отрицательную корреляцию. При инокуляции препаратом Байкал-ЭМ1 содержание аскорбиновой кислоты в листьях в 1-й и 2-й год жизни растений повышалось относительно контроля, к 3-му году — практически сравнялось с контрольными значениями, в смешанном посеве на 3-й год снижалось относительно контроля. Содержание флавоноидов в листьях при применении микробиопрепарата и в контроле на 3-й год (когда растения перешли к генеративному развитию) резко снизилось, тогда как смешанном посеве, где продолжалась виргинильная стадия, — резкое возросло (в 1,6 раза по сравнению с предыдущими годами). В целом полученные данные свидетельствуют, что применение микробиологического препарата Байкал-ЭМ1 в большей степени способствовало адаптации растений галеги восточной 2-го и 3-го года к новым экологическим условиям.
Список литературы Накопление фотосинтетических пигментов и вторичных метаболитов в листьях галеги (Galega orientalis Lam.) сорта гале в зависимости от возраста травостоя и агротехнологии при интродукции в зоне средней тайги Западной Сибири
- Ignaczak S., Andrzejewska J., Sadowska K., Albrecht K.A. Fractional harvest of fodder galega for improved herbage nutritive value. Agronomy, 2021, 11(3): 480 (doi: 10.3390/agron-omy11030480).
- Домаш В.И., Прохоров В.Н., Канделинсксая, О.Л., Шарпио Т.П., Забрейко С.А., Гри-щенко Е.Р. Биохимическая характеристика генотипов галеги восточной (Galega orientalis Lam.), произрастающей в условиях Беларуси. Сельскохозяйственная биология, 2013, 6: 105111 (doi: 10.15389/agrobiology.2013.6.105rus)
- Balezentiene L., Spruogis V. Experience of fodder Galega (Galega orientalis Lam) and traditional fodder grasses use for forage production in organic farm. Veterinarija ir zootechnika (Vet. Med. Zoot.), 2011, 56(78): 19-26.
- Zarczynski P.J., Sienkiewicz S., Wierzbowska J., Krzebietke S.J. Fodder Galega — a versatile plant. Agronomy, 2021, 11(9): 1797 (doi: 10.3390/agronomy11091797).
- POWO Plants of the World Online. Facilitated by the Royal Botanic Gardens, Kew, 2021. Режим доступа: https://powo.sci-ence.kew.org/taxon/urn:lsid:ipni.org:names:495682-1. Дата обращения: 09.02.2022.
- Osterman J., Chizhevskaja E.P., Andronov E.E., Fewer D.P., Terefework Z., Rou-milantseva M.L., Onichtchouk O.P., Dresler-Nurmi A., Simarov B.V., Dzyubenko N.I., Lindstrom K. Galega orientalis is more diverse than Galega officinalis in Caucasus—whole-genome AFLP analysis and phylogenetics of symbiosis-related genes. Molecular Ecology, 2011, 20(22): 4808-4821 (doi: 10.1111/j.1365-294X.2011.05291).
- Баркалов В.Ю., Прокопенко С.В. Galega orientalis Lam. (Fabaceae) — новый вид для адвентивной флоры российского Дальнего Востока. Бюллетень Ботанического сада-института, 2017, 17: 45-46.
- Teleu^a A., TOei V., Cowman S. Biological peculiarities and nutritional value of Astragalus galegi-formis L. and Galega orientalis Lam. species in Moldova. J. Bot., 2015, VII(1-10): 126-133.
- Fairey N.A., Lefkovitch L.P., Coulman B.E., Fairey D.T., Kunelius T., McKenzie D.B., Michaud R., Thomas W.G. Cross-Canada comparison of the productivity of fodder galega (Galega orientalis Lam.) with traditional herbage legumes. Canadian Journal of Plant Science, 2000, 80(4): 793-800 (doi: 10.4141/P99-162).
- Iwabuchi K. Adaptability and cultivation of Leguminosae galega (Galega orientalis Lam.) in Hokkaido (usefulness, cultivation and feeding value of galega (Galega orientalis Lam.) in Hokkaido). Journal of the Japanese Grassland Society, 2012, 58(2): 113-121 (doi: 10.14941/grass.58.113).
- Гульшина И.И. Основные приемы возделывания козлятника восточного (Galega orientalis Lam.) в одновидовых и смешанных посевах в условиях лесостепи ЦЧР. Автореф. канд. дис. М., 2000.
- Кшникаткина А.Н., Гущина В.А., Варламов В.А., Галиуллин А.А. Продукционный процесс агрофитоценозов козлятника восточного в условиях Cреднего Поволжья. Сельскохозяйственная биология, 2003, 2: 101-107.
- Фаизов И.Ф. Продуктивность козлятника восточного в чистых и смешанных посевах на обыкновенных черноземах степной зоны Саратовского правобережья. Автореф. канд. дис. Пенза, 2004.
- Батыршина Э.Р. Основные технологические приемы возделывания козлятника восточного в одновидовых и смешанных посевах в условиях Среднего Урала. Автореф. канд. дис. М., 2004.
- Сагирова Р.А. Онтогенетический морфогенез галеги восточной (Galega orientalis Lam.) как перспективного кормового растения. Сельскохозяйственная биология, 2009, 4: 75-80.
- Литвяк Г.К. Продуктивность козлятника восточного на корм и семена в зависимости от нормы высева и способа посева в условиях оренбургского Предуралья. Автореф. канд. дис. Оренбург, 2002.
- Жукова М.А. Биохимическая характеристика популяций козлятника восточного (Galega orientalis Lam.). Автореф. канд. дис. СПб, 2003.
- Shymanska O.V., Vergun O.M., Rakhmetov D.B., Brindza J. Antiradical activity of plant extracts of Galega officinalis L. and G. orientalis Lam. Plant Introduction, 2018, 78: 12-19 (doi: 10.5281/ze-nodo.2229075).
- Darmohray L.M., Sedilo G.M., Gutyj B.V. Conceptual framework for the assessment of the nutritional and biological value of the plant Galega orientalis (Lam.). Scientific Messenger LNUVMB, 2017, 19(79): 9-12 (doi: 10.15421/nvlvet7902).
- Perez-Galvez A., Viera I., Roca M. Carotenoids and chlorophylls as antioxidants. Antioxidants (Basel), 2020, 9(6): 505 (doi: 10.3390/antiox9060505).
- Akbari A., Jelodar G., Nazifi S., Sajedianfard J. An overview of the characteristics and function of vitamin C in various tissues: relying on its antioxidant function. Zahedan J. Res. Med. Sci., 2016, 18(11): e4037 (doi: 10.17795/zjrms-4037).
- Kumar S., Pandey A.K. Chemistry and biological activities of flavonoids: an overview. The Scientific World Journal, 2013, 2013: Article ID 162750 (doi: 10.1155/2013/162750).
- Apak R., OzyUrek M., Gttijlu K., Qapanoglu E. Antioxidant activity/capacity measurement. 1. Classification, physicochemical principles, mechanisms, and electron transfer (ET)-based assays. J. Agric. Food Chem, 2016, 64(5): 997-1027 (doi: 10.1021/acs.jafc.5b04739).
- Swapnil P., Meena M., Singh S.K., Dhuldhaj U.P., Harish, Marwal A. Vital roles of carotenoids in plants and humans to deteriorate stress with its structure, biosynthesis, metabolic engineering and functional aspects. Current Plant Biology, 2021, 26: 100203 (doi.org/10.1016/j.cpb.2021.100203).
- Тютерева Е.В., Иванова А.Н., Войцеховская О.В. Фотосинтез без хлорофилла b: уникальная организация фотосинтетического аппарата мутанта ячменя chlorina 3613. Труды Межд. науч. конф. «Ботаника: история, теория, практика (к 300-летию основания Ботанического института им. В.Л. Комарова Российской академии наук». СПб, 2014: 190-203.
- Gest N., Gautier H., Stevens R. Ascorbate as seen through plant evolution: the rise of a successful molecule. Journal of Experimental Botany, 2013, 64(1): 33-53 (doi: 10.1093/jxb/ers297).
- Иванов Б.Н. Роль аскорбиновой кислоты в фотосинтезе. Биохимия, 2014, 79(3): 364-372.
- Toth S.Z., Nagy V., Puthur J.T., Kovacs L., Garab G. The physiological role of ascorbate as photosystem II electron donor: protection against photoinactivation in heat-stressed leaves. Plant Physiology, 2011, 156(1): 382-392 (doi: 10.1104/pp.110.171918).
- Trubitsin B.V., Mamedov M.D., Semenov A.Y., Tikhonov A.N. Interaction of ascorbate with photosystem I. Photosynthesis Research, 2014, 122: 215-231 (doi: 10.1007/s11120-014-0023-7).
- Ivanov B., Asada K., Kramer D.M., Edwards G. Characterization of photosynthetic electron transport in bundle sheath cells of maize. I. Ascorbate effectively stimulates cyclic electron flow around PSI. Planta, 2005, 220: 572-581 (doi: 10.1007/s00425-004-1367-6).
- Зверев Я.Ф. Флавоноиды глазами фармаколога. Антиоксидантная и противовоспалительная активность. Обзоры по клинической фармакологии и лекарственной терапии, 2017, 15(4): 5-13 (doi: 10.17816/RCF1545-13).
- Vergun O., Shymanska O., Rakhmetov D., Grygorieva O., Ivanisova E., Brindza J. Parameters of antioxidant activity of Galega officinalis L and Galega orientalis Lam. (Fabaceae Lindl.) plant raw material. Potravinarstvo Slovak Journal of Food Sciences, 2020, 14: 125-134 (doi: 10.5219/1271).
- Balezentiene L. Bioassay of phenolics accumulation and activity in fodder galega at different growth stages. Zemdirbyste-Agriculture, 2009, 96(1): 170-181.
- Лапина Е.А., Шепелева Л.Ф. Эколого-биоморфологические особенности развития козлятника восточного (Galega orientalis L.) первого года интродукции в условиях средней тайги Западной Сибири. Вестник Оренбургского государственного университета, 2014, 6(167): 30-35.
- Моисеева Е.А., Шепелева Л.Ф. Продукционные процессы при интродукции галеги восточной (Galega orientalis Lam.) в условиях средней тайги Западной Сибири. Вестник Крас-ГАУ, 2016, 8: 9-14.
- Моисеева Е.А., Шепелева Л.Ф., Кравченко И.В. Динамика содержания пигментов фотосинтеза галеги восточной (Galega orientalis Lam.) в условиях средней тайги Западной Сибири. Вестник КамчатГТУ, 2016, 37: 70-76 (doi: 10.17217/2079-0333-2016-37-70-76).
- Моисеева Е.А., Бордей Р.Х. Эколого-биологическая оценка козлятника восточного (Galega orientalis Lam.) как перспективной культуры для интродукции в условиях г. Сургута. Вестник КрасГАУ, 2017, 10: 140-147.
- Моисеева Е.А., Бордей Р.Х, Самойленко З.А. Перспективы возделывания галеги восточной (Galega orientalis Lam.) на подзолистых почвах средней тайги Западной Сибири (в условиях Ханты-Мансийского автономного округа-Югры). Известия Коми научного центра Уральского отделения Российской академии наук, 2018, 3(35): 54-60.
- Моисеева Е.А. Некоторые аспекты репродуктивной биологии козлятника восточного (Galega orientalis Lam.) в условиях средней тайги Западной Сибири. Мат. IVМежд. науч.-практ. конф. «Экология и география растений и растительных сообществ». Екатеринбург, 2018: 567-570.
- Доспехов Б.А. Методика полевого опыта (с основами статистической обработки результатов исследований). М., 1985.
- Методика полевых опытов с кормовыми культурами /Под ред. А.С. Митрофанова, Ю.П. Новоселова, Г.Д. Харькова. М., 1971.
- Работнов Т.А. Работы в области изучения жизненного цикла многолетних травянистых растений в естественных ценозах. Вопросы ботаники. М.-Л., 1954, вып. 2.
- Федоров А.А., Кирпичников М.Э., Артюшенко З.Т. Атлас по описательной морфологии высших растений. Лист. М.-Л., 1956.
- Федоров А.А., Кирпичников М.Э., Артюшенко З.Т. Атлас по описательной морфологии высших растений. Стебель и корень. М.-Л., 1962.
- Федоров А.А., Кирпичников М.Э., Артюшенко З.Т. Атлас по описательной морфологии высших растений. Соцветие. М.-Л., 1979.
- Федорова А.И., Никольская А.Н. Практикум по экологии и охране окружающей среды. М., 2003.
- Мокроносов А.Т. Нефтегазодобыча и окружающая среда. М., 1994.
- Maslova T.G., Popova I.A. Adaptive properties of the plant pigment systems. Photosynthetica, 1993, 29(2): 195-203.
- Lichtenthaler H.K. Chlorophylls and carotenoids: pigments of photosynthetic biomembranes. In: Methods in enzymology, V. 148 /L. Packer, R. Douce (eds.). Academic Press, San Diego, 1987: 350-382 (doi: 10.1016/0076-6879(87)48036-1).
- Hewitt E.J., Dickes G.J. Spectrophotometric measurements on ascorbic acid and their use for the estimation of ascorbic acid and dehydroascorbic acid in plant tissues. Biochemical Journal, 1961, 78(2): 384-391 (doi: 10.1042/bj0780384).
- Чупахина Г.Н. Система аскорбиновой кислоты растений. Калининград, 1997.
- Флавиновые гликозиды. Методы выделения, очистки, разделения и анализа. Л., 1991.
- Дымова О.В., Головко Т.К. Фотосинтетические пигменты в растениях природной флоры таежной зоны европейского северо-востока России. Физиология растений, 2019, 66(3): 198206 (doi: 10.1134/S0015330319030035).
- Ладыгин В.Г., Ширшикова Г.Н. Современные представления о функциональной роли каротиноидов в хлоропластах эукариот. Журнал общей биологии, 2006, 67(3): 163-189. Иванова Л.А., Ронжина Д.А., Юдина Д.А., Золотарева Н.В., Калашникова И.В., Иванова Д.А. Сезонная динамика содержания хлорофиллов и каротиноидов в листьях степных и лесных растений на уровне вида и сообщества. Физиология растений, 2020, 67(3): 278-288 (doi: 10.31857/S0015330320030112).
- Zhang H., Zhong H., Wang J., Sui X., Xu N. Adaptive changes in chlorophyll content and photosynthetic features to low light in Physocarpus amurensis Maxim and Physocarpus opulifolius "Diabolo". PeerJ, 2016, 4: e2125 (doi: 10.7717/peerj.2125).
- Jansson S. Light-harvesting complex (LHC) I and II: pigments and proteins. In: Encyclopedia of biological chemistry. Elsevier, New York, 2004: 567-570 (doi: 10.1016/B0-12-443710-9/00490-7).
- Nahakpam S. Chlorophyll stability: a better trait for grain yield in rice under drought. Indian Journal of Ecology, 2017, 44(special issue-4): 77-82.
- Maglovski M., Gersi Z., Rybansky L., Bardacova M., Moravcikova J., Bujdos M., Dobrikova A., Apostolova E., Kraic J., Blehova A., Matusikova I. Effect of nutrition on wheat photosynthetic pigment responses to arsenic stress. Polish Journal of Environmental Studies, 2019, 28(3): 18211829 (doi: 10.15244/pjoes/89584).
- Larcher W. Physiological plant ecology. Ecophysiology and stress physiology of functional groups. Springer-Verlag, Berlin, Heidelberg, New-York, 2003.
- Головко Т.К., Далькэ И.В., Дымова О.В., Захожий И.Г., Табаленкова Г.Н. Пигментный комплекс растений природной флоры европейского Северо-Востока. Известия Коми научного центра УрО РАН, 2010, 1: 39-46.
- Surai P., Fisinin V.I. Natural antioxidant in hens' embryogenesis and antistress defense in postnatal development (review). Sel'skokhozyaistvennaya Biologiya [Agricultural Biology], 2013, 2: 318 (doi: 10.15389/agrobiology.2013.2.3eng).
- Остренко К.С., Галочкин В.А, Колоскова Е.М., Галочкина В.П. Влияние нового микро-нутриента —аскорбата лития на стрессоустойчивость и продуктивность свиноматок. Проблемы биологии продуктивных животных, 2017, 2: 74-86.
- Войтехович М.А., Кучинская В.А, Новосельский И.Ю., Гриусевич П.В., Самохина В.В., Мацкевич В.С., Соколик А.И., Демидчук В.В. L-аскорбиновая кислота как антиоксидант и сигнально-регуляторный агент в клетках высших растений. Журнал Белорусского государственного университета. Биология, 2018, 2: 27-38.
- Matsui T. Vitamin C nutrition in cattle. Asian-Australas. J. Anim. Sci., 2012, 25(5): 597-605 (doi: 10.5713/ajas.2012.r.01).
- Зенькова Н.Н., Разумовский Н.П., Субботина И.А. Продуктивность, состав и кормовые достоинства галеги восточной. Ученые записки УО ВГАВМ, 2010, 46, 2(2): 122-127.
- Кравченко И.В., Моисеева Е.А., Устинова М.В., Шепелева Л.Ф. Динамика накопления аскорбиновой кислоты в надземной фитомассе Galega orientalis Lam. Юг России: экология, развитие, 2021, 16(1): 36-44 (doi: 10.18470/1992-1098-2021-1-36-44).
- Филатов В.И., Мельников В.Н., Лугинина Т.Ф., Слабженинова Н.В. Продуктивность козлятника восточного при применении нитрагина и физиологически активных соединений в условиях ЦРНЗ. Плодородие, 2010, 4: 36-38.
- Ghasemzadeh A., Nasiri A., Jaafar H.Z., Baghdadi A., Ahmad I. Changes in phytochemical synthesis, chalcone synthase activity and pharmaceutical qualities of Sabah snake grass (Clinacanthus nutans L.) in relation to plant age. Molecules, 2014, 19(11): 17632-17648 (doi: 10. 3390/molecules191117632).
- Кирсанова Н.В. Эколого-биологические особенности Eupatorium cannabinum L. в связи с интродукцией в подзоне южной тайги Западной Сибири. Автореф. канд. дис. Томск, 2012. Mutalib L. Effect of growth age period on biochemical composition of Plantago major plant. International Journal of Current Research and Review, 2015, 7(19): 6-10.
- Eryashev A.P., Eryashev P.A. The influence of pesticides and Albite on the photosynthetic activity and seed yield of eastern galega (Galega orientalis). Journal of Pharmaceutical Sciences and Research, 2018, 10(12): 3422-3425.
- Tian D., Wang F., Duan M., Cao L., Zhang Y., Yao X., Tang J, Coumarin analogues from the Citrus grandis (L.) osbeck and their hepatoprotective activity. Journal of Agricultural and Food Chemistry, 2019, 67(7): 1937-1947 (doi: 10.1021/acs.jafc.8b06489).
- Yamini B., Poppenga R.H., Braselton W.E., Judge L.J. Dicoumarol (moldy sweet clover) toxicosis in a group of Holstein calves. Journal of Veterinary Diagnostic Investigation, 1995, 7: 420-422.
- Smith B.N., Dilger R.N. Immunomodulatory potential of dietary soybean-derived isoflavones and saponins in pigs. Journal of Animal Science, 2018, 96(4): 1288-1304 (doi: 10.1093/jas/sky036).
- Chaudhary S.K., Rokade J.J., Aderao G.N., Singh A., Gopi M., Mishra A., Raje K. Saponin in poultry and monogastric animals: a review. International Journal of Current Microbiology and Applied Sciences, 2018, 7(7): 3218-3225 (doi: 10.20546/ijcmas.2018.707.375).
- Jensen T.L. Livestock foraging behavior in response to sequence and interactions among alkaloids, tannins and saponins. Utah State University, 2012.
- Symanowicz B., Kalembasa S., Jaremko D., Niedbala M. Effect of nitrogen application and year on concentration of Cu, Zn, Ni, Cr, Pb and Cd in herbage of Galega orientalis Lam. Plant Soil Environ., 2015, 61(1): 11-16 (doi: 10.17221/558/2014-PSE).
- Symanowicz, B., Kalembasa, S., Jaremko, D., Niedbala, M. Effect of nitrogen fertilization of Galega orientalis Lam. on the yield and content of K, Na, Ca and Mg in the plant and soil. Environmental Protection and Natural Resources, 2015, 26(2): 15-20 (doi: 10.1515/oszn-2015-0004).
- Vinogradova Y. Bio-morphological characters of alien legume species, influencing their invasion in natural plant communities. American Journal of Plant Sciences, 2016, 7(16): 2390-2398 (doi: 10.4236/ajps.2016.716209).


