Накопление полигидроксиалканоатов в клетках родококков при несбалансированном росте
Автор: Максимова Ю.Г., Бурлуцкая Е.Ю.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2016 года.
Бесплатный доступ
Определено общее содержание полигидроксиалканоатов (ПГА) в клетках штаммов бактерий рода Rhodococcus при периодическом двустадийном росте на полноценной и лимитированной по источнику азота или фосфора среде культивирования с разными источниками углерода. Методом фазо-во-контрастной световой микроскопии изучена морфология бактериальных клеток при несбалансированном росте. Не было обнаружено значимых различий в накоплении этих запасных питательных веществ как при росте изученных штаммов на разных источниках углерода, так и на средах, лимитированных по азоту или фосфору. Показано, что R. ruber П5-8 накапливает наибольшее количество ПГА на среде, лимитированной по фосфору, при росте на бутирате и ацетате натрия в качестве источника углерода - 312.5 и 466.7 мкг/мг соответственно. При росте R. ruber П5-8 на среде, дефицитной по азоту, отмечается заметное изменение морфологии, которое выражается в неравномерных утолщениях клеток. Наибольшее накопление биомассы R. ruber П5-8 (до 9.4 мг АСБ/мл) наблюдается при росте на среде, лимитированной по фосфору, с бутиратом натрия в качестве источника углерода.
Полигидроксиалканоаты, родококки, цитоплазматические включения, запасные питательные вещества, морфология бактериальной клетки
Короткий адрес: https://sciup.org/147204793
IDR: 147204793 | УДК: 579.222
Текст научной статьи Накопление полигидроксиалканоатов в клетках родококков при несбалансированном росте
(С Максимова Ю. Г., Бурлуцкая E. Ю., 2016
Alcaligenes eutrophus) - микроорганизм-суперпродуцент, который способен аккумулировать ПГА в количестве 80% от абсолютно сухой биомассы [Anderson, Dawes. 1990; Sudesh, Abe, Dol 2000: Волова и др,, 2007]. Он используется в промышленном масштабе для производства биодеграда бел ьного термопластика [Волова, Шишацкая, 2011].
Способность к накоплению ПГА известна у представителей большого количества родов микроорганизмов из разнообразных экологических ниш - деструкторов углеводородов Pseudomonas, J cineiobacter, Sphingobactenum, Brochothrix, С 'a и lob acter, Ralston iaY BwkhcdderiaY Yokene! la [Dalal et al., 2010]; галофилов Halobacterium, Haloferax, Ha!onion as, Haloarc и la [Quillaguamran el aL 2010; Saharan, Grewal. Kumar, 2014]; фотосинтетиков - цианобактерий [de Philippis et al., 1992: Nishioka et at, 2001: Panda. Sharma. Mallick, 2005]; ризосферных бактерий Azotobacter, A zospiri 11am h Sinorh izobiam h Rh izob Ium, Bradvrhizobhmr Mesorhizobium [Trainer, Charles, 2006: Ratcliff, Kadam. Denison, 2008]: стрептомицетов - продуцентов антибиотиков [Manna, Banerjee, Paul, 1999]: светящихся бактерий [Бояндин и др,, 2008]: бактерий аэробного и анаэробного активного ила [Bengtsson et aL 2008: Vcnkatcswar Reddy et al., 2012: Venkateswar Reddv, Venkata Mohan, 2012; Cavaille et al. 2013; Lee et at, 2015; Cha et al., 2016], В то же время незаслуженно мало внимания уделяется изучению биосинтеза ПГА у актинобактерий рода Rhodococcus. известных своим биодеградативным потенциалом и способностью к росту на различных углеводородных субстратах [Ившина, Пшсничнов, Оборин, 1987; Соляникова и др., 2010; Ившина и др,, 2011], Только единичные работы посвящены изучению биосинтеза ПГА и генов, вовлеченных в метаболизм этих соединений у родококков [Pieper, SteinbucheL 1992; Anderson et al., 1995; Hernandez et al., 2008; Matias et al., 2009].
Известно, что при недостатке в среде культивирования элементов, необходимых для синтеза компонентов бактериальной клетки, избыток углеродных субстратов приводит к накоплению в ней запасных питательных веществ. Синтез и деградация ПГА в нормальных условиях происходят одновременно, поэтому, чтобы достигнуть эффективной аккумуляции этих веществ, ферменты биосинтеза ПГА должны быть индуцированы, тогда как деградации - ингибированы [Kim, Park, Lee, 1996]. Однако не до конца ясно, какое сочетание лимитированных и избыточных элементов в среде культивирования способно привести к максимальном}7 накоплению ПГА в клетках родококков. При этом интересен вопрос о предпочтительном углеродном субстрате, наличие которого в среде культивирования приводит к максимальному синтезу ПГА у различных групп микроорганизмов. Так, есть сведения. что таким субстратом может являться бутират [Marang et al.. 2013]. Также механизм образо вания запасных питательных веществ часто изучается у культур микроорганизмов, растущих на простых, легко биодеградируемых субстратах, таких как ацетат или глюкоза [Biros et al.. 2014].
В связи с этим, целью настоящей работы являлось сравнение уровня накопления ПГА в клетках бактерий рода Rhodococcus при росте на содержащих различные источники углерода средах, лимитированных по азогут или фосфору.
Материалы и методы исследования
Бактериальные штаммы Rhodococcus erythro-polis ПЗ-8, 4-1, 6-21 и R* ruber П5-8, изолированные из почв Пермского края и способные к гидролизу и синтезу сложных эфиров [Осипова, Рсмс-зовская, Максимов, 2015], культивировали последовательно на среде 1 и среде 2. Среда 1 служила для накопления биомассы и была сбалансирована по источникам углерода, азота и фосфора. Она состояла из минеральной основы, содержащей (г/л): КН3РО4 - L0: К2НГО4^ЗН3О - 1,6; NaCl - 0.5; MgSO4x7H2O - 0.5, микроэлементы СаС12 - 0.005; FcSO4x7H2O - 0,01; СоСГ^бНзО - 0,01; pH 7.2±0.2. Источником азота являлся 0.01 М хлорид аммония, источниками углерода — глюкоза (0.1%), сахароза (0.1%), ацетат натрия (0.02 М), бутират натрия (0.1 М). Среда 2 служила для синтеза ПГА и была дефицитной по азоту, в этом случае пред-ставляла собой минеральную основу, как в среде Г без источника азота с глюкозой (5%), сахарозой (5%), ацетатом натрия (0.2 М), бутиратом натрия (0,5 М) в качестве источников углерода. В случае дефицитной по фосфору среды 2 ее основой был физиологический раствор (0,9%-ный хлорид натрия), содержащий микроэлементы, как в среде I, и хлорид аммония (0.01 М). Концентрация источников углерода соответствовала таковым безазоти-стой среды.
Культивирование проводили в колбах Эрлсн-мейера объемом 100 мл в 50 мл среды 1 в течение 5 дней при температуре 25°С на шейкере со скоростью перемешивания 140 об/мин. затем переносили в стерильные центрифужные пробирки, центрифугировали 20 мин. при 10 000 g, отмывали однократно от среды стерильным физиологическим раствором, и вносили 10 мл среды 2, Культивировали в тех же условиях еще 5 дней, центрифугировали, высушивали биомассу до постоянного веса и определяли общее содержание ПГА.
Биомассу гидролизовали в концентрированной серной кислоте на водяной бане при температуре 100°С в течение часа, концентрацию кротоновой кислоты определяли спектрофотометрически при 235 нм по калибровочному графику, построенному по оптической плотности кротоновой кислоты возрастающей концентрации, которая была получена в тех же условиях из поли [(R)-3-гидроксибутирата] (Sigma-Aldrich, Германия).
Контролем служили культуры, выращенные в течение суток на полноценной среде Луриа-
Бертани (LB).
Микрофотографии получали в световом микроскопе Leica DM LS (Германия) с фазовым контрастом при увеличении 1000 раз.
Статистическую обработку проводили с использованием непара метрического Т-критерия Вилкоксона и U-критерия Манна-Уитни с использованием пакета стандартных программ Statistica 10.0 (fl StatSoft 1псЛ 2012). Различия считали значимыми при р<0.05>
Результаты и их обсуждение
Изучено накопление ПГА в клетках родококков при двустадийном выращивании. Среда. сбаланси
Таблица 1
Накопление ПГА у родококков при росте на средах^ лимитированных по азоту и фосфоруi мкг/мг
|
Источники угле-рода |
Штаммы |
|||
|
R. erythropolts ПЗ-8 |
R. erythropoiis 4-1 |
R. ruber П5-8 |
R. erythropolis 6-21 |
|
|
Среда, лимитированная по азоту |
||||
|
Ацетат натрия |
109.0 ±33.5 |
62.2±3.4 |
88 2±14.3 |
128.5±35.9 |
|
Бутират натрия |
70.5±0.0 |
67.4±0.0 |
64.1±0.0 |
41.1±0.0 |
|
Глюкоза |
60.3±44 |
60.1±49 |
77 6±6.9 |
64,7±35 |
|
Сахароза |
84.3±35 |
120.1±332 |
85.5±78 |
66.6±3 4 |
|
Среда, |
лимитированная по фосфору |
|||
|
Ацетат натрия |
36.5±0.0 |
40.7±0.0 |
466.7±0.0 |
40.8±00 |
|
Бутират натрия |
31.0±0.0 |
58.9±0.0 |
312.5±0.0 |
31.1±00 |
|
Глюкоза |
84.2±0.0 |
70.1±0.0 |
64.Н0.0 |
67.2±0.0 |
|
Сахароза |
57.1±0.0 |
73.7±0.0 |
124.0±0.0 |
57.3±0.0 |
|
Среда LB |
||||
|
Полноценная среда |
31.Ш.1 |
38.6W.8 |
62.5±5.9 |
42.5±2.7 |
Сравнивали влияние различных источников углерода при росте на несбалансированных средах на накопление ПГА в клетках родококков. При вычислении Т-критсрия Вилкоксона нс было обнаружено значимых различий в накоплении этих запасных питательных веществ как при росте изученных штаммов на разных источниках углерода, так и между образованием ПГА в клетках на среде, лимитированной по азоту, и среде, лимитированной по фосфору. Наименьший р-уровень значимости составлял 0.068 при сравнении содержания ПГА в клетках родококков, выращенных на LB и среде без азота с глюкозой, сахарозой и ацетатом. без фосфора с глюкозой и сахарозой.
Была изучена морфология клеток штаммов R. erythropobs 4-1 и R. ruber П5-8 на 5< сутки культивирования на среде 2, лимитированной по азоту или фосфору, с бутиратом иж ацетатом натрия в качестве источников углерода (рис. 1-10). В клетках 7?. ruber П5-8 на среде, лимитированной как по азоту, так и по фосфору, как на бутирате, так и на ацетате натрия, в клетках заметны опалесцирующие включения ПГА (рис. 7-10). Заметное изменение морфологии/?, ruber П5-8 отмечается при росте на среде, дефицитной по азоту (рис. 7, 8). Клетки имеют неравномерные утолщения, палочки неровные, не наблюдается длинных ветвящихся клеток. Однако у R. eryihropobs 4-1 опа рованная по источникам питания, способствовала накоплению биомассы, в то время как перенос в Среду, ЛИМИТИрОБаннуЮ ПО ОДНОМ}' из источников питания, приводил к накоплению ПГА в клетках. Наибольшее количество ПГА было накоплено в клетках R. ruber П5-8 при росте на среде, лимитированной по фосфору, с ацетатом или бутиратом натрия в качестве источников углерода (табл. 1). При вычислении U-кригерия Манна-Уитни было определено, что накопление ПГА только у R. ruber П5-8 при росте на нс сбалансированных по азоту и фосфору средах значимо отличается от других штаммов (UyMIL = 11-13, р < 0.05).
лесцирующие включения отмечены только при росте на лимитированной по азоту среде (рис. 2, 3). Значительного изменения морфологии клеток этого штамма нс выявлено ни при росте без азота, ни при культивировании на бесфосфорной среде (рис. 2-5).
При сравнении урожая клеток (табл. 2) было показано, что максимальная биомасса может быть получена при двустадийном росте R. ruber П5-8 на сбалансированной среде с бутиратом натрия как источником углерода, с переносом биомассы на среду7, лимитированную по источнику фосфора, с бутиратом натрия, добавленным в избытке. Остальные значения, отражающие накопление биомассы, были близки у изученных штаммов при росте на вышеперечисленных вариантах питательных сред.
Таблица 2
Урожаи биомассы на несбалансированных средах, мг АСБ/мл
|
Вещество |
R. erythropohs 4-1 |
R. ruber П5-8 |
|
Среда, лимитированная по азоту |
||
|
Ацетат натрия |
0.28 |
0.24 |
|
Бутират натрия |
0.56 |
0,55 |
|
Глюкоза |
0.44 |
0.43 |
|
Сахароза |
0.24 |
0,64 |
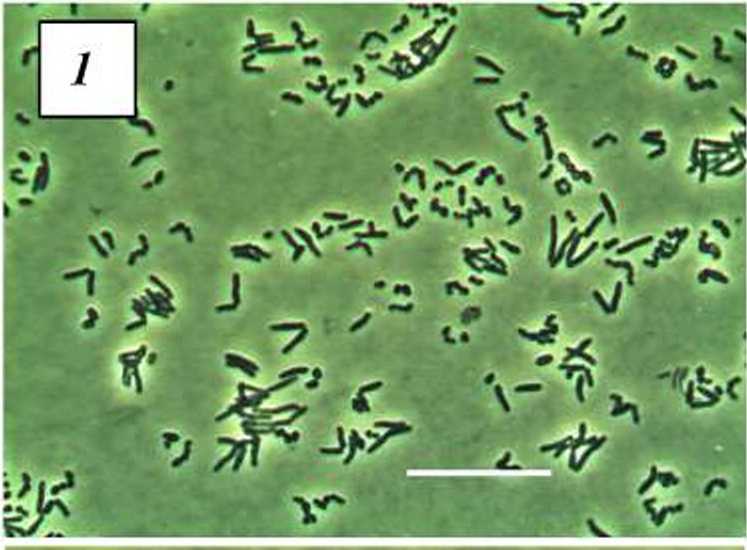
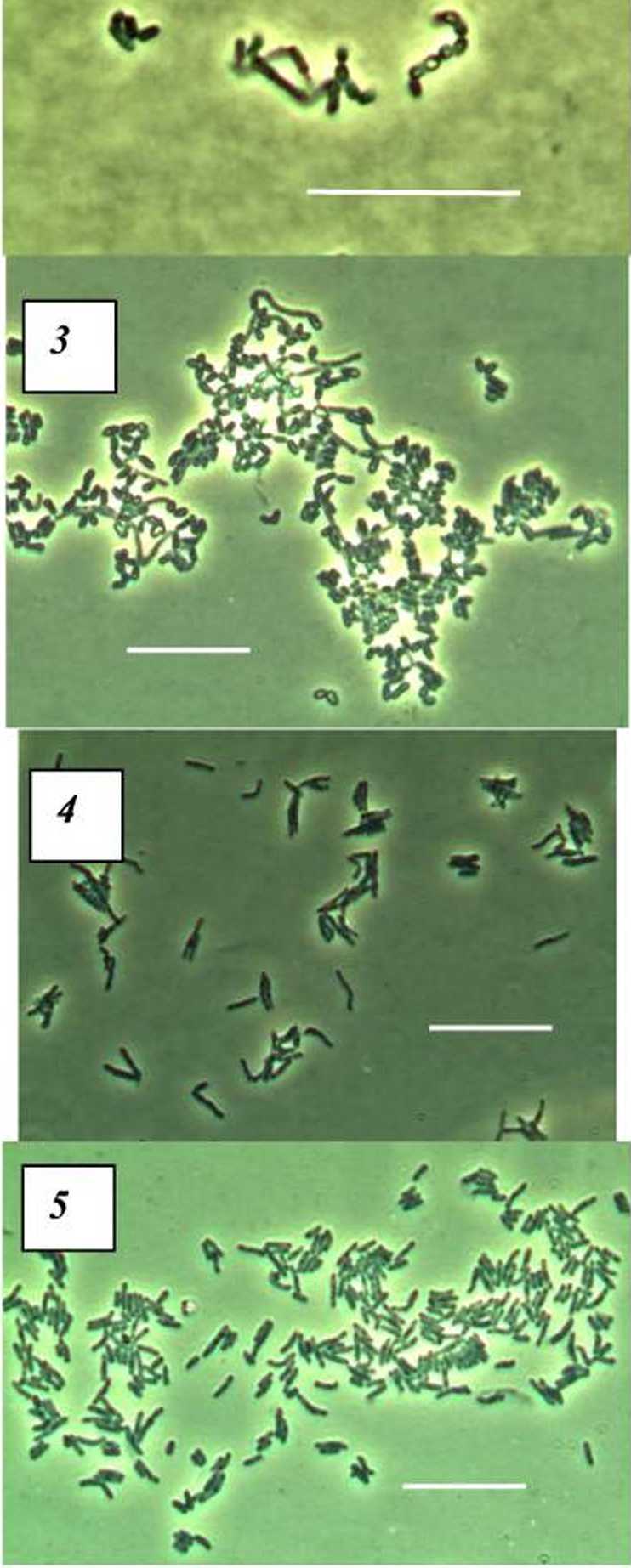
Рис. 1-10. Морфология R. erythropolis 4-1 (1-5) и R. ruber 115-8 (6-10) при росте на полноценной (LB) (1, 6) и лимитированной по азоту (2, 3, 7, 8) или фосфору (4, 5, 9, 10) средах с бутиратом натрия (2, 4, 7, 9) или ацетатом натрия (3, 5, 8, 10).
Масштабная линейка соответствует 20 мкм
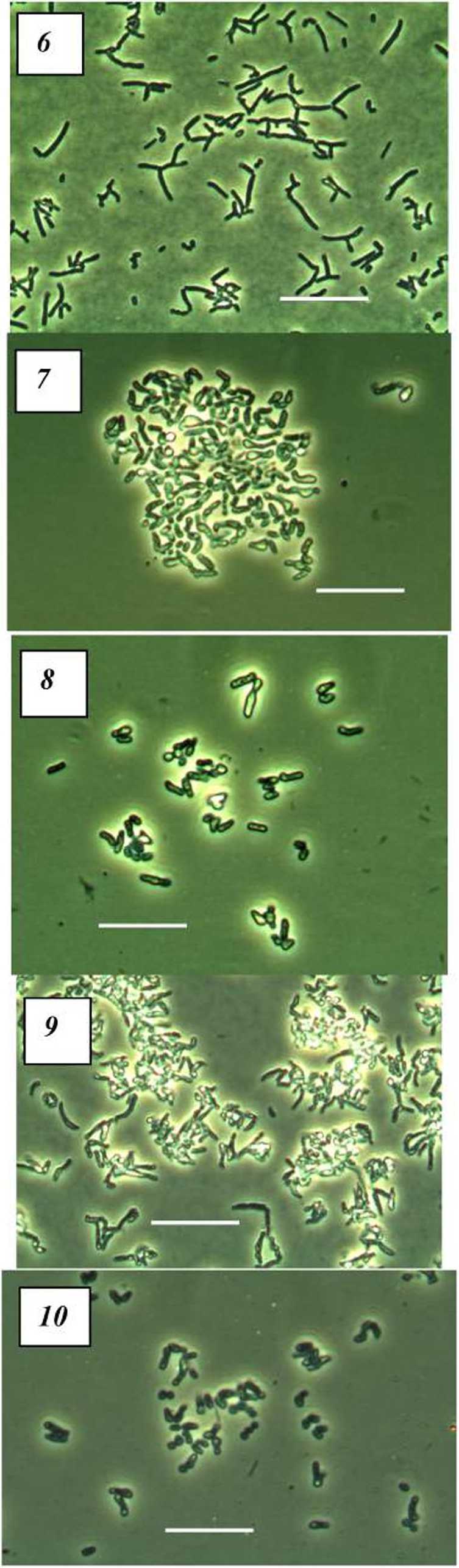
Окончание табл. 2
|
Вещество |
/?. erythropohs 4-1 |
R. ruber П5-8 |
|
Среда, лимитированная по фосфору |
||
|
Ацетат натрия |
L70 |
2.83 |
|
Бутират натрия |
2.29 |
9.41 |
|
Глюкоза |
L54 |
2.22 |
|
Сахароза |
L78 |
0.60 |
Таким образом, наиболее перспективным штаммом из изученных является R. ruber П5-8, накапливающий наибольшее количество ПГА на среде, лимитированной по фосфору. Также у этого штамма отмечаются заметные изменения морфологии клетки, связанные, по-видимому, с ростом на несбалансированной среде, и наибольшее накопление биомассы при росте на среде с бутиратом натрия, лимитированной по фосфору.
Работа поддержана Комплексной программой Уральского отделения РАН (0426-2015-0028). проект № 15-4-4-26 «Биосинтез и биокаталитическая трансформация полимерных соединений».
Список литературы Накопление полигидроксиалканоатов в клетках родококков при несбалансированном росте
- Бояндин А.Н. и др. Синтез резервных полигидроксиалканоатов светящимися бактериями//Микробиология. 2008. Т. 77, № 3. С. 364-369
- Волова Т.Г. и др. Биосинтез многокомпонентньгх полигидроксиалканоатов бактериями Wautersia eutropha//Микробиология. 2007. Т. 76, № 6. С. 797-804
- Волова Т.Г., Шишацкая Е.И. Разрушаемые биополимеры: получение, свойства, применение. Красноярск, 2011. 392 с
- Ившина И.Б. и др. Биокатализаторы многофункционального назначения на основе ресурсного потенциала коллекции алканотрофов//Инновационные биотехнологии в странах ЕвраАзЭС. Минск, 2011. С. 105-119
- Ившина И.Б., Пшеничнов Р.А., Оборин А.А. Пропанокисляющие родококки. Свердловск, 1987. 125 с
- Осипова И.А., Ремезовская Н.Б., Максимов А.Ю. Биотрансформации, катализируемые эстеразами в гетерогенных системах//Российский иммунологический журнал. 2015. Т. 9(18), № 2(1). С. 744746
- Соляникова И.П. и др. Бактерии рода Rhodococcus -перспективные деструкторы устойчивых поллютантов для очистки сточных вод//Вода: химия и экология. 2010. № 4. С. 18-26
- Anderson A.J., Dawes E.A. Occurrence, metabolism, metabolic role, and industrial uses of bacterial polyhydroxyalkanoates//Microbiological reviews. 1990. Vol. 54, № 4. P. 450-472
- Anderson A.J. et al. Biosynthesis of poIy(3-hydroxybutyrate-co-3-hydroxyvalerate) in Rhodococcus ruber//Canadian Journal of Microbiology. 1995. Vol. 41 (Suppl. I). P. 4-13
- Bengtsson S. et al. Production of polyhydroxyalkanoates by activated sludge treating a paper mill wastewater//Bioresource Technology. 2008. Vol. 99, № 3. P. 509-516
- Biros Y. et al. Effect of acetate to biomass ratio on simultaneous polyhydroxybutyrate generation and direct microbial growth in fast growing microbial culture//Bioresource Technology. 2014. Vol. 171. P. 314322
- Cavaille L. et al. Polyhydroxybutyrate production by direct use of waste activated sludge in phosphoruslimited fed-batch culture//Bioresource Technology. 2013. Vol. 149. P. 301-309
- Cha S.-H. et al. Characterization of polyhydroxyalkanoates extracted from wastewater sludge under different environmental conditions//Biochemical Engineering Journal. 2016. Vol. 112. P. 1-12
- Colombo B. et al. Polyhydroxyalkanoates (PHAs) production from fermented cheese whey by using a mixed microbial culture//Bioresource Technology. 2016. Vol. 218. P. 692-699
- Dalal J. et al. Evaluation of bacterial strains isolated from oil-contaminated soil for production of polyhydroxyalkanoic acids (PHA)//Pedobiologia. 2010. Vol. 54, № 1. P. 25-30
- Hernandez M.A. et al. Biosynthesis of storage compounds by Rhodococcus jostii RHA1 and global identificationof genes involved in their metabolism//BMC Genomics. 2008. Vol. 9. P. 600-614
- Ke Y. et al. Reactive blends based on polyhydroxyalkanoates: Preparation and biomedical application//Materials Science and Engineering C. 2016. URL: http://dx.doi.o DOI: rg/10.1016/j.msec.2016.03.114
- Kim T.-W., Park J.-S., Lee Y.-H. Enzymatic characteristics of biosynthesis and degradation of poly-β-hydroxybutyrate of Alcaligenes latus//Journal of Microbiology and Biotechnology. 1996. Vol. 6, № 6. P. 425-431
- Lee W.S. et al. Strategy for the biotransformation of fermented palm oil mill effluent into biodegradable polyhydroxyalkanoates by activated sludge//Chemical Engineering Journal. 2015. Vol. 269. P. 288-297
- Manna A., Banerjee R., Paul A.K. Accumulation of poly(3-hydroxybutyric acid) by some soil Streptomyces//Current Microbiology. 1999. Vol. 39, № 3. P. 153-158
- Matias F. et al. Polyhydroxyalkanoates production by actinobacteria isolated from soil//Canadian Journal of Microbiology. 2009. Vol. 55. P. 790-800
- Marang L. et al. Butyrate as preferred substrate for polyhydroxybutyrate production//Bioresource Technology. 2013. Vol. 142. P. 232-239
- Mozejko-Ciesielska J., Kiewisz R. Bacterial polyhydroxyalkanoates: Still fabulous?//Microbiological Research. 2016. Vol. 192. P. 271-282
- Nishioka M. et al. Production of poly-p-hydroxybutyrate by thermophilic cyanobacterium, Synechococcus sp. MA19, under phosphate-limited conditions//Biotechnology Letters. 2001. Vol. 23, № 14. P. 10951099
- Panda B., Sharma L., Mallick N. Poly-p-hydroxybutyrate accumulation in Nostoc muscorum and Spirulina platensis under phosphate limitation//Journal of Plant Physiology. 2005. Vol. 162, № 12. P. 1376-1379.
- de Philippis R. et al. Factors affecting poly-β -hydroxybutyrate accumulation in cyanobacteria and in purple non-sulfur bacteria//FEMs Microbiology Reviews. 1992. Vol. 103, № 2-4. P. 187-194
- Pieper U., Steinbuchel A. Identification, cloning and sequence analysis of the poly(3-hydroxyalkanoic acid) synthase gene of the gram-positive bacterium Rhodococcus ruber//FEMS Microbiology Letters. 1992. Vol. 75, № 1. P. 73-79
- Quillaguamtan J. et al. Synthesis and production of polyhydroxyalkanoates by halophiles: current potential and future prospects//Applied Microbiology and Biotechnology. 2010. Vol. 85, № 6. P. 1687-1696
- Ratcliff W.C., Kadam S.V., Denison R.F. Poly-3-hydr-oxybutyrate (PHB) supports survival and reproduction in starving rhizobia//FEMS Microbiology Ecology. 2008. Vol. 65, № 3. P. 391-399
- Saharan B.S., Grewal A., Kumar P. Biotechnological production of polyhydroxyalkanoates: a review on trends and latest developments//Chinese Journal of Biology. 2014. URL: http://dx.doi.o802984 DOI: rg/10.1155/2014/
- Sudesh K., Abe H., Doi Y. Synthesis, structure and properties of polyhydroxyalkanoates: biological polyesters//Progress in Polymer Science. 2000. Vol. 25. P. 1503-1555
- Trainer M.A., Charles T.C. The role of PHB metabolism in the symbiosis of rhizobia with legumes//Applied Microbiology and Biotechnology. 2006. Vol. 71, № 4. P. 377-386
- Venkateswar Reddy M. et al. Pseudomonas otitidis as a potential biocatalyst for polyhydroxyalkanoates (PHA) synthesis using synthetic wastewater and aci-dogenic effluents//Bioresource Technology. 2012. Vol. 123. P. 471-479
- Venkateswar Reddy M., Venkata Mohan S. Influence of aerobic and anoxic microenvironments on polyhydroxyalkanoates (PHA) production from food waste and acidogenic effluents using aerobic consortia//Bioresource Technology. 2012. Vol. 103, № 1. P. 313-321


