Накопление тяжелых металлов и активность антиоксидантных ферментов в пшенице при воздействии
Автор: Мурзаева С.В.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биология и экология
Статья в выпуске: 2 т.4, 2002 года.
Бесплатный доступ
Исследовали накопление тяжёлых металлов (ТМ) в зерне пшеницы при воздействии многокомпонентных загрязнителей (промышленных стоков разной степени очистки). Показано, что степень очистки стоков определяет абсолютное содержание токсических металлов: Zn, Cd, Cu, Cr, Ni, Co, Pb и Mn. Увеличение загрязненности зерна ТМ сопровождалось повышением уровня активностей антоксидантных ферментов: супероксиддисмутазы, каталазы и пероксидазы в листьях и супероксиддисмутазы, пероксидазы в корнях проростков. Обнаружено высокое отношение мембранных форм ферментов к цитозольным. Обсуждается мембранотропное воздействие многокомпонентных загрязнителей, опосредованное ТМ (через образование активных форм кислорода), которые индуцировали антиоксидантную защиту в проростках нового поколения пшеницы.
Короткий адрес: https://sciup.org/148197698
IDR: 148197698 | УДК: 628.581.13.577.7.15
Текст научной статьи Накопление тяжелых металлов и активность антиоксидантных ферментов в пшенице при воздействии
Открытые системы сброса промышленных и бытовых стоков являются многокомпонентными загрязнителями. Проблема оценки токсичности смесей загрязнителей заключается в малой изученности механизмов аддитивного, синергического и конкурентного взаимодействия составляющих вредных веществ [1]. Разнообразный состав, химическое взаимодействие и динамика изменений присутствующих компонентов усложняет проблему. Особо опасными токсичными веществами в стоках представляются тяжелые металлы (ТМ) [2]. ТМ способны метаболизировать в растениях и накапливаться в их биомассе [3]. По пищевым цепям, через растения, они попадают в организм животных и человека, вызывая терратогенное, мутагенное и канцерогенное действие [4].
В литературе обсуждаются вопросы инициирования тяжелыми металлами свободнорадикальных реакций при контакте с биологическими мембранами, приводящие к образованию активных форм кислорода (АФК) [5] и индуцированию окислительных стрессов [6]. В живых организмах существует многоуровневая система защиты от окислительного стресса, включающая специализированные антиоксидантные ферменты и низкомолекулярные антиоксиданты. Ферментные системы супероксиддисмутазы (СОД), каталазы (КАТ) и пероксидазы (ПО)
составляют первую линию защиты от окислительного стресса, регулируя уровень и устраняя излишки АФК [7]. Степень устойчивости и надежности живых систем, их старение в сильной степени зависят от активности антиоксидантных ферментов [8]. Существуют доказательства экспрессии генов СОД, КАТ и других антиоксидантных белков, индуцированных ТМ и АФК ‒ супероксидом кислорода (О-2) и перекисью водорода (Н2О2) [7, 9, 10]. С этой точки зрения, идентификация мишеней воздействия многокомпонентных загрязнителей по изменению активностей защитных антиоксидантных ферментов представляется актуальной задачей для выявления механизмов трансформации ТМ в растениях.
В настоящей работе исследовали накопление ТМ в пшенице под влиянием промышленных стоков разной степени очистки. Проведена оценка изменения генеративной и ферментативной антиоксидантной функций в проростках в зависимости от уровня загрязненности зерна токсичными ТМ.
Методика
Пшеницу (не сортовую) выращивали в вегетационных ящиках при естественном освещении на открытом воздухе. Поливали све-жеотобранными стоками 1-2 раза в неделю (1 л на 10 см2 при плотности посева семян 1
шт на см2). Контрольные варианты поливали отстоянной водопроводной водой. Использовали сточные воды завода производства минеральных удобрений разной степени очистки: А1 ‒ стоки после биологической очистки, А2 - неочищенные стоки и СМ - условно-чистые, содержащие промышленные и бытовые стоки города. Во избежание постороннего увлажнения, ночью и во время дождя, вегетационные сосуды с растениями накрывали пленкой. После созревания урожая, целые растения с корнем отмывали от почвы, высушивали и обмолачивали зерно. В отдельных частях - колосках без зерна, стеблях с листьями, корнях и молотом зерне определяли тяжелые металлы методом атомноадсорбционной спектроскопии [11].
Семена полученного урожая пшеницы проращивали в темноте, в чашках Петри на фильтровальной бумаге по 100 шт в 3-х повторностях . Увлажняли по мере подсыхания дистиллированной водой. Наклюнувшиеся семена выставляли на свет под люминостат-ные лампы (интенсивность 20 Вт м-2) и выращивали, с периодом освещения 12 ч, при температуре 20-270. Прорастание учитывали по количеству наклюнувшихся семян, биомассу - по весу зеленой массы проростков. В гомогенатах растертых листьев, определяли концентрацию хлорофилла по Вернону [12].
Цитозольные и мембранные белки выделяли из листьев и корней проростков. Навеску растительного материала, 2 г, растирали в ступке с жидким азотом в 20 мл среды, содержащей 50 мМ KH2PO4 и 0,5 мМ этилендиаминтетраацетат (ЭДТА), рН 7,8. Гомогенат листьев или корней фильтровали через четыре слоя капрона и центрифугировали 30 мин при 17000 g. Супернатант использовали для выделения цитозольных, а осадок - для выделения мембранных белков.
Супернатант пропускали через обеззоленный бумажный фильтр, растворимые белки из фильтрата осаждали сульфатом аммония до 80 % насыщения, выдерживая сутки в холодильнике. Высоленные белки отделяли центрифугированием 15 мин при 1300 g, растворяли в минимальном объеме среды, содержащей 0,01 М фосфатный буфер, рН 7,8 и
0,1 мМ ЭДТА, затем обессоливали на колонке с сефадексом g-25, уравновешенной 0,05 М Трис - ацетатным буфером, рН 8,0. В полученном элюате определяли активность растворимых цитозольных ферментов.
Мембранные белки получали из осадка ступенчатым экстрагированием, как описано в работе [13]. Первую экстракцию проводили 1 М NaCl, выдерживая раствор 1 ч при 40, непрерывно перемешивая. Экстракт отделяли центрифугированием и обессоливали на колонке с сефадексом g-25, как описано выше. Элюат содержал от 40 до 70 % мембранных ковалентно связанных белков. Оставшийся осадок обрабатывали охлажденным до -180 абсолютным ацетоном (объемное отношение осадка к ацетону 1:9), выдерживали, помешивая, 1 ч на ледяной бане, затем после осаждения на центрифуге (режим указан выше), промывали охлажденным 80 % ацетоном до полного удаления пигментов. Ацетоновые экстракты, содержащие растворимые пигменты и липиды, отбрасывали. Оставшийся осадок подсушивали под феном и из него экстрагировали липидорастворимые мембранные белки раствором, содержащим 10 мМ фосфатный буфер и 0,1 мМ ЭДТА, рН 7,8, непрерывно помешивая 1 ч при 40. Нерастворимую фракцию отделяли центрифугированием и заливали раствором 100 мМ NaOH на 1 ч при 40 для экстрагирования щелочнорастворимых мембранных белков. В результате последовательных трех экстракций удавалось наиболее полно (до 98 %) извлечь труднорастворимые мембранные белки из растений.
В экстрактах, содержащих цитозольные и мембранные белки, определяли содержание белка по методу Бредфорд [14] и активность антиоксидантных ферментов: суперок-сиддисмутазы (СОД), каталазы (КАТ), пероксидазы (ПО), как описано в работе [15]. За 1 относительную единицу активно сти СОД принято количество фермента, ингибирующее восстановление нитросинего тетразолия на 50 %, на мг белка в пробе. За единицу активности КАТ (или ПО) принято количество фермента, разрушающего 1 мкмоль Н2О2 (или ммоль) в мин на мг белка в пробе.
В работе использовали реактивы отече- ственного производства марки Х.Ч. и О.С.Ч., кроме: НАДН и ЭДТА фирмы "Reanal" (Венгрия), сефадекс g-25 средний и ФМС фирмы "Serva" (Швеция).
Результаты
В пшенице, выращенной при поливе сточными водами А1, А2 и СМ, определяли девять металлов - Fe, Mn, Cu, Zn, Cr, Co, Ni, Pb и Cd . Все эти элементы присутствуют в сточных водах, сбрасываемых в водохранилище [16] . В табл.1 представлено абсолютное содержание исследуемых элементов и их суммы ( ∑ ТМ) в четырех вариантах пшеницы (контроль, А1, А2, СМ) в целых растениях и в отдельных частях - корнях, зерне, соломе (листья + стебель и колос без зерна). Для удобства сравнения с контролем, увеличение содержания тяжелых металлов в опытных вариантах А1, А2 и СМ выделено в таблице затенением ячеек и жирным шрифтом.
Суммарное содержание элементов в целых растениях пшеницы ( ∑ ТМ) соответствует принятой классификации абсолютного содержания металлов в растениях на кг сухой массы [3, 17]: высокие концентрации (выше 100 мг) - Fe, Mn, Zn ; средние (1-100 мг) - Cu,Cr,Ni, Co, Pb и низкие (меньше 1 мг) - Сd, табл. 1. Характер распределения элементов по органам пшеницы акропетальный [3], однако, несмотря на концентрирование ТМ в корнях, они активно переходят в надземные части растений и накапливаются в зерне. Для сравнения показаны ПДК Cu, Zn, Cr, Co, Ni, Pb и Cd , допускаемые ГОСТом в зерне и кормовых [18]. Исходя из норм ПДК, можно сказать, что контрольный вариант зерна пшеницы загрязнен и неудовлетворителен по содержанию Co, Ni, Pb, а соломы - Zn, Cr . Возможно, это было связано с загрязнением почвы, которую использовали для выращивания пшеницы. По данным работы [19] в почвах нашего региона содержание этих металлов, превышает величины кларка.
Сравнивая с контролем, можно видеть, что сточные воды избирательно способствовали накоплению элементов в пшенице (целое растение). Воды А1 снижали на 27-47% содержание Cd, Pb, Co, незначительно уве- личивали - Fe, Mn, Cr, Ni. Общий уровень тяжелых металлов, ∑ТМ, под действием этих стоков был повышен только на 5 %.
Воды СМ увеличивали накопление Cd, Ni, Mn и Cu на 6-14 %, концентрации остальных металлов - уменьшали, особенно, Fe и Co (на 22 и 42 %), в итоге сумма элементов была уменьшена на 20 %.
Воды А2 способствовали накоплению всех металлов, кроме Co . Значительно увеличивали содержание Fe и Cr (на 71 и 101%). Общий уровень металлов в растениях возрастал на 67 %. Причиной тому, по-видимому, была большая загрязненность неочищенных стоков, по сравнению с двумя другими, которые частично очищаются [16 с.140].
По суммарному накоплению ТМ целыми растениями, исследуемые варианты пшеницы представляют ряд: А2 > А1 > К > СМ, что показывает зависимость действия стоков от очистки и положительное влияние условно-чистых стоков СМ. Такой же ряд соответствует загрязнению ТМ корней. Однако, при распределении металлов по другим органам пшеницы ряд накопления ∑ ТМ варьирует: в соломе - А2> А1> СМ > К, а в зерне - СМ > К > А2> А1.
Относительно накопления ТМ зерном, следует отметить, что все стоки способствовали активному транспорту из корней в зерно Zn и Mn . Стоки СМ оказывали заметное действие по продвижению Cr и Fe из корней в зерно. В данном случае превышение по железу в зерне составляло в 1,5 раза, а по хрому в 10 раз по сравнению с контролем , поэтому приоритетными загрязнителями зерна по ∑ ТМ были стоки СМ.
Оценивая фитотоксичность пшеницы в целом, отметим, что в основном, ТМ аккумулируется в корнях и, следовательно, остаются в почве. Определенная часть металлов трансформируется по растению и, в зависимости от метаболизма фотосинтезирующими органами, попадает в стебли, листья и зерно. В итоге, солома (кормовой продукт для скота) обогащена не менее чем 5-7, а зерно - 3-4 аккумулированными элементами. Среди них высоко токсичные - Zn, Cd и токсичные - Cu, Cr, Ni, Co, Pb, Mn (классификация токсично-
Таблица 1. Содержание металлов в пшенице, мг на кг сухой массы
|
Вариант пшеницы |
Органы пшеницы |
Ее |
Мп |
Си |
Zn |
Ст |
Со |
м |
РЬ |
Cd |
Ztm |
|
Контроль |
корни |
4550.8 |
117.3 |
10.4 |
44.8 |
6.1 |
2.1 |
9.9 |
2,63 |
0.13 |
4744.16 |
|
*солома |
322.3 |
76.9 |
7.2 |
52.9 |
0.74 |
1.7 |
2.5 |
0.95 |
0.23 |
465,42 |
|
|
зерно |
35.6 |
44,7 |
4,3 |
39.5 |
0,07 |
2 Л |
2.2 |
0.71 |
0Л2 |
129.3 |
|
|
целое растение |
4908.7 |
238.9 |
21,9 |
137,2 |
6.91 |
5.9 |
14.6 |
4.29 |
0,48 |
5338.88 |
|
|
Стоки А] |
корни |
4773,3 |
117.8 |
10.7 |
34.8 |
6,26 |
2.0 |
10,1 |
2,21 |
0.14 |
495731 |
|
солома |
415,8 |
82,3 |
7.0 |
46.9 |
1,08 |
1.1 |
3,6 |
0.69 |
0.1 |
558,57 |
|
|
зерно |
11,3 |
48,4 |
3,1 |
47,6 |
н/о |
н/о |
2,5 |
н/о |
0.11 |
113.01 |
|
|
целое растение |
5200,4 |
248,5 |
20.8 |
129.3 |
7,34 |
ЗД |
16,2 |
2.9 |
0.35 |
5628,99 |
|
|
Стоки А2 |
корни |
7800,4 |
139,7 |
13.2 |
42,2 |
13,02 |
3,4 |
13,7 |
2,95 |
0,14 |
8028,71 |
|
солома |
606,9 |
101,4 |
6.6 |
52.0 |
0,89 |
2,3 |
3,8 |
2,62 |
0.21 |
776,72 |
|
|
зерно |
9.7 |
54,0 |
4.4 |
49,5 |
н/о |
н/о |
2,5 |
0.54 |
0,27 |
120.91 |
|
|
целое растение |
8417,0 |
295,1 |
24,2 |
143,7 |
13,91 |
5,7 |
20,0 |
6,11 |
0,62 |
892634 |
|
|
Стоки СМ |
корни |
3433.0 |
132,8 |
11,8 |
33.9 |
5.6 |
1.0 |
9.1 |
1,69 |
0,21 |
3629,1 |
|
солома |
333,3 |
84,5 |
8,0 |
42,3 |
0,92 |
1.7 |
43 |
2,17 |
0.19 |
477,38 |
|
|
зерно |
53,0 |
55,2 |
3.6 |
52,5 |
0,2 |
0.7 |
2.2 |
н/о |
0.11 |
167,51 |
|
|
целое растение |
3819.3 |
272,5 |
23,4 |
128.7 |
6.72 |
3.4 |
15,6 |
3.86 |
0,51 |
4273.99 |
|
|
ГОСТ |
ПДК для зерна. |
- |
— |
10 |
50 |
0.35 |
0.06 |
0.7 |
0.5 |
0.1 |
|
|
1986 г |
|||||||||||
|
для кормовых |
- |
- |
30 |
50 |
0,5 |
- |
- |
3.0 |
0.5 |
Биология и экология
Таблица 2. Влияние стоков на генеративную функцию семян пшеницы
|
Вариант |
Проросло, % |
Зеленая часть |
|||
|
Рост, см |
Биомасса растений, 100 г |
Хлорофилл, мкг на мг с |
∗ Белок, ырой массы |
||
|
Контроль |
97 |
5 |
4,4 |
0,95 |
32 |
|
А 1 |
98 |
9 |
7,0 |
0,95 |
34 |
|
А 2 |
99 |
7 |
5,6 |
0,9 |
29 |
|
СМ |
98 |
8 |
5,4 |
1,0 |
37 |
Примечание: * - общий белок (мембранные + цитозольные белки). Возраст проростков 9 суток, освещение 20 Вт на м2. Приведены средние данные трех биологических опытов, хлорофилл и белок определяли в каждом опыте в двух аналитических повторностях - отклонение от среднего не превышало ± 5 %.
сти элементов по ГОСТу 1983 [20]). Качественный состав стоков и степень их очистки определяли абсолютное содержание токсикантов в органах пшеницы. Так, стоки А 1 , прошедшие биологическую очистку аккумулировали в зерне Mn, Zn и Ni , стоки А2 - Mn, Zn, Ni и Cd , а стоки СМ - Mn, Zn и Cr . Содержание Ni в зерне соответствующих вариантов превышало ПДК в 3,6 , Cd - в 2,7 , а Zn -1,05 раза. В то же время стоки А 1 и СМ ограничивали поступление в репродуктивные органы пшеницы Cd, Pb и Cu . В итоге ряд загрязнения зерна токсичными ТМ соответствует степени очистки стоков: А 2 > СМ > А 1 > К и отличается от такового по суммарному накоплению ТМ зерном, где на первое место выходили стоки СМ и контроль, а затем уже А 2 и А
Пролонгирующее действие ТМ на генеративную функцию полученных семян показано в табл.2. Оказалось, что семена всех четырех вариантов пшеницы при проращивании имели одинаковую энергию прорастания. По скорости роста и наращиванию зеленой биомассы все опытные варианты проростков опережали контроль. Наибольшие показатели по биомассе имели проростки А Впрочем, такие же результаты были получены нами при проращивании "родительских" с емян в присутствии соответствующих стоков [21]. Следовательно, те изменения, которые произошли на уровне родительских форм под воздействием стоков проявились при генерации нового поколения, но каких-либо новых морфологических отклонений обнаружено не было.
Проростки практически не различались по биохимическим показателям - содержанию хлорофилла и белка. Незначительные изменения, которые наблюдали, скорее можно расценивать как тенденцию негативного или положительного влияния соответствующих стоков на биохимические синтезы белков и пигментов в пшенице.
Главные и заметные изменения на биохимическом уровне обнаружены в антиоксидантной защите проро стков. Они проявлялись в изменении активностей ферментов СОД, КАТ и ПО. Эти ферменты присутствуют в растительной клетке в мембранах и цитозоле [13, 15,22]. На рис.1,2, 3 представлены активности мембранных и цитозольных форм ферментов в листьях и корнях исследу-
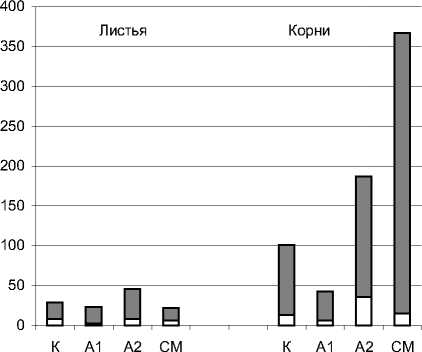
цитозоль мембраны
Рис. 1. Активность супероксиддисмутазы в проростках пшеницы
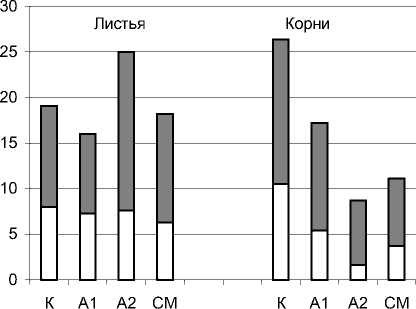
цитозоль мембраны
Рис. 2. Активность каталазы в проростках пшеницы
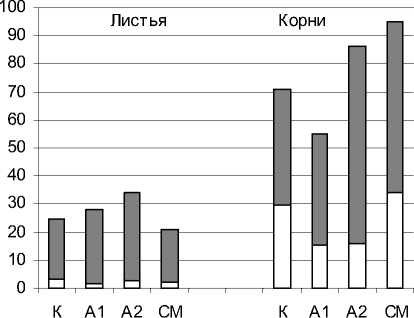
цитозоль мембраны
Рис. 3. Активность пероксидазы в проростках пшеницы
емых вариантов проростков пшеницы.
На рис.1. показаны изменения активности СОД. Характерным признаком была буль-шая активность СОД в корнях, по сравнению с листьями (в 2-16 раз) и преобладание активности мембранной формы фермента над цитозольной. В листьях отношение мембранная/цитозольная СОД варьировало в пределе 2,5-9,2 раза, в корнях - 4,2-22,8. Сравнивая с контролем, видно, что стоки А 1 повлияли на уменьшение активности фермента в листьях и корнях в 1,3 и 2,3 раза, а А2 - на увеличение - в 1,6 и 1,9 раза, соответственно. Воды СМ уменьшали активность СОД в листьях в 1,3, но увеличивали - в корнях в 3 раза. Увеличения активности связаны, в основном, с мембранной формой фермента.
В отличие от СОД, каталазная активность была выше в листьях, а не в корнях, за исключением контроля, и отмечалось наличие большей доли цитозольной формы фермента, рис.2. Отношение мембранная/цито-зольная КАТ было меньше чем для СОД (варьировало в пределе 1,2-2,3), но преобладала также мембранная форма. Увеличение активности КАТ в 1,3 раза происходило только в листьях проростков А 2 и оно было связано, в основном, с мембранной формой. В о стальных случаях наблюдали уменьшение активности КАТ - незначительное в листьях А 1 (в 1,2 раз) и более сильное в корнях
А1, А2 и СМ (в 1,5 - 3 раза).
Общая активность ПО в проростках, также как и СОД, была выше в корнях (в 2-5 раз), по сравнению с листьями, рис.3. Подобно СОД в листьях присутствовала, в основном, мембранная форма фермента и следы цитозольной. В корнях обнаруживали обе формы пероксидазы с преобладанием в 1,4 - 2,6 раза мембранной над цитозольной. Стоки А1 незначительно повышали активность ПО в листьях (в 1,1), А2 - в листьях и корнях (в 1,4 и 1,2, соответственно), а СМ - только в корнях (в 1,3 раза). Стоки СМ способствовали снижению активности фермента в листьях (в 1,2), а стоки А 1 - в корнях (в 1,3 раза).
Динамика изменения активностей ферментов в зависимости от стоков, в процентном отношении к контролю, показана в табл.3. Видно, что колебания активности СОД в про-ро стках происходили в пределе от -58 до +265, КАТ - от -67 до +30, а ПО - от -23 до +40 %. Самые большие изменения в активности под влиянием стоков происходили с СОД, особенно в корнях. Ферменты КАТ и ПО испытывали меньшие изменения. Следует также отметить соответствие увеличения или уменьшения активностей всех трех ферментов СОД, КАТ, ПО в листьях и пары СОД, ПО в корнях в зависимости от уровня, присутствующих в зерне токсичных ТМ: А2 > СМ > А 1 .
Таблица 3. Динамика изменений активностей антиоксидантных ферментов в проростках пшеницы в зависимости от стоков, %
|
Вариант |
Листья |
Корни |
||||
|
СОД |
КАТ |
ПО |
СОД |
КАТ |
ПО |
|
|
А 1 |
-23 |
-16 |
+10 |
-58 |
-35 |
-23 |
|
А 2 |
+60 |
+30 |
+40 |
+87 |
-67 |
+20 |
|
СМ |
-23 |
-5 |
-15 |
+265 |
-58 |
+30 |
± - увеличение или уменьшение по отношению к контролю.
Обсуждение результатов
Данные, представленные в настоящей работе, показывают, что в присутствии сточных вод пшеница накапливает ТМ. Характер количественных изменений распределения отдельных элементов по органам пшеницы, свидетельствуют о сложных механизмах трансформации загрязнителей в растениях. Возможно, действующим началом поглощения растениями элементов являются неорганические и органические комплексы металлов, содержащиеся в стоках и образующиеся при поступлении в органы растений. Они могли конкурировать между собой и составлять конкуренцию подвижным формам элементов используемой почвы [23-25], что можно проследить по Cd .
Подвижный элемент Cd, проявляющий повышенную мобильность в растениях [4], обнаруживался в значительных количествах во всех органах контрольного варианта пшеницы. Биологически очищенные стоки А1 снижали, а неочищенные стоки А2 и условно-чистые СМ способствовали увеличению этого элемента в целых растениях пшеницы, по сравнению с контролем. Причем, стоки СМ задерживали кадмий в корнях, а стоки А2, напротив, способствовали трансформации токсиканта по растению и накоплению в семенах. По-видимому, в стоках СМ содержались компоненты, способные связывать кадмий и ограничивать его поступление в фотосинтезирующие, а затем в репродуктивные органы растений. Это могли быть основания, сдвигающие рН в щелочную сторону и способствующие осаждению Ме [3, 18, 23]. В действительности, измерение рН стоков во время наших экспериментов показывали более щелочной показатель у СМ (рН 8-9), по сравнению со стоками А1 и А2 (рН 6-8).
Не следует исключать и конкуренцию между Ме или, образуемыми органическими комплексами с катионами металлов, стабильность которых определяется природой металла [23, 25]. Стоки СМ и А1 задерживали в корнях и листьях не только Cd , но и Cu, Pb , Mn , что уменьшало их накопление в зерне. Следовательно, репродуктивные органы пшеницы были защищены от наиболее активных ТМ, легко реагирующих с физиологически важными веществами. Cd и Pb - вызывают мутагенез [3, 4], а Cu индуцирует оксидазные системы в живых организмах [25]. В итоге, фитотоксиность зерна по загрязнению токсичными ТМ была снижена, по сравнению со стоками А2.
В работе [21] нами было показано, что во время вегетации пшеница в присутствии стоков А2 быстрее проходила все стадии развития, но отставала в росте и имела более ломкий стебель. Кроме того, эти стоки увеличивали долю уродливых растений. Вероятно, это было следствие канцерогенного действия Cd [3,4], которое, как показали данные в настоящей работе, не проявилось при проращивании новых семян. Увеличение в два раза количества этого элемента в зерне варианта А2, не вызывало каких-либо внешних морфологических нарушений в эмбриогенезе. Энергия прорастания и биологическая продуктивнсть (биомасса) проростков увеличивались (см. табл.2) и были сходны тем, что наблюдали у родительских форм [21]. Данные показывают, что при явном отсутствии внешних морфологических нарушений, в пшенице нового поколения на ранней стадии развития происходили изменения на биохимическом уровне - изменялись активнос- ти антиоксидантных ферментов: СОД, КАТ, ПО. Под действием стоков отмечается увеличение доли мембранных форм ферментов по отношению к цитозольным. Этот факт указывает на мембранотропное последействие стоков.
Увеличение загрязненности зерна токсичными ТМ приводит к повышению уровня антиоксидантной защиты в проростках. Это прослеживается по возрастанию активности трех ферментов СОД-КАТ-ПО в листьях у варианта А2 или пары - СОД-ПО в корнях вариантов А2 и СМ, см. рис.1-3, родительские растения которых имели больший уровень накопления ТМ в соответствующих органах и зерне см табл.1. Напротив, у пшеницы подверженной действию менее загрязненных сточных вод А1 (которые, в дополнение, уменьшали накопление токсичных металлов в зерне), в проростках обнаруживали уменьшение активностей СОД-КАТ-ПО в корнях и СОД-КАТ в листьях.
Функция ферментов СОД, КАТ и ПО связана с утилизацией активных форм кислорода [5]. СОД осуществляет дисмутацию супероксидного радикала (О2-.) до менее токсичной перекиси водорода [5], а Н2О2 удаляется каталазой и пероксидазой разными путями [22, 26]. КАТ разрушает избыток образуемой перекиси водорода, а ПО использует Н2О2 для окисления широкого спектра веществ, в том числе при детоксикации чужеродных соединений [26, 27]. При оксидазном механизме пероксидазы при определённых условиях могут продуцироваться О2-. и, более токсичный гидроксил радикал (ОН.) [28]. Эти формы АФК инактивируют СОД и, особенно, КАТ [29]. Есть сообщения, что и СОД может продуцировать ОН. [25, 29, 30]. Таким образом, СОД и ПО, кроме антиоксидантного, проявляют еще и прооксидативное свойство, что может способствовать развитию окислительных реакций и инициированию окислительного стресса.
Экспериментально, в работе [15], нами было показано, что развитие окислительного стресса в растениях при токсических дозах ксенобиотика сопровождается гиперусилением пероксидазной активности, в 10 и более раз, на фоне увеличения СОД в 2-3 раза. Растения при этом погибали. В настоящей работе морфологических нарушений в проростках не наблюдали, следовательно окислительный стресс на ранней стадии развития растения не испытывали. Однако индуцирование пары ферментов СОД-ПО и уменьшение каталазной активности свидетельствуют об активно протекающих окислительных реакциях в корнях проростков. Известно, что ферменты СОД и ПО участвуют в детоксикации ксенобиотиков [26, 30]. Возможно, увеличение окислительной активности связано с продолжающимися реакциями инактивирования ТМ, осажденных в виде каких либо хелатов и комплексов в мембранах клеток корней, через окислительные реакции и образование неактивных лигандов [25]. В любом случае это следует расценивать как индукцию прооксидативного действия ферментов СОД-ПО в растительных клетках тяжелыми металлами и возможность усиления окислительной активности в растениях при дальнейшем развитии.
Итак, заключая полученные данные, отметим следующее.
-
- Многокомпонентные загрязнители -сточные воды, способствуют накоплению ТМ растениями пшеницы, адсорбируя их в зерне.
-
- В проростках пшеницы семян 1-го поколения индуцируются активности антиоксидантных ферментов СОД, КАТ и ПО с высоким отношением мебранные/цитозольные формы.
-
- Уровень и качественный состав ТМ в зерне определяют мембранотропный уровень антиоксидантной защиты - СОД-КАТ-ПО в новом поколении на ранней стадии развития проростков.
-
- Увеличение активностей СОД ‒ ПО, на фоне уменьшения каталазной активности, показывают возможность прооксидативного действия антиоксидантных ферментов при токсическом воздействии ТМ.
Остается вопрос о механизме индукции антиоксидантной защиты. Был ли это синтез ферментов de novo, вызванный экспрессией генов в родительских формах растений и пе- реданный новому поколению, или это активация ферментов, связанная с защитой мембран от ТМ, накопленных зерном и трансформируемых в проростках? Оба эти механизма могут иметь место. Из литературы известно, что индукторами экспрессии генов белков, защищающих от окислительного и других стрессов, являются факторы, вызывающие соответствующий стресс, в том числе АФК (О-.2, Н2О2) и ТМ [7, 9, 10]. На наш взгляд, некоторым подтверждением синтеза ферментов de novo, по крайней мере СОД, служит сильная активация этого фермента по сравнению с КАТ и ПО. Если такое происходило у родительских форм, то продуцируемая СОД перекись водорода, не успевая разрушаться, свободно проникала в цитозоль к ядерному матриксу и, как сигнальная молекула, могла индуцировать соответствующие участки в генах [10]. Вызывает интерес закрепления этих признаков - индуцирования антиоксидантной защиты, далее в поколениях пшеницы, что безусловно способствует формированию устойчивости растений к загрязнению окружающей среды ТМ. Эти вопросы является предметом наших дальнейших исследований.


