Нанесение окрашенных декоративных покрытий на поверхность конструкционных сталей
Автор: Липкин Семен Михайлович, Кучеренко Светлана Викторовна, Жукова Ирина Юрьевна, Колчина Мария Викторовна
Журнал: Advanced Engineering Research (Rostov-on-Don) @vestnik-donstu
Рубрика: Машиностроение и машиноведение
Статья в выпуске: 4 (91) т.17, 2017 года.
Бесплатный доступ
Введение. Химическая декоративная обработка стали заключается в окрашивании стальных изделий и нанесении на поверхность оксидных пленок для создания привлекательного вида и защиты изделия от ржавчины. Окрашивание водными растворами органических соединений меди обладает особенностью: окраска покрытия меняется в зависимости от времени выдержки в растворе, что связано с изменением толщины формирующегося оксидного слоя, в котором возникают явления интерференции. Для широкого применения данного способа необходимы исследования связи режимов окрашивания с получаемым цветом покрытия. Целью настоящей работы является установление связи между окраской покрытия, получаемого из щелочных медьсодержащих растворов, и их количественным и качественным фазовым составом. Материалы и методы. Фазовый состав получаемых покрытий исследовали методом локального электрохимического анализа (ЛЭА), основанного на катодном восстановлении оксидных фаз покрытий в гальваноимпульсном режиме с помощью датчика прижимной конструкции. В полученных импульсных хронопотенциограммах рассматривали значения потенциала в момент паузы и сопоставляли эти значения со стандартными потенциалами различных редокс-пар оксидов меди. Результаты исследования. Анализируемые покрытия формировались в течение разного времени выдержки образца в растворе и имели разную окраску. Данные редокс-пары соответствуют: [Сu(OH)4]2-/Cu - адсорбционному слою гидроксокупрат-анионов на поверхности электроосажденной на сталь меди; Cu(OH)2/Cu - адсорбционному слою гидроксида меди на поверхности электроосажденной меди; Cu2О/Cu - оксидной пленке оксида меди (I) на меди. Это позволяет сделать вывод о составе цветных покрытий на исследованных образцах. Коричневая, фиолетовая и синяя пленки, формирующиеся в начальный период выдержки медного покрытия в растворе, содержат адсорбированные гидроксокупрат и гидроксид меди. Голубая, желтая и сиреневая пленки, формирующиеся более длительное время, содержат кроме этих фаз оксид меди (I). Обсуждение и заключение. Из полученных данных следует, что управление временем смены окраски, необходимое в различных технологических приложениях, может осуществляться за счет изменения концентрации сульфата меди, а также органического восстановителя. На механизм окрашивания покрытий оказывают влияние адсорбционные слои, формирующиеся на поверхности стали. Изменяя время выдержки образца в электролите, можно управлять фазовым составом адсорбционных слоев, а, следовательно, влиять на окрашиваемость покрытия.
Полихромные покрытия, декоративное окрашивание, локальный электрохимический анализ, сталь, электролит, явление интерференции, фазовый состав, время выдержки, сульфат меди, хронопотенциограмма
Короткий адрес: https://sciup.org/142211898
IDR: 142211898 | УДК: 621.793.14 | DOI: 10.23947/1992-5980-2017-17-4-83-88
Текст научной статьи Нанесение окрашенных декоративных покрытий на поверхность конструкционных сталей
Введение. Окрашивание металла является важным этапом производства многих видов металлопродукции. Оно формирует художественно-декоративный вид изделия, а также обеспечивает требуемую отражательную способность, защитные свойства и пр. [1–4]. Перспективными методами являются химическое и электрохимическое окрашивание металлов. Их преимущество — получение оригинальной цветовой гаммы покрытия за счет влияния явлений интерференции в тонких пленках, образующихся на окрашенной поверхности. Этот вид окрашивания может осу- ществляться:
-
— введением в раствор, применяемый для обработки поверхности, окислителей металлов (например, таких солей, как нитрит и нитрат натрия) [5, 6];
-
— электроосаждением на катоде [5, 6];
-
— анодированием [7–10].
Электрохимическое окрашивание можно проводить при различных режимах и в электролитах разного состава, например:
-
— электролитах, содержащих гипосульфит как окислитель и реагент для образования сульфида железа;
-
— аммиак с молибдатом аммония;
-
— уксуснокислый ацетат свинца с гипосульфитом.
Однако окрашивание в этих растворах отличается нестабильностью [1, 5]. Значительно более перспективными представляются способы окрашивания в растворах, содержащих сульфат меди и гидроксид натрия с органическими восстановителями, которые дают большое количество цветов в зависимости от времени обработки окрашиваемой поверхности [6].
Особенность окрашивания водными растворами органических соединений меди — периодическая смена окраски покрытия в зависимости от времени выдержки в растворе. Окраску связывают с изменением толщины формирующегося оксидного слоя на поверхности электроосажденной металлической меди:
Cu + CuSO 4 + 2 NaOH = Cu 2 O + Na 2 SO 4 + H 2 O .
В оксидном слое возникают явления интерференции, обусловливающие разную окраску в зависимости от толщины оксидной пленки, которая, в свою очередь, зависит от времени взаимодействия электроосажденного покрытия с ионами меди (II), находящимися в растворе. При этом, однако, не учитываются многие другие процессы, возможные в данной системе:
-
— образование адсорбционных слоев гидроксида меди (II) на поверхности медного покрытия и оксидной пленки;
-
— образование продуктов взаимодействия органического восстановителя (сахар) с гидроксидом меди;
-
— контактный обмен железа с ионами меди через поры образующегося покрытия.
В связи с этим картина цветообразования формирующихся покрытий может быть сложнее. Поэтому исследование механизмов образования цвета является актуальным и необходимым для оптимизации и управления процессом окрашивания. Известны трудности исследования тонкослойных покрытий методом рентгенофазового анализа. Значительные преимущества в этом отношении имеют электрохимические методы фазовой идентификации, основанные на восстановлении составляющих оксидных покрытий. При этом потенциал восстановления позволяет провести качественную идентификацию, а время восстановления дает возможность оценки той или иной фазы.
Целью настоящей работы является установление связи между окраской покрытия, получаемого из щелочных медьсодержащих растворов, и количественным и качественным фазовым составом формируемого покрытия.
Материалы и методы. Для приготовления 1 л электролита было взято 60 г (0,38 моль) сульфата меди, 90 г (0,26 моль) сахара и 45 г (1,13 моль) гидроксида натрия. Плотность раствора электролита 1,10 г/см 3 при 16° С. Анод — медь, катодом являлась покрываемая стальная деталь. Режим нанесения покрытия: температура электролита 25–40° С; катодная плотность тока 0,01 А/дм 2 . Изделие погружали в ванну и выдерживали под током в течение 1 мин, затем ток отключали и выдерживали деталь в электролите для нанесения покрытия (табл. 1).
Таблица 1
Table 1 Зависимость окраски покрытий от времени выдержки образца в электролите
Dependence of coating staining on time of sample exposure in electrolyte
|
№ образца |
Время нанесения медного покрытия, мин |
Цвет покрытия |
Фазовые составляющие покрытия |
|
1 |
2 |
Коричневый |
[ Сu ( OH ) 4 ]2–, Cu ( OH ) 2 |
|
2 |
2–3,5 |
Фиолетовый |
[ Сu ( OH ) 4 ]2–, Cu ( OH ) 2 |
|
3 |
3,5–5,5 |
Синий |
[ Сu ( OH ) 4 ]2–, Cu ( OH ) 2 |
|
4 |
6,5–8,5 |
Голубой |
[ Сu ( OH ) 4 ]2–, Cu ( OH ) 2 , Cu 2 O |
|
5 |
8,5–12 |
Желтый |
[ Сu ( OH ) 4 ]2–, Cu ( OH ) 2 , Cu 2 O |
|
6 |
12–13 |
Сиреневый |
[ Сu ( OH ) 4 ]2–, Cu ( OH ) 2 , Cu 2 O |
Фазовый состав получаемых покрытий исследовали методом локального электрохимического анализа (ЛЭА), основанного на катодном восстановлении оксидных фаз покрытий в гальваноимпульсном режиме с помощью датчика прижимной конструкции (площадь контакта с исследуемой поверхностью 0,5 мм 2 ). Для метода ЛЭА в качестве электролита использовали раствор гидроксида калия концентрацией 0,1 моль/л. Режим поляризации представлял собой последовательность импульсов тока, чередующихся с паузами. Длительность импульса составляла 1,5 с, паузы — 0,3 с. На каждом последующем импульсе амплитуда увеличивалась на 4 мкА, начиная с этого значения. Количество импульсов — 30. Из полученных импульсных хронопотенциограмм рассматривали значения потенциала в момент паузы и сопоставляли эти значения со стандартными потенциалами различных редокс-пар оксидов меди [7]. Количество соответствующих фаз определяли по длине участка (рис. 1), находящегося в выделенном диапазоне потенциалов.
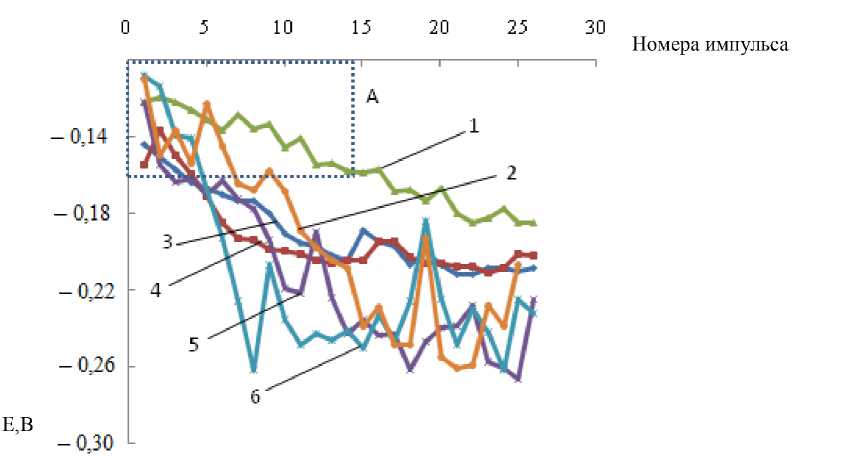
Рис. 1. Результаты измерений в моменты окончания пауз потенциалов (Е, измеряется в вольтах — В) исследуемых образцов с покрытиями разных цветов: 1 —синего, 2 — сиреневого, 3 — коричневого, 4 — фиолетового, 5 — голубого, 6 —желтого
Pic. 1. Measurement results at the terminal time of potentials pauses (E, measured in volts – B) of test samples with coatings of different colors: 1 – blue, 2 – lilac, 3 – brown, 4 – violet, 5 – blue, 6 – yellow
Например, для покрытия синего цвета протяженность участка в интервале потенциалов –0,1÷–0,16 В ограничивается номером импульса, который соответствует достижению потенциала –0,16 В (зона А на рис. 1).
Обсуждение и результаты. Анализируемые покрытия формировались в течение разного времени выдержки образца в растворе и имели разную окраску (табл. 1).
На рис. 1 представлены результаты измерений потенциалов покрытий исследуемых образцов в моменты окончания пауз, полученные с помощью метода ЛЭА.
Машиностроение и машиноведение
Как следует из полученных данных, в покрытиях присутствуют в разных соотношениях 3 вида фаз ([ Си ( OH) 4 ]2-, Cu ( OH ) 2 , Си 2 O ), восстанавливающихся в диапазонах потенциалов -0,1 --0,16 В, -0,16 --0,22 В и - 0,22 - -0,26 В (относительно нормального водородного электрода (н. в. э.) [7]. Имеющиеся нерегулярности связаны с неупорядоченным расположением фаз по глубине покрытия. С выделенными диапазонами потенциалов можно сопоставить следующие редокс-потенциалы пар оксидов и гидроксидов меди.
Диапазон -0,1 --0,16В: [ Си ( OH ) 4 ]2- + 2 е = Си +4 ОН -; Е 0 = -0132 B.
Диапазон -0,16 --0,23 В: Си ( OH ) 2 + 2 е = Си + 2 OH -; Е 0 = -0,226 B.
Диапазон менее -0,23 В: Си 2 O + H 2 O + 2 е = 2 Си + 2 OH -; Е 0 = -0,365 B.
Данные редокс-пары соответствуют:
— [ Си ( OH) 4]2-/ Си — адсорбционному слою гидроксокупрат-анионов на поверхности электроосажденной на сталь меди;
— Си ( OH) 2 / Си — адсорбционному слою гидроксида меди на поверхности электроосажденной меди;
— Си 2 О / Си — пленке оксида меди (I) на меди.
Таким образом, можно сделать вывод о составе цветных покрытий на исследованных образцах. Коричневая, фиолетовая и синяя пленки, формирующиеся в начальный период выдержки медного покрытия в растворе, содержат адсорбированные гидроксокупрат и гидроксид меди (II) (см. табл. 1). Голубая, желтая и сиреневая пленки, формирующиеся более длительное время, содержат кроме этих фаз оксид меди (I). Это соответствует определенной последовательности стадий формирования покрытий:
— электроосаждение меди;
-
— образование адсорбционных слоев на электроосажденном покрытии из гидроксокупрата и гидроксида меди (II);
-
— взаимодействие адсорбционных слоев с органическим восстановителем (медленно) с образованием оксида меди (I).
Относительное количество каждой из идентифицированных фаз рассчитывалось в единицах длины участка восстановления (количество точек, принадлежащих интервалам потенциалов восстановления, N i ) и в относительных единицах (долях по отношению к общей длине кривой восстановления, X i ):
X = N^ 1 Е N
Результаты расчетов вместе с длиной волны, соответствующей цвету покрытия, приведены в табл. 2.
Таблица 2
Table 2 Состав цветных покрытий
Color coating composition
Характеристики окрашенных покрытий Количество фаз покрытия в единицах Цвет Соответствующая длина волны, нм длины участка восстановления, Ni относительных, Xi- Си (OH) 2 [ Си (OH) 4]2 Си 2 O Си (OH) 2 [ Си (OH) 4]2 Си 2 O Коричневый 602,5 23 3 0 0,885 0,115 0 Фиолетовый 415 22 4 0 0,846 0,154 0 Синий 465 13 13 0 0,5 0,5 0 Голубой 495 7 6 13 0,269 0,231 0,5 Желтый 580 5 2 19 0,192 0,077 0,731 Сиреневый 480 8 9 9 0,308 0,346 0,346
Как следует из приведенных данных, связь количества фаз с длиной волны целесообразно рассматривать для двух групп: содержащих оксид меди (I) и не содержащих его. Для группы «голубой, желтый, сиреневый» окраску формирует оксид меди (I), образующийся за счет восстановления Си ( OH) 2 и [ Си ( OH) 2]2 органическим восстановителем. Длина волны, соответствующая цвету покрытия, определяется относительным количеством Си 2 O . Формирование окраски покрытия адсорбированным комплексом меди на начальных стадиях процесса происходит, по -видимому, за счет смешивания цвета слоя электроосажденной меди с цветом адсорбционных слоев Си ( OH) 2 и [ Си ( OH) 4]2-, в связи с чем длина волны, соответствующая цвету покрытия, зависит от относительного количества гидроксокомплекса.
Из полученных данных следует, что управление временем смены окраски, необходимое в различных технологических приложениях, может осуществляться за счет изменения концентрации сульфата меди, а также органического восстановителя.
Выводы. На механизм окрашивания покрытий в электролите оказывают влияние адсорбционные слои, формирующиеся на поверхности стали. Изменяя время выдержки стального образца в щелочном медьсодержащем элек- тролите, можно управлять фазовым составом адсорбционных слоев, и, следовательно, влиять на окрашиваемость покрытия.
-
1. Шлугер, М. А. Гальванические покрытия в машиностроении / М. А. Шлугер, Л. Д. Тока. — Москва : Машиностроение, 1985. — 248 c.
-
2. Способ нанесения цветного защитно-декоративного покрытия с рисунком : патент 2154124 Рос. Федерация : C23C14/04 / И. И. Колесова, М. Д. Парфенов. — № 97100079/02 ; заявл. 06.01.97 ; опубл. 10.08.2000, Бюл. № 22. — 3 с.
-
3. Decorative Coatings of Crystallite Type on Metallic and Non-metallic Surfaces / M. S. Satayev [et al.] // Asian journal of chemistry. — 2013. — Vol. 25, № 18. — Р. 10329–10331.
-
4. Способ нанесения декоративных медных покрытий : заявка на изобретение Рос. Федерация : С25D 3/38 / Г. Н. Шутик [и др.]. — № 2000111796/02 ; опуб. 10.04.02. — 1 с.
-
5. Дасоян, М. А. Технология электрохимических покрытий / М. А. Дасоян. —Москва : Машиностроение, 1989. — 391 с.
-
6. Вансовская, К. М. Металлические покрытия, нанесенные химическим способом / К. М. Вансовская ; под ред. П. М. Вячеславова. — Ленинград : Машиностроение, 1985. — 103 с.
-
7. Кучеренко, С. В. Химическое окрашивание стали как декоративная обработка покрытия / С. В. Кучеренко, И. С. Иванина, Ю. А. Абраменко // Новая наука: современное состояние и пути развития. — 2015. — № 6-3. — С. 183–186.
-
8. Чумакова, Е. А. Оксидирование изделий из нержавеющих сталей для их интерференционного окрашивания / Е. А. Чумакова, Р. А. Мирзоев, И. К. Боричева // Тр. Санкт-Петербургского политехн. ун-та Петра Великого. — 2009. — № 510. — С. 62–69.
-
9. Износостойкое декоративное черное покрытие на титановых сплавах, получаемое методом микродугового оксидирования / А. Г. Ракоч [и др.] // Изв. высших учебных заведений. Порошковая металлургия и функциональные покрытия. — 2016. — № 1. — С. 44–50.
-
10. Износостойкие защитно-декоративные покрытия на алюминии и его сплавах / А. Н. Болотов [и др.] // Механика и физика процессов на поверхности и в контакте твердых тел, деталей технологического и энергетического оборудования. — 2010. — № 3. — С. 179–181.
Список литературы Нанесение окрашенных декоративных покрытий на поверхность конструкционных сталей
- Шлугер, М. А. Гальванические покрытия в машиностроении/М. А. Шлугер, Л. Д. Тока. -Москва: Машиностроение, 1985. -248 c.
- Способ нанесения цветного защитно-декоративного покрытия с рисунком: патент 2154124 Рос. Федерация: C23C14/04/И. И. Колесова, М. Д. Парфенов. -№ 97100079/02; заявл. 06.01.97; опубл. 10.08.2000, Бюл. № 22. -3 с.
- Decorative Coatings of Crystallite Type on Metallic and Non-metallic Surfaces/M. S. Satayev //Asian journal of chemistry. -2013. -Vol. 25, № 18. -Р. 10329-10331.
- Способ нанесения декоративных медных покрытий: заявка на изобретение Рос. Федерация: С25D 3/38/Г. Н. Шутик . -№ 2000111796/02; опуб. 10.04.02. -1 с.
- Дасоян, М. А. Технология электрохимических покрытий/М. А. Дасоян. -Москва: Машиностроение, 1989. -391 с.
- Вансовская, К. М. Металлические покрытия, нанесенные химическим способом/К. М. Вансовская; под ред. П. М. Вячеславова. -Ленинград: Машиностроение, 1985. -103 с.
- Кучеренко, С. В. Химическое окрашивание стали как декоративная обработка покрытия/С. В. Кучеренко, И. С. Иванина, Ю. А. Абраменко//Новая наука: современное состояние и пути развития. -2015. -№ 6-3. -С. 183-186.
- Чумакова, Е. А. Оксидирование изделий из нержавеющих сталей для их интерференционного окрашивания/Е. А. Чумакова, Р. А. Мирзоев, И. К. Боричева//Тр. Санкт-Петербургского политехн. ун-та Петра Великого. -2009. -№ 510. -С. 62-69.
- Износостойкое декоративное черное покрытие на титановых сплавах, получаемое методом микродугового оксидирования/А. Г. Ракоч //Изв. высших учебных заведений. Порошковая металлургия и функциональные покрытия. -2016. -№ 1. -С. 44-50.
- Износостойкие защитно-декоративные покрытия на алюминии и его сплавах/А. Н. Болотов //Механика и физика процессов на поверхности и в контакте твердых тел, деталей технологического и энергетического оборудования. -2010. -№ 3. -С. 179-181.


