Наночастицы Fe в сочетании с аминокислотами изменяют продуктивные и иммунологические показатели у цыплят-бройлеров
Автор: Яушева Е.В., Мирошников С.А., Косян Д.Б., Сизова Е.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Наночастицы металлов: биологические эффекты
Статья в выпуске: 6 т.51, 2016 года.
Бесплатный доступ
Известны работы, показывающие перспективы применения наночастиц металлов в качестве препаратов, стимулирующих продуктивность сельскохозяйственных животных. В то же время наноформы проявляют различные негативные свойства, например обладают прооксидантным эффектом, провоцируют апоптоз, поражение почек. Возможный подход заключается в применении ультрадисперсных веществ в сочетании с агентами, нивелирующими неблагоприятные последствия применения наноформ. Мы впервые изучили перспективы совместного использования препаратов наночастиц железа и аргинина, механизм их взаимодействия и влияния на продуктивность сельскохозяйственной птицы и показали, что их одновременное применение способствует повышению прироста живой массы. Цыплятам-бройлерам кросса Смена 8, из которых в возрасте 11 сут сформировали 6 групп (по n = 28), на фоне 2-кратных инъекций наночастиц железа (с интервалом 2 нед) в состав рациона дополнительно включали аргинин (известно, что эта аминокислота проявляет различные метаболические и иммунологические эффекты и считается условно незаменимой при воспалительных и окислительных стрессах) или смесь аргинина, лизина и метионина. Как оказалось, при совместном применении наночастиц железа с аргинином происходило увеличение показателей живой массы (разница до 9,2 % в сравнении с контролем), а сочетание наночастиц железа со смесью аминокислот улучшало этот результат (прибавка до 20 %), тогда как их раздельное использование приводило к меньшему приросту живой массы (во II и III группах к окончанию эксперимента она увеличивалась соответственно на 6,1 и 5,9 %, Р £ 0,05). Внутримышечное введение наночастиц железа способствовало развитию иммунного ответа, что выражалось в активизации синтеза лейкоцитов в III, IV и VI группах в первые сутки эксперимента соответственно на 8,12; 10,50 и 3,88 % (Р £ 0,05) в сравнении с контролем, через 1 нед - соответственно на 7,30; 8,19 и 4,00 % (Р £ 0,05). При определении содержания NO-метаболитов выявили увеличение этого показателя в крови и тканях печени только в III, IV и VI группах (на 3-4 %). Внутримышечные инъекции наночастиц железа сопровождались изменением обмена аргинина в организме птицы, что выражалось в увеличении его содержания на 3,83 % (Р £ 0,05) у особей в III группе. Отмечается, что совместное применение препарата наночастиц железа и комплекса аргинина с другими аминокислотами наиболее целесообразно при производстве мяса птицы.
Наночастицы железа, аргинин, no-метаболиты, цыплята-бройлеры, интенсивность роста, химические элементы, биохимические и морфологические показатели крови
Короткий адрес: https://sciup.org/142213996
IDR: 142213996 | УДК: 636.52/.58:636.087.7:[546.72-022.532+577.112.3 | DOI: 10.15389/agrobiology.2016.6.912rus
Текст научной статьи Наночастицы Fe в сочетании с аминокислотами изменяют продуктивные и иммунологические показатели у цыплят-бройлеров
Поиск веществ с ростостимулирующим действием относится к актуальным направлениям сельскохозяйственной биологии. Ряд работ указывают на перспективы применения наночастиц металлов в качестве препаратов для повышения продуктивности сельскохозяйственных животных (1, 2). Сообщается, что наночастицы эссенциальных металлов значительно превосходят аналоги в форме минеральных солей по биодоступности (3), характеризуются менее выраженным токсическим действием (4), с чем связывают перспективность их использования в качестве источников микроэлементов (5).
Однако наночастицы имеют ряд недостатков — стимулируют продукцию активных форм кислорода (6, 7), апоптоз (8) и структурно-функциональную реорганизацию тканей (9), провоцируют поражение почек (10), влияют на элементный статус органов и тканей (11). Тем не менее, комплекс мер по нивелированию негативных эффектов наночастиц микроэлементов может сделать практическое применение таких ультрадисперс-
∗ Исследования выполнены при финансовой поддержке Российского научного фонда (проект ¹ 14-1600060). Гематологические исследования проводились по стандартизированным методикам в лаборатории «Агроэкология техногенных наноматериалов» и Испытательном центре ФГБНУ Всероссийского НИИ мясного скотоводства (аттестат аккредитации RA. RU.21ПФ59 от 02.12.15).
ных веществ возможным.
Ранее мы показали, что поступление в организм животного наночастиц железа сопряжено с повышением содержания аргинина в печени (12). Механизм этого пока неясен. Известно, что аргинин проявляет различные метаболические и иммунологические эффекты и считается условно незаменимым при воспалительных и окислительных стрессах (13, 14). В то же время аргинин — один из факторов, участвующих в регуляции роста животных (15). Механизмы запуска синтеза аргинина тесно связаны с пролиферацией белых клеток крови и активацией NO-синтетазы. Примечательно, что гомеостаз железа также тесно сопряжен с гомеостазом NO-метаболитов (16). Об использовании аргинина для снижения негативных последствий от поступления в организм наночастиц цинка сообщали в своих публикациях L.M. Faddah с соавт. (17).
В представляемой работе впервые показано, что включение аргинина в рацион в сочетании с внутримышечными инъекциями наночастиц железа повышает продуктивность сельскохозяйственной птицы эффективнее, чем каждый из этих приемов по отдельности.
Нашей целью было изучение перспектив совместного применения препаратов наночастиц железа с аргинином и другими аминокислотами, механизма их взаимодействия и влияния на показатели продуктивности у сельскохозяйственной птицы.
Методика . Были использованы наночастицы (НЧ) железа с размером d = 80±5 нм (частицы представляют собой ядро из кристаллического железа с оксидной оболочкой Fe3O4 на поверхности). Препараты наночастиц получали методом высокотемпературной конденсации на установке МиГен (Институт энергетических проблем химической физики РАН, г. Москва). Материаловедческая аттестация препаратов включала электронную сканирующую и просвечивающую микроскопию на JSM 7401F и JEM-2000FX («JEOL», Япония), рентгенофазовый анализ на дифрактометре ДРОН-7 (НПП «Буревестник», Россия), атомно-силовую микроскопию на мульти-микроскопе СММ-2000 (ОАО «ПРОТОН-МИЭТ», Россия). Препараты железа для инъекций готовили смешиванием наночастиц с физраствором, после чего подвергали УФ-стерилизации и обрабатывали в течение 30 мин на ультразвуковом диспергаторе УЗДН-2Т («НПП Академ-прибор», Россия) (35 кГц; 300-450 Вт, амплитуда колебаний 10 мкм).
В качестве препаратов аминокислот использовали метионин кормовой (ОАО «Волжский Оргсинтез», Россия); монохлоргидрат лизина («Ha-ngzhou Greensky Biological Tech Co., Ltd», Китай) и гидрохлорид аргинина («Tianjin Tiyanyan Pharmaceutical Сo., Ltd», Китай).
Опыты проводили в условиях вивария (Оренбургский государственный университет) на цыплятах-бройлерах кросса Смена 8. Содержание птицы и процедуры при выполнении экспериментов соответствовали требованиям инструкций и рекомендациям российского регламента (Приказ МЗ СССР ¹ 755 от 12.08.1977) и «The Guide for Care and Use of Laboratory Animals (National Academy Press, Washington, D.C., 1996)». Были предприняты все усилия, чтобы свести к минимуму страдания животных и уменьшить число используемых образцов. Для эксперимента отобрали 11-суточных цыплят ( n = 168), которых методом пар-аналогов разделили на 6 групп (по n = 28). В возрасте 15 и 29 сут птице из III, IV и VI групп внутримышечно вводили лиозоли наночастиц (НЧ) Fe (2 мг/кг живой массы) (18). Птице во II и IV группах, начиная с 15-суточного возраста, ежедневно к основному рациону (ОР) добавляли аргинин в дозе 7 г/кг корма (19). Цыплятам из V и VI групп в ОР вводили аргинин (7 г/кг), лизин (6 г/кг) и метионин (2 г/кг).
В контроле (I группа) птица получала ОР. Рационы формировали с учетом рекомендаций по кормлению (20).
В течение эксперимента вся птица содержалась в одинаковых условиях, микроклимат в помещении соответствовал рекомендациям и требованиям ВНИТИП (21). Кормление проводили дважды в сутки, учет поеда-емости корма контролировали ежесуточно. Поение осуществлялось вволю. Оценивали рост и развитие цыплят (осмотр и индивидуальные взвешивания). Декапитации птицы под нембуталовым эфиром производили на 1-е, 7-е и 14-е сут. Образы крови для гематологических исследований отбирали в вакуумные пробирки с антикоагулянтом (EDTA-К3), для биохимических исследований — в вакуумные пробирки с активатором свертывания (тромбин).
Гематологические показатели (число и вид лейкоцитов) учитывали на автоматическом гематологическом анализаторе URIT-2900 Vet Plus ( « URIT Medical Electronic Group Co., Ltd», Китай).
Концентрацию NO-метаболитов (суммарное количество нитрат- и нитрит-ионов) в плазме крови определяли спектрофотометрически с реактивом Грисса на микропланшетном анализаторе Infinite PROF200 («Tecan Austria GmbH», Австрия) при X = 540 нм. Предварительно кровь депротеинизировали добавлением к 1 мл 2-кратного избытка 96 % этилового спирта. Поскольку метод позволяет определять только нитрит-ионы, для восстановления нитратов в нитриты к плазме добавляли хлорид ванадия (III), после чего пробирки помещали на водяную баню (37 °С, 30 мин). Полученные результаты измерения оптической плотности образцов сравнивали с калибровочной кривой. Для ее построения готовили серию разведений раствора NaNO2 (от 5 до 100 мкМ) и обрабатывали пробы аналогично опытным образцам (21). Так же определяли NO-метаболиты в образцах тканей. В этом случае пробоподготовка включала обработку биоматериала в фосфатном буферном растворе (рН 7,45) на гомогенизаторе TissueLyser LT («Qiagen N.V.», Германия).
При изучении аминокислотного состава тканей птицы и кормов учитывали массовую долю аргинина, лизина, метионина, тирозина, фенилаланина, гистидина, лейцин-изолейцина, валина, пролина, треонина, серина, аланина и глицина. При подготовке тканей печени и проб корма материал гомогенизировали (TissueLyser LT, «Qiagen N.V.», Германия), высушивали при 60-70 °С и измельчали. Исследуемые образцы подвергали кислотному или щелочному (только для определения триптофана) гидролизу при температуре 110 °С в течение 14-16 ч. По окончании кислотного гидролиза пробы фильтровали (обеззоленные медленно фильтрующие фильтры «синяя лента», ООО «МЕЛИОР ХХI», Россия), после щелочного гидролиза фильтрацию не проводили. Гидролизаты смешивали с реактивами (карбонат натрия, АО «Башкирская содовая компания», Россия; фе-нилизотиоционат, «Shandong Hailan Chemical Industry Co., Ltd», Китай) и выпаривали в струе теплого воздуха. Сухой остаток разводили в дистиллированной воде (0,5 мл) и центрифугировали (5 мин, 5000 об/мин). Полученную надосадочную жидкость исследовали методом капиллярного электрофореза с использованием системы Капель (ООО «Люмэкс-Мар-кетинг», Россия; ГОСТ 55569-2013).
Данные представлены как среднее арифметическое ( M ) со стандартной ошибкой среднего ( m ). Статистический анализ выполняли с использованием методик ANOVA (программный пакет Statistica 10.0, «StatSoft Inc.», США). Различия считали статистически значимыми при Р < 0,05.
Результаты . Повышение содержания аргинин в рационе II группы сопровождалось увеличением живой массы птицы в сравнении с контролем 914
на 4,0 % через 1 сут, на 5-6 % — через 2 нед и на 6,1 % (Р ≤ 0,05) к завершению исследования (табл. 1). Внутримышечная инъекция препарата Fe НЧ цыплятам из III группы привела к увеличению живой массы на 6,2 % (Р ≤ 0,05) в сравнении с контролем в 1-е сут, на 9,4 % (Р ≤ 0,05) — к 4-м сут. На 2-ю нед наблюдалось снижение прироста до 3,5 % относительно контрольного. Повторная инъекция наночастиц спустя 2 нед, как и первая, повышала живую массу в III группе — на 5,9 % (Р ≤ 0,05) в сравнении с контролем через 1 сут. Эта разница практически сохранялась в течение 2 нед, и к окончанию эксперимента в III группе соответствующий показатель превышал контрольный на 7,1 % (Р ≤ 0,05). В IV группе сочетание инъекций Fe НЧ с добавлением дополнительного количества аргинина в рацион способствовало, как и в III группе, схожим изменениям по живой массе в 1-ю нед исследований. Так, в IV группе эти показатели через 1 сут превышали контрольные на 7,8 % (Р ≤ 0,05), через 1 нед — на 7,5 % (Р ≤ 0,05). В течение 2-й нед цыплята из IV группы превосходили контрольных по приросту массы (увеличение на 6,0 %, Р ≤ 0,05). Повторное введение Fe НЧ усилило прирост живой массы, и к концу исследования разница между бройлерами из IV и контрольной групп по массе достигала 9,2 % (Р ≤ 0,05).
1. Динамика живой массы (г) у бройлеров кросса Смена 8 при внутримышечных инъекциях наночистиц (НЧ) Fe на фоне кормовых добавок аминокислот ( M ± m , n = 7, опыт в условиях вивария)
|
Группа по вариантам опыта 1 |
1-я нед |
1 2-я нед |
3-я нед |
|
I (контроль, OР) |
886,6±14,9 |
1268,0±17,4 |
1608,1±23,6 |
|
II (ОР + аргинин) |
835,1±9,21 |
1347,9±19,5 |
1663,6±17,9* |
|
III (ОР, инъекции Fe НЧ) |
868,8±8,69* |
1312,8±12,7* |
1672,7±20,3 |
|
IV (ОР + аргинин, инъекции Fe НЧ) |
866,2±6,32* |
1344,1±11,5* |
1693,3±15,4* |
|
V (ОР + аргинин + лизин + метионин) |
905,9±8,39* |
1392,2±10,8* |
1775,0±16,3* |
|
VI (ОР + аргинин + лизин + метионин, инъекции Fe НЧ) |
924,0±10,3* |
1431,6±14,7* |
1937,2±13,8* |
|
П р и м е ч а н и е. ОР — основной рацион. * Различия с контролем достоверны при Р ≤ 0,05. |
Совместное использование наночастиц железа и смеси аминокислот оказалось оптимальным: к окончанию эксперимента живая масса цыплят в VI группе на 20,5 % (Р ≤ 0,001) превысила показатель в контроле и была на 9,1 % (Р ≤ 0,01) больше, чем в V группе, что демонстрирует хорошо выраженный синергизм в воздействии этих веществ на рост птицы. Известно, что метионин активно участвует в обменных процессах, в частности увеличивает всасываемость железа в желудочно-кишечном тракте. Сочетание метионина и аргинина эффективно в отношении роста продуктивности (22). Лизин и аргинин — антагонисты, однако при совместном действии они стимулируют продукцию гормона роста. Часть энергии, необходимой для белкового синтеза, образуется за счет окисления лизина (23). Этим объясняются ярко выраженные эффекты при совместном использовании Fe НЧ с комплексом аминокислот аргинина, лизина и метионина.
Анализ морфологических и биохимических показателей крови выявил изменения только в группах, которым вводили препараты наночастиц железа (табл. 2). Так, в III, IV и VI группах число лейкоцитов возрастало в 1-е сут соответственно на 8,12; 10,5 и 3,88 % (Р ≤ 0,05) в сравнении с контролем, через 1 нед — на 7,30; 8,19 и 4,00 % (Р ≤ 0,05), а через 2 нед существенных различий с контролем не отмечали. Аналогичные изменения показателей наблюдали в отношении отдельных видов лейкоцитов.
В III, IV и VI группах содержание лимфоцитов через 1 сут увеличивалось относительно контроля соответственно на 3,63; 5,91 и 2,20 % (Р ≤ 0,05), моноцитов — на 15,40; 17,90 и 10,20 % (Р ≤ 0,05), гранулоци- тов — на 13,10; 15,60 и 5,24 % (Р ≤ 0,05). Через 1 нед в этих группах число лимфоцитов достоверно повышалось на 10,90; 10,90 и 5,40 % (Р ≤ 0,05), моноцитов — только на 4,30; 2,47 и 2,47 % (Р ≤ 0,05), гранулоцитов — на 3,61; 5,25 и 2,55 % (Р ≤ 0,05).
2. Динамика содержания (½109/л) белых клеток крови у бройлеров кросса Смена 8 при внутримышечных инъекциях наночистиц (НЧ) Fe на фоне кормовых добавок аминокислот ( M ± m , n = 7, опыт в условиях вивария)
|
Группа 1 |
Лейкоциты 1 |
Лимфоциты 1 |
Моноциты |
^ Гранулоциты |
|
I (контроль) |
22,2±0,58 |
Н а 1-е сут 12,1±0,02 |
1,37±0,040 |
8,69±0,700 |
|
II |
21,7±1,07 |
12,7±0,32 |
1,34±0,030 |
7,63±1,360 |
|
III |
23,9±0,08* |
12,6±0,02* |
1,58±0,010* |
9,83±0,030* |
|
IV |
24,5±0,12* |
12,8±0,01* |
1,61±0,050* |
10,05±0,110* |
|
V |
22,6±0,31 |
12,3±0,23 |
1,35±0,020 |
8,98±0,430 |
|
VI |
23,0±0,03* |
12,4±0,03* |
1,50±0,020* |
9,15±0,050* |
|
I (контроль) |
25,2±0,62 |
Н а 7-есут 13,2±0,29 |
1,62±0,070 |
10,50±0,440 |
|
II |
25,8±0,63 |
13,2±0,22 |
1,77±0,020 |
10,80±0,410 |
|
III |
27,1±0,06* |
14,6±0,10* |
1,69±0,020* |
10,80±0,130* |
|
IV |
27,3±0,08* |
14,6±0,09* |
1,66±0,010* |
11,00±0,050* |
|
V |
25,9±0,63 |
13,4±0,40 |
1,76±0,050 |
10,80±0,180 |
|
VI |
26,2±0,04* |
13,8±0,10* |
1,66±0,020* |
10,70±0,060* |
|
I (контроль) |
25,5±0,29 |
Н а 14-е сут 12,9±0,26 |
2,01±0,020 |
10,50±0,100 |
|
II |
25,0±0,37 |
13,2±0,23 |
1,89±0,010 |
9,94±0,260 |
|
III |
26,1±0,28 |
13,8±0,27 |
2,01±0,030 |
10,30±0,100 |
|
IV |
26,2±0,29 |
13,7±0,39 |
2,04±0,020 |
10,50±0,090 |
|
V |
26,0±0,12 |
13,5±0,14 |
2,00±0,030 |
10,50±0,150 |
|
VI |
25,2±0,35 |
13,3±0,26 |
2,03±0,030 |
9,83±0,130 |
|
П р и м еч а ни е. I группа — контроль (основной рацион, ОР), II группа — ОР + |
аргинин, III группа — |
|||
|
ОР, инъекции Fe НЧ, |
IV группа — ОР + |
аргинин, инъекции Fe НЧ, V группа — |
ОР + аргинин + ли- |
|
|
зин + метионин, VI группа — ОР + аргинин + лизин + метионин, инъекции Fe НЧ (подробнее см. в |
||||
|
разделе «Методика»). * Различия с контролем достоверны при Р ≤ 0,05. |
||||
Эти данные согласуются с результатами проведенной нами ранее оценки влияния наночастиц железа на продуктивность и физиологический статус цыплят-бройлеров (12). Аналогичное воздействие наночастиц железа и аминокислот на продуктивность описано другими авторами (24, 25). Представленные в настоящей работе сведения о морфологическом составе крови согласуются с выводами о способности наночастиц металлов и их соединений стимулировать иммунный ответ (26, 27). Вероятно, наблюдаемое изменение состава лейкоцитов при введении наночастиц — это кратковременный «физиологический лейкоцитоз», который особенно проявляется на фоне аминокислотных добавок (белковой пищи). Полученные нами данные также указывают на тесную связь между усилением лейкопо-эза и ростостимулирующим действием препаратов. Известно, что через синтез полиаминов и белка обмен аргинина тесно связан с пролиферацией моноцитов и лимфоцитов и развитием окислительного стресса (28-32).
В крови концентрация NO-метаболитов возрастала через 1 сут после введения наночастиц в III, IV и VI группах (на 3,3; 3,5 и 3,7 %) (рис. 1). Через 1 нед отмечали ее увеличение в тех же группах (на 3,0-3,4 % относительно контрольной), через 2 нед повышенная концентрация NO-метаболитов (на 3,85 % в сравнении с контролем) сохранялась только в III группе. Содержание NO-метаболитов в печени имело сходную динамику: закономерные изменения отмечали только для III, IV и VI групп. Так, в III группе в результате введения наночастиц этот показатель возрастал на 2,0-3,0 % в сравнении с контролем, и такая разница сохранялась в течение всего срока наблюдения. В IV группе использование инъекции Fe НЧ с включением аргинина в рацион увеличивало содержание NO-мета-916
болитов в печени птицы только в первые 7 сут (на 2,0-3,4 % относительно контроля). Аналогичные изменения в те же сроки отмечали в VI группе (повышение содержания на 2,7-3,7 % по сравнению с контролем).
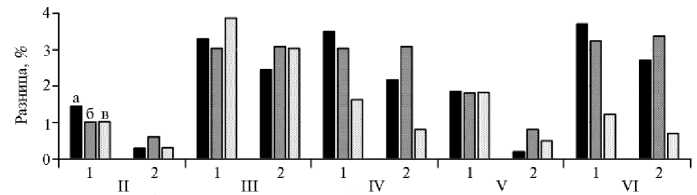
Рис. 1. Разница (%) с контролем (I группа) по содержанию NO-метаболитов в крови (1) и печени (2) бройлеров кросса Смена 8 разного возраста при внутримышечных инъекциях наночистиц Fe на фоне кормовых добавок аминокислот: II, III, IV, V и VI — группы по вариантам опыта (подробнее см. в разделе «Методика»); а, б, в — возраст птицы 16, 21 и 35 сут (соответственно 1-е сут эксперимента, 1 и 2 нед эксперимента) ( n = 7, опыт в условиях вивария).
Аминокислотный состав печени изменялся только в III группе: к окончанию исследования содержание аргинина увеличивалось относительно контроля на 3,83 % (Р ≤ 0,05) (рис. 2).

Рис. 2. Разница (%) с контролем (I группа) по аминокислотному составу печени у бройлеров кросса Смена 8 в возрасте 42 сут при внутримышечных инъекциях наночистиц Fe на фоне кормовых добавок аминокислот: а, б, в, г, д — II, III, IV, V, VI группы по вариантам опыта (подробнее см. в разделе «Методика») ( n = 7, опыт в условиях вивария).
Образование аргинина может быть инициировано посредством нескольких механизмов, в том числе активацией обмена веществ, а также через синтез оксида азота (NO), что показано экспериментально (33, 34). Нами установлена взаимосвязь между усилением образования оксида азота и поступлением наночастиц железа, а также зависимость его количества от присутствия аргинина в рационе. В частности, при использовании наночастиц совместно с аминокислотами содержание NO-метаболитов в крови и печени цыплят увеличивалось только в первую неделю эксперимента, тогда как в отсутствие аминокислотных добавок наночастицы вызывали рост количества NO-метаболитов на протяжении всего срока наблюдений. Дополнительно отметим, что увеличение количества аргинина в рационе, исключающее необходимость его синтеза в организме, сопровождалось значительным и достоверным повышением продуктивности птицы.
Таким образом, внутримышечные инъекции наночастиц железа сопровождаются изменением обмена аргинина в организме птицы. Совместное применение препарата наночастиц железа и комплекса аргинина с другими аминокислотами приводит к повышению продуктивности цыплят-бройлеров.
Авторы благодарят д-ра Н.Н. Глущенко (Институт энергетических проблем
химической физики РАН, г. Москва) за любезно предоставленные препараты наночастиц Fe, использованные в работе.
Список литературы Наночастицы Fe в сочетании с аминокислотами изменяют продуктивные и иммунологические показатели у цыплят-бройлеров
- Абрамян А., Беклемышев В., Солодовников И., Летов А., Филиппов К., Махонин И. Биоактивные нанокомпоненты для медицины и сельского хозяйства. Наноиндустрия, 2007, 6: 24-25.
- Ильичев Е., Назарова А., Полищук С., Иноземцев В. Переваримость рациона и баланс питательных веществ при скармливании телятам нанопорошков кобальта и меди. Молочное и мясное скотоводство, 2011, 5: 27-29.
- Никонов И.Н., Фолманис Ю.Г., Фолманис Г.Э., Коваленко Л.В., Лаптев Г.Ю., Егоров И.А., Фисинин В.И., Тананаев И.Г. Наноразмерное железо -кормовая добавка для сельскохозяйственной птицы. Доклады академии наук, 2011, 440(4): 565-569.
- Богословская О.А., Сизова Е.А., Полякова В.С., Мирошников С.А., Лейпунский И.О., Ольховская И.П., Глущенко Н.Н. Изучение безопасности введения наночастиц меди с различными физико-химическими характеристиками в организм животных. Вестник Оренбургского государственного университета, 2009, 2: 124-127.
- Aslam M.F., Frazer D.M., Faria N., Bruggraber S.F.A., Wilkins S.J., Mirciov C., Powell J.J., Anderson G.J., Pereira D.I.A. Ferroportin mediates the intestinal absorption of iron from a nanoparticulate ferritin core mimetic in mice. FASEB J., 2014, 28(8): 3671-3678.
- Li N., Sioutas C., Cho A., Misra C., Sempf J., Wang M., Oberley T., Froines J., Nel A. Ultrafine particulate pollutants induce oxidative stress and mitochrondrial damage. Environmental Health Perspectives, 2003, 111: 455-460.
- Møller P., Jacobsen N.R., Folkmann J.K., Danielsen P.H., Mikkelsen L., Hemmingsen J.G., Vesterdal L.K., Forchhammer L., Wallin H., Loft S. Role of oxidative damage in toxicity of particulates. Free Radical Research, 2010, 44(1): 1-46 ( ) DOI: 10.3109/10715760903300691
- Сизова Е.А., Мирошников С.А., Полякова В.С., Лебедев С.В., Глущенко Н.Н. Наночастицы меди -модуляторы апоптоза и структурных изменений в некоторых органах. Морфология, 2013, 144(4): 47-52.
- Полякова В.С., Сизова Е.А., Мирошников С.А., Нотова С.В., Завалеева С.М. Морфофункциональная характеристика щитовидной железы при введении в организм наночастиц меди. Морфология, 2015, 148(6): 54-58.
- BeruBe K., Balharry D., Sexton K., Koshy L., Jones T. Combustion-derived nanoparticles: mechanisms of pulmonary toxicity. Clinical and Experimental Pharmacology and Physiology, 2007, 34(10): 1044-1050 ( ) DOI: 10.1111/j.1440-1681.2007.04733.x
- Sizova E., Glushchenko N., Miroshnikov S., Skalny A. Influence of Cu10x copper nanoparticles intramuscular injection on mineral composition of rat spleen. Journal of Trace Elements in Medicine and Biology, 2011, 25: 84-89.
- Sizova E., Yausheva E., Kosyan D., Miroshnikov S. Growth enhancement by intramuscular injection of elemental iron nano-and microparticles. Modern Applied Science, 2015, 9(10): 17-26 ( ) DOI: 10.5539/mas.v9n10p17
- Huang C.C., Tsai S.C., Lin W.T. Potential ergogenic effects of L-arginine against oxidative and inflammatory stress induced by acute exercise in aging rats. Exp. Gerontol., 2008, 43(6): 571-577 ( ) DOI: 10.1016/j.exger.2008.03.002
- Mostafavi-Pour Z., Zal F., Monabati A., Vessal M. Protective effects of a combination of Quercetin and vitamin E against cyclosporine A-induced oxidative stress and hepatotoxicity in rats. Hepatol. Res., 2008, 38(4): 385-392 ( ) DOI: 10.1111/j.1872-034X.2007.00273.x
- Flynn N.E., Meininger C.J., Haynes T.E., Wu G. The metabolic basis of arginine nutrition and pharmacotherapy. Biomed. Pharmacother., 2002, 56: 427-438.
- Nairz M., Schleicher U., Schroll A., Sonnweber T., Theurl I., Ludwiczek S., Talasz H., Brandacher G., Moser P.L., Muckenthaler M.U., Fang F.C., Bogdan C., Weiss G.J. Nitric oxide-mediated regulation of ferroportin-1 controls macrophage iron homeostasis and immune function in Salmonella infection. J. Exp. Med., 2013, 210(5): 855-873 ( ) DOI: 10.1084/jem.20121946
- Faddah L.M., Abdel Baky N.A., Al-Rasheed N.M., Al-Rasheed N.M., Fatani A.J., Atteya M. Role of quercetin and arginine in ameliorating nano zinc oxide-induced nephrotoxicity in rats. BMC Complementary and Alternative Medicine, 2012, 12: 1062 ( ) DOI: 10.1186/1472-6882-12-60
- Сипайлова О.Ю., Лебедев С.В., Сизова Е.А. Влияние высокодисперсного порошка железа на морфофункциональное состояние селезенки (экспериментальное исследование). Вопросы биологической, медицинской и фармацевтической химии, 2011, 9(8): 43-46.
- Sakomura N.K., Ekmay R.D., Mei S.J., Coon C.N. Lysine, methionine, phenylalanine, arginine, valine, isoleucine, leucine, and threonine maintenance requirements of broiler breeders. Poultry Sci., 2015, 94(11): 2715-2721 ( ) DOI: 10.3382/ps/pev287
- Фисинин В.И., Егоров И.А., Ленкова Т.Н., Околелова Т.М., Игнатова Г.В., Шевяков А.Н. и др. Методические указания по оптимизации рецептов комбикормов для сельскохозяйственной птицы. М., 2009.
- Мажитова М.В. Спектрофотометрическое определение уровня метаболитов монооксида азота в плазме крови и ткани мозга белых крыс. Современные проблемы науки и образования, 2011, 3: 2-9.
- Chamruspollert M., Pesti M., Bakalli R.I. Dietary interrelationships among arginine, methionine, and lysine in young broiler chicks. Brit. J. Nutr., 2002, 88(6): 655-660.
- Ekmay R.D., De Beer M., Mei S.J., Manangi M., Coon C.N. Amino acid requirements of broiler breeders at peak production for egg mass, body weight, and fertility. Poultry Sci., 2013, 92(4): 992-1006 ( ) DOI: 10.3382/ps.2012-02554
- Szabó J., Andrásofszky E., Tuboly T., Bersényi A., Weisz A., Hetényi N., Hullár I. Effect of arginine or glutamine supplementation on production, organ weights, interferon gamma, interleukin 6 and antibody titre of broilers. Acta Vet. Hung., 2014, 62(3): 348-361.
- Bautista-Ortega J., Cortes-Cuevas A., Ellis E.A., Ruiz-Feria C.A. Supplemental L-arginine and vitamins E and C preserve xanthine oxidase activity in the lung of broiler chickens grown under hypobaric hypoxia. Poultry Sci., 2014, 93(4): 979-988.
- Mohammadi V., Ghazanfari S., Mohammadi-Sangcheshmeh A., Nazaran M.H. Comparative effects of zinc-nano complexes, zinc-sulphate and zinc-methionine on performance in broiler chickens. Brit. Poultry Sci., 2015, 56(4): 486-493.
- Džarová A., Dubničková M., Závišová V., Koneracká M., Kopčanský P., Gojzewski H., Timko M. The influence of magnetite nanoparticles on human. Journal of Life Sciences, 2010, 4(5): 37-43.
- Yu S.S., Lau C.M., Thomas S.N., Jerome W.G., Maron D.J., Dickerson J.H., Hubbell J.A., Giorgio T.D. Size-and charge-dependent non-specific uptake of PEGylated nanoparticles by macrophages. Int. J. Nanomedicine, 2012, 7: 799-813.
- Suchner U., Heyland D.K., Peter K. Immune-modulatory actions of arginine in the critically ill. Brit. J. Nutr., 2002, 87: 121-132.
- Huang C.C., Lin T.J., Lu Y.F., Chen C.C., Huang C.Y., Lin W.T. Protective effects of L-arginine supplementation against exhaustive exercise-induced oxidative stress in young rat tissues. Chinese J. Physiol., 2009, 52(5): 306-315.
- Lin W.T., Yang S.C., Chen K.T., Huang C.C., Lee N.Y. Protective effects of L-arginine on pulmonary oxidative stress and antioxidant defenses during exhaustive exercise in rats. Acta Pharmacologica Sinica, 2005, 26(8): 992-999 ( ) DOI: 10.1111/j.1745-7254.2005.00155.x
- Ahamed M., Akhtar M.J., Siddiqui M.A., Ahmad J., Musarrat J., Al-Khedhairy A.A., AlSalhi M.S., Alrokayan S.A. Oxidative stress mediated apoptosis induced by nickel ferrite nanoparticles in cultured A549 cells. Toxicology, 2011, 283(2-3): 101-108 ( ) DOI: 10.1016/j.tox.2011.02.010
- Weiss G., Werner-Felmayer G., Werner E.R., Grünewald K., Wachter H., Hentze M.W. Iron regulates nitric oxide synthase activity by controlling nuclear transcription. J. Exp. Med., 1994, 180: 969-976.
- Dlaska M., Weiss G. Central role of transcription factor NF-IL6 for cytokine and iron-mediated regulation of murine inducible nitric oxide synthase expression. J. Immunol., 1999, 162: 6171-6177.


