Нанокалориметр для измерения теплопродукции в митохондриях
Автор: Котельников Г.В., Моисеева Софья Петровна
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение физико-химической биологии
Статья в выпуске: 3 т.26, 2016 года.
Бесплатный доступ
Измерение трансформации и диссипации энергии в митохондриях калориметрическим методом было осуществлено во второй половине прошлого столетия. Однако до настоящего времени не было создано специализированного калориметра для этой цели. Выбор соединений, обеспечивающих разобщенное дыхание митохондрий без повреждения компонентов дыхательной цепи, для использования в составе фармацевтических композиций лекарственных средств, разработка новых нейропротекторов, новых нефропротекторов, требуют прецизионных измерений тепловыделений митохондрий под действием различных разобщителей окислительного фосфорилирования. В ИБП РАН создан капиллярный дифференциальный нанокалориметр для изучения трансформации и диссипации энергии в митохондриях, который отвечает этим требованиям. Принципиальное достоинство калориметра заключается в том, что он имеет тепловые мосты для термостатирования инъекции митохондрий. В них инъекция митохондрий приобретает температуру измерительного объема калориметрических камер в течение нескольких секунд. Митохондрии вводятся тонким слоем по всей длине калориметрической камеры, перемещающейся дозирующей иглой. Это обеспечивает смешивание митохондрий с образцом без больших энергетических затрат и тепловых шумов. Прецизионные измерения тепловой мощности процессов трансформации и диссипации энергии в митохондриях выполняются с абсолютной погрешностью не более 50 нВт.
Капиллярный нанокалориметр, митохондрия, тепловой шунт, изотермический режим, разобщение
Короткий адрес: https://sciup.org/14265030
IDR: 14265030 | УДК: 536.629
Текст научной статьи Нанокалориметр для измерения теплопродукции в митохондриях
В работе [1] еще в 1978 г. на основе изучения тепловой энергии при дыхании митохондрий показано, что "баланс энергии реакций в системе трансформации энергии может непосредственно измеряться калориметрически". Данные результаты базируются на экспериментальном подтверждении равенства измеренной энергии окисления субстрата митохондриями и известной теплотой сгорания использованного субстрата. Данные получены на двух разных субстратах, и на сукцинате и на глутамате. Оценка АТФ-синтеза сделана по разнице измеренной тепловой энергии при сопряженном и разобщенном дыхании митохондрий. Эти важные научные результаты получены с использованием зарождавшегося в 60-е годы метода дифференциального термического анализа, предшественника точной калориметрии. При этом расчет энергии выполнен благодаря использованию оригинальной калибровки для преобразования измеренных температурных перепадов в единицы энергии.
В последующий период стали появляться работы по исследованию теплопродукции митохондрий на лабораторных калориметрических установках, решающих специфические задачи. В работе [2] представлены калориметрические измерения в условиях ограниченного содержания кислорода в калориметрической камере. В работе [3] выполнен поиск условий, при которых митохондрии риса выделяют больше или меньше энергии. Современные аналоги, например описанные в работах [4, 5], Omega [6], VP-ITC, iTC200, Auto iTC200 (MicroCal, USA), не предназначены для измерения тепловой мощности в процессах трансформации и диссипации энергии в митохондриях из-за разобщения дыхания митохондрий в процессе длительного, более 10 мин, выравнивания температуры добавки в них до температуры исследуемого образца. Однако современные задачи поиска соединений, обеспечивающих разобщенное дыхание митохондрий без повреждения компонентов дыхательной цепи, для использования в составе фармацевтических композиций лекарственных средств [7], разработка новых нейропротекторов [8–10], новых нефропротекторов [10] требуют новых калориметрических приборов для прецизионных измерений тепловыделений митохондрий под действием различных разобщителей окислительного фосфорилирования.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПОСТРОЕНИЯ НАНОКАЛОРИМЕТРА
Разработанные теоретические основы построения калориметра касаются ключевых проблем:
метода выделения измерительного объема калориметрических камер; метода выравнивания концентрации добавки в измерительном объеме калориметрической камеры; метода введения добавки в калориметрическую камеру.
теплопроводности меди; λ к — коэффициент теплопроводности материала камеры; λ ш — коэффициент теплопроводности материала шунта; λ ж — коэффициент теплопроводности жидкости; d — зазор между шунтами.
Метод выделения измерительного объема
Чтобы оценить теоретически точность выделения измерительного объема калориметрических камер в дифференциальном титрационном калориметре, была разработана и исследована тепловая модель калориметрической камеры [11]. По указанной модели предусмотрен идеальный тепловой контакт калориметрических камер с пассивным тепловым шунтом, который имеет идеальный тепловой контакт с изотермическим экраном, температура которого поддерживается постоянной системой автоматического регулирования. Показано, что пассивный тепловой шунт исключает влияние теплового эффекта в зоне этого шунта на величину регистрируемого сигнала тепловой мощности, возникающей в измерительном объеме калориметрических камер. Предложенная техническая реализация теплового шунта сводит практически к нулю влияние теплового эффекта в зоне шунта. Данная погрешность оценивается величиной коэффициента K , рассчитываемого по формуле (1), и равна 0.003 %.
Выравнивание концентрации добавки в измерительном объеме калориметрической камеры
Капиллярные калориметрические камеры были выбраны для титрационного калориметра после оценки эффективности смешивания добавки и образца в такой камере. В качестве критерия было выбрано время выравнивания концентрации добавки в объеме образца в результате концентрационной диффузии, которое определяется по предложенному расчетному соотношению (2):
т = R^-
2 D k
( уЛ
1 — d- ln
I V k )
1 ( V k
k I
V d
—
2а * L * r + n' rnp2(Л + Хм)
2 l пр
22 2
2 Л,,, * h ( r r 1 ) А к + r А ж
ш__ + ln Rш d r2
X
1 + пр 2 пр \ конст м /
2/ Pfr2 -r2V Л +г2 • Л 1
l пр ^ ( r 2 r l ) А к + r l А ж J
где α — коэффициент теплоотдачи; r 1 — внутренний радиус калориметрической камеры; r 2 — внешний радиус калориметрической камеры; L — высота рабочего объема; h — высота шунта; R ш — радиус шунта; n — число ветвей медь-константановой измерительной термобатареи, установленной между камерами; r пр — радиус проводов ветвей термобатареи; l пр — длина каждой ветви термобатареи; λ конст — коэффициент теплопроводности константана; λ м — коэффициент
где V d — объем жгута (дозы титранта); R 0 — радиус жгута; V k — рабочий объем калориметрической камеры; D k — коэффициент диффузии титранта в образце; k — коэффициент выравнивания концентрации титранта в образце.
Это соотношение подтверждено экспериментально на капиллярном калориметре по зарегистрированному тепловому процессу взаимодействия: никотинамидадениндинуклеотид (восстановленная форма НАДН) и лактатдегидрогеназа (ЛДГ) [12].
Введение добавок осуществляется следующим образом: при введении дозы производится продольное перемещение шприцов на всю длину калориметрических камер винтовым механизмом перемещения, управляемым шаговым двигателем перемещения шприцов. Одновременно с этим производится перемещение поршней винтовым механизмом, управляемым шаговым двигателем перемещения поршней. За счет различной величины перемещений винтовых механизмов шприцами осуществляется дозирование заданного количества реагентов. Управление шаговыми двигателями осуществляется компьютером. При этом добавка распределяется по всей длине рабочего объема калориметрической камеры в виде тонкого жгута. В процессе эксперимента добавка может вводиться многократно.
В калориметре предусмотрено также механическое перемешивание реагентов в калориметрических камерах за счет колебаний дозирующих игл с амплитудой и частотой, выбираемых из условий эксперимента. Этот режим работы исключает образование осадка при исследовании митохондрий.
Метод введения дозирующей иглы в калориметрическую камеру нанокалориметра
Открытые калориметрические камеры были применены впервые в созданном дифференциальном адиабатическом сканирующем микрокалориметре ДАСМ-1 [13]. Данное техническое решение, хорошо зарекомендовавшее себя в научной практике, применено в нанокалориметре. Введение добавки в калориметрические камеры осуществляется через открытые концы камер дозирующими шприцами. В нанокалориметре предусмотрена система тепловых шунтов, проходя через которые добавка принимает температуру исследуемого образца, что позволяет вводить добавку, имеющую температуру, соответствующую температуре хранения, т. е. без какого-либо предварительного термостатирования. При этом скорость введения может достигать величины 13.7 мм/с, что позволяет выполнить операцию введения добавки в нанокалориметр в течение 5 с. В работе [14] приведено теоретическое обоснование данного режима нанокалориметра. Экспериментально подтверждено, что указанный режим введения добавки не вносит паразитного тепла в измерительный объем калориметрической камеры, что позволяет при измерениях трансформации и диссипации энергии в митохондриях вводить в калори- метрические камеры митохондрии в виде добавки. Это обстоятельство позволяет регистрировать мощность теплового эффекта без задержки во времени с момента введения митохондрий в калориметрическую камеру и является важным достоинством нанокалориметра, обеспечивающим прецизионные измерения тепловой мощности трансформации и диссипации энергии в митохондриях. В случае постановки эксперимента, при котором митохондрии загружаются непосредственно в калориметрическую камеру и выдерживаются в ней до достижения заданной температуры, точность измерений может снижаться из-за того, что изменяется жизнеспособность митохондрий при длительном пребывании при температуре порядка 26 оС. Однако количественной оценки указанного процесса в литературе не встречается. Возможности нашего нанокалориметра позволяют выполнить такую оценку. Реагенты, используемые для испытания прибора, получены из Sigma.
КРАТКОЕ ОПИСАНИЕ КАЛОРИМЕТРИЧЕСКОГО БЛОКА НАНОКАЛОРИМЕТРА
Калориметрический блок нанокалориметра представлен на рис. 1. На нем показаны элементы, в построении которых учтены требования предыдущего теоретического раздела статьи.
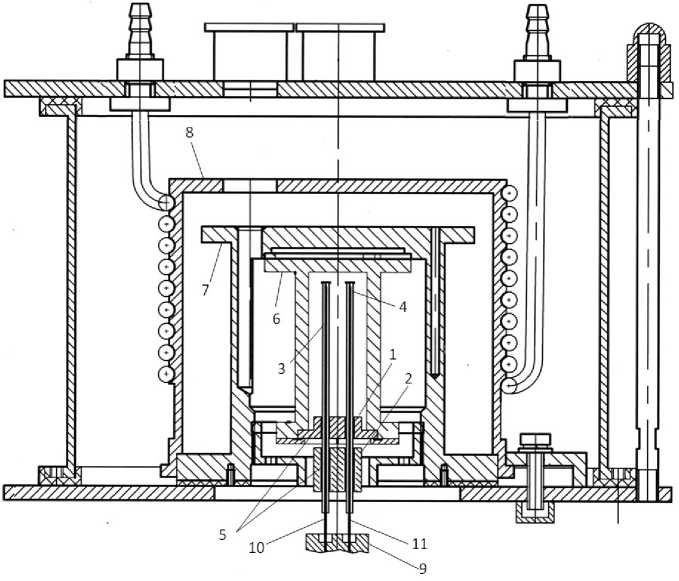
Рис. 1. Калориметрический блок нанокалориметра для измерения теплопродукции в митохондриях.
1 — пассивный тепловой шунт; 2 — активный тепловой шунт; 3, 4 — калориметрические камеры; 5 — пайка серебряным припоем; 6, 7, 8 — термостатирующие экраны; 9 — держатель; 10, 11 — дозирующие иглы
Тепловые шунты 1 и 2 соединены с капиллярами 3 и 4 с обеспечением надежного теплового контакта за счет пайки 5 серебряным припоем, а тепловой контакт пассивного шунта 1 с экраном 6 обеспечивается механическим сжатием деталей. Надежный тепловой контакт между камерами 3 и 4 и тепловыми шунтами 1 и 2 обеспечивает точное выделение рабочего объема, благодаря тому что тепло из зоны пассивного шунта 1 не попадает в измерительный объем калориметрических камер. Это тепло отводится в корпус теплового шунта 1 и далее на термостатирующую оболочку, состоящую из экранов 6–8. Таким образом, в измерительный сигнал вклад дает только тепло, выделяющееся в измерительном объеме. Теплообмен между калориметрическими камерами и экраном 6 отсутствует, поскольку температуры калориметрических камер 3, 4 и экрана 6, в котором они замкнуты, равны. Данное решение не требует использования отдельного регулятора температуры калориметрических камер для регулирования их температуры, что исключает в измерительном сигнале возникновение тепловых шумов, связанных с работой указанной системы регулирования.
Конструкция калориметрического блока предусматривает соосность установленных на держателе 9 дозирующих игл 10, 11 и калориметрических камер 3, 4, что исключает удары дозирующих игл о стенки камер, сопровождающиеся возникнове- нием тепловых шумов, снижающих отношение сигнал/шум при измерениях тепловой мощности. При этом обеспечивается соответствие времени перемешивания реагентов за счет концентрационной диффузии расчетному времени. Перемешивание за счет концентрационной диффузии реагентов в калориметрической камере эффективно. Например, тестирование калориметра по связыванию Ba2+ с 18-Crown-6 с использованием только указанного перемешивания дает точное значение параметров связывания [15], необходимая при этом высокая воспроизводимость базовой линии обеспечивается благодаря работе тепловых шунтов, минимизирующих паразитные тепловые потоки в измерительный объем калориметрических камер.
ТЕСТИРОВАНИЕ НАНОКАЛОРИМЕТРА ПО ВЗАИМОДЕЙСТВИЮ BA2+—18-CROWN-6
Масштабный коэффициент шкалы мощности определен по первому пику термограммы связывания Ba2+—18-Crown-6 [16], которая приведена на рис. 2. При этом энергия пика равна 5229 мкДж. Указанная энергия содержится в сигнале прямоугольной формы с высотой 4526.26 нВ и продолжительностью 96 с, что дает масштабный коэффициент мощности, равный 83 нВ / мкВт.
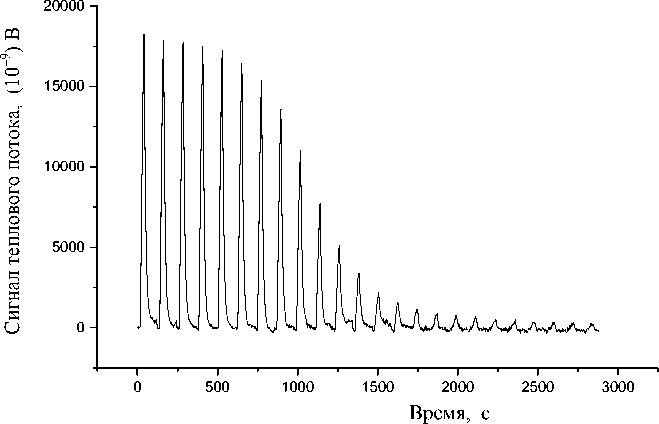
Рис. 2. Tермограмма связывания Ba2+—18-Crown-6.
Образец — 156 мкл 18-Crown-6 (0.01 М); добавка — 1.6644 мкл Ba2+ (0.1 М). Температура: 25 ºС. Перемешивание: колеблющаяся игла 18.5 Гц
ТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ НАНОКАЛОРИМЕТРА
Масштабный коэффициент шкалы мощности —
Измерение исследуемых процессов трансформации и диссипации энергии в митохондриях с абсолютной погрешностью не более —
Измерительный объем калориметрической камеры —
Объем добавки суспензии митохондрий (титранта) —
Изотермический режим работы нанокалориметра: рабочий диапазон температур —
Механическое перемешивание реагентов в калориметрических камерах колеблющимися дозирующими иглами с частотой —
83 нВ / 1мкВт;
50 нВт;
156 мкл;
от 1 до 10 мкл;
от 15 до 50 оС;
от 1 до 20 Гц.
Разработанный нанокалориметр представляет собой модификацию калориметра КТД-2156 [14]. Нанокалориметр отличается повышенной чувствительностью за счет созданного для него высокочувствительного калориметрического блока (ЮФВК.418227.001СБ). Это обеспечило соответствие нанокалориметра современным требованиям, необходимым для измерения тепловой мощности процессов диссипации и трансформации энергии в митохондриях.
РЕЗУЛЬТАТЫ КАЛОРИМЕТРИЧЕСКИХ ИЗМЕРЕНИЙ
Для калориметрических измерений митохондрии печени крысы линии Wistar выделяли методом дифференциального центрифугирования по стандартной методике. Среда выделения содержала 0.3 М сахарозы, 10 мМ HEPES (рН 7.4), 1 мМ EGTA. Митохондрии отмывали в среде выделения без EGTA. Среда инкубации содержала 125 мM KCl, 3 мM KH 2 PO4, 1 мM MgSO 4 , 10 мM HEPES рН 7.4 [17].
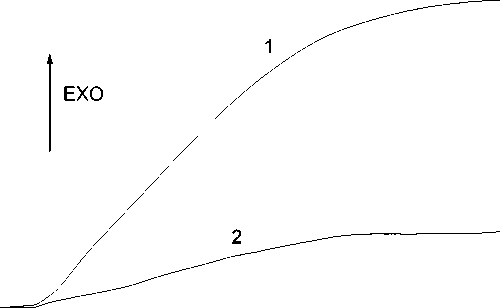
На рис. 3 приведены кривые, представляющие собой временн у ю зависимость тепловой энергии, полученной в результате интегрирования сигналов тепловой мощности: кривая 1 — при введении 6.6 мкл размороженной суспензии митохондрий в среде выделения в измерительный объем калориметрической камеры 156 мкл со средой инкубации и сукцинатом (5 мМ); кривая 2 — при введении 6.6 мкл размороженной суспензии митохондрий в среде выделения в измерительный объем калориметрической камеры 156 мкл со средой инкубации и гидроксибутиратом (8 мМ). Температура калориметрических камер — 26 °С.
-1-----------1-----------1-----------1-----------1-----------1-----------1-----------1-----------1-----------1-----------г
100 200 300 400 500 600
Время, с
-1000
Рис. 3. Тепловая энергия, полученная в результате интегрирования сигналов тепловой мощности при введении в калориметрическую камеру размороженной суспензии митохондрий в зависимости от вида субстрата.
Кривая 1 — интегрированная тепловая мощность на субстрате сукцинат; кривая 2 — интегрированная тепловая мощность на субстрате гидроксибутират
ЗАКЛЮЧЕНИЕ
Нанокалориметр перспективен для решения современных задач поиска соединений, обеспечивающих разобщенное дыхание митохондрий без повреждения компонентов дыхательной цепи, для использования в составе фармацевтических композиций лекарственных средств, разработки новых нейропротекторов, новых нефропротекторов. Он может быть использован для прецизионных измерений тепловыделений митохондрий под действием различных разобщителей окислительного фосфорилирования.
Работа выполнена при поддержке фонда РФФИ 13-08-00933-а.
Список литературы Нанокалориметр для измерения теплопродукции в митохондриях
- Nakamura T., Matsuoka I. Calorimetric studies of heat of respiration of mitochondria//Journal of Biochemistry. 1978. Vol. 84, no. 1. P. 39-46.
- Gnaiger E., Mendez G., Hand S.C. High phosphorylation efficiency and depression of uncoupled respiration in mitochondria under hypoxia//PNAS. 2000. Vol. 97, no. 20. P. 11080-11085 DOI: 10.1073/pnas.97.20.11080
- Zhou P.-J., Zhou H.-T., Liu Y., Qu S.-S., Zhu Y.-G., Wu Z.-B. Studies on the energy release of rice mitochondria under different conditions by means of microcalorimetry//Journal of Biochemical and Biophysical Methods. 2001. Vol. 48, no. 1. P. 1-11 DOI: 10.1016/S0165-022X(00)00123-8
- Velázquez-Campoy A., López-Mayorga O., Cabrerizo-Vı́lchez M.A. Development of an isothermal titration microcalorimetric system with digital control and dynamic power Peltier compensation. I. Description and basic performance//Review of Scientific Instruments. 2000. Vol. 71, no. 4. P. 1824-1831 DOI: 10.1063/1.1150543
- Garcia-Fuentes L., Baron C., Mayorga O.L. Influence of dynamic power compensation in an isothermal titration microcalorimeter//Analytical Chemistry. 1998. Vol. 70, no. 21. P. 4615-4623 DOI: 10.1021/ac980203u
- Wiseman Т., Williston S., Brandts J.F., Lin L.-N. Rapid measurement of binding constants and heats of binding using a new titration calorimeter//Analytical Biochemistry. 1989. Vol. 179, no. 1. P. 131-137.
- Патент РФ № 2527519, 10.09.2014.
- Silachev D.N., Khailova L.S., Babenko V.A., Gulyaev M.V., Kovalchuk S.I., Zorova L.D., Plotnikov E.Y., Antonenko Y.N., Zorov D.B. Neuroprotective effect of glutamate-substituted analog of gramicidin A is mediated by the uncoupling of mitochondria//Biochimica et Biophysica Acta. General Subjects. 2014. Vol. 1840, no. 12. P. 3434-3442.
- Khailova L.S., Silachev D.N., Rokitskaya T.I. et al. A short-chain alkyl derivative of Rhodamine 19 acts as a mild uncoupler of mitochondria and a neuroprotector//Biochimica et Biophysica Acta. Bioenergetics. 2014. Vol. 1837, no. 10. P. 1739-1747. 2014.07.006 DOI: 10.1016/j.bbabio
- Plotnikov E.Y., Silachev D.N., Jankauskas S.S. et al. Mild uncoupling of respiration and phosphorylation as a mechanism providing nephro-and neuroprotective effects of penetrating cations of the SkQ family//Biochemistry (Moscow). 2012. Vol. 77, no. 9. P. 1029-1037 DOI: 10.1134/S0006297912090106
- Kotelnikov G.V., Moiseyeva S.P., Mezhburd E.V., Krayev V.P. Method of separating the sensitive volume of calorimetric cells in a differential titration calorimeter//Journal of Thermal Analysis and Calorimetry. 2000. Vol. 62, no. 1. P. 39-50 DOI: 10.1023/A:1010150409126
- Kotelnikov G.V., Moiseyeva S.P., Mezhburd E.V., Krayev V.P. New isothermal titration calorimeter for investigations on very small samples. Theoretical and experimental studies//Journal of Thermal Analysis and Calorimetry. 2002. Vol. 68, no. 3. P. 803-818. Doi: 10.1023/A:1016165817003.
- Патент США N 4112734, 12.09.1978.
- Kotelnikov G.V., Moiseyeva S.P., Mezhburd E.V., Maevsky E.I., Grishina E.V. Studying dispersoid systems method of introducing an injecting needle into calorimetric chamber of capillary titration calorimeter//Journal of Thermal Analysis and Calorimetry. 2005. Vol. 81, no. 2. P. 255-259 DOI: 10.1007/s10973-005-0775-6
- Патент РФ № 2335743, 10.10.2008.
- Briggner L.E., Wadsö I. Test and calibration processes for microcalorimeters, with special reference to heat conduction instruments used with aqueous systems//Journal of Biochemical and Biophysical Methods. 1991. Vol. 22, no. 2. P. 101-118 DOI: 10.1016/0165-022X(91)90023-P
- Гpишина Е.В., Xауcтова Я.В., Ваcильева А.А., Маевcкий Е.И. Возрастные особенности влияния сукцината на индуцированное окисление липидов митохондрий печени крыс//Биофизика. 2015. Т. 60, № 4. С. 708-715.


