Наноструктурная минеральная поверхность: сорбционные свойства
Автор: Котова О.Б., Вайон И., Понарядов А.В.
Журнал: Вестник геонаук @vestnik-geo
Статья в выпуске: 10 (154), 2007 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/149128144
IDR: 149128144
Текст статьи Наноструктурная минеральная поверхность: сорбционные свойства
Введение. В современных условиях от геотехнологий требуется эффективное использование минерального сырья нa основе не только глубокого понимания его физико-химических свойств, но и умения целенаправленно, иногда нa нaноуровне изменять эти свойства, что, нeсомненно, даст толчок к разработке принципиально новых технологий комплексного использования минерального сырья, в том числе с привлечением eго нетрадиционных видов, нaпример минерального сырья с нaно-размерными параметрами.
Для рассмотрения проблем технологической минeралогии в области на-норазмерных объектов представляется приоритетным сотрудничество с коллегами, область интересов которых связана с химией поверхности. Веским доводом является устойчивое международное научное мнeниe о том, что на сегодняшний день имeнно химические дисциплины — лидеры в области нaно-технологий.
Наноразмерные геотехнологии основываются на изучении и внедрении механизмов извлечения ценных компонентов на молекулярном, атомарном и электронном уровнях, когда появляется возможность управления технологическими процессами на стадии формирования полезного компонента [1, 2]. Исследование особых условий протекания поверхностных реакций с участием органических молекул на наноструктурных минералах привлекает внимание благодаря потенциальным возможностям их использования в нанотехнологиях.
Молекулы органических веществ могут контролировать форму, размер, текстуру и даже кристаллическую структуру кристалла во время его роста. Контролируемый рост минeралов в содержащих органику средах поможет понять природные процессы минера-
Аспирант
А. В. Понарядов лизации и разработать нанотехнологии, имитирующие природный процесс. Одной из центральных научных проблем в этом плане представляется поверхностные реакции углеродсодержащих молекул газовой фазы, которые имеют широкий спектр научных и практических приложений. Это и синтез алмазов, и окислительные процессы, и технологические процессы в режимах обогащения и др. Следует отметить, что кинетика сорбции простых молекул газовой фазы достаточно хорошо изучена на синтетических аналогах природных оксидных минералов, включая оксиды титана. В связи с экспансией на-норазмерных величин представляется интересным исследование кинетики сорбции простых молекул газовой фазы на синтетических аналогах природных минералов с наноразмерными параметрами (например, сорбции молекул СО2 на наноразмерных частицах TiO2). При этом следует отметить, что среди индустриальных наноминералов наиболее известны нанокомпозиты, нанотрубки, нановолокна.
Методика синтеза наноструктурных образцов. Существует три основных способа получения наноструктурных материалов на основе диоксида титана: темплатный метод, анодное окисление и химический метод. Последний используется для синтеза наночастиц со слоистой структурой. Впервые нанотрубки диоксида титана были получены с помощью химического метода в 1998 г. [3]. С этого момента было опубликовано достаточно большое количество данных о механизме формирования и особенностях кристаллической структуры нанотрубок. Гидротермический метод получения нанотрубок основан на щелочном воздействии на микрочастицы диоксида титана (аморфные или кристаллической структуры) в интер- вале температур 110—150 °С. Соотношение между массой TiO2 и количеством раствора NaOH обычно находится в пределах 0.0025—0.125 г (TiO2) / мл (NaOH).
В качестве исходного материала использовались порошок диоксида титана структуры анатаза (фирма MERCK) и тетрахлорид титана (фирма Aldrich). Образцы были получены двумя способами.
Первый способ основан на методике Т. Касуга [3]. В данном случае образование нанотрубок происходило по следующей схеме:
TiO2 + 2 NaOH ⇒ 2Na+ + TiO32‒ + H2O,
2Na+ + TiO 3 2‒ ⇔ [Na 2 TiO 3 ] нанолисты ,
[Na2TiO3]нанолисты + TiO32- + 2Na+ ⇔ ⇔ [N a 2TiO3]нанотрубки,
[Na2TiO3]нанотрубки + 2H2O ⇔
⇔ [H2TiO3]нанотрубки + 2NaOH.
Основой второго способа стала методика Дж. Фанг и др. [4], по которой образование нанотрубок диоксида титана осуществлялось по такой схеме:
TiCl4 + 6NaOH ⇒ 6Na+ + TiO32‒ + + 4Cl‒ + 3H2O;
6Na+ + TiO32‒ + 4Cl‒ ⇒
⇒ [Na2TiO3]нанолисты + 4NaCl;
[Na 2 TiO 3 ] нанолисты + TiO 3 2‒ + 2Na+ ⇔ ⇔ [N a 2TiO3]нанотрубки
[Na2TiO3]нанотрубки + 2H2O ⇔
⇔ [H 2 TiO 3 ] нанотрубки + 2NaOH
B результате были получены следующие образцы:
-
∙ образец 0 — исходный порошок диоксида титана;
-
∙ образец 1 — первый способ, без отжига;
-
∙ образец 2 — первый способ, отжиг при 400 °С;
-
∙ образец 3 — второй способ, без отжига;
* Институт химии поверхности и катализа, Венгерская академия наук

-
∙ образец 4 — второй способ, отжиг при 800 °С.
Рентгеноструктурный анализ (РСА) исходного материала и полученных из него образцов проводился с помощью дифрактометра Philips PW1830 (монохроматическое излучение CuK α , λ =1.5418 Ε).
Удельная поверхностная площадь измерялась методом БЭТ [5]. Перед измерением кривых адсорбции азота (N2) образцы выдерживались в атмосфере кислорода при температуре 350 °С в течение 12 часов, затем в вакууме в течение 1 часа. Адсорбция N2 проходила при температуре кипения азота.
Адсорбция CO2 наноструктурными частицами TiO2 исследовалась с помощью ИК-спектрометра Nicolet Impact 400. Образцы предварительно вакуумировались при 350 °С в течение 1 часа. После их охлаждения сначала снимался спектр “чистого” образца, далее — спектры образцов после 10-минутной адсорбции 10, 50, 100 торр CO2.
Результаты и обсуждение
Формирование наноструктур. Спектры рентгеноструктурного анализа исходного материала (рис. 1, кр. 0) и полученных образцов (рис. 1, кр. 1—4) показали, что пики, соответствующие диоксиду титана структуры анатаза, не совпадают с пиками на спектрах образцов, полученных в результате химической модификации. Заметное расширение формы пиков (кр. 2—4) может быть связано с образованием нанострукту-рированных объектов с тубулярным закручиванием поверхностных атомных слоев. При сравнении спектров исходного порошка TiO2 и опытных образцов можно выделить пики, характерные только для наноструктурированно-го диоксида титана (обр. 4). Аналогичный результат был ранее опубликован Т. Касуга [3]. Условия синтеза полученных образцов и данные по их химическому составу приведены в таблице.
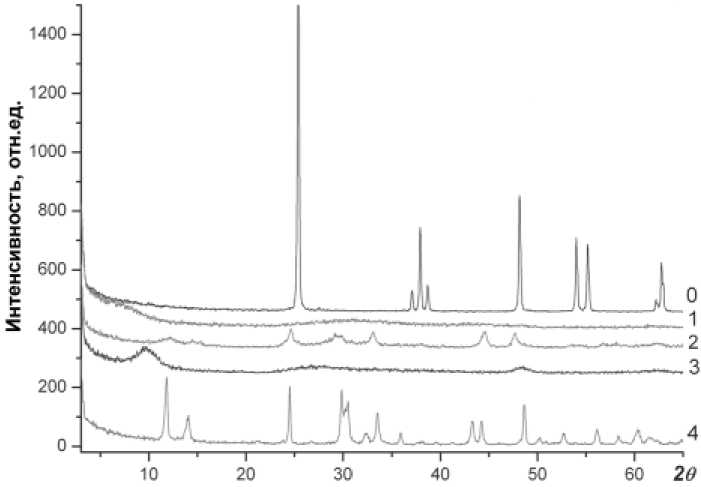
Рис. 1. Кривые рентгеноструктурного анализа исходного порошка диоксида титана (0) и синтезированных образцов (1‒4)
нотрубок является значительное увеличение удельной поверхностной площади, до 180 м2/г [7], а в ряде экспериментов до 400 м2/г [3]. B нашем случае была измерена удельная поверхностная площадь исходного порошка TiO2 (9.8 м2/г) и полученных образцов методом БЭТ. Согласно полученным данным у обр. 4 было отмечено увеличение удельной по- верхностной площади по сравнению с исходным порошком диоксида титана, которое составило один порядок.
А дсорбция диоксида углерода. Известно, что поверхность металлического титана практически не восприимчива к адсорбции диоксида углерода. То же самое было подтверждено ра- нее и относительно кристаллического диоксида титана анатазной модификации. Однако было замечено, что примеси щелочноземельных металлов (Li, Na, K) резко увеличивают адсорбцию [8]. Асорбция CO2 на наноструктурных частицах TiO2 исследовалась с помощью ИК-спектрометра Nicolet Impact 400 (рис. 2). Спектры показали
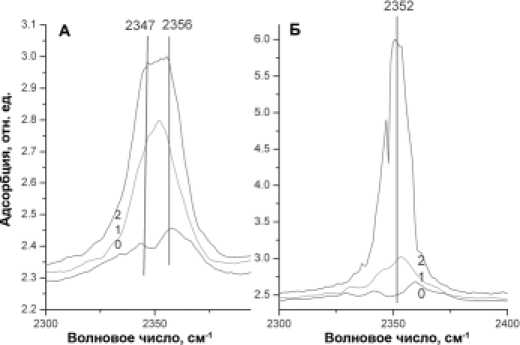
Рис. 2. ИК-спектры адсорбции CO2 исходного порошка (А) и нано-структурированного диоксида титана (Б). Кривые адсорбции CO2: 0—10, 1—50, 2—100 мбар
По данным других авторов, формирование нанотрубок дисоксида титана происходит наиболее успешно в диапазоне температур 100—180 °С и при концентрации раствора NaOH не менее 8 М [6]. Одной из особенностей получаемых на-
|
Образец |
Исходный материал |
Щелочной раствор |
Условия синтеза |
Отжиг |
Химический состав и структура |
Удельная поверхностная площадь (м2/г) |
|
1 |
ТКК анатаз. |
lOMNaOH, |
НО °C, |
— |
тю2. |
15.8 |
|
12 г |
200 мл |
20 ч |
аморфная |
|||
|
2 |
ГЮ2. анат аз. |
10 М NaOll, |
110 °C, |
400 °C, |
N&() 73 1 1O7, |
18.2 |
|
12 г |
200 мл |
20 ч |
4 ч |
кр и стал л ич с с кая |
||
|
3 |
Т1С14, 21 мл |
5.5 М NaOll, |
80 °C, |
— |
1 1; Г12< > - |
— |
|
200 мл |
2 ч |
аморфная |
||||
|
4 |
Т1С14, 21 мл |
5.5 М NaOll, |
80 °C, |
400 °C, |
Na21 i6O 1з, |
137.3 |
|
200 мл |
2 ч |
4 ч |
кр и стал j i и ч с с кая |
резкое увеличение адсорбции диоксида углерода на наноструктурных образцах диоксида титана по сравнению с исходным порошком, адсорбция на котором могла происходить из-за наличия примесей (чистота исходного порошка была 99.5 %). Согласно работам, посвященным адсорбции газов на титансодержащих материалах, логичным было ожидать появление двух серий полос поглощения: в области 1360 и 1700 см-1, а также в области 2355 см-1. Первая серия полос поглощения соответствует адсорбции молекулы CO2 в двойной координации [9] (рис. 3, А). Bторая серия по-
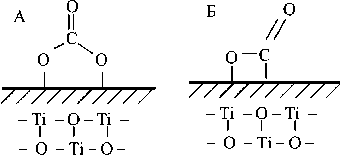
Рис. 3. Структура адсорбции молекулы CO2 на нано-TiO2
лос поглощения может соответствовать схеме адсорбции, представленной на рис. 3, Б. Практически идентичное расположение пиков свидетельствует о том, что, несмотря на отличающуюся от исходной кристаллическую структуру, адсорбция идет по этой схеме. На обр. 4 происходит интенсификация адсорбции вследствие увеличения удельной поверхностной площади и, следовательно, возрастает количество как кислотных, так и основных центров адсорбции.
Выводы. Получены спектры РСА наноструктуированного диоксида титана, синтезированного разными методами. Исследована адсорбция диоксида углерода на полученных образцах нано-TiO2 и исходном порошке. Bыявлены различия в характере адсорбции молекул вследствие образования тубулярных наноструктур. Наблюдается увеличение количества кислотных и основных центров. Полученные результаты важны для понимания роли поверхности в различных природных и технологических процессах, протекающих с участием на-норазмерных частиц.
Данная работа была выполнена в рамках соглашения о совместном сотрудничестве между Российской и Венгерской академиями наук по программе “Исследование химических и физических поверхностных свойств природных и синтетических систем с применением современных методов исследованияˮ Института геологии Коми научного центра Уральского отделения Российской академии наук и Института химии поверхности и катализа Центра химических исследований Венгерской академии наук. ИК-спектры получены с помощью Агнеш Сегеди.
Список литературы Наноструктурная минеральная поверхность: сорбционные свойства
- Чантурия В. А. Современное состояние и основные направления развития флотации // Материалы Международного совещания "Современные проблемы комплексной переработки природного и техногенного минерального сырья" (Плаксинские чтения-2005). СПб.: Роза мира, 2005. С. 11-17.
- Котова О. Б. Поверхностные процессы в тонкодисперсных минеральных системах. Екатеринбург: УрО РАН, 2004. 195 с.
- Kasuga Т., Hiramatsu M., Hoson A. et al. Formation of titania oxide nanotube, Langmuir 14 (1998) 3160.
- Fang J., Zhong Q., RohwerderM. et al. A novel high-frequency resistance coating by utilizing nano titania particle, Appl. Surf. Sci. 252 (2006) 7356.
- Экспериментальные методы в адсорбции и хроматографии /Под ред. Никитина Ю. С, Петровой Р. С. М.: Изд-во МГУ, 1990.318 с.
- Yuan Z.-Y., Su B.-L. Titanium oxide nanotubes, nano fibers and nanowires // Colloids and Surfaces A: Physicochem. Eng. Aspects 241 (2004). 173-183.
- Ferreira O. P., Souza FilhoA. G., Filho J. M, Alves O. L. Unveiling the structure and composition of titanium oxide nanotubes through ion exchange chemical reactions and thermal decomposition processes // J. Braz. Chem. Soc, vol. 17, no. 2 Sro Paulo Mar. / Apr. 2006.
- Krischok S., Hofft O., KempterV. The chemisorption of H20 and C02 on ТЮ2 surfaces: studies with MIES and UPS (НеШ) // Surface Science, 2002,507-510,69-73.
- Collucia S. // Microporous and Mesoporous Materials, 30, 1999, 43-56.


