Нанотехнологии в изучении работы генов (обзор)
Автор: Шихов И.Я.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы, итоги
Статья в выпуске: 6 т.42, 2007 года.
Бесплатный доступ
Обсуждаются современные технологии микроскопирования, позволяющие напрямую наблюдать генные продукты в клетках, и в частности перспективы применения нанок-ристаллов - квантум-дотов (QDs). Приведены материалы флуоресцентного микроскопирования ткани молочной железы овец, трансгенных по химозину. Эти данные сравниваются с результатами использования новых методических решений для визуализации в клетке продуктов синтеза на основе флуоресцентных проб с наночастицами. Описаны другие способы повышения эффективности микроскопирования при выявлении следов генной активности.
Ген, клетка, квантум-дот, нанокристаллы, праймер, fish (флуоресцентная in situ гибридизация)
Короткий адрес: https://sciup.org/142133226
IDR: 142133226 | УДК: 577.2:57.086.8
Текст обзорной статьи Нанотехнологии в изучении работы генов (обзор)
Геном млекопитающих состоит из 60 000-80 000 генов, из которых в среднем на клетку активно транскрибируется лишь одна треть (1). Из общего пула мРНК около половины синтезируется в процессе экспрессии небольшого числа генов с выходом от 10 000 до
100 000 копий мРНК каждого вида, 15 % представлено умеренно экспрессирующимися видами (в пределах 1000-10 000 копий на клетку), остальное приходится примерно на 10 000 разных видов мРНК с выходом от 1 до 1000 копий на клетку (2).
In situ гибридизация (ISH) с меченой пробой дает возможность наблюдать мРНК на клеточном и субклеточном уровне и является в определенном смысле ключевым способом изучения генной экспрессии (3).
Рис. 1. Флуоресцентная микроскопия гистосрезов молочной железы овцы, трансгенной по химозину. Стрелкой отмечены участки секрета, измененного под действием рекомбинантного химозина (разные оттенки желтого цвета; в контроле цвет флуоресценции зеленый). Замороженные срезы толщиной 15 мкм, окраска акридиновым оранжевым, рН 7,0; ½10.
Одна из задач исследований по биотехнологии — распознавание трансгенов в клетках подопытных животных. Если продукт чужеродного гена явно выражен, то даже обычные гистологические методы могут дать информативную картину генной экспрессии. Так, у овец, трансгенных по химозину, встроенному под а 81-казеиновый промотор (4), в альвеолах молочной железы довольно четко выявляются плотные сгустки молочного секрета. Они как бы «створаживаются» под действием рекомбинантного энзима и забивают просветы концевых отделов секреторного органа (5). В результате животные теряют способность нормально лактировать. Это наглядно видно на гистопрепаратах молочной железы, окрашенных акридиновым оранжевым (АО), при микроскопировании в УФ-свете (рис. 1).
На снимках (рис. 1) можно видеть «заполненные» плотным содержимым молочные альвеолы у трансгенной овцы (желтая флуоресценция по сравнению с зеленой флуоресценцией в контроле, где содержимое молочных альвеол нормальной консистенции).
Однако не во всех случаях трансгенеза столь явно обнаруживается генно-инженерный продукт. Тем более, что нередко трансген оказывает блокирующее действие, обусловливающее так называемый эффект посттранскрипционного генного молчания (PTGS) или РНК-интерференцию (РНК-и) (6, 7). В связи с этим представляет интерес изучение механизма транскрипции и трансляции в клетках трансгенных организмов.
Когда исследователи имеют дело с исключительно малыми количествами транскриптомов, то требуются, соответственно, достаточно чувствительные методы детекции проб, выявляющие одиночные таргетные мРНК. В различных прямых и непрямых методах анализа транскриптомов используются синтетические РНК- и ДНК-пробы. Синтезированные олигонуклео-тидные пробы наиболее приемлемы в расшифровке сплайсинг-продуктов либо тесно связанных с ними последовательностей. Кроме того, программированный дизайн и синтез олигонуклеотидных проб потенциально позволяет на транскриптомном уровне устанавливать местоположение большого числа мРНК на анатомических срезах.
Новые технологии микроскопирования, описанные во многих работах, позволяют напрямую наблюдать в клетках генные продукты, визуализировать пробы клеточных функций у трансгенных животных, составлять карты тканевой организации организмов (8).
Однако органические флуорофоры (флуоресцеин, родамин и др.), обычно используемые для флуоресцентной ISH (FISH), характеризуются относительно широким спектром эмиссии и значительным светобликовым эффектом, поэтому ограничены в примене- нии по количественному анализу сигнала.
Значительные перспективы открываются в связи с применением нанокристаллов — квантум-дотов (QDs). Эти нанокристаллы при облучении светом даже в широком спектральном диапазоне дают узкую специфическую полосу эмиссии с ярко выраженным пиком, характеризуются длительным жизненным циклом флуоресценции и отсутствием фотобликов (9). Квантум-доты представляют собой полупроводниковые нанокристаллы размером от 1 до примерно 10 нм. Полупроводниковый материал отбирается преимущественно из элементов II.B и VI.A групп периодической таблицы Менделеева, в частности используется селенид кадмия (CdSe), сульфид кадмия (CdS), селенид цинка (ZnSe) и сульфид цинка (ZnS). QDs могут состоять из одного вещества (например, CdSе или ZnS) или из специфически построенных компонентов коровых конфигураций (типа CdSe-ZnS). Характерно, что меньшие по размеру частицы дают свечение с меньшей длиной волны и наоборот. Так, QDs, представленные CdSe-наночастицами с размером 2,8 нм, показывают флуоресценцию в области 535 нм, тогда как CdSe-наночастицы с размером 5,6 нм имеют эмиссию с максимумом 640 нм. PbSe-QDs с разным диаметром могут флуорес-цеировать в области, близкой к инфракрасной.
Блокирование избытка стрептавидиновых сайтов биоцетином
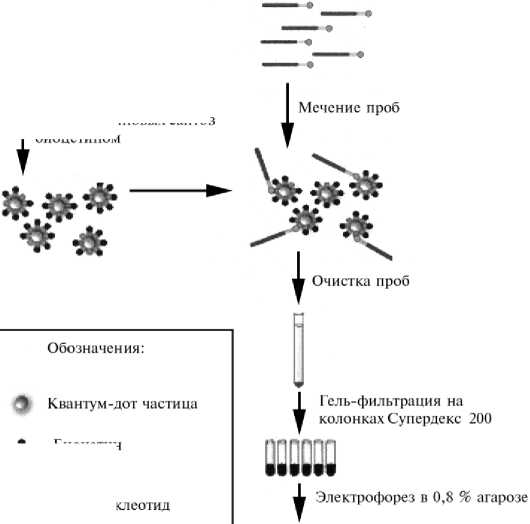
Биоцетин
Биотин
С54-спейсер
Стрептавидин
Рис. 2. Cхема подготовки квантум-дот ( QD) олигонуклеотидной пробы, стратегически меченной для применения в флуоресцентной гибридизации in situ (FISH).

Схема подготовки меченых проб для FISH с использованием QD-нанокристаллов приведена на рисунке 2.
При выборе люминофоров следует учитывать их свойства, влияющие на обработку биообъекта и информативность полученного окрашивания.
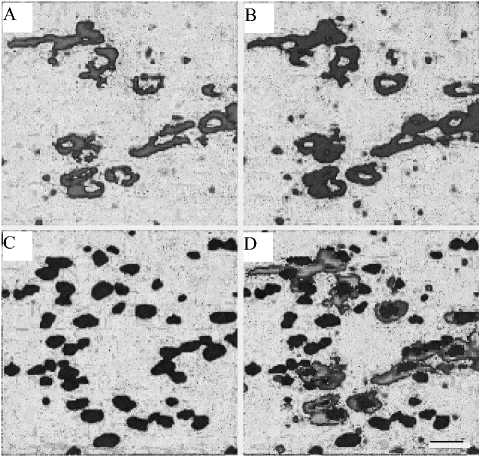
Рис. 3. Флуоресцентная гибридизация in situ ( FISH) нейронов cубстанции Нигра среднего мозга мыши. А — c использованием метки QD 525; B — с QD 585; С — с использованием DAPI флуорохрома для выявления ядер клеток; D — наложение сигналов DAPI и QD 525 + QD 585. Флуоресцентный сигнал для DAPI и QDs определялся под микроскопом Zeiss Meta 510 LSM с использованием диод-405 синего лазера. Шкальная полоска — 20
мкм.
Идеальные требования к люминесцирующим материалам и их смесям следующие: четкая одноволновая или монораспространенная узкая световая эмиссия для каждой индивидуальной люминесцирующей субстанции; эмиссионный спектр, который не зависит от возбуждающего света в определенном диапазоне длин волн возбуждения; единый источник света для всех люминесцирующих субстанций, используемых в смеси; отсутствие взаимодействия (перехода энергий) между флуоресцирующими молекулами, то есть каждая люминесцирующая субстанция реагирует на возбуждающий свет независимо от другой; от-сутствие влияния матричного материала на эмиссионные свойства; хо- рошая смешиваемость люминесцирующей субстанции с выбранной системой «матричный материал/растворитель»; легко доступная сменяемость интенсивности и длин волн спектра флуоресценции (10).
Полупроводниковые нанокристаллы соответствуют большинству из перечисленных требований и потому максимально пригодны для работ с использованием множественной кодирующий оптической технологии в применении к биоанализу.
Рисунок 3 иллюстрирует использование QD-нанокристаллов в FISH-исследованиях нейронов среднего мозга мыши. Определяли мРНК везикулярного моноаминного транспортера (переносчика) ( Vmat2 ) . Применялась двойная метка FISH c использованием QD 525 и QD 585 олигонуклеотидных проб для окрашивания нейронов в SN (субстанция Нигра). FISH сигнал на мРНК был получен только в цитоплазме при достаточно низком фоновом шуме. Следует обратить внимание на комплексное наложение QD 525 и QD 585 сигнала и довольно чистую флуоресценцию DAPI окрашенных ядер клеток ( D ).
In situ гибридизация используется для локализации специфических последовательностей нуклеиновых кислот на клеточном уровне, однако следует отметить относительно низкую чувствительность этого метода.
In situ обратная транскрипция—полимеразная цепная реакция (IS RT-PCR) умножает чувствительность выявления таких локализаций, в том числе и низкокопийных мРНК в клетке. Однако применимость метода ограничена неспецифической амплификацией фрагментов вследствие ложного прайминга и/или вовлечения в реакцию частично переваренных остатков геномной ДНК. В последних работах неспецифическая фоновая амплификация преодолевается посредством предварительной обработки образцов рестриктазами перед перевариванием ДНКазой I (11).
Принципиально схему FISH RT-PCR можно представить следующим образом. На первом этапе (фиксация и заливка блока ткани) проводят пропитку в 2 % формальдегиде на фосфатно-солевом буфере (РBS) и заливку в парафин с предварительной спиртовохлороформенной обработкой. Далее выполняют микротомирование (толщина срезов 7-10 мкм) и обработку образцов ткани ферментами — рестриктазами, ДНКазой, а затем РНК-обратной транскриптазой. После этого осуществляют мечение флуорохромом праймера-5′ для РСR (первый вариант) либо введение гаптенизированного dUТP для последующего флуорохромирования (второй вариант). Следующий этап — термоциклирование и полимеризация генного фрагмента в цепной реакции (PCR). Для этого используется термоциклер MJRPTC-100 («MJ Research», Watertown, MA), оборудованный держателем стекол. Наконец, проводят бальзамирование образца и микроскопирование на конфокальном лазерном сканирующем микроскопе Zeiss LSM 510 (Германия) с аргонным и гелий-неоновым лазерами.
Праймер-шаблоны с присоединенными флуоресцентными красителями, например Су5, в РСR позволяют идентифицировать комплементарные мРНК под флуоресцентным микроскопом. Такие приемы помогают увеличивать специфичность и ускорять детекцию клеточной мРНК и тем самым расширять возможности метода в генодиагностике (11). Особое значение в этих исследованиях имеет конфокальный лазерный сканирующий микроскоп Zeiss LSM 510, применение которого стало неотъемлемой частью современных биотехнологических исследований, позволяющих контролировать манипуляции на генном уровне (рис. 4).
Некоторые принципиальные особенности этого устройства следующие. Объектив микроскопа фокусирует лазерный луч на образце, являющемся источником флуоресценции. Флуоресцентный пучок собирается на детекторе, проходя через полупрозрачное зеркало. Эмиссионный фильтр отбирает интересующие области спектра. Пинхоль (конфокальная апертура) расположен против детектора в плоскости, конъюгированной с фокальной плоскостью объектива. Свет, проходящий через эту плоскость выше или ниже фокальной плоскости, выходит за фокус и не попадает на пинхоль, в результате чего не участвует в формировании изображения.
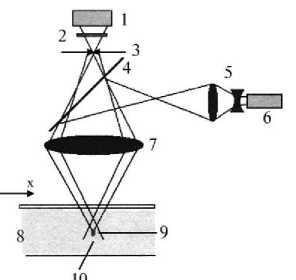
Рис. 4. Конфокальный путь луча при лазерном микроскопировании: 1 — детектор (фотоумножитель), 2 — эмиссионный фильтр, 3 — пинхоль, 4 — дихроическое зеркало, 5 — растяжитель луча, 6 — лазер, 7 — объектив микроскопа, 8 — среда, 9 — фокальная плоскость, 10 — определяемый объем; x и z — соответственно плоскость и глубина анализа.
Особенностью конфокального лазерного сканирующего микроскопа по сравнению с обычным является конфокальная апертура
(или пинхоль), расположенная в плоскости, конъюгированной с промежуточной плоскостью изображения и, таким образом, с плоскостью объекта. В результате на детекторе (фотоумножителе) регистрируется только то, что прошло через пинхоль. Диаметр пинхоля может быть различным, в идеале — бесконечно малым, и таким образом детектор улавливает точку (точковая детекция). Поскольку луч лазера сфокусирован на дифракционно ограниченное пятно, которое высвечивает только точку объекта в данное время, то светящаяся точка и наблюдаемая точка (точки объекта и изображения) формируются в конъюгированной плоскости, то есть они фокусируются одна по отношению к другой, что и называется конфокальным путем луча (см. рис. 4).
В обычном световом микроскопе оптический переход «объект–изображение» происходит одновременно и параллельно во всех точках. Напротив, образец в конфокальном лазерном сканирующем микроскопе освещается способом «точка за точкой», то есть серийно, и физическое взаимодействие между лазерным лучом и светящимися элементами образца (в том числе люминесцентными) также измеряется «точка за точкой». Для получения информации о целом образце необходимо вести лазер через образец или двигать образец относительно лазерного луча — это процесс, известный как сканирование. Соответственно конфокальные системы осуществляют сканирование по точкам, а для получения изображения всего объекта подключается компьютерная цифровая программа.
Итак, мы попытались описать ключевые особенности новой технологии изучения работы генов в клетках и тканях живых организмов. Предоставляемые этими технологиями возможности составляют основу для прорыва в исследованиях эффективности развития тех или иных признаков сельскохозяйственных животных. В частности, с помощью современной технологии детекции мРНК в клетках можно получить объективные свидетельства функциональной активности интегрированных генов у трансгенных животных, что во всех отношениях является одной из актуальнейших проблем биотехнологии в животноводстве.
Л И Т Е Р А Т У Р А
-
1. Л ь ю и н Б. Гены. М., 1997.
-
2. D i r k s R.W. RNA molecules lighting up under the microscope. Histochem. Cell Biol., 1996, 106: 151-166.
-
3. A n t e q u e r a F., B i r d A. Predicting the total number of human genes. Nature Genet., 1994, 7: 345-346.
-
4. Г о л ь д м а н И.Л., Э р н с т Л.К., Б р е м Г. и др. Получение трансгенных овец — продуцентов молока, содержащего физиологически активные белки, в условиях племенной фермы. С.-х. биол., 1994, 6: 46-53.
-
5. Ш и х о в И.Я. Структурные изменения в молочной железе трансгенных по химозину овец. В сб.: Мат. конф. ВИЖ «ДНК-технологии». Дубровицы, 2001: 98-100.
-
6. B a s s B. Double-stranded RNA as a template for gene silencing. Cell, 2000, 101(3): 235-238.
-
7. F i r e A.Z., M e l l o C.C. The Nobel Prize in physiology or medicine 2006. http//nobelprize.org.
-
8. C h a n P.M., Y u e n T., R u f F. е.а. Method for multiplex cellular detection of mRNAs using quantum dot-fluorescent in situ hybridization. Nucl. Acids Res., 2005, 33(18):
-
9. P i n a u d F., M i c h a l e t X., T s a y J.M. е.а. Advances in fluorescence imaging with quantum dot bio-probes. Biomaterials, 2006, 27(9): 1670-1687.
-
10. С h a n g S., Z h o u M., G r o v e r C.P. Information coding and retrieving using fluorescent semiconductor nanocrystals for object identification. Optic Express, 2004, 12(1):
-
11. K h e r R., B a c a l l a o R. Direct in situ reverse transcriptase-polymerase chain reaction Am. J. Physiol.-Cell Physiol., 2001, 281: 726-732.
143-148.
ГНУ Всероссийский НИИ животноводства Россельхозакадемии,


