Направленная доставка доксорубицина с помощью экзогенных биосовместимых нановекторов при экспериментальных неоплазиях
Автор: Заборовский Андрей Владимирович, Кокорев Александр Викторович, Бродовская Екатерина Павловна, Фирстов Сергей Александрович, Минаева Ольга Владимировна, Куликов Олег Александрович, Червякова Наталья Николаевна, Медвежонков Вячеслав Юрьевич
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Медико-биологические науки
Статья в выпуске: 1, 2017 года.
Бесплатный доступ
Введение. В статье предложен метод получения конъюгата противоопухолевого химиопрепарата доксорубицин с экзогенной двухцепочечной ДНК осетровых рыб (источник - коммерческий препарат «Деринат»). Были подобраны оптимальные условия синтеза конъюгата (рН, температура и массовое соотношение компонентов), обеспечивающие наибольшую степень связывания химиопрепарата с носителем. Проведено исследование токсичности и специфической противоопухолевой активности синтезированного комплекса. Материалы и методы. Синтез конъюгатов ДНК-доксорубицин проводили смешиванием раствора ДНК, водного раствора доксорубицина и фосфатного буфера. Смесь инкубировали 60 мин при постоянной температуре и непрерывном шей-кировании. Очистку конъюгата от невключившегося химиопрепарата проводили методом ультрафильтрации. Показатели токсичности препарата установлены на интактных мышах в соответствии с принятыми стандартами. Противоопухолевая активность оценивалась по индексу торможения роста опухоли и индексу ингиби-рования метастазирования на мышах с трансплантированной карциномой Льюис. Специфическая противоопухолевая активность была исследована в эквитоксиче-ских дозах препарата. Результаты исследования. Было установлено, что при введении в эквитоксиче-ских дозах конъюгат обладает большей противоопухолевой активностью, чем водорастворимый препарат (на 35 % по объему опухоли и на 51 % по индексу торможения роста опухоли). Все исследованные формы, за исключением водорастворимого доксорубицина в дозе 0,5 LD10, достоверно уменьшали количество метастазов опухоли в легкие. Метастазов в группах, получавших ДНК-конъюги-рованный препарат, было меньше, чем в группах, которым проводили лечение водным доксорубицином, однако эти различия не были статистически значимыми. Обсуждение и заключения. Наиболее вероятным механизмом увеличения противоопухолевой активности доксорубицина при его конъюгации с ДНК является избирательное накопление химиопрепарата в опухолевой ткани, обусловленное эндоцитозом комплекса ДНК-доксорубицин.
Доксорубицин, противоопухолевый препарат, направленная доставка лекарств, днк-коньюгат, токсичность
Короткий адрес: https://sciup.org/14720246
IDR: 14720246 | УДК: 61:577.2 | DOI: 10.15507/0236-2910.027.201701.093-107
Текст научной статьи Направленная доставка доксорубицина с помощью экзогенных биосовместимых нановекторов при экспериментальных неоплазиях
Results. It is found that administered in the toxically equivalent doses conjugate has a higher antitumor activity than soluble drug (up to 35 % by volume of the tumor and 51 % by the index of tumor growth inhibition). It is found that all investigated forms except the water soluble doxorubicin 0,5 LD10, significantly reduced the number of tumor metastases in the lungs. The number of metastases in animals treated with DNA-conju-gated drug was lower than in the animals that were treated with aqueous doxorubicin, but these differences were not statistically significant.
Discussion and Conclusions . The most probable mechanism of increasing antitumor activity of the DNA-conjugated doxorubicin is a selective accumulation of the drug in the tumor tissue, due to the endocytosis of the DNA complex.
Повышение избирательности противоопухолевых химиотерапевтических агентов является одной из наиболее актуальных задач онкофармакологии. Наиболее распространенный путь ее решения – связывание цитостатического химиопрепарата с тем или иным вектором, который может обеспечить специфическое связывание с рецепторами на поверхности опухолевой клетки и последующий эндоцитоз. Наше внимание привлекла возможность использования в качестве такого вектора нативной экзогенной ДНК.
Обзор литературы
Известно, что экзогенная ДНК может фагоцитироваться клетками животных [1–8]. Установлено, что эндоцитоз ДНК имеет рецептор-опосредованный характер [2–6]. Этот механизм внутриклеточного проникновения ДНК был выявлен также для опухолевых клеток [7–8]. Данные факты послужили основанием для использования экзогенной ДНК в качестве вектора для направленной доставки противоопухолевых химиопрепаратов [9–12]. Однако в приведенных работах для синтеза конъюгата ДНК с доксорубицином (Докс) использовали не чистый химиопрепарат, а его комплекс с человеческими альбумином. Фактически альбумин выступал в роли линкера при связывании химиопрепарата с ДНК. Необходимо отметить, что в водной среде при температуре тела ДНК образует прочные комплексы только с катионными полимерами, а конъюгат с нативным альбумином, имеющим сравнимое количество анионных и катионных групп, является недостаточно стабильным [13–15]. Поскольку альбумин в условиях стресса может достаточно интенсивно поглощаться клетками [16–17], в том числе опухолевыми [18], невозможно установить роль каждого из векторов в транспорте химиопрепарата, то ставит под сомнение необходимость использования ДНК. В связи с этим нами был разработан и апробирован метод синтез конъюгата ДНК-Докс, не требующий использования альбумина.
Цель работы – разработка метода синтеза конъюгата противоопухолевого химиопрепарата доксорубицин с ДНК, исследование токсичности и специфической противоопухолевой активности синтезированного конъюгата.
Материалы и методы
Материалы
В работе были использованы следующие реактивы:
– ДНК-Na (источник – коммерческий препарат «Деринат», ЗАО «Тех-номедсервис», Россия);
– доксорубицина гидрохлорид (Dox), > 98 % (Sigma-Aldrich, США);
– вода Milli-Q;
– фосфатный буфер (PBS) (Sigma-Aldrich, США);
– раствор Хенкса (ООО «Биолот», Россия).
Синтез конъюгатов ДНК-Докс
В стерильных условиях смешивали 2 мл раствора ДНК с содержанием субстанции 15 мг/мл, 2 мл водного раствора Докс с содержанием препарата 7,5, 10 или 15 мг/мл (в зависимости от серии) и 2 мл фосфатного буфера с рН 7.0 либо 8.0 (в зависимости от серии). Описание серий приведено в разделе «результаты». Смесь инкубировали 60 минут при постоянной температуре (4 оС, 20 оС и 37 оС) и непрерывном шейкировании. Полученный конъюгат очищали от свободного Докс методом ультрафильтрации на оригинальной установке [19] с использованием целлюлозной мембраны Q1210-55 F3 («Orange scientific», Бельгия) с диаметром пор 12–14 кДа; продолжительность процедуры – 4 ч. Для каждого переменного параметра (рН, температура, соотношение реагентов) выполняли по 3 синтеза. Степень включения препарата в конъюгат рассчитывали по формуле:
ω = (m0 – m) / m0 ∙ 100 %, где m0 – исходное количество Докс, m – количество невключившегося Докс (рассчитывали по концентрации в ультрафильтрате).
Концентрацию препарата в ультрафильтрате определяли спектрофотометрически на спектрофотометре UV-2600 Shimadsu (Япония) при длине волны 490 нм по предварительно построенному калибровочному графику.
Эксперименты на животных
Животные для исследования были получены из питомника «Столбовая» и содержались в стандартных условиях вивария. Эксперименты на животных проводились с соблюдением норм биоэтики после одобрения локальным этическим комитетом при ФГБОУ ВО «МГУ им Н. П. Огарёва».
Исследование острой токсичности
Исследование токсичности было выполнено на 240 белых мышах линии BALB. Животные были разделены на 4 группы (1 контрольную и 3 опытных). В контрольной группе животным внутривенно вводили 0,2 мл изотонического раствора натрия хлорида. В 1-й опытной группе вводили внутривенно Докс; в 2-й – Докс, конъюгированный с ДНК; в 3-й – 1,5%-ный раствор ДНК. Внутри опытных групп было выделено по 6 подгрупп (в каждой 5 особей мужского пола и 5 – женского), в которых вводили препараты в дозах 2, 4, 8, 16, 24, и 32 мг/кг в пересчете на чистый Докс соответственно. Животные наблюдались в течение 30 дней, ежедневно фиксировалась летальность. Определение показателей токсичности проводилось с помощью probit-analisys. Также были рассчитаны LD10, LD50 и LD100 исследуемых субстанций и их 95%-ные доверительные интервалы.
Исследование противоопухолевой активности
Исследование противоопухолевой активности было проведено на 60 мышах обоего пола линии С57Вl/6. Противоопухолевую активность изучали на сингенной опухолевой системе из банка опухолевых штаммов ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России – карциноме легкого Льюис (LLC).
Опухолевую ткань LLC трансплантировали животным внутримышечно в бедро задней лапки слева в количестве 1×106 клеток в растворе Хенкса. На 22-е сут. после трансплантации опухолевых клеток животные выводились из эксперимента.
Противоопухолевое и антимета-статическое действие оценивали в соответствии с методическими рекомендациями по изучению специфической активности противоопухолевых препаратов, действующими в РФ [20–21].
В процессе эксперимента определяли объем первичного опухолевого узла, а в конце эксперимента – его массу. Количество метастазов в легких подсчитывали после фиксации их в растворе Карнуа с помощью бинокулярной лупы МБС-9 (увеличение 16х). Размеры опухолей на месте трансплантации определяли с помощью штангенциркуля и рассчитывали их объем по формуле эллипсоида:
V = 0,131 ∙ L ∙ (D1 + D2)2, где L – длина опухоли; D1 и D2 – два взаимно перпендикулярных диаметра.
Инъекции препаратов производились внутривенно трехкратно с интервалом в 72 ч сут. начиная с 7-х сут. после перевивки штамма LLC. Выбор доз был сделан на основе проведен- составили половину LD10, во 2-й и 4-й – ных токсикологических исследований LD10. Доза ДНК в 5-й группе соответ-(сравнивались эквитоксические дозы). ствовало дозе в группе с высшей дозой В 1-й и 3-й группах дозы препаратов конъюгата (табл. 1).
Т а б л и ц а 1
T a b l e 1
Противоопухолевую активность оценивали по индексу торможения роста опухоли (ИТРО), который рассчитывали по формуле:
ИТРО = (Vк – Vо) / Vк ∙ 100 %, где Vк и Vо – средний объем опухоли в контрольной и опытных группах соответственно.
Об антиметастатическом действие препаратов судили по следующим показателям.
-
1. Частота метастазирования опухоли – процент животных с метастазами по отношению к общему количеству животных в группе;
-
2. Среднее количество метастазов на одно животное в каждой группе.
-
3. Индекс ингибирования метастазирования (ИИМ):
ИИМ = (( А к ∙ В к) –
– (А ∙ В)) / Ак ∙ Вк ∙ 100%, где Ак и А – частота метастазирования в легкие у мышей контрольной и опытной групп; Вк и В – среднее количество метастазов в легких на одно животное в контрольной и опытной группах соотвественно.
Статистическую обработку данных осуществляли с использованием t-критерия Стьюдента и критерия хи-квадрат. Критический уровень значимости различий принимался равным 5 % (р < 0,05).
Результаты исследования
Разработка метода синтеза конъюгата ДНК-Докс
Исследовано влияние концентрационных отношения ДНК-Докс, рН и температуры на эффективность связывания ДНК с Докс (табл. 2).
Схемы проводимой терапии
Schemes of the therapy
|
Группа / Group |
N |
Препарат / Drug |
Доза / Dose |
|
|
% от LD |
mg |
|||
|
Контрольная / Control |
10 |
– |
– |
– |
|
1-я опытная / 1st experimental |
10 |
Водорастворимый Докс / Water solvable Dox |
0,5 LD 10 |
2 mg/kg |
|
2-я опытная / 2nd experimental |
10 |
Водорастворимый Докс / Water solvable Dox |
LD10 |
4 mg/kg |
|
3-я опытная / 3rd experimental |
10 |
Конъюгат ДНК-Докс / DNA conjugated Dox |
0,5 LD10 |
6 mg/kg (Dox) |
|
4-я опытная / 4th experimental |
10 |
Конъюгат ДНК-Докс / DNA conjugated Dox |
LD10 |
12 mg/kg (Dox) |
|
5-я опытная / 5th experimental |
10 |
ДНК / DNA |
– |
7,5 mg/kg (DNA) |
Т а б л и ц а 2
T a b l e 2
Эффективность связывания Докс ДHК при различных параметрах синтеза Efficiency of doxorubicin-DNA conjugation at different synthesis parameters
|
рН |
Массовое соотношение ДНК/Докс / Mass ratio DNA/Dox |
Температура, оС / Temperature, оС |
Степень конъюгации / Conjugation level |
Содержание Докс (мг на 1 мг ДНК) / Dox contents (mg per 1 mg of DNA) |
|
7,0 |
2:1 |
4 |
74 ± 3 |
0,37 ± 0,02 |
|
21 |
64 ± 3 |
0,32 ± 0,01 |
||
|
37 |
48 ± 4 |
0,24 ± 0,01 |
||
|
3:2 |
4 |
71 ± 5 |
0,47 ± 0,02 |
|
|
21 |
66 ± 4 |
0,44 ± 0,02 |
||
|
37 |
61 ± 6 |
0,41 ± 0,03 |
||
|
1:1 |
4 |
Комплекс нестабилен / Complex is unstable |
||
|
21 |
42 ± 3 |
0,42 ± 0,01 |
||
|
37 |
38 ± 4 |
0,38 ± 0,02 |
||
|
8,0 |
2:1 |
4 |
43 ± 5 |
0,22 ± 0,03 |
|
21 |
39 ± 5 |
0,20 ± 0,03 |
||
|
37 |
34 ± 6 |
0,17 ± 0,03 |
||
|
3:2 |
4 |
44 ± 3 |
0,29 ± 0,01 |
|
|
21 |
42 ± 4 |
0,28 ± 0,02 |
||
|
37 |
38 ± 6 |
0,25 ± 0,03 |
||
|
1:1 |
4 |
Комплекс нестабилен / Complex is unstable |
||
|
21 |
32 ± 6 |
0,32 ± 0,03 |
||
|
37 |
29 ± 5 |
0,29 ± 0,02 |
||
В кислой среде коллоидная система была нестабильной, в связи с чем исследовалась эффективность синтеза при нейтральном и слабощелочном значении рН. Из табл. 2 видно, что оптимальным для синтеза конъюгата является нейтральное значение рН, причем по мере понижения температуры степень включения Докс в конъюгат увеличивалась. Наибольшее содержание химиопрепарата на единицу массы носителя отмечалось при массовом соотношении ДНК/Докс 3:2. Таким образом, для синтеза конъюгата, использованного в данной работе, были выбраны следующие условия: рН = 7,0; температура 4 оС; массовое соотношение ДНК/Докс = 3:2. Последовательность операций синтеза описана выше.
Известно, что одним из главных механизмов противоопухолевого эффекта Докс является интеркаляция между нуклеотидами во время синтеза ДНК, что прерывает последний. В связи с этим возникает вопрос
о том, не будет ли потеряна активность препарата при взаимодействии с ДНК in vitro? Однако результаты ранее проведенных исследований [10–12], а также полученные в настоящей работе показывают, что Докс, связанный с экзогенной ДНК, сохраняет свою противоопухолевую активность. Этот феномен, видимо, объясняется тем, что в использованных условиях синтеза не происходит необратимого связывания Докс с нуклеотидами; данные связи с нуклеотидами в составе ДНК имеют не ковалентный, а водородный характер (средняя энергия связи – 4,9 ккал/моль) [22–23]. Фагоцитированные комплексы ДНК-Докс разрушаются эндонуклезами, что сопровождается высвобождением химиопрепарата внутри клетки.
Исследование острой токсичности конъюгата ДНК-Докс
Результаты исследования острой токсичности Докс представлены в табл. 3–4.
Т а б л и ц а 3
T a b l e 3
Летальность животных при введении различных лекарственных форм Докс Lethality of animals when injecting different doxorubicin forms
|
Группа / Group |
Исследуемая субстанция / Substance |
Летальность (абс. %) в зависимости от дозы Докс, мг/кг / Lethality (abs %) depending on dose of Dox, mg/kg |
|||||
|
2 |
4 |
8 |
16 |
24 |
32 |
||
|
1 |
Водорастворимый Докс / Water solvable Dox |
0 |
1 |
3 |
7 |
10 |
10 |
|
2 |
Конъюгат ДНК-Докс / DNA-Dox conjugate |
0 |
0 |
2 |
5 |
8 |
10 |
|
3 |
ДНК / DNA |
0 |
0 |
0 |
0 |
0 |
0 |
Т а б л и ц а 4
T a b l e 4
Показатели острой токсичности различных лекарственных форм Докс Acute toxicity markers for different doxorubicin forms
|
Показатели / Markers |
Водный раствор Докс / Water solution of Dox |
Конъюгат ДНК-Докс / DNA-Dox conjugate |
||
|
Доза, мг / Dose, mg |
U95* |
Доза, мг / Dose, mg |
U95* |
|
|
1 |
2 |
3 |
4 |
5 |
|
LD10 |
4,4 |
2,1–6,4 |
6,2 |
2,7–9,0 |
|
LD 50 |
9,9 |
7,1–13,4 |
14,6 |
10,5–19,9 |
|
LD100 |
43,9 |
27,7–118,2 |
69,5 |
41,1–256,8 |
Примечание: * – 95%-ный доверительный интервал / Note: * – 95% confidence interval
Периоды наблюдения, сут. / Periods of observation, day
-
• Контроль (LLC) / Control (LLC)
-
— •— Водорастворимый ДР LD;0/ Water-soluble DR LDW
— Конъюгат ДР-ДНК LDJt / Conjugate DR-DNA LDM
-
— *— Водорастворимый ДР 0,5 LD;„ / Water-soluble DR 0,5 LD10
Конъюгат ДР-ДНК 0.5 LDK / Conjugate DR-DNA 0.5 LD^
-■-ДНК/ОКА
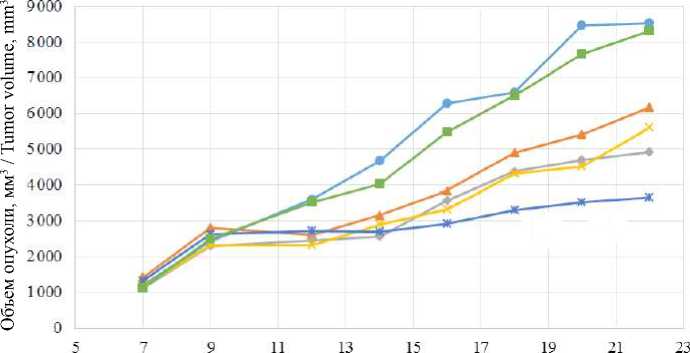
Р и с у н о к. Динамика объема опухоли в группах (* – достоверное отличие объема опухоли в группе водорастворимого Докс от аналогичного показателя в группе ДНК-конъюгированного Докс в дозе LD10) F i g u r e. Dynamics of tumor volume in groups. For all groups except the group treated with DNA, the tumor volume is significantly different from that of the control group starting from the 14th day.
* – significant difference in tumor volume in the group of water-soluble Dox and the group of DNA conjugated Dox in LD10 doses)
Медико-биологические науки
Из табл. 4 видно, что токсические дозы конъюгата в среднем в 1,5 раза выше по сравнению с водорастворимым Докс. Причиной снижения токсичности может быть неполная диссоциация конъюгата в соматических клетках, меньшее накопление в миокарде, а также ингибирование прооксидантного эффекта Докс нуклеиновой кислотой. Учитывая, что уменьшение токсично-
сти может сопровождаться снижением специфической противоопухолевой активности химиопрепарата, для дальнейшего исследования были использованы эквитоксические дозы химиопрепарата.
Исследование противоопухолевой активности
Результаты оценки объема опухоли представлены на рисунке; индекс торможения роста опухоли – в табл. 5.
Т а б л и ц а 5
T a b l e 5
Видно, что на фоне химиотерапии происходило торможение роста опухоли во всех группах животных. На 14-е сут. наблюдения появились статистически значимые различия в объеме
опухоли между контрольной и всем опытными группами. Между опытными группами достоверных различий в данных показателях не было зарегистрировано до 20-х сут. наблюде-
Значения индекса торможения роста опухоли в группах
The values of Tumor Growth Inhibition Index (TGII) in the groups
воримого Докс на 20 и 22 сут. составляла 14,1 и 15,0 процентных пунктов (или 50,9 и 52,8 %) соответственно.
Аналогичная тенденция отмечалась также для групп животных, получавших препарат в дозе 0,5 LD10, однако статистически эти различия подтверждены не были.
Т а б л и ц а 6
T a b l e 6
Результаты оценки антиметастатической активности
Results of antimetastatic activity investigation
|
Группы животных / Groups of animals |
Масса опухоли на 22-е сут., г (M ± сигма) / Tumor mass on the 22nd day, g (M ± sigma) |
Частота метастазирования % / Frequency of metastases, % |
Среднее число поверхностных метастазов (M ± сигма) / Average number of metastases on the surface (M ± sigma) |
Индекс ингибирования метастазирования / Metastasis Inhibition Index |
|
Контрольная (без лечения) / Control (no treatment) |
8,8 ± 2,9 |
100 |
94,7 ± 4,2 |
– |
|
Водорастворимый Докс, 0,5 LD 10 / Water-soluble doxorubicin, 0,5 of LD10 |
6,4 ± 2,1 |
100 |
71,2 ± 6,9 |
24,8 |
|
Конъюгат ДНК-Докс, 0,5 LD / DNA-Dox conjugate, 10 0,5 LD10 |
5,8 ± 2,4 |
100 |
65,3 ± 11,2 |
31,0 |
|
Водорастворимый Докс, LD10 / Water-soluble doxorubicin, LD10 |
5,1 ± 2,2 |
90 |
44,5 ± 12,1 |
57,7 |
|
Конъюгат ДНК-Докс, LD10 / DNA-Dox conjugate, LD10 |
4,1 ± 1,8 |
80 |
35,6 ± 9,8 |
69,9 |
|
ДНК / DNA |
8,6 ± 3,1 |
100 |
90,2 ± 8,5 |
4,8 |
Примечание: полужирный шрифт – достоверные отличия от контрольной группы / Note: bold is significant differences from the control group
При оценке антиметастатической активности было установлено, что все исследованные формы, за исключением водорастворимого Докс в дозе 0,5 LD10, достоверно снижали количество метастазов опухоли в легкие. Число метастазов в группах, получавших ДНК-конъюгированный препарат, было меньше, чем группах, которым проводили лечение водным Докс, однако эти различия не были статистически значимыми. Наиболее вероятным механизмом увеличения противоопухолевой активности Докс при его конъюгации с ДНК является избирательное накопление химиопрепарата в опухолевой ткани, обусловленное эн-доцитозом комплекса ДНК-Докс.
Обсуждение и заключения
В результате исследования был предложен метод получения конъюгата противоопухолевого химиопрепарата Докс с экзогенной двухцепочечной ДНК; проведено исследование токсичности и специфической противоопухолевой активности синтезированного комплекса; показано, что токсичность конъюгата ниже, чем у свободного Докс (LD50 были равны 14,6 мг/кг и 9,9 мг/кг для конъюгата и Докс соответственно). Введение в эквитоксических дозах конъюгата обладает большей противоопухолевой активностью, чем водорастворимый препарат (максимум на 35 % по объему опухоли и на 51 % по ИТРО).
Все авторы прочитали и одобрили окончательный вариант рукописи.
Medical and biological sciences 105
106 Медико-биологические науки
All authors have read and approved the final manuscript.
Список литературы Направленная доставка доксорубицина с помощью экзогенных биосовместимых нановекторов при экспериментальных неоплазиях
- Lamers M. C., De Groot Е. R., Roos D. Phagocytosis and degradation of DNA-anti-DNA complexes by human phagocytes. I. Assay conditions, quantitative aspects and differences between human blood monocytes and neutrophils//Eur. J. Immunol. 1981. Vol. 11 (10). P. 757-764 DOI: 10.1002/eji.1830111005
- Receptor-Mediated Endocytosis and Nuclear Transport of a Transfecting DNA Construc/A. A. Rosenkranz //Experimental cell research. 1992. Vol. 199. P. 323-329. 4827(92)90441-A DOI: 10.1016/0014-
- Guy J., Drabek D., Antoniou M. Delivery of DNA into mammalian cells by receptor-mediated endocytosis and gene therapy//Mol. Biotechnol. 1995. Vol. 3. P. 237-248 DOI: 10.1007/BF02789334
- Таргетный транспорт противоопухолевых химиопрепаратов: современные технологии и перспективы развития/Н. А. Пятаев //Поволжский онкологический вестник. 2012. № 2. С. 60-71. URL: http://elibrary.ru/item.asp?id=18903294
- Hypothesis: naked plasmid DNA is taken up by cells in vivo by a receptor-mediated process/V. Bud-ker //J. Gene. Med. 2000. Vol. 2. P. 76-88. DOI: 10.1002/(SICI)1521-2254(200003/04)2:23.0.CO;2-4
- Kensuke M., Masahiro O. Endocytosis-free DNA sensing by cell surface TLR9 in neutrophils: Rapid defense with autoimmune risks//Eur. J. Immunol. 2013. Vol. 43. P. 2006-2009. DOI: 10.1002/eji.201343882
- Wittrup A., Belting M. Characterizing peptide-mediated DNA internalization in human cancer cells//Methods Mol. Biol. 2009. Vol. 480. P. 101-112 DOI: 10.1007/978-1-59745-429-2_7
- Orava Е. W., Cicmil N., Gariepy J. Delivering cargoes into cancer cells using DNA aptamers targeting internalized surface portals//Biochimica et Biophysica Acta. 2010. Vol. 1798. P. 2190-2200 DOI: 10.1016/j.bbamem.2010.02.004
- Comparative study in mice of the toxicity, pharmacology, and therapeutic activity of daunorubicin-DNA and doxorubicin-DNA complexes/D. Depres-de Campeneere //Cancer Chemother. Pharmacol. 1979. Vol. 2. P. 25-30. URL: https://www.ncbi.nlm.nih.gov/pubmed/?term=Deprez-De+Campeneere+D.% 2C+Baurain+R%2C+Huybrechts+M+and+Trouet+A+%2F%2F
- Self-assembled, aptamer-tethered DNA nanotrains for targeted transport of molecular drugs in cancer theranostics/G. Zhu //Proc. Natl. Acad. Sci. USA. 2013. Vol. 110 (20). P. 7998-8003. DOI: 10.1073
- Особенности тканевого распределения и противоопухолевой активности доксорубицина при введении в форме конъюгата с ДНК у крыс с трансплантированной карциномой РС-1/Н. А. Пята-ев //Российский биотерапевтический журнал. 2011. № 10 (2). P. 55-59. URL: http://elibrary.ru/item.asp?id=18884986
- Эффективность ДНК-конъюгированных форм доксорубицина и цисплатина при холанги-оцеллюлярной карциноме у крыс/Н. А. Пятаев //Фундаментальные исследования. 2014. № 10-5. P. 959-963. URL: https://www.fundamental-research.ru/pdf/2014/10-5/35773.pdf
- Fried M. G., Bromberg J. L. Factors that affect the stability of protein-DNA complexes during gel Electrophoresis//Electrophoresis. 1997. Vol. 18, no. 1. P. 6-11 DOI: 10.1002/elps.1150180103
- Effect of Albumin and Polyanion on the Structure of DNA Complexes with Polycation Containing Hydrophilic Nonionic Block/D. Oupicky //Bioconjugate Chem. 1999. Vol. 10 (5). P. 764-772. URL: https://www.ncbi.nlm.nih.gov/pubmed/10502341
- Cationized human serum albumin as a non-viral vector system for gene delivery? Characterization of complex formation with plasmid DNA and transfection efficiency/D. Fischer //Int. J. Pharm. 2001. Vol. 225. P. 97-111. URL: https://www.ncbi.nlm.nih.gov/pubmed/11489558
- Albumin-based drug delivery as novel therapeutic approach for rheumatoid arthritis/A. Wunder //J. Immunol. 2003. Vol. 170. P. 4793-4801. URL: https://www.ncbi.nlm.nih.gov/pubmed/?term=16.%09Albumin-based+drug+delivery+as+novel+therapeutic+approach+for+rheumatoi d+arthritis
- Native albumin for targeted drug delivery/E. Neumann //Expert Opin. Drug Deliv. 2010. Vol. 7. P. 915-925 DOI: 10.1517/17425247.2010.498474
- Frei E. Albumin binding ligands and albumin conjugate uptake by cancer cells//Diabetology and Metabolic Syndrome. 2011. Vol. 1. P. 3-11 DOI: 10.1186/1758-5996-3-11
- Пат. на полезную модель 154660 (РФ), МПК B01D61/14; B01D63/16; B01D61/18. Устройство для ультрафильтрации жидкостей/Н. А. Пятаев . Опубл. 26.11.2014. URL: http://elibrary.ru/item.asp?id=23929187
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ/Под ред. Р. У. Хабриева. Москва: Медицина, 2005. 832 c. URL: http://www.booksmed.com/farmakologiya/275-rukovodstvo-po-yeksperimentalnomu-doklinicheskomu.html
- Руководство по проведению доклинических исследований лекарственных средств/Под ред. А. Н. Миронова. Москва: Гриф и Ко, 2012. Ч. 1. 944 с. URL: http://www.regmed.ru/Content/Page.aspx?id=30e5e2b2-74a6-4616-9624-b796f00d0a9b
- Intercalation of antitumor drug doxorubicin and its analogue by DNA duplex: Structural features and biological implications/D. Agudelo //International journal of biological macromolecules. 2014. Vol. 66. P. 144-150 DOI: 10.1016/j.ijbiomac.2014.02.028
- New Insights into the Mechanism of the DNA/Doxorubicin Interaction/C. Perez-Arnaiz //J. Phys. Chem. B. 2014. Vol. 118 (5). P. 1288-1295 DOI: 10.1021/jp411429g


