Нарушение регуляторных механизмов как фактор стресса для пациентов с метаболическим синдромом
Автор: Грибанов И.А., Зарубина Е.Г.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 6 (60), 2022 года.
Бесплатный доступ
Введение. На протяжении всей истории человечество жило и развивалось в соответствии со своими биологическими ритмами, которые обеспечивали приспособление организма к факторам внешней и внутренней среды, создавая нормальную синхронность функционирования всех его составляющих.Целью данной работы стало определение степени стрессового влияния нарушения околосуточных ритмов на пациентов с метаболическим синдромом в условиях темновой депривации.Материал и методы исследования. Отобраны пациенты с метаболическим синдромом и нарушенными циркадными ритмами, всего 102 человека (все мужчины), из числа лиц, постоянно работающих в ночное время, у которых на предварительном этапе было зафиксировано снижение уровня мелатонина. В соответствии с поставленными задачами всех пациентов (молодого возраста по критериям ВОЗ) разделили на три группы - 33, 37 и 32 человека соответственно по критерию «длительность воздействия темновой депривации и длительность анамнеза метаболического синдрома»: 0-5 лет, 5-10 лет и свыше 10 лет. В первой группе средний возраст составил 30,1 ± 1,4 года, во второй группе - 36,5 ± 1,5 года, в третьей группе средний возраст не превышал 40,3 ± 0,9 года. Изучение уровня мелатонина в сыворотке крови проводилось у всех участников исследования с применением метода иммуноферментного анализа набора Melatonin ELISA (IBL, Германия).Результаты и их обсуждение. В норме при измерении кортизола в крови до 10 утра в среднем показатели варьируют в широком диапазоне - от 138 до 635 нмоль/л. Допускается повышение показателя до 700 нмоль/л, что считается негативным воздействием внешних факторов при иследовании. При этом следует учитывать, что при вечернем измерении уровень кортизола у мужчин в норме может снижаться до 80 нмоль/л.Выводы. Таким образом, темновая депривация у пациентов с метаболическим синдромом приводит к формированию стрессовой реакции. Максимальные изменения происходят после 10 лет нарушения регуляторных механизмов и приводят к выраженному дисбалансу между симпатической и парасимпатической нервной системой, повышению тонуса сосудов и изменению профиля артериального давления в течение суток в сторону преобладания таких как Non-dippers и Night-peakers, что увеличивает риск прогрессирования симптомов метаболического синдрома.
Метаболический синдром, мелатонин, кортизол
Короткий адрес: https://sciup.org/143179599
IDR: 143179599 | УДК: 616.127-005.8 | DOI: 10.20340/vmi-rvz.2022.6.CLIN.3
Текст научной статьи Нарушение регуляторных механизмов как фактор стресса для пациентов с метаболическим синдромом
УДК 616.127-005.8
На протяжении всей истории человечество жило и развивалось в соответствии со своими биологическими ритмами, которые обеспечивали приспособление организма к факторам внешней и внутренней среды, создавая нормальную синхронность функционирования всех его составляющих [1–4].
Однако в последнее столетие из-за бурного развития промышленности, появления новых технологий, требующих круглосуточных производственных процессов, освоения ранее неиспользованных земель на Крайнем Севере, в заполярных областях, появилась достаточно значимая часть населения, которая работает в условиях нарушения естественных биоритмов: в условиях круглосуточной искусственной освещенности [5–9]. В настоящее время пребывание в ночное время суток в ярко освещённых помещениях стало настолько обыденным явлением, что на него зачастую не обращают внимание. Однако свет является одним из мощнейших факторов окружающей среды, влияющих на гомеостаз любого живого организма, включая человека [10–13]. Естественно, что длительное пребывание на свету в ночное время может стать стрессовым фактором [14–16].
Целью данной работы стало определение степени стрессового влияния нарушения околосуточных ритмов на пациентов с метаболическим синдромом (МС) в условиях темновой депривации.
Материал и методы исследования
Для реализации поставленной цели нами на основе критериев ВОЗ были отобраны пациенты с МС и нарушенными циркадными ритмами – всего 102 человека (все мужчины) из числа лиц, постоянно работающих в ночное время, у которых на предварительном этапе было зафиксировано снижение уровня мелатонина. Пациенты отбирались по амбулаторным картам в поликлиниках города Самары с последующим дообследованием в клинике медицинского университета «Реавиз». Так как единых общепризнанных критериев диагностики расстройств регуляции в настоящее время нет, на первом этапе ориентировались на маркер нарушений циркадианных ритмов – уровень мелатонина в сыворотке крови.
В соответствии с поставленными задачами, 102 пациента (все мужчины) работоспособного возраста (молодого возраста по критериям ВОЗ) разделили на три группы – 33, 37 и 32 человека соответственно по критерию «длительность воздействия темновой депривации и длительность анамнеза МС»: 0–5 лет, 5–10 лет и свыше 10 лет. В первой группе средний возраст составил 30,1 ± 1,4 года, во второй группе – 36,5 ± 1,5 года, в третьей группе средний возраст не превышал 40,3 ± 0,9 года.
В качестве контрольной группы было обследовано 45 пациентов с МС. Контрольная группа сопоставима с основными группами по фоновой патологии, возрасту и различной длительности анамнеза МС, но не подвергалась воздействию темновой депривации. В подгруппу А контрольной группы вошли 15 пациентов, средний возраст которых составлял 29,8 ± 1,2 года при длительности анамнеза заболевания МС до 5 лет. В подгруппу Б контрольной группы были отнесены 15 человек (средний возраст 34,2 ± 1,3 года) с длительностью анамнеза МС от 5 до 10 лет. Подгруппу В контрольной группы составили 15 обследованных в возрасте 41,1 ± 1,3 года, у которых МС был диагностирован более 10 лет назад. Все пациенты группы контроля не имели признаков расстройств регуляции по результатам предварительного обследования.
Основным методом, в ходе проведенного исследования, послужил метод клинического анализа. Изучение уровня мелатонина в сыворотке крови для подтверждение нарушения околосуточных ритмов проводилось у всех участников исследования с применением метода иммунофермент-ного анализа набора Melatonin ELISA (IBL, Германия). Измерение показателей проводилось с использованием фотометра для проведения иммуно-ферментного анализа PR–2100 (Sanofi Diagnostics Pasteur, Франция). В норме оптимальная концентрация мелатонина в сыворотке крови человека отличается широкой вариабельностью концентрации от 8 до 20 пг/мл, а во время определения в ночной период уровень мелатонина не должен превышать 150 пг/мл. Все исследования проводились на протяжении одного климатического периода в стандартизированных условиях.
Для диагностики метаболического синдрома нами использовались критерии, указанные в Методических рекомендациях по ведению пациентов с метаболическим синдромом (2013, РФ), включая биохимические и антропометрические показатели. Круглосуточное определение показателей артериального давления (АД) проводилось с использованием аппарата Холтер-ДМС (Передовые технологии, Россия). Помимо регистрации уровня АД, определялось также соотношение между различными профилями АД в группах пациентов, включенных в исследование: Dippers – 10 % ≤ степень снижения ночного давления < 20 %; Non-dippers – 0 % ≤ степень снижения ночного давления < 10 %; Night-peakers – повышение АД в ночное время.
При определении баланса симпатической и парасимпатической частей вегетативной нервной системы применялась ортостатическая проба Шеллонга.
Сосудодвигательную функцию эндотелия кровеносных сосудов определеляли посредством метода механической стимуляции эндотелия повышенным кровотоком [17]. Исследование проводили на ультразвуковом аппарате ACUSON-128ХР (Acuson, США) линейным датчиком 5,5–7,5 МГц по методике, описанной Celermajer D.S. и соавт., утром (до 10 часов) натощак, в положении пациента на спине после 10–15-минутного отдыха.
Статистическая обработка данных проводилась с помощью пакета программ Statistica for Win-dous 6.0. Статистические результаты считались достоверными при p < 0,05.
Результаты и их обсуждение
Результаты изучения уровня кортизола – глюкокортикостероидного гормона коркового слоя надпочечников, в крови обследованных пациентов с метаболическим синдромом и выявленным на предварительном этапе отбора снижением уровня мелатонина, что подтверждает у них наличие нарушения регуляторных механизмов, представлены в таблице 1.
Таблица 1. Колебания уровня кортизола у пациентов с различным уровнем мелатонина в крови
Table 1. Fluctuations in cortisol levels in patients with different levels of melatonin in the blood
|
Группа |
Уровень мелатонина, пг/мл |
Уровень общего кортизола в крови, нмоль/л |
||||
|
После дежурства 7:00 |
На третий день отдыха, 7:00 |
После дежурства 7:00 |
На третий день отдыха, 7:00 |
На третий день отдыха, 19:00 |
||
|
Основные группы наблюдения |
||||||
|
I группа, n = 33, из них: IА подгруппа, n = 13 IБ подгруппа, n = 20 |
18,0 ± 2,2 9,8 ± 1,3 |
19,7 ± 1,6 18,8 ± 1,6 |
729,2 ± 42,2* 897,8 ± 46,9** |
616,9 ± 50,2 789,5 ± 51,1** |
145,6 ± 17,6* 395,6 ± 28,9*** |
|
|
II группа, n = 37, из них: IIА подгруппа, n = 10 IIБ подгруппа, n = 12 IIВ подгруппа, n = 15 |
14,6 ± 1,3*** 10,2 ± 1,2*** 7,5 ± 0,6*** |
18,9 ± 0,2 17,8 ± 0,1*** 12,3 ± 0,5*** |
785,6 ± 49,1** 911,1 ± 51,9*** 1073,6 ± 52,3*** |
734,6 ± 51,3* 822,7 ± 50,2** 917,5 ± 50,6*** |
487,3 ± 44,8*** 687,3 ± 52,3*** 687,3 ± 50,9*** |
|
|
III группа, n = 32 |
5,5 ± 0,4*** |
10,3 ± 1,3*** |
1261,4 ± 50,8*** |
995,3 ± 50,2*** |
878,7 ± 51,4*** |
|
|
Группа контроля |
||||||
|
Группа контроля, n = 45 |
Уровень мелатонина, пг/мл |
Уровень общего кортизола в крови, нмоль/л |
||||
|
в 7:00 |
в 7:00 |
в 19:00 |
||||
|
А подгруппа, n = 15 Б подгруппа, n = 15 В подгруппа, n = 15 |
19,5 ± 0,3 19,1 ± 0,1 18,6 ± 0,2 |
596,9 ± 52,3 |
98,6 ± 11,2 |
|||
Примечание: *p < 0,05 по сравнению с аналогичным показателем группы контроля, **p < 0,01 по сравнению с аналогичным показателем группы контроля, ***p < 0,001 по сравнению с аналогичным показателем группы контроля.
Как видно из представленных данных, между уровнем мелатонина и уровнем кортизола имеется сильная обратная корреляционная связь (r = –0,96), то есть у лиц с более низким содержанием мелатонина в крови отмечается повышенный уровень кортизола, что говорит о наличии хронического стресса.
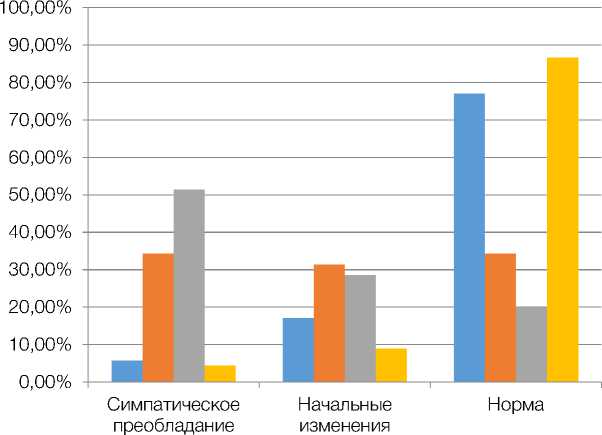
В норме, при измерении кортизола в крови до 10 утра, в среднем показатели варьируют в широком диапазоне – от 138 до 635 нмоль/л. Допускается повышение показателя до 700 нмоль/л, что считается негативным воздействием внешних факторов при иследовании. При этом следует учитывать, что при вечернем измерении уровень кортизола у мужчин в норме может снижаться до 80 нмоль/л. Подобное увеличение концентрации глюкокортикостероидов в крови может приводить, по-видимому, к росту интенсивности катаболизма в организме, в связи с чем усиливается распад мышечной ткани с одновременным более интенсивным накоплением триглицеридов (у всех обследованных нами пациентов с МС было зарегистрировано повышение уровня триглицеридов ≥ 1,7 ммоль/л), которые под действием глюкокортикостероидов, как следует из проведённых исследований других авторов, могут несимметрично распределяться в подкожном пространстве и становиться причиной абдоминального ожирения, ускоряя развитие метаболического синдрома. Кроме этого, мелатонин является также важным гормоном-регулятором активности вегетативной нервной системы. Для оценки баланса между симпатической и парасимпатической нервной системой при обследовании пациентов использовался тест Шелонга. Показатели группы контроля и лиц основных групп представлены на рисунке 1.
Были выявлены достоверные различия среди лиц исследуемых групп. Наибольшая частота симпатических преобладаний встречалась у пациентов группы III (с давностью анамнеза МС и регуляторных нарушений свыше 10 лет) – 51,4 % (p < 0,001) по сравнению с 34,3 % (p < 0,001) и 5,8 % (p < 0,05) для пациентов группы I и II соответственно. При этом в группе контроля, несмотря на наличие метаболического синдрома с аналогичной давностью анамнеза, количество пациентов с нормальным балансом симпатической и парасимпатической системы оставалось на уровне 86,7 %.
■ Группа I
■ Группа II
■ Группа III
■ Группа контроля
Рисунок 1. Преобладание симпатической иннервации по Шелонгу у обследованных лиц с метаболическим синдромом и лиц контрольной группы
-
Figure 1. Prevalence of sympathetic innervation according to Schelong in the examined persons with metabolic syndrome and the control group
Анализ данных, представленных на рисунке 1, позволяет сделать вывод о том, что по мере увеличения периода работы в ночное время происходит смещение баланса между парасимпатической и симпатической нервной системой в сторону последней, что связано, по-видимому, с нарушением регулирующей функции мелатонина. Полученные данные могут свидетельствовать о дезадаптации у обследованных пациентов, особенно из группы III, с выраженным преобладанием симпатических влияний. Подобное повышение тонуса симпатической нервной системы являлось, по-видимому, одной из главных причин формирования стойкого повышения АД у пациентов, имеющих нарушение регуляторных механизмов на фоне темновой депривации, а также нарушало суточные ритмы АД, приводя к развитию неблагоприятных профилей АД.
В ходе изучения результатов мониторирования АД включенных в исследование лиц, было установлено, что по мере увеличения длительности темновой депривации у пациентов с МС происходит значительное изменение тонуса сосудистой системы, коррелирующее с уровнем мелатонина (r= –0,96).
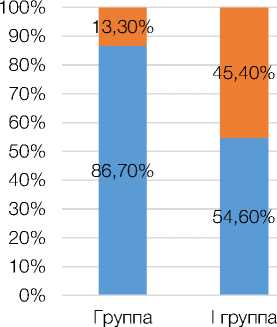
Выявленные особенности суточных профилей артериального давления характеризуют скомпенси-рованность сосудистого тонуса на фоне изменения ритмов сна и бодрствования (рис. 2), а также в сравнении с пациентами контрольной группы, страдающих МС, но работающих в дневное время (рис. 1).
Проведение венооклюзионной пробы подтвердило нарушение сосудистого тонуса у пациентов с МС и нарушением регуляторных механизмов на фоне темновой депривации.
Так, у 86,7 % пациентов группы контроля после механической обтурации сосуда (плечевой артерии) происходило кратковременное его сужение, не превышающее 10 % от первоначального диаметра, с последующим компенсаторным его расширением более чем на 18 % от первоначального диаметра. Восстановление исходного просвета сосуда происходило к концу 5-й минуты после снятия манжеты. Подобная сосудодвигательная реакция свидетельствовала о полном отсутствии эндотелиальной дисфункции у обследованных из группы контроля. И лишь у 13,3 % лиц из группы были зафиксированы признаки эндотелиальных нарушений (все имели профиль Non-dippers).
У пациентов, подвергающихся темновой депривации не более 5 лет, в 40 % случаев отмечалось удлинение периода постобтурационной ишемии до 1 минуты вместо 30 секунд в группе контроля и сокращение с 2-х минут до 1 минуты периода компенсаторной гиперемии. При этом прирост диаметра сосуда составлял 16,3 %, что свидетельствовало об отсутствии эндотелиальных нарушений.
контроля для I группы
6,70%
20,00%
73,30%
Группа контроля для II группы
32,40%
35,20%
32,40%
II группа
13,30%
33,40%
53,30%
Группа контроля для III группы
53,10%
46,90%
0,00%
III группа
■ Dippers ■ Non-dippers ■ Night-peakers
Рисунок 2. Характер распределения суточных профилей у обследованных пациентов с метаболическим синдромом и лиц групп контроля
-
Figure 2. Distribution pattern of the daily profiles in the examined patients with metabolic syndrome and the control group persons
У пациентов с десятилетним стажем работы в условиях темновой депривации сосудодвигательная функция была нарушена в большей степени. У 71 % обследованных период постобтурационной ишемии возрастал до 2-х минут, а максимальный прирост диаметра сосуда возникал лишь на 3-й минуте после пробы и не превышал 10–11 %, что свидетельствовало о начале формирования эндотелиальной дисфункции.
В третьей группе пациентов у 60 % обследованных были выявлены признаки эндотелиальной сосудодвигательной дисфункции, о чём свидетель- ствовали: удлинение периода восстановления исходного диаметра сосуда до 7 минут, появление двух периодов ишемической реакции со стороны сосуда (сразу после обтурации в течение 2-х минут и после кратковременного расширения сосуда повторно на 4–6 минуте после пробы). При этом максимальный прирост диаметра сосуда не превышал 7,5 % (был менее 10 %), что также подтверждало наличие сосудодвигательных нарушений эндотелия.
Пример реакции сосудистого русла пациента IIIВ подгруппы приведен на рисунке 3.
Рисунок 3. Изменение диаметра сосуда под действием веноокклюзионной пробы: a – через 30 секунд после пробы; b – через 1 минуту после пробы; c – через 3 минуты после пробы; d – через 6 минут после пробы
Figure 3. Сhange of the vessel diameter under the veno-occlusive test: a – 30 seconds after the test; b – 1 minute after the test; c – 3 minutes after the test; d – 6 minutes after the test
Выводы
Таким образом, темновая депривация у пациентов с метаболическим синдромом приводит к формированию стрессовой реакции. Максимальные изменения происходят после 10 лет нарушения регуляторных механизмов и приводят к выраженному дисбалансу между симпатической и парасимпатической нервной системой, повышению тонуса сосудов и изменению профиля артериального давления в течение суток в сторону преобладания таких как Non-dippers и Night-peakers, что увеличивает риск прогрессирования симптомов метаболического синдрома.
Список литературы Нарушение регуляторных механизмов как фактор стресса для пациентов с метаболическим синдромом
- Refinetti R. Integration of biological clocks and rhythms. Compr Physiol. 2012 Apr;2(2):1213-39. https://doi.org/10.1002/cphy.c100088. PMID: 23798299.
- Arendt J. Biological rhythms: the science of chronobiology. J R Coll Physicians Lond. 1998 Jan-Feb;32(1):27-35. PMID: 9507438.
- Hut RA, Paolucci S, Dor R, Kyriacou CP, Daan S. Latitudinal clines: an evolutionary view on biological rhythms. Proc Biol Sci. 2013 Jul 3;280(1765):20130433. https://doi.org/10.1098/rspb.2013.0433. PMID: 23825204; PMCID: PMC3712436.
- Kuhlman SJ, Mackey SR, Duffy JF. Biological Rhythms Workshop I: introduction to chronobiology. Cold Spring Harb Symp Quant Biol. 2007;72:1-6. https://doi.org/10.1101/sqb.2007.72.059. PMID: 18419258.
- Geiger-Brown J, Rogers VE, Trinkoff AM, Kane RL, Bausell RB, Scharf SM. Sleep, sleepiness, fatigue, and performance of 12-hour-shift nurses. ChronobiolInt. 2012 Mar;29(2):211-9. https://doi.org/10.3109/07420528.2011.645752. Erratum in: Chronobiol Int. 2012 Aug;29(7):961. PMID: 22324559.
- McElroy SF, Olney A, Hunt C, Glennon C. Shift work and hospital employees: A descriptive multi-site study. Int J Nurs Stud. 2020 Dec;112:103746. https://doi.org/10.1016/jJjnurstu.2020.103746. Epub 2020 Aug 12. PMID: 32928504.
- Folkard S. Shift work, safety, and aging. Chronobiol Int. 2008 Apr;25(2):183-98. https://doi.org/10.1080/07420520802106694. PMID: 18484360.
- Nevels TL, Burch JB, Wirth MD, Ginsberg JP, McLain AC, Andrew ME, Allison P, Fekedulegn D, Violanti JM. Shift Work Adaptation Among Police Officers: The BCOPS Study. Chronobiol Int. 2021 Jun;38(6):907-923. https://doi.org/10.1080/07420528.2021.1895824. Epub 2021 Mar 30. PMID: 33781135; PMCID: PMC8262273.
- Arendt J. Biological rhythms during residence in polar regions. Chronobiol Int. 2012 May;29(4):379-94. https://doi.org/ 10.3109/07420528.2012.668997. Epub 2012 Apr 12. PMID: 22497433; PMCID: PMC3793275.
- Touitou Y. Light at night pollution of the internal clock, a public health issue. Bull Acad Natl Med. 2015 0ct;199(7):1081-1098. English, French. PMID: 29879330.
- Bedrosian TA, Nelson RJ. Influence of the modern light environment on mood. Mol Psychiatry. 2013 Jul;18(7):751-7. https://doi.org/10.1038/mp.2013.70. Epub 2013 May 28. PMID: 23711982.
- Walker WH 2nd, Bumgarner JR, Becker-Krail DD, May LE, Liu JA, Nelson RJ. Light at night disrupts biological clocks, calendars, and immune function. Semin Immunopathol. 2022 Mar;44(2):165-173. https://doi.org/10.1007/s00281-021-00899-0. Epub 2021 Nov 3. PMID: 34731290; PMCID: PMC8564795.
- Dufier JL, Touitou Y. Pollution lumineuse [Light pollution]. Rev Prat. 2022 Feb;72(2):141-146. French. PMID: 35289519.
- Tähkämö L, Partonen T, Pesonen AK. Systematic review of light exposure impact on human circadian rhythm. Chronobiol Int. 2019 Feb;36(2):151-170. https://doi.org/10.1080/07420528.2018.1527773. Epub 2018 Oct 12. PMID: 30311830.
- Falchi F, Furgoni R, Gallaway TA, Rybnikova NA, Portnov BA, Baugh K, Cinzano P, Elvidge CD. Light pollution in USA and Europe: The good, the bad and the ugly. J Environ Manage. 2019 Oct 15;248:109227. https://doi.org/10.1016/j.jenvman.2019.06.128. Epub 2019 Jul 27. PMID: 31362173.
- Jedidi H, Depierreux F, Jedidi Z, Beckers A. LA POLLUTION LUMINEUSE. Entre écologie et santé [Light pollution. A connection between ecology and health]. Rev Med Liege. 2015 Nov;70(11):557-62. French. PMID: 26738267.
- Celermajer D.S. et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 1992;340:1111-1115.


