Нарушения системы гемостаза в колоректальной хирургии
Автор: Хачатурова Э.А., Савушкин А.В., Губко А.В., Мусин И. И., Ерошкина Т.Д., Каменева А.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 2 (13), 2015 года.
Бесплатный доступ
В статье обсуждаются изменения в системе гемостаза, обусловленные разными причинами (при хирургическом лечении колоректального рака - 24 больных, операции после химиолучевой терапии - 27 пациента, комбинированные операции с резекцией печени при метастазах колоректального рака - 24 больных). Сравнительная оценка показателей системы гемостаза и клинические данные позволили выявить нестабильность данной системы в разных группах и возможность развития как тромботических осложнений, так и опасности развития периоперационного неуправляемого кровотечения. Наибольшая частота нарушений в системе гемостаза отмечена при комбинированных симультанных вмешательствах и обширной резекции печени. Специфическая антикоагулянтная профилактика требует динамического мониторинга как со стороны свертывающих факторов, так и антикоагулянтов.
Система гемостаза, колоректальный рак, метастазы печени, антикоагулянтная профилактика, фраксипарин
Короткий адрес: https://sciup.org/14045531
IDR: 14045531
Текст научной статьи Нарушения системы гемостаза в колоректальной хирургии
Рак прямой кишки в структуре онкологической заболеваемости среди населения России занимает третье место и достигает 10,2% [6]. Мировой стандартный показатель смертности при раке прямой кишки составляет 7,4, европейский – 11,1. Показатель смертности у мужчин равен 9,6 и 14,4, а у женщин – 5,5 и 8,1. Удельный вес больных раком прямой кишки в запущенном состоянии (III стадии опухоли) составляет 30,5%, (IV стадии) – 26,5% [6]. В клинике ГНЦ колопроктологии выполняются различные оперативные вмешательства при раке ободочной и прямой кишки – как одномоментные, так и комбинированные с резекцией печени при наличии метастазов. С 1980 г. развилось представление о неоадьювантной химиолуче-вой терапии (ХЛТ), при которой химиотерапию и лучевую терапию назначают до операции. При этом преследуется цель: уменьшить массу опухоли, снизить стадию заболевания, облегчить выполнение хирургического вмешательства [9, 10, 11]. В подавляющем большинстве, противоопухолевая терапия вызывает поражение системы кроветворения, повреждение функции печени, нарушение гемореологии и микроциркуляции. Кроме того, лучевая терапия представляет угрозу для жизни больного, так как обладает нефро- и гепатотоксичностью, а также нейротоксичностью [12]. Однако в литературе нет указаний на особенность выполнения операций у онкологических больных раком прямой кишки в связи с комплексным применением химиолучевой терапии, которая сама может провоцировать сдвиги в системе гемостаза и повышает риск тромбоэмболических осложнений – с одной стороны, а с другой – неуправляемой коагулопатии.
С появлением новых медицинских технологий и инструментов, хирурги получили возможность активнее оперировать, разрабатывать новые виды и модификации сложнейших вмешательств. При метастазировании опухолевого процесса все чаще решаются на комбинированные операции, т.е. резекцию кишки и удаление метастазов в печени, а также повторные операции на печени – гемиге-патэктомию. Результаты лечения рака толстой кишки при метастазах в печени – вселяют весьма оптимистические надежды на выздоровление при патологии этого жизненно важного органа. По данным РОНЦ РАМН, больные, оперированные на печени, имеют 5 летнюю выживаемость, что составляет по данным разных авторов 17–23,1% [8, 9]. Полагают, что эти успехи связаны не только с более радикальной техникой операций, также совершенствованием комбинированного метода лечения опухолей, включающего химиотерапию [9, 10, 11]. Среди послеоперационных осложнений при резекции печени важное место имеет профузное кровотечение и возможность развития диссеминированного внутрисосудистого свертывания (ДВС-синдрома) – с одной стороны, а с другой – развитие тромбоэмболических осложнений [8, 9, 13]. Так, ведущее значение после обширных резекций печени, по данным этих авторов, занимает острая печеночная недостаточность – 21%, и 4% послеоперационное кровотечение в зоне операции. Геморрагические осложнения могут быть обусловлены тромбоцитопенией, в связи с чем некоторые исследователи рекомендуют трансфузии концентрата тромбоцитов [4]. Однако имеются указания, что применение химиотерапии при обширной резекции печени не приводят к увеличению интраоперационной кровопотери [8]. В это же время, возможность развития дисфункции системы гемостаза отмечают исследователи при операциях кардиохирургического профиля, челюстно-лицевой и абдоминальной хирургии, а также у больных терапевтического профиля с внебольничной пневмонией [1, 3, 7, 12]. Антикоагулянтная профилактика, в плане доказательной медицины, является одним из эффективных методов и позволяет значительно снизить летальность при тромбоэмболии легочной артерии (ТЭЛА), а выбор рекомендуемых препаратов варьирует в широких пределах [14, 15, 17]. На современом этапе с целью профилактики тромботических осложнений при абдоминальных, травматологических операциях и колоректальном раке рекомендуется применять низкомолекулярные гепарины [15, 17]. Однако мы не встретили специальных исследований о состоянии системы гемостаза при комбинированных операциях удаления прямой кишки и опухолевых метастазов в печени. Не достаточно изучено состояние системы свертывания крови во время хирургического вмешательства после комбинированного метода, как неоадьювантной химиолучевой терапии у данных больных. Нет четких показаний
Диагностика и лечение опухолей. Оригинальные статьи и противопоказаний к назначению антикоагулянтов у пациентов на этапах хирургического лечения с колоректальным раком и метастазами в печень.
Материалы и методы
Проведено проспективное исследование у 75 больных колоректальным раком. Статистическая обработка проводилась применением параметрического метода по нормальному распределению. Контрольную группу составили 24 пациента, которым проведено оперативное вмешательство по поводу рака толстой кишки, им в дооперационном периоде не применялась химиолучевая терапия (мужчин – 14, женщин – 10). Средний возраст составил 64,8±9,5. Во время операции кровопотеря составила 80,3±19,2 мл. В данной группе больных препараты крови не применялись. Инфузионно-трансфузионная (ИТТ) терапия во время операции включала переливание коллоидов с кристаллоидами в соотношении 1:2. Объем ИТТ составила 23,0±8,15 мл/кг массы тела. В состав коллоидов включался препарат «Гелофузин». При выборе препарата для профилактики тромботических осложнений мы применили низкомолекуляный гепарин (фраксипарин 0,3 п/к) до операции за 12 часов, и после операции назначался в той же дозе через 12 и последующие дни послеоперационного периода. Во вторую группу были включены 27 пациентов с колоректальным раком, которым проводилась неоадьювантная хими-олучевая терапия (ХЛТ), из них – 11 мужчин, 6 – женщин. Средний возраст составил 63,3±12,4. Хирургическое лечение при раке прямой кишки в нашей клинике проводилось после ХЛТ, которая включала следующие препараты: 5-фторуроцил (2,5 г), цисплатин (90 мг) в сочетании с лучевой терапией в дозе (40 грей). В данной группе ИТТ терапия во время операции включала переливание коллоидов с кристаллоидами в соотношении 1:2. Кровопотеря в среднем в данной группе составила 125,5±17,4 мл. Объем ИТТ составил 22,52±4,6 мл/кг массы тела. Из препаратов крови трем больным переливалась свежезамороженная плазма для восполнения факторов свертывания крови, связанной с повы- шенной кровоточивостью из операционной раны, а также транексамовая кислота по показаниям. В состав коллоидов включался также препарат «Гелофузин». Для профилактики тромботических осложнений мы применили низкомолекулярный гепарин (фраксипарин 0,3 п/к) до операции за 12 часов, и после операции назначался в той же дозе через 12 часов и последующие дни. Третью группу составили пациенты, которым наряду с различными видами резекции толстой кишки одновременно выполнялось удаление метастазов в печени, или вторым этапом проводилась гемигепатэк-томия. Всего в этой группе было 24 больных, из них 13 мужчин и 11 женщин. Средний возраст составил 69,8±12,4. В данной группе инфузионно-трансфузионная (ИТТ) терапия во время операции включала переливание коллоидов с кристаллоидами в соотношении 1:2. Кровопотеря операционная составила в среднем 885±212,4 мл. Препараты крови переливались в качестве эритроцитной массы пяти пациентам, где объем кровопотери колебался от 500 до 4000 мл. Свежезамороженная плазма для восполнения факторов свертывания крови была перелита у 10 пациентов, также переливалась транексамовая кислота при повышенной кровоточивости из операционной раны. Объем ИТТ составил 40,8±13,6 мл/кгмассытела.Всоставколлоидоввключался также препарат «Гелофузин». В этой группе больных низкомолекулярный гепарин до операции мы не назначали, а после операции назначался фраксипарин 0,3 п/к через 24 часа при отсутствии признаков кровотечения и продолжался в последующие дни. Группы больных и виды оперативных вмешательств представлены в таблице 1.
Исследование системы гемостаза включало в себя гемокоагулограмму, и которое проводилось на анализаторе гемостаза Sysmex C A – 500 series. Определялся протромбиновый индекс по Квику, в%, снижение его уровня свидетельствует о возможном дефиците факторов свертывания и склонности к повышенной кровоточивости. Повышение уровня протромбинового индекса по Квику указывает на склонность к тромбообразованию. Определялось активированное частичное тромбопластиновое время (АЧТВ-тест) в сек. АЧТВ – тест, выявляющий исключительно плазменные дефекты
Нарушения системы гемостаза в колоректальной хирургии
Таблица 1. Виды оперативных вмешательств у больных раком прямой кишки
Результаты исследования
Известно, что у онкологических больных имеется высокий риск тромбозов и эмболий, и повышена активность системы свертывания крови [2, 14]. Химиолучевая терапия также вносит свои коррективы в систему гемостаза. Современные режимы химиотерапии направлены на редукцию доз с целью снижения токсичности препаратов и побочных эффектов (тяжелой диареи, фебрильной нейтропении) [11, 17]. Однако их влияние на свертывающую систему по данным источникам не представлены. На риск кровотечений при трансплантации печени, резекции печени, при шунтировании коронарных артерий, простатэктомии с потерей крови более 20% и необходимости применения таргетной терапии (апротинин, транексам) указывают ряд авторов [14, 15, 17]. Данная терапия позволяет снизить количество применяемых переливаний препаратов крови и уменьшить риск осложнений. Однако
Диагностика и лечение опухолей. Оригинальные статьи в данных исследованиях не представлены данные о системе гемостаза на этапах операции. Как показали результаты наших исследований, до операции у больных раком прямой кишки в трех группах не отмечались значимые изменения активности плазменного звена гемостаза (% протромбина по Квику, АЧТВ), и лишь проявлялась тенденция повышения уровня фибриногена. Антикоагулянтная активность (АIII) во всех трех группах была в пределах также физиологической нормы. Данные показателей гемокоагулограммы и тромбоэластограммы представлены в таблице 2.
Данные исследований тромбоэластограммы во всех трех группах больных до операции показали, что время реакции (образование тромбокиназы) R указывает на гиперкоагуляцию. Агрегация тромбоцитов и плотность сгустка (МА) во всех трех группах были в пределах нормальных значений. Таким образом, у больных раком прямой кишки как в контрольной группе, так и с химиолучевой терапией и метастазами в печень отмечены со стороны системы гемостаза явления умеренной гиперкоагуляции. В связи с чем возникает необходимость применения антикоагулянтной профилактики. В дооперационном периоде больным контрольной группы и с ХЛТ за 12 часов до операции назначался фраксипарин в дозе 0,3 мг п/к. Однако больным с планируемой резекцией печени в связи с высоким риском кровотечения до операции мы отказались от введения антикоагулянтов. В послеоперационном периоде (через 24 часа) по данным гемокоагулограммы, не смотря на снижение протромбинового индекса в% в трех группах, данный показатель оставался в пределах нормальных значений. Неинформативным оставался расчетный пока-
Таблица 2. Данные показателей гемокоагулограммы и тромбоэластограммы в динамике в трех группах больных
|
Показатели: норма |
Контрольная группа 1 группа (п 24) |
ХЛТ 2 группа (п 27) |
Операции на толстой кишке, печени 3 группа (п 24) |
|||
|
До операции |
После операции |
До операции |
После операции |
До операции |
После операции |
|
|
% по Квику (74–112) |
102,4±13,5 |
77,9±10,7 |
90,9±9,6 |
77,2±13 |
90,1±11,3 |
65,8±11,2 |
|
МНО (0,9–1,2) |
1,24±0,23 |
1,11±0,09 |
0,99±0,07 |
1,13±0,16 |
1,14±0,14 |
1,33±0,18 |
|
АЧТВ (28–38) сек |
31,5±2,5 |
41,7±4,66 |
36,0±4,1 |
70,6±14,9 |
34,4±5,3 |
60,3±7,45 |
|
р=0,4 |
р=0,3 |
|||||
|
АIII% |
85,4±7,6 |
68,1±5,4 |
83,3±6,5 |
68,0±9,1 |
97,7±12,9 |
60,0±10,9 |
|
73–109 |
р=0,4 |
|||||
|
Д-димер |
0,182±0,10 |
0,196±0,16 |
0,2±0,11 |
1,0±0,69 |
0,22±0,11 |
1,1±0,3 |
|
0–0,5 мкг/мл |
р=0,1 |
|||||
|
Фибриноген |
4,2±1,3 |
4,27±0,7 |
3,12±0,65 |
4,6±0,63 |
3,03±1,26 |
5,3±1,8 |
|
(2,8–3,8) г/л |
р=0,5 |
р=0,5 |
||||
|
R время реакции |
5,02±2,2 |
8,94±3,9 |
5,94±2,3 |
13,17±0,48 |
6,08±3,1 |
14,9±7,1 |
|
9–27 мин |
р=0,4 |
р=0,3 |
р=0,1 |
|||
|
К, время образования сгустка 2–9 мин |
1,24±0,68 |
2,33±1,46 |
1,47±0,5 |
3,97±2,5 |
1,55±0,6 |
4,64±0,6 |
|
МА, образование фибрина 44–64 мм |
67,06±12,2 |
67,8±5,8 |
66,51±6,0 |
64,35±5,2 |
62,24±8,8 |
61,47±8,2 |
Нарушения системы гемостаза в колоректальной хирургии затель МНО на всех этапах операции. В то время как на дефицит плазменных факторов после операции указывало увеличение АЧТВ в группах с ХЛТ (70,6±14,9 р=0,4) и резекцией печени (60,3±7,45, р=0,4), что проявлялось повышенной кровоточивостью на этапах операции. В связи с чем у трех больных с ХЛТ, а также при резекции печени, было необходимым в программу инфузионной терапии включить переливание факторов свертывания крови во время операции (свежезамороженной плазмы), тра-нексамовой кислоты. Значимое снижение АIII (60,0±10,9 р=0,4) после операции отмечено в третьей группе больных, что обусловлено более высокой кровопотерей и потерей факторов свертывания крови при обширных резекциях печени, в связи с чем этим пациентам проводилось переливание препаратов донорской крови и плазмы на этапах хирургического вмешательства. При высокой кровопотере (свыше 1000 мл) проводился забор собственной крови и реинфузия аппаратом (C.A.T.S.). Удлинение АЧТВ отражает дефицит плазменных факторов и преобладание гипокоагуляции. Динамическое мониторирование системы гемостаза как до операции, так и в ближайшем послеоперационном периоде позволяет более осторожно проводить антикоагулянтную профилактику в группе с ХЛТ и резекцией печени. Назначение антикоагулянтов согласуется с оперирующим хирургом. Исследование Д-димера не имело значимых отличий, лишь в группе после резекции печени данный показатель повышался (1,1±0, р=0,1). О повышении тромбоопас-ности имело значение повышение фибриногена в группе больных с ХЛТ (4,6±0,63 р=0,5) и резекцией печени (5,3±1,8 р=0,5). Повышение активности коагулянтов (фибриногена) и снижение активности прокоагулянтов (АIII) указывает на нестабильность системы гемостаза в группах оперируемых больных раком прямой кишки. Что касается методики тромбо-эластогафии, то отмечена нормализация показателей R и К, что можно объяснить эффектом гемодилюции, особенно в группе с ХЛТ и резекцией печени, тромбоцитарная активность сохранялась.
Таким образом, после операции во второй и особенно в третьей группе отмечен эффект коагулопатии разведения, что характеризовалось сочетанием гипокоагуляции
(снижение протромбина по Квику в %, АIII, АЧТВ, нормализация показателей R и К) с гиперкоагуляцией и тенденцией к увеличениям фибриногена и Д-димера. Данные изменения в системе гемостаза требуют индивидуального подхода к назначению антикоагулянтов в каждой группе больных. В первой и второй группах больных антикоагулянтная профилактика после операции проводилась по стандартной методике через 12 часов после операции. В третьей группе больных при обширной резекции печени и значимой кровопотери антикоагулянтная профилактика назначалась не ранее чем через 24 часа после операции и только при условии стабильности системы гемостаза и отсутствия клинических признаков кровотечения. Эффективность антикоагулянтной терапии низкомолекулярным фракционированным гепарином (фраксипа-рином) у больных с колоректальным раком, начиная с первого дня после операции, проводилась под контролем тромбоэластографии, данные которой, представлены на тромбоэластограмме. Рис. 1 и Рис. 2.
В группе с ХЛТ во время операции у одного пациента был выявлен первичный фибринолиз. Во время операции отмечена повышенная кровоточивость. Больному выполнена операция: «Низкая передняя резекция прямой кишки с наложением привентивной илеостомы». Кровопотеря составила 700 мл. Во время операции переливались препараты крови и фи-бринолитики (транексам). Тромбоэластограмма представлена на Рис. 3.
У больного третьей группы после правосторонней гемигепатэктомиии отмечена выраженная тромбоцитарная гипокоагуляция, что естественно потребовало коррекции переливанием препаратов крови, транексама. Тромбоэластограмма представлена на Рис. 4.
По нашим данным, коррекция системы гемостаза антикоагулянтной терапией нуждается в дальнейшей доработке. Нельзя однозначно оценить степень гемокоагуляционных нарушений только одним каким-либо методом и каждый пациент нуждается в индивидуальной оценке системы гемостаза и ее мониторинге на всем протяжении операционного периода, включая такие показатели как АЧТВ, (АIII), Д-димер, тромбоэластографический метод, который позволяет на наш взгляд оценить
Диагностика и лечение опухолей. Оригинальные статьи
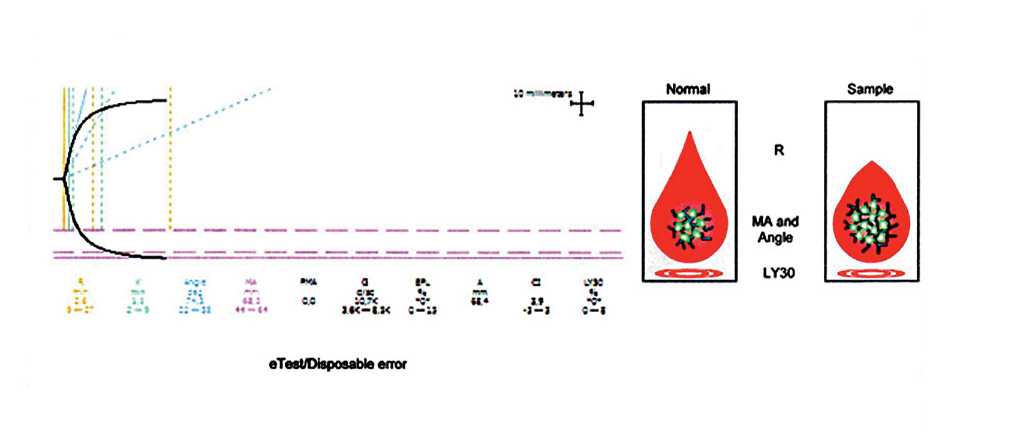
Рис.1. Тромбоэластограммма после операции (гиперкоагуляция) у больного контрольной группы
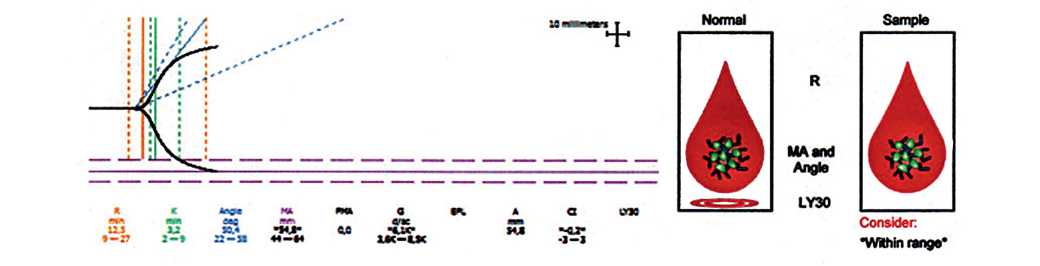
Рис. 2. Тромбоэластограмма после антикоагулянтной терапии у больного контрольной группы (нормокоагуляция)
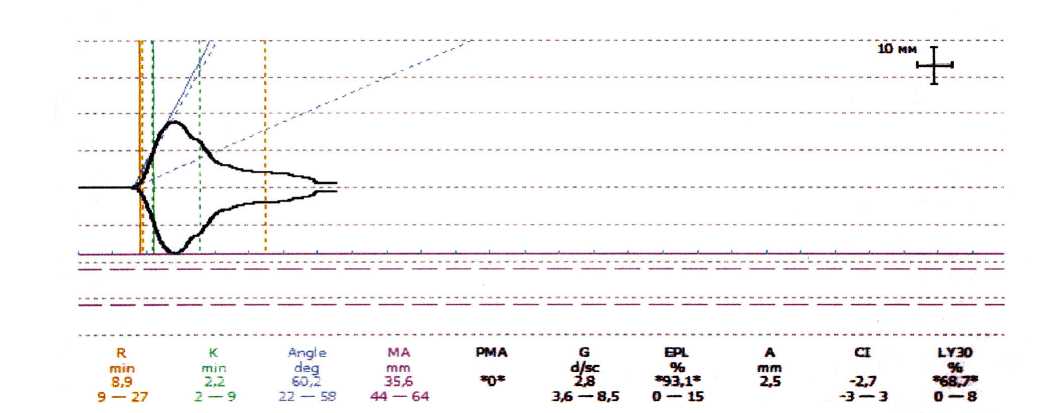
Рис. 3. Первичный фибринолиз у больного с ХЛТ
Нарушения системы гемостаза в колоректальной хирургии
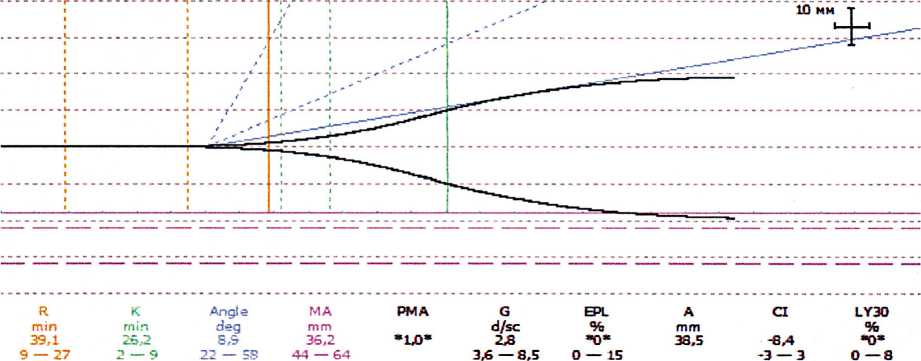
Рис.4. Гипокоагуляция у больного с резекцией печени.
риски не только тромбоопасности, но и возможности развития неуправляемой коагулопатии. Анализ рисков послеоперационных осложнений в результате профилактики тромботических осложнений показал, что тромбозов и эмболий во всех трех группах не было отмечено, тогда как неуправляемая коагулопатия в связи с массивной кровопотерей с летальным исходом отмечена у одной пациентки после гемигепатэктомии. Отмечено также два случая внутреннего кровотечения с релапаротомией в раннем послеоперационном периоде. Таким образом, успех хирургического лечения больных раком толстой кишки зависит от комплексной интенсивной терапии, включающей инфузионную терапию с медикаментозной антикоагулянтной терапией (НМГ – фраксипа-рина) с первого дня после операции, что снижает риск развития тромботических осложнений. На нестабильность в системе гемостаза и возможность развития неуправляемой коагулопатии потребления в послеоперационном периоде у больных с ХЛТ и резекцией печени указывают ряд факторов как свертывающей, так и противосвертывающей систем крови. В связи с этим необходим динамический мониторинг данной системы, включающей высокоинформативные тесты, от показаний которых может зависеть не только дозировка и время назначения антикоагулянта, но и необходимость его отмены в связи с риском развития кровотечения.
Выводы
-
1. У больных с колоректальным раком в доо-перационном периоде система гемостаза во всех трех группах находится в состоянии умеренной гиперкоагуляции, при этом сохранена активность естественных антикоагулянтов и факторов свертывания. Химиолучевая терапия не оказывает значимых изменений в системе гемостаза по сравнению с контрольной группой. В контрольной группе и в группе после ХЛТ антикоагулянтная профилактика может назначаться уже в доопе-рационном периоде за 12 часов до операции.
-
2. В послеоперационном периоде в группе больных с комбинированной резекцией печени и толстой кишки нестабильность в системе гемостаза проявляется снижением факторов свертывания (укорочение протромбинового индекса по Квику в %, удлинение АЧТВ, уменьшение естественного коагулянта АIII до 60%), что указывает на тенденцию к гипокоагуляции и необходимость индивидуального подхода к применению антикоагулянтной профилактики только после нормализации данных показателей.
-
3. Мониторинг и динамический контроль системы гемостаза позволит своевременно назначить антитромботическую, а при необходимости и гемостатическую терапию с целью предупреждения развития коагулопатии и ДВС-синдрома.
Диагностика и лечение опухолей. Оригинальные статьи
Список литературы Нарушения системы гемостаза в колоректальной хирургии
- Бедило Н. В., Воробьева Н. А., Исмайлова Н. В., Вещагина Н. А., Насонов И. Я., Малугин Ю. Ю. Оценка некоторых показателей гемостаза и эндотелиальной дисфункции у пациентов с внебольничной пневмонией. Анестезиология и реаниматология № 1, 2014, с. 33-38
- Баркаган З. С., Момот А. П., Диагностика и контролируемая терапия нарушений гемостаза. М.: Ньюмед; 2001
- Биткова Е. Е., Зверева Н. Ю., Хватов В. Б., Чумаков М. В., Тимербаев В. Х., Дублев А. В., Редкобородый А. В. Коагуляционный профиль пациентов в конце кардиохирургической операции. Анестезиология и реаниматология. № 1, 2014, с.14-17
- Бычинин М. В., Галстян Г. М., Шулутко Е. М., Куликов С. М. Катетеризация артeрий у больных с геморрагическим синдромом. Анестезиология и реаниматология № 2, 2014, с. 64-69
- Гордеев С. С., Расулов А. О., Мамедли З. З., Алиев В. А., Кулушев В. М. Неоадьювантная химиотерапия колоректального рака -время изучать новую стратегию лечения? Вопросы онкологии. 2014, ТОМ 60, № 1, с.18-24
- Давыдов М. И., Аксель Е. М. 2006. Статистика злокачественных новообразований в России и странах СНГ в 2006 г. Вестник РОНЦ им. Н. Н. Блохина Рамн.-2010; 21 (прил. 1):59
- Зайцев А. Ю., Дубровин К. В., Светлов В. А. Причины и патогенез гипокоагуляции в реконструктивно-восстановительной челюстно-лицевой хирургии. Анестезиология и реаниматология. № 2, 2014, с. 56-58
- Лазарев А. Ф., Мамонтов К. Г., Котельников А. Г., Лубенников В. А., Хайс С. Л. Обширные резекции печени с предоперационной регионарной химиотерапией по поводу метастазов колоректального рака с высоким риском массивной кровопотери. Российский онкологический журнал. 1. 2014, с. 4-7
- Патютко Ю. И., Мамонтов К. Г., Котельников А. Г., Пономаренко А. А., Лазарев А. Ю. Обширные резекции печени с предоперационной химиотерапией по поводу метастазов колоректального рака с высоким риском осложнений. Российский онкологический журнал. 2. 2014, с. 4-11
- Расулов А. О., Шелыгин Ю. А., Бойко А. В., Орлова Л. П., Дрошнева И. В., Жданкина С. Н. «Непосредственные результаты комплексного лечения рака прямой кишки с применением предоперационной химиолучевой терапии в режиме динамического фракционирования. Колопроктология. Научно-практический медицинский журнал. № 2, (28) -2009.-с. 27-37
- Семенов Н. Н., Мещеряков А. А. Оценка побочных эффектов двух режимов трехкомпонентной химиотерапии диссеминированного колоректального рака в первой линии лечения. Российский онкологический журнал. Москва. Издательство «Медицина», 3, 2014, с. 29-31
- Руководство по химиотерапии опухолевых заболеваний. Под редакцией Н. И. Переводчиковой. 2-е издание, дополненное и переработанное. Практическая медицина. Москва. 2005.-698 с
- Цеймах Е. А., Кундиус С. А., Бомбизо В. А., Булдаков П. Н., Удовиченко А. В., Смирнова О. И., Макин А. А. Сравнительные данные об использовании криосупернатанта и свежезамороженной плазмы в терапии синдрома диссеминированного свертывания крови у больных с распространенным перитонитом. Анестезиология и реаниматология. № 2, 2014, с. 52-56
- Злокачественные новообразования, тромбофилия и тромбозы. Под редакцией Макацария А. Д. Издательство «Триада-Х», 2008-784 с
- Todd H. Baron, M.D., Patrick S. Kamath, M.D., and Robert D. McBane, M. D. Management of Antithrombotic Therapy in Patients Undergoing Invasive Procedures. N Engl J Med 2013; 368:2113-2124
- Pier Mannuccio Mannucci, M.D., and Marcel Levi, M.D., Ph.D. Prevention and Treatment of Major Blood Loss. N Engl J Med 2007; 356:2301-2311
- Schmoll H. J., Van Cutsem E., Stein A., Valentini V., Himelius B., Haustermaus K. et al.ESMO Consensus guidelines for management of patients with colon anal rectal cancer. A personalized approach to clinical decision making. Ann. Onclo. 2012; 23; 2479-516
- References
- Bedilo N. V., Vorobyova N. A., Ismailova N. V., Veschagina N. A., Nasonov I. Ya., Malugin Yu. Yu. Evaluation of haemostasis and endothelial dysfunction in patient with community-acquired pneumonia. Anesthesiology and intensive care 2014; 1: 33-36
- Barkagan Z. S., Momot A. P. Diagnostics and treatment of coagulation disorders. M: N’jumed; 2001
- Bitkova E. E., Zvereva N. Yu., Khvatov V. B., Chumakov M. V., Timerbaev V. Kh., Dublev A. V., Redkoborodyi A. V. Whole blood coagulation thromboelastometric profiles after cardiac surgery. Anesthesiology and intensive care 2014; 1: 14-17
- Bychinin M. V., Galstyan G. M., Shulutko E. M., Kulikov S. M. Pulmonary artery catheterization in patients with blood diseases. Anesthesiology and intensive care 2014; 2: 64-69
- Gordeev S. S., Rasulov A. O., Mamedly Z. Z., Aliev V. A., Kulushev V. M. Neoadjuvant chemotherapy for colorectal cancer -the time to learn a new treatment strategy? Problems in oncology 2014; Vol. 60; 1: 18-24
- Davydov M. I., Aksel E. M. 2006. Statistics of malignant tumors in Russia and CIS. Journal on N. N. Blokhin Russian Cancer Research Center RAMS. 2010; 21 (1): 59
- Zaytsev A. Yu., Dubrovin K. V., Svetlov V. A. Causes and pathogenesis of hypocoagulation in reconstructive maxillofacial surgery. Anesthesiology and intensive care 2014; 2: 56-58
- Lazarev A. F., Mamontov K. G., Kotelnikov A. G., Lubennikov V. A., Khays S. L. Extensive liver resection with preoperative chemotherapy for colorectal metastases with high risk of blood loss. Russian journal of oncology 2014; 1: 4-7
- Patyutko Yu. I., Mamontov K. G., Kotelnikov A. G., Ponomarenko A. A., Lazarev A. F. Extensive liver resection with preoperative chemotherapy for colorectal metastases with high risk of complications. Russian journal of oncology 2014; 2: 4-11
- Rasulov A. O., Shelygin Yu. A., Boyko A. V., Orlova L. P., Droshneva I. V., Zhdankina S. N. The results of rectal cancer treatment with preoperative chemoradiotherapy in dynamic fractionation regime. Coloproctology 2009; Vol. 28 2: 27-37
- Manual for chemotherapy of tumor diseases. Edition 2. Practical medicine 2005; p. 698
- Tseimakh E. A., Kundius S. A., Bombizo V. A., Buldakov P. N., Udovichenko A. V., Smirnova O. I., Makin A. A. Comparative data about cryosupernatant and fresh frozen plasma use in treatment of disseminated intravascular coagulation in patients with generalized peritonitis. Anesthesiology and intensive care 2014; 2: 52-56
- Cancer, thrombophylia and thrombosis. Makacarija A. D. «Triada-X» 2008-784 p
- Todd H. Baron, M.D., Patrick S. Kamath, M.D., and Robert D. McBane, M. D. Management of Antithrombotic Therapy in Patients Undergoing Invasive Procedures. N Engl J Med 2013; 368:2113-2124
- Pier Mannuccio Mannucci, M.D., and Marcel Levi, M.D., Ph.D. Prevention and Treatment of Major Blood Loss. N Engl J Med 2007; 356:2301-2311
- Schmoll H. J., Van Cutsem E., Stein A., Valentini V., Himelius B., Haustermaus K. et al.ESMO Consensus guidelines for management of patients with colon anal rectal cancer. A personalized approach to clinical decision making. Ann. Onclo. 2012; 23; 2479-516
- Semenov N. N., Mescheryakov A. A. Side effects’ evaluation of two regimes of three component chemotherapy of disseminated colorectal cancer in first steps of treatment. Russian journal of oncology 2014; 3: 29-31


