Наш опыт применения реваскуляризированных лоскутов при оперативном лечении пациентов с саркомами мягких тканей
Автор: Иванов В.В., Каганов О.И., Орлов А.Е., Николаенко А.Н., Дороганов С.О., Бондаренко И.В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 5 т.14, 2024 года.
Бесплатный доступ
Введение. Саркомы мягких тканей - это достаточно редкие злокачественные опухоли мезенхимального происхождения. Заболеваемость составляет до 2% среди всех злокачественных новообразований. В России ежегодно регистрируется около 10 000 новых случаев саркомы мягких тканей. 5-летняя выживаемость при саркоме мягких тканей I-II стадии - от 70 до 100%, при III-IV стадии - от 50% до 10%. На протяжении длительного времени основным методом лечения пациентов с саркомами мягких тканей конечностей служили радикальные органуносящие операции, которые приводили к снижению уровня качества жизни и инвалидизации. В настоящее время, благодаря мультидисциплинарному подходу, удалось выработать оптимальную тактику в комплексном лечении пациентов с этой патологией. Современный взгляд на лечение данной группы пациентов предполагает проведение лекарственной терапии и адекватное иссечение опухоли, соблюдая принцип радикальности и футлярности. Необходимым условием считается, что расстояние от пальпируемого края опухоли должно составлять 5-8 см. Вследствие такого отступа возникает вопрос о закрытии обширных пострезекционных дефектов мягких тканей. Данный аспект создаёт определённые сложности при лечении пациентов с локализацией опухоли преимущественно на дистальных отделах, таких как кисть и особенно стопа. Целью настоящей работы является анализ опыта применения реваскуляризированных лоскутов при оперативном лечении пациентов с саркомами мягких тканей. Исследование проведено на базе Центра онкоортопедии Самарского областного клинического онкологического диспансера (ГБУЗ СОКОД). Объект и методы. С 2020 по 2023 год в наше наблюдение была включена группа пациентов из 10 человек - 6 женщин и 4 мужчины, возраст от 29 до 64 лет. Нозологические разновидности составляли: веретеноклеточная саркома, липосаркома, фибросаркома (pT1,2a-bN0M0, GI-III, IA-B, IIA-B, III стадия). Всем пациентам были выполнены оперативные вмешательства, которые включали в себя радикальное удаление опухоли мягких тканей и реконструктивный этап замещения пострезекционного дефекта с использованием реваскуляризированных лоскутов на микрососудистых анастомозах.
Микрохирургия, реваскуляризированный лоскут, саркомы мягких тканей
Короткий адрес: https://sciup.org/143183672
IDR: 143183672 | УДК: 616-006.3.04-089.843 | DOI: 10.20340/vmi-rvz.2024.5.CLIN.3
Текст научной статьи Наш опыт применения реваскуляризированных лоскутов при оперативном лечении пациентов с саркомами мягких тканей
Саркомы мягких тканей (СМТ) – это редкие злокачественные опухоли мезенхимального происхождения, составляющие около 2% от всех злокачественных новообразований человека. В России ежегодно регистрируется около 10 000 новых случаев СМТ [1]. Локализация первичного очага СМТ может быть различной, однако свыше 40% всех сарком мягких тканей локализуются на нижних конечностях, а вместе с ягодичной областью их частота достигает 60%, причём 75% из них локализуется на бедре и в области коленного сустава. Верхние конечности поражаются в 15–20% случаев. Таким образом, 60% сарком мягких тканей локализуются на конечностях, около 30% – на туловище и 10% – на голове и шее. Однако доминирующее расположение занимает нижняя конечность [2].
Начальные признаки и симптомы СМТ зависят от локализации и размера опухоли, гистологического строения и степени злокачественности. Наиболее часто больные обращаются к врачу, обнаружив у себя безболезненную опухоль. Более чем у полови- ны пациентов опухоль – первый и единственный симптом заболевания. Иногда к этому присоединяются неврологическая симптоматика при сдавлении или прорастание опухолью магистральных нервов и сосудистые расстройства при сдавлении магистральных сосудов. При поражении надкостницы и кортикального слоя кости появляются боли, характерные для костной патологии. При вовлечении в опухолевый процесс капсулы сустава нарушается его функция. «Золотым стандартом» в диагностике СМТ является магнитно-резонансная томография (МРТ), позволяющая точно определить место и распространённость опухоли, её близость к важным анатомическим структурам и кости. Данная информация необходима при планировании лечения [3]. Разные типы СМТ отличаются своим клиническим проявлением и ответом на лечение. Их гистологическое строение играет важную роль как предиктор прогнозирования метастатического риска и процента выживания, в связи с чем необходимо проводить биопсию ещё до начала комплексного лече- ния, при этом стадия опухолевого процесс определяет последовательность видов лечения.
Долгое время единственным вариантом хирургического лечения СМТ являлись калечащие операции в виде ампутаций конечности и экзартикуляций. На сегодняшний день комплексный подход в лечении данной патологии, несомненно, является актуальной задачей и предметом дискуссий для врачей онкологов, ортопедов и медицинского сообщества. Закрытие обширных дефектов на дистальных отделах конечностей после радикального удаления опухоли ещё более усложняет поиск оптимального метода реконструкции и повышает интерес в решении этой проблемы. Для этого требуется взаимодействие врачей множества специальностей. Обязательное участие таких врачей, как онкологи, травматологи-ортопеды, морфологи, пластические хирурги или врачи, прошедшие курс повышения квалификации по реконструктивной хирургии, в том числе микрохирургии, определяет мультидисци-плинарный подход.
В настоящее время разработаны алгоритмы лечения, в большинстве случаев сохраняющие пациенту конечность и качество жизни. При этом оперативное лечение должно выполняться с соблюдением онкологических принципов радикальности и футлярности удаления злокачественных опухолей мягких тканей. Выполняется широкое иссечение опухоли в пределах здоровых тканей с отступом от краёв резекции. Большинство клиницистов считают, если планируется только одна операция, то достаточно отступить 5 см от краёв, при сочетании с лучевой терапией необходимой дистанцией является расстояние в 3 см [5, 6]. При этом стоит отметить, что при простом удалении опухолевого узла рецидивы возникают в 60–90% случаев. Радикальная резекция с достаточным запасом нормальных тканей вокруг опухоли позволяет снизить процент рецидивов до 25–30% [7]. После ампутаций и экзартикуля-ций рецидивы возникают в 10–15% случаев. Оптимальным расстоянием, по данным большинства авторов, является дистанция в 5–8 см от пальпируемого края опухоли. В большей степени это относят к проксимальному полюсу опухоли. Нередко мягкотканная саркома распространяется, контактируя с сосудисто-нервным пучком, но в подавляющем большинстве случаев опухоль не прорастает сосуды, а отодвигает их, что, в свою очередь, создаёт много трудностей для пациентов с локализацией поражения мягких тканей таких областей, как кисть и, особенно, стопа. Стоит отдельно отметить, что на стопе есть нагружаемые зоны – три точки опоры: головки 1 и 5 плюсневых костей и пяточная кость, которые постоянно подвергаются физической и механической нагрузке. В этих случаях использование свободных дерматомных лоскутов для замеще- ния пострезекционных дефектов не применимо. Встает вопрос о реабилитации таких пациентов и дальнейшем сохранении функциональности этих структур. Для замещения обширных дефектов кожи и мягких тканей требуется выполнение реконструктивного этапа, в том числе с использованием микрохирургической техники. Возникают высокие требования к прочности и пластическим свойствам выбранного материала ввиду специфичности архитектоники тканей данных областей, скопления множества структур в ограниченном пространстве, особенности кровоснабжения и сохранения функциональности конечности. Несомненно, наилучшим вариантом замещения, несмотря на сложности хирургической техники, является применение сложносоставных реваскуляризированных лоскутов.
Цель исследования: проанализировать опыт применения реваскуляризированных лоскутов в хирургическом лечении пациентов с саркомами мягких тканей.
Объект и методы
С 2020 по 2023 год в наше наблюдение была включена группа пациентов из 10 человек – 6 женщин и 4 мужчины, возраст от 29 до 64 лет.
Нозологические разновидности составляли: веретеноклеточная саркома, липосаркома, фибросаркома (pT1,2a-bN0M0, GI-III, IA-B, IIA-B, III стадия).
После полного догоспитального обследования в условиях поликлиники СОКОД по программе поиска первичного очага и распространённости опухолевого процесса всем пациентам были выполнены оперативные вмешательства, которые включали в себя радикальное удаление опухоли мягких тканей и реконструктивный этап замещения пострезекционного дефекта с использованием реваскуляризи-рованных лоскутов на микрососудистых анастомозах. Всем пациентам выполняли замещение пострезекционного дефекта лучевым лоскутом на микро-сосудистых анастомозах лучевой артерии и коми-тантных вен.
Рассмотрим применение реваскуляризирован-ного кожно-фасциального лучевого лоскута на примере нескольких клинических ситуаций.
Клинический пример 1
Пациент Г., 39 лет. Обратился в ГБУЗ СОКОД с жалобами на наличие опухолевидного новообразования в области ахиллова сухожилия левой голени. После обследования был установлен диагноз: мик-софибросаркома мягких тканей левой голени cT1bN0M0 GII (рис. 1).
Учитывая локализацию новообразования в нижней трети голени и прогнозируя дефицит укрывных мягких тканей после удаления опухоли было принято реше- ние о проведении оперативного вмешательства в следующем объёме: футлярно-фасциальное иссечение опухоли мягких тканей нижней трети левой голени; замещение дефекта свободным реваскуляризиро-ванным лучевым лоскутом предплечья.
Нами выполнен окаймляющий разрез кожи с отступом от краёв опухоли 5 см. Опухоль удалена единым блоком радикально по границе здоровых тканей, при этом обнажена латеральная поверхность паратенона ахиллова сухожилия.
Из этого же доступа выше дефекта на 2 см выделен и мобилизован задний большеберцовый сосудисто-нервный пучок (артерия, вены, нерв), сосуды разделены и подготовлены к подшиванию донорских сосудов, путём деликатной диссекции снята адвентиция. Лучевой кожно-фасциальный лоскут предплечья выделен от дистального края к проксимальному, из дополнительного «lazy S» доступа проксимальнее лоскута выделена его сосудистая ножка длиной 5 см, лигирована и пересечена. У дистальной границы лоскута выделены и лигированы лучевые артерия и вены (рис. 2).
Лучевой лоскут предплечья уложен в зону дефекта и центрирован по форме. Выполнено формирование венозного анастомоза «конец в конец» между лучевой и задней большеберцовой венами. Выполнен анастомоз «конец в бок» между лучевой и задней большеберцовой артериями. Снятие клипс, проверка анастомозов: швы состоятельны, герметичны. Область анастомозов укрыта гемостатической губкой и местной жировой тканью (рис. 3).
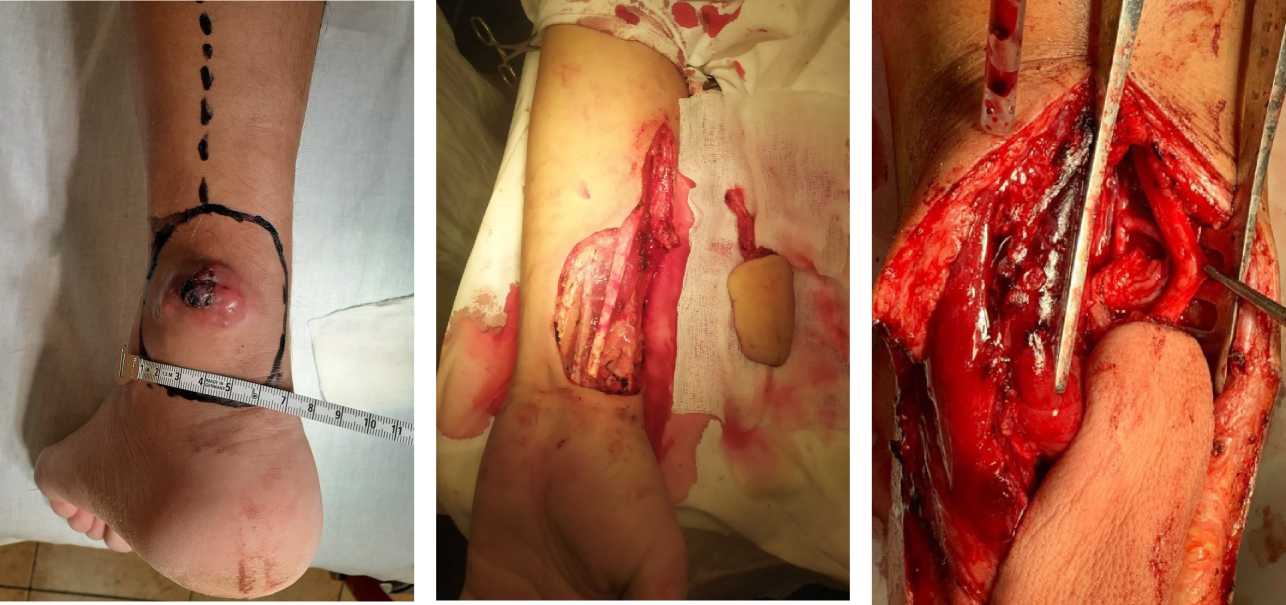
Рисунок 1. Общий вид левой голени с опухолью
Figure 1. General view of the left lower leg with a tumor
Рисунок 2. Вид реципиентной зоны. Выделен лучевой лоскут с сосудистой ножкой
Figure 2. View of the recipient zone. The radial flap with a vascular pedicle is isolated
Рисунок 3. Вид операционной раны. Фор мирование микрососудистых анастомозов Figure 3. View of the surgical wound Formation of microvascular anastomoses
Кровоток проверен «методом двух пинцетов». Симптом «белого пятна» положительный. Лоскут подшит узловыми швами. Рана дренирована резиновым выпускником. Асептические повязки на раны. С помощью дерматома выполнен забор расщеплённого кожного лоскута с правой ягодицы, ткань подготовлена и заранее перфорирована. Донорская область предплечья укрыта расщеплённым трансплантатом, подшита узловыми швами (рис. 4).
Пациент выписан из стационара на 10-е сутки в удовлетворительном состоянии без осложнений. Рана на реципиентной зоне зажила первичным натяжением. Донорская область, замещённая дер- матомным лоскутом с полной адгезией и явлениями грануляции. Пациенту вторым этапом проведено 4 цикла адъювантной полихимиотерапии (ПХТ) по схеме AI (доксорубицин + ифосфамид).
Пациент находится под диспансерным наблюдением. В настоящее время срок наблюдения составил 4 года. Данных за прогрессию и рецидив нет.
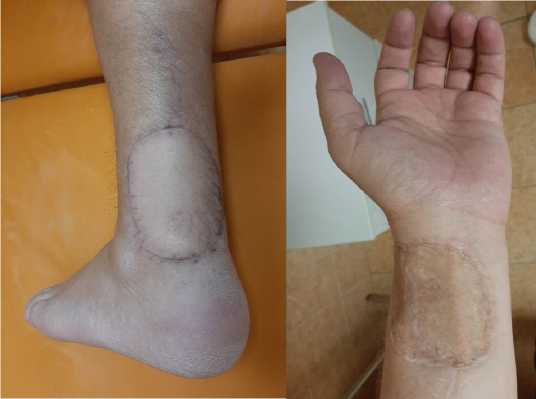
При очередном контрольном осмотре в СОКОД: послеоперационные области (донорская и реципи-ентная) полностью замещены и восстановлены, контрактуры и ограничение движений в суставах нет. Отмечается отличный косметический и фукцио-нальный результаты (рис. 6).
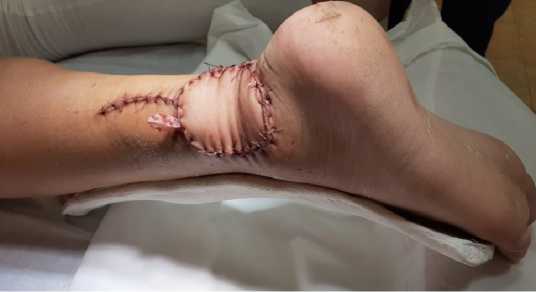
Рисунок 4. Общий вид послеоперационной раны. 1-е сутки после операции
Figure 4. General view of the postoperative wound. 1st day after surgery
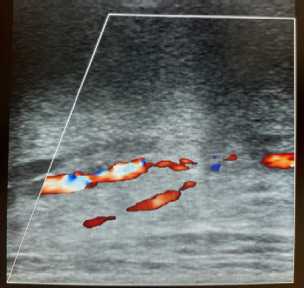
Рисунок 5. Цветовое допплеровское картирование: кровоток сосудистого анастомоза
Figure 5. Color Doppler mapping: blood flow of the vascular anastomosis
Клинический пример 2
Пациентка Г., 29 лет. Обратилась в ГБУЗ СОКОД с жалобами на наличие опухолевидного новообразования в области подошвенной поверхности стопы. После обследования был установлен диагноз: липосаркома мягких тканей правой стопы T2bN0M0 Ib ст.
Учитывая локализацию новообразования в нижней трети голени и прогнозируя дефицит укрывных мягких тканей после удаления опухоли было принято решение о проведении оперативного вмешательства в объёме: футлярно-фасциальное иссечение опухоли мягких тканей правой стопы; замещение дефекта ревас-куляризованным лучевым лоскутом предплечья.
Выполнен окаймляющий опухоль правой стопы, разрез кожи, отступив от краёв 2 см. Мягкие ткани тупо и остро разведены. Последовательной диссекцией опухоль удалена по границе здоровых тканей: интраоперационно выявлено, что новообразование прорастает в проксимальную фалангу 4 пальца, в связи с чем принято решение об ампутации пальца.
А Б
Рисунок 6. Общий вид конечностей: А – реципиентная зона; Б – донорская зона
Figure 6. General view of the limbs: A - recipient zone; Б - donor zone
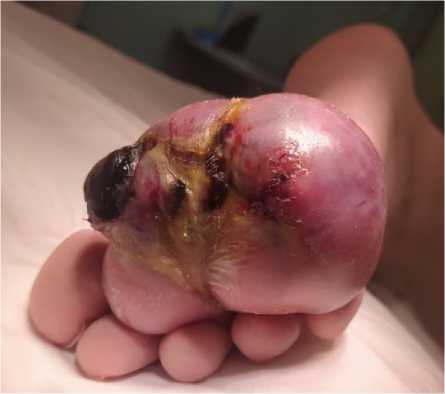
Рисунок 7. Общий вид конечности с опухолью Figure 7. General view of the limb with the tumor
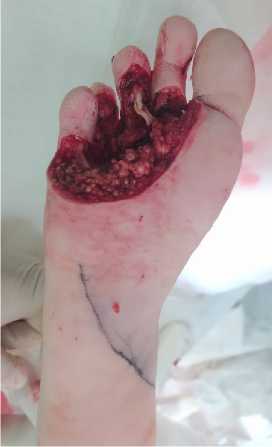
Рисунок 8. Ложе удаленной опухоли Figure 8. Bed of the removed tumor
Макропрепарат (округлая опухоль мягких тканей правой стопы 10x6 см с очагами распада и изъязвления на поверхности кожи) отправлен на гистологическое исследование. Суставная поверхность головки 4 плюсневой кости скусана. Разрез кожи и подкожной клетчатки продлён дугообразно в проксимальном направлении в проекции латерального подошвенного сосудисто-нервного пучка длиной 8 см. Латеральные подошвенные вены и артерия выделены проксимальнее уровня образования глубокой подошвенной дуги. Сосуды разделены, освобождены от адвентиции. В нижней трети предплечья на 2 см выше проксимальной складки запястья выполнен круговой разрез кожи. У дистальной границы лоскута выделены и лигированы лучевые вены и артерия. Лучевой кожно-фасциальный лоскут предплечья выделен от дистального края к проксимальному, из дополнительного «lazy S» доступа проксимальнее лоскута выделена его сосудистая ножка длиной 7 см, лигирована и пересечена. С помощью дерматома выполнен забор расщеплённого кожного лоскута с правого бедра, ткань подготовлена. Донорская область предплечья укрыта расщеплённым трансплантатом, подшита узловыми швами.
Лучевой лоскут предплечья уложен в зону дефекта и центрирован по форме. Выполнено формирование венозного анастомоза «конец в конец»
между лучевой и латеральной подошвенной венами. Выполнен анастомоз «конец в конец» между лучевой и латеральной подошвенной артериями. Снятие клипс, проверка анастомозов: кровоток состоятелен.
Область анастомозов укрыта местной жировой тканью. Лоскут подшит узловыми швами. Фиксация 4-го пальца к плюсневой кости гемотрансфузионной иглой. Установлен капиллярный дренаж из перчаточной резины. Наложены асептические повязки на раны.
Пациент выписан из стационара на 12-е сутки в удовлетворительном состоянии без осложнений. Рана на реципиентной зоне зажила первичным натяжением. Донорская область, замещенная дерматомным лоскутом с полной адгезией и явлениями грануляции.
Пациент находится под диспансерным наблюдением. В настоящее время срок наблюдения составил 3 года. Данных за прогрессию и рецидив нет.
При очередном контрольном осмотре в СОКОД: послеоперационные области (донорская и реципи-ентная) полностью замещены и восстановлены. Опорная функция стопы не нарушена. Отмечается отличный косметический и фукциональный результаты.
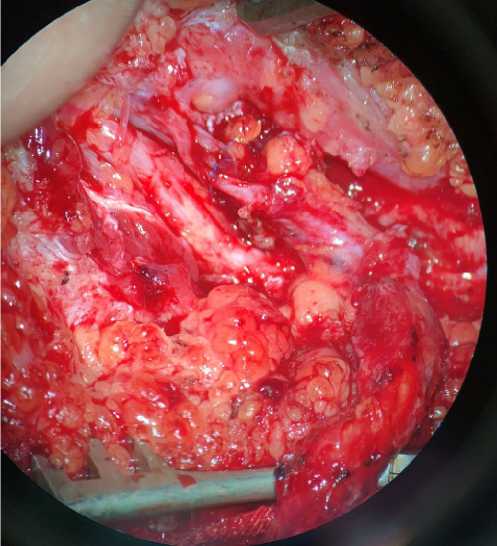
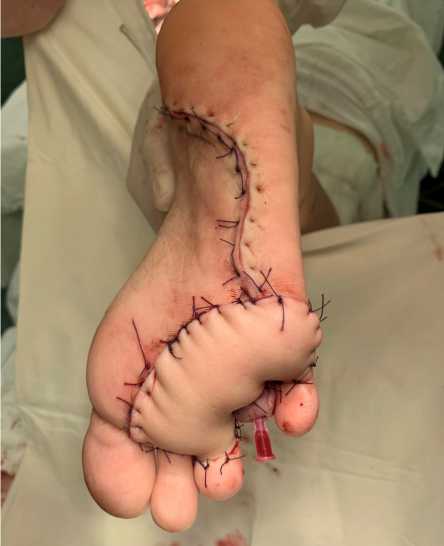
Рисунок 9. Вид операционной раны. Формирование микрососу- Рисунок 10. Общий вид послеоперационной раны. 1-е сутки после дистых анастомозов операции
Figure 9. View of the surgical wound. Formation of microvascular Figure 10. General view of the postoperative wound. 1st day after anastomoses surgery
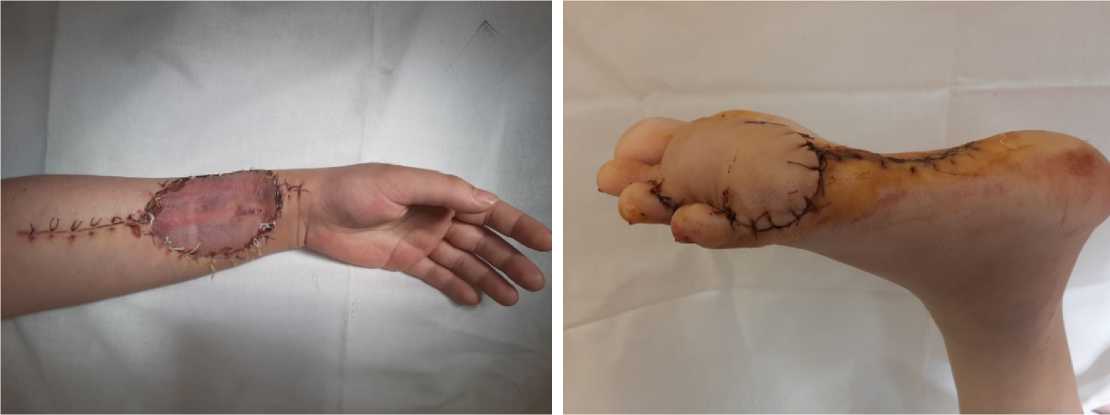
Рисунок 10. 11-е сутки после операционного лечения Figure 10. 11th day after surgical treatment
А
Б
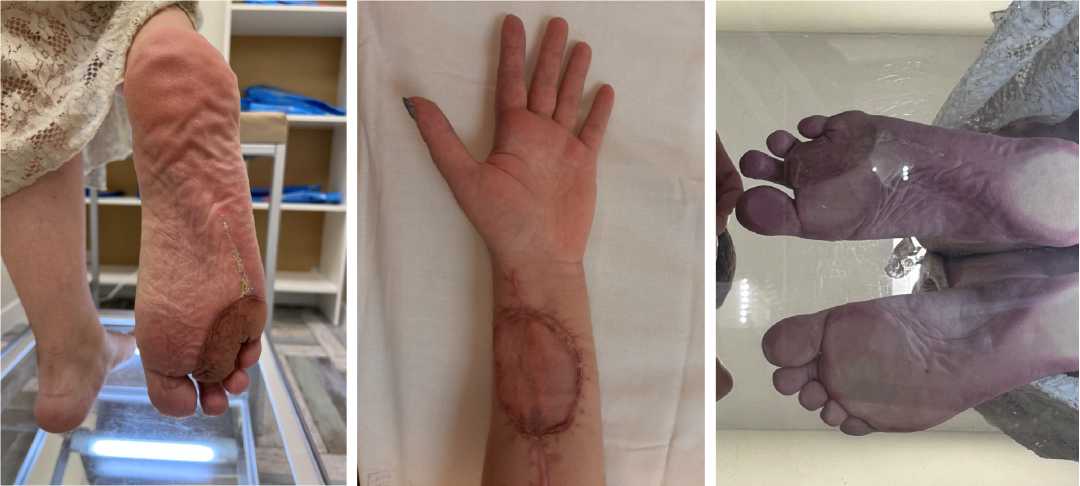
Рисунок 11. Общий вид конечностей: А – реципиентная зона; Б – донорская зона
Figure 11. General view of the limbs: A – recipient zone; Б – donor zone
Рисунок 12. Общий вид конечностей.
Плантоскопия
Figure 12. General view of the limbs. Plantoscopy
Результаты
К главному достоинству реконструктивного этапа с применением микрохирургической техники относится быстрое восстановление кожного покрова, восполнение дефицита мягких тканей, в том числе толщины, прочность лоскута для выполнения опорной функции, отсутствие трофических расстройств, отсутствие контрактуры суставов, восстановление функции конечности в кратчайшие сроки. Срок наблюдения составил 3 года. За это время было отмечено: выживаемость – 100%, рецидив – 0 случаев, тромбоз микрососудистого анастомоза –
0 случаев, краевой некроз лоскута – 1 случай, контрактура сустава – 0 случаев.
К относительным недостаткам применения данной методики можно отнести: продолжительность оперативного вмешательства, необходимость одновременной работы нескольких хирургических бригад, постоянное усовершенствование мануальной и практической техники хирурга, трудоемкость выполнения подобных операций и обязательное наличие специального оптического оборудования и шовного материала.
Обсуждение
Использование микрохирургической техники для лечения пациентов с СМТ, несомненно, способствует наиболее благоприятному прогнозу во всех аспектах лечения для пациентов данной группы. Однако применение данной техники требует от врачей прохождения дополнительного обучения, времени освоения, а также увеличивает трудоёмкость самого оперативного вмешательства. Среднее время продолжительности оперативного вмешательства одной операционной бригадой составляет примерно 420 минут, когда задействованы две операционные бригады, то продолжительность операции сокращается приблизительно до 300 минут. Так как в со- ставе центра онкоортопедии Самарского областного клинического онкологического диспансера трое человек, то, в основном, оперативное вмешательство выполнялось одной операционной бригадой. Средняя кровопотеря составила 150 мл.
Заключение
Применение реваскуляризированных лоскутов при оперативном лечении пациентов с саркомами мягких тканей позволяет радикально удалить опухоль и полноценно заместить пострезекционный дефект, что, в свою очередь, снижает риск рецидивов и способствует восстановлению функции конечности с хорошим косметическим результатом.
Список литературы Наш опыт применения реваскуляризированных лоскутов при оперативном лечении пациентов с саркомами мягких тканей
- Doyle L.A. Sarcoma classification: an update based on the 2013 World Health Organization Classification of Tumors of Soft Tissue and Bone. Cancer. 2014 Jun 15;120(12):1763-74. Epub 2014 Mar 19. PMID: 24648013. DOI: 10.1002/cncr.28657 PMID: 24648013
- Гилязутдинов И.А. Саркомы мягких тканей. Казань; 2008:166. Gilyazutdinov I.A. Soft tissue sarcomas. Kazan; 2008:166. (In Russ).
- Wu JS, Hochman MG. Soft-tissue tumors and tumor like lesions: a systematic imaging approach. Radiology. 2009;253(2):297-316. DOI: 10.1148/radiol.2532081199
- Amanda R, Karama A, Torsten O Nielsen. Advances in sarcoma diagnostics and treatment. Oncotarget. 2017:8(4):7068-93. DOI: 10.18632/oncotarget.12548 EDN: YXIYBJ
- Саркомы мягких тканей: клинические рекомендации. 2020. Soft tissue sarcomas: clinical recommendations. 2020. (In Russ). URL: https://old.oncology-association.ru/files/clinical-guidelines-2020/sarkoma_mjagkih_tkanej.pdf.
- Sadoski C., Suit H.D., Rosenberg A. et al. Preoperative radiation, surgical margins, and local control of extremity sarcomas of soft tissues. J. Surg. Oncol. 1993;52:223.
- Rosenberg S.A., Tepper J., Glatstein E. et al. The treatment of softtissue sarcomas of the extremities: prospective randomized evaluations of (1) limb sparing surgery plus radiation therapy compared with amputation and (2) the role of adjuvant chemotherapy. Ann Surg. 1982;196:305.


