Наследование и экспрессия способности к индукции соматического эмбриогенеза in vitro в онтогенезе растений перца сладкого
Автор: Тимина О.О., Цыкалюк Р.А., Орлов П.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биотехнология. Культура клеток и тканей
Статья в выпуске: 3 т.40, 2005 года.
Бесплатный доступ
Оценивали показатели экспрессии и наследования способности к соматическому эмбриогенезу in vitro у 35 различных генотипов перца сладкого на разных этапах онтогенеза. Рассматриваются механизмы регуляции индукции образования соматических зародышей на уровне генов.
Короткий адрес: https://sciup.org/142133082
IDR: 142133082 | УДК: 635.649:581.143.6:575.117.2
Текст научной статьи Наследование и экспрессия способности к индукции соматического эмбриогенеза in vitro в онтогенезе растений перца сладкого
При изучении индуцированного органогенеза и соматического эмбриогенеза особый интерес представляет, на наш взгляд, не эмпирическая разработка протоколов различных методов для отдельных генотипов, а фундаментальные исследования генетики развития изучаемого объекта и экспрессии конкретных генов. Предлагается следующая стратегия исследований соматического эмбриогенеза у растений перца сладкого: оценка генофонда с целью выделения разнокачественных доноров признака; детальная характеристика экспрессии признака в онтогенезе; выявление биотических и абиотических факторов, индуцирующих экспрессию; выявление закономерностей изменчивости и наследования признака у доноров различных типов, а также возможных плейотропных эффектов; разработка методов управления экспрессией признака.
Ранее нами были выделены генотипы перца сладкого, характеризующиеся способностью к индукции формирования соматических зародышей в культуре клеток и тканей in vitro (7). В задачу настоящей работы входила оценка степени проявления способности к индукции соматического эмбриогенеза в онтогенезе и характера ее наследования у гибридов перца сладкого, полученных при участии разнокачественных доноров.
Методика . Объектом исследования служили 35 генотипов перца сладкого Capsicum annuum L. var. annuum , включая 12 гибридов F1 (8). Определяли частоту индукции соматических эмбриоидов (%), общее количество эмбриоидов, число нормальных эмбриоидов и альбиносов-химер. В качестве эксплантов использовали незрелые зиготические зародыши различного возраста, выделенные фрагменты гипокотиля, семядолей и настоящих листьев растений, выращенных из семян в стерильных условиях на среде Мурасиге-Скуга (без гормональных добавок), разбавленной в 2 раза.
С целью оценки характера наследования способности к индукции соматического змбриогенеза в онтогенезе проводили скрещивания индуцибельных генотипов по неполной диаллельной схеме. Для этого в течение весенне-летнего периода растения выращивали в пленочных необогреваемых теплицах по общепринятой технологии. Растения материнской формы опыляли избыточным количеством отцовской пыльцы. У родительских форм и гибридов F1 извлекали зародыши на разных фазах развития — глобулярной, сердечковидной, торпедовидной, стика, полукольца и кольца по Fari (2). Выделенные зародыши, участки гипокотиля, семядолей и настоя- стик (рис. 1 и 2).
Рис. 1. Частота образования соматических эмбриоидов Capsicum annuum L. in vitro на разных фазах развития экспланта (среднее по 35 генотипам): I, II, III, IV, V, VI, VII, VIII и IX — соответственно глобула, сердце, торпеда, стик, полукольцо, кольцо, гипокотиль, семядоли и настоящий лист.
V VI VII VIII IX Фаза развития экспланта
щих листьев помещали на питательную среду, содержащую 2,4-Д (3). Опыт закладывали в 2-кратной повторности (не менее 10 флаконов в каждой). Статистическую обработку данных и оценку степени доминирования ( hp ) проводили по Жученко с со-авт. (9). Генетические параметры определяли на основе полудиаллельных скрещиваний (10).
Для вторичного индуцирования эмбриоидов каллус выделяли из семян с нарушенной семенной кожурой, содержащих как эндосперм, так и зародыш (фазы полукольца и кольца). Через 3 мес после культивирования этот каллус субкультивиро-вали на свежей среде с 2,4-Д (1). Культуру помещали на 2 нед в камеру (интенсивность освещения 3000 лк, фотопериод 16 ч), а затем на 1 мес в термостат при температуре 25 оС.
Результаты . При оценке регенерационной способности были выделены генотипы перца сладкого, у которых наблюдался как прямой, так и вторичный эмбрио-идогенез (7). Особенностью прямого образования соматических эмбриоидов как у доноров признака, так и некоторых гибридов F 1 , полученных на их основе, была строгая приуроченность к очень ранним фазам развития экспланта в онтогенезе — торпеда и
Экспланты отдельных генотипов обладали высокой способностью формировать соматические эмбриоиды даже в глобулярной и сердечковидной фазах развития (например межвидового гибрида F1 С. frutescens х С. annuum ). Это, возможно, свидетельствует о неодинаковой адаптивной способности и вследствие этого разной степени выживаемости зародыша на искусственной питательной среде в конкретной фазе развития. Такая дифференциация по выживаемости соматических зародышей может служить основой при разработке экспресс-методов оценки адаптивности к абиотическим стрессорам и связанных с ней плейотропных эффектов генов.
Следовательно, переключение гетерофазной репродукции на гомо-фазную в случае прямого эмбриоидо-генеза (использование в качестве индуктора 2,4-Д) при благоприятных условиях культивирования оказывается необратимым процессом, позволяющим предположить наличие у растений перца сладкого особой генной системы, скорее всего, генов-регуляторов. При этом эффект предполагаемого гена-переключателя развития в значительной степени зависит от физиологического состояния донора-экспланта.
Рис. 2. Структуры, формирующиеся в культуре клеток перца сладкого сорта Толстый барон на разных фазах соматического эмбриогенеза: а, б, в и г — соответственно торпедовидные, тюльпановидные, альбиносы-химеры, скопление клеток зеленой окраски (начало каллусообразования).
Фаза развития растения-донора
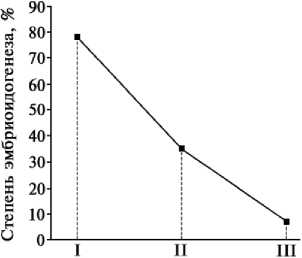
Рис. 3. Зависимость индукции соматического эмбриогенеза у эксплантов из плодов перца сладкого от стадии развития растений-доноров (среднее по пяти генотипам): I, II и III — соответственно начало технической зрелости, полная техническая зрелость и полная биологическая зрелость.
Так, у эксплантов, изъятых из плодов растений на стадии «начало технической зрелости», отмечено интенсивное формирование кластерных биполярных структур, «полная техническая зрелость» — значительное снижение индукции, «полная биологическая зрелость» — формирование в основном неэмбриогенного каллуса (рис. 3). Наиболее вероятной причиной подобной модуляции экспрессии может быть старение организма и возрастное изменение эндогенного баланса гормонов-индук-торов либо образование белков-репрес-соров.
При использовании в качестве эксплантов зародышей в фазах полукольца и кольца у подавляющего большинства генотипов, обладающих высокой способностью к переключению фаз репродукции, наблюдался только каллусоге-нез. Однако у эксплантов потомства F1 в комбинации скрещивания Колобок х Л 48 на этой же фазе развития отмечено прямое образование эмбриоидов, что подтверждает данные Harini и 67
Lakshmisita, наблюдавших аналогичный процесс у сформировавшихся зрелых зародышей перца сорта California Wonder (цит. по 2), и, возможно, свидетельствует о другом механизме каскадной активации соматического эмбриогенеза.
Вторичное образование эмбриоидов выявлено у образцов-доноров Л 49, Гогошары и Колобок. К особенностям вторичного эмбриогенеза относятся как необходимость дедифференциации и субкультивирования, так и стрессовой обработки каллуса. Известно, что при стрессе образуются белки теплового шока (БТШ), которые играют ключевую роль в регуляции клеточного цикла во время гаметогенеза у млекопитающих, а также опосредованно регулируют рост клеток, дифференцировку и экспрессию в онтогенезе некоторых ферментов (11). Возможно, что и в нашем случае БТШ, образование которых могло быть вызвано общим старением культуры, изменением рН, накоплением токсичных соединений, длительным культивированием в темноте, способствовали повышению индуцибельности и экспрес- сии генов-регуляторов.
Как показано, для успешного осуществления андрогенеза у растений перца необходимо сочетание таких факторов, как отзывчивый генотип, наличие в питательной среде гормона-индуктора, определенная стадия развития микроспор и способность последних к выживанию in vitro, подходящее физиологическое состояние донора, стрессовые условия на начальных этапах культивирования (3-5, 12, 13). Одни и те же факторы, необходимые как для андрогенеза, так и соматического эмбриогенеза, позволяют предположить хотя бы частичное совпадение генетических систем, обусловливающих эти процессы.
Разобщенность и дифференцированность образования соматических эмбриоидов у разных доноров косвенно свидетельствует, на наш взгляд, о том, что эм-бриоидогенез в условиях in vitro можно разделить на ряд этапов: индукция, форми-
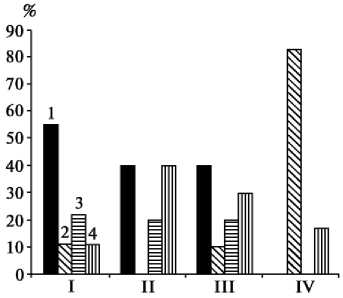
Рис. 4. Степень доминирования ( h p ) способности к переключению фазы репродукции у гибридов F 1 перца сладкого по этапам соматического эмбриогенеза: I, II, III и IV — соответственно индукция, формирование общего числа эмбриоидов, дифференциация альби-носов и нормальных эмбриоидов; 1, 2, 3 и 4 — соответственно отрицательное сверхдоминирование, отрицательное доминирование, сверхдоминирование и промежуточный характер доминирования.
рование альбиносов-химер и нормальных эмбриоидов.
У гибридов F 1 степень доминирования по способности к индукции эм-бриоидогенеза зависела от комбинации скрещивания и фазы развития экспланта (табл., рис. 4).
В целом, хотя для всего процесса и отмечено преобладание отрицательного сверхдоминирования или отрицательного доминирования, при формировании общего числа эмбриоидов выявлены отрицательное сверхдоминирование, при дифференциации альбиносов — отрицательное и положительное доминирование в одинаковой степени, при образовании нормальных эмбриоидов — резко выраженное отрицательное доминирование. Такая дифференцированность свидетельствует о том, что каждый
Оценка характера наследования способности к переключению фазы развития у эксплантов гибридов F1 Capsicum annuum L. in vitro на разных этапах соматического эмбриогенеза
|
Комбинация скрещивания |
Частота индукции соматических эмбриоидов, % |
h p |
Общее число эмбриоидов |
h p |
Число альбиносов-химер |
h p |
Число нормальных эмбриоидов |
h p |
||||||||
|
Р 1 |
Р 2 |
F 1 |
Р 1 |
Р 2 |
F 1 |
Р 1 |
Р 2 |
F 1 |
Р 1 |
Р 2 |
F 1 |
|||||
|
Ф а з а «т о р п е д а» |
||||||||||||||||
|
Л 48 х Прометей |
6,7 |
8,3 |
12,5 |
6,00 |
15 |
25 |
24 |
0,80 |
15 |
25 |
23 |
0,60 |
0 |
0 |
1 |
(+) |
|
Колобок х Прометей |
9,1 |
8,3 |
0 |
–23,00 |
29 |
25 |
0 |
–13,50 |
27 |
25 |
0 |
–26,00 |
2 |
0 |
0 |
–1,00 |
|
Л 49 х Прометей |
8,3 |
8,3 |
22,7 |
(+) |
21 |
25 |
125 |
51,0 |
21 |
25 |
113 |
45,00 |
0 |
0 |
12 |
(+) |
|
Добрыня х Прометей |
18,18 |
8,3 |
12,5 |
–0,15 |
51 |
25 |
49 |
0,85 |
49 |
25 |
49 |
1,00 |
2 |
0 |
0 |
–1,00 |
|
Колобок х Л 48 |
9,1 |
6,7 |
10,0 |
1,75 |
29 |
15 |
33 |
1,57 |
27 |
15 |
33 |
2,00 |
2 |
0 |
0 |
–1,00 |
|
Л 49 х Л 48 |
8,31 |
6,7 |
0 |
–9,00 |
21 |
15 |
0 |
–6,00 |
21 |
15 |
0 |
–6,00 |
0 |
0 |
0 |
(+) |
|
Добрыня х Л 48 |
18,18 |
6,7 |
4,2 |
–1,40 |
51 |
15 |
6 |
–1,50 |
49 |
15 |
6 |
–1,53 |
2 |
0 |
0 |
–1,00 |
|
Л 49 х Колобок |
8,31 |
9,1 |
0 |
–23,00 |
21 |
29 |
0 |
–6,25 |
21 |
27 |
0 |
–8,00 |
0 |
2 |
0 |
(–) |
|
Добрыня х Колобок |
18,18 |
9,1 |
8,3 |
–1,20 |
51 |
29 |
40 |
0 |
49 |
27 |
40 |
0,18 |
2 |
2 |
0 |
(–) |
|
Добрыня х Л 49 |
18,18 |
8,3 |
9,3 |
–0,80 |
51 |
21 |
26 |
0,67 |
49 |
21 |
24 |
–0,78 |
2 |
0 |
1,8 |
0,80 |
|
Ф а з а |
«с т и к» |
|||||||||||||||
|
Л 48 х Прометей |
30,77 |
0 |
4,3 |
–0,72 |
225 |
0 |
34 |
–0,70 |
225 |
0 |
34 |
–0,70 |
0 |
0 |
0 |
— |
|
Колобок х Прометей |
0 |
0 |
8,3 |
(+) |
0 |
0 |
11 |
(+) |
0 |
0 |
11 |
(+) |
0 |
0 |
0 |
— |
|
Л 49 х Прометей |
0 |
0 |
0 |
— |
0 |
0 |
0 |
— |
0 |
0 |
0 |
— |
0 |
0 |
0 |
— |
|
Добрыня х Прометей |
0 |
0 |
4,2 |
(+) |
0 |
0 |
8 |
(+) |
0 |
0 |
8 |
(+) |
0 |
0 |
0 |
— |
|
Колобок х Л 48 |
0 |
30,8 |
0 |
–1,00 |
0 |
225 |
0 |
–1,00 |
0 |
225 |
0 |
–1,00 |
0 |
0 |
0 |
— |
|
Л 49 х Л 48 |
0 |
30,8 |
11,1 |
–0,28 |
0 |
225 |
6 |
–0,95 |
0 |
225 |
6 |
–0,95 |
0 |
0 |
0 |
— |
|
Добрыня х Л 48 |
0 |
30,8 |
0 |
–1,00 |
0 |
225 |
0 |
–1,00 |
0 |
225 |
0 |
–1,00 |
0 |
0 |
0 |
— |
|
Л 49 х Колобок |
0 |
0 |
8,3 |
(+) |
0 |
0 |
2 |
(+) |
0 |
0 |
0 |
— |
0 |
0 |
2 |
(+) |
|
Добрыня х Колобок |
0 |
0 |
0 |
— |
0 |
0 |
0 |
— |
0 |
0 |
0 |
— |
0 |
0 |
0 |
— |
|
Добрыня х Л 49 |
0 |
0 |
0 |
— |
0 |
0 |
0 |
— |
0 |
0 |
0 |
— |
0 |
0 |
0 |
— |
П р и м е ч а н и е. Прочерк означает отсутствие проявления признака; h p — степень доминирования.
этап эмбриогенеза контролируется независимыми генетическими си-стемами. В комбинациях скрещивания Колобок х Прометей, Л 49 х Л 48, Добрыня х Л 48, Л 49 х Колобок, Добрыня х Колобок h p по абсолютной величине оказалась больше единицы, что свидетельствует как об эпистатичных генных взаимодействиях, так и о функционировании разных генетических систем, контролирующих этапы эмбриогенеза у использованных доноров.
Следует отметить еще один тип генных взаимодействий, характеризующих формирование нормальных эмбриоидов зеленой окраски у эксплантов в гибридных комбинациях Л 48 х Прометей и Л 49 х Прометей (см. табл.). Проведенный функциональный тест на аллелизм выявил появление в F 1 нормальных эмбриоидов, отсутствующих у соответствующих родительских форм, что свидетельствует о комплементарном типе взаимодействия генных систем. Помимо того, что это наиболее ценные идентифицированные генетические системы, обусловливающие в дальнейшем регенерацию растений, они являются разными у доноров Л 48, Л 49 и сорта Прометей.
Выявленные генные взаимодействия не позволили определить генетические параметры на основе полудиаллельной схемы скрещиваний из-за несоответствия экспериментальных данных предлагаемой модели: коэффициенты регрессии недостоверны. Поэтому для более детальной генетической идентификации доноров в дальнейшем необходимо провести генетический анализ с использованием гибридов F 2 , F 3 и беккроссов.
В результате генетического анализа эксплантов в фазе стик у гибридов Л 49 х Прометей, Добрыня х Колобок, Добрыня х Л 49 было выявлено полное затухание процесса образования соматических зародышей; Колобок х Прометей, Л 49 х Колобок — смена типа взаимодействия генов; Л 48 х Прометей, Добрыня х Прометей, Колобок х Л 48, Л 49 х Л 48, Добрыня х Л 48 — смена характера доминирования, что и обусловливало различную экспрессию способности к индукции соматического эмбриогенеза в онтогенезе (см. табл., рис. 1.).
Таким образом, у растений перца сладкого имеется по крайней мере два механизма генной регуляции образования соматических эмбриоидов: первый связан с действием предполагаемого гена-переключателя гетерофазной репродукции на го-мофазную и функционирует на ранних стадиях онтогенеза незрелого зиготического зародыша; второй — со сменой генных взаимодействий и характера доминирования и функционирует на поздних стадиях онтогенеза. И хотя пока неизвестны молекулярные механизмы каскадной активации и репрессии процесса соматического эмбриогенеза in vitro, выявленная специфика экспрессии и влияние генетического фона позволяют уже на этом этапе исследований целенаправленно проводить синтетическую селекцию и отбор на регенерационную способность у образцов перца сладкого.
Л И Т Е Р А Т У Р А
-
1. B i n z e l M.L., S a n k h l a N. Somatic embryogenesis — an approach for regeneration and transformation of pepper. In: Proc. of the 13th National Pepper Conference. Naples, Florida, USA, 1996: 38-39.
-
2. F a r i M. Impact of cell- and tissue culture techniques on the breeding of Capsicum . In: EUCARPIA IX-th Meeting on Genetics and Breeding of Capsicum and Eggplant. Budapest, 1995: 53-63.
-
3. V e n c z e l G., G e m e s n e J u h a s z A. Pepper breeding methods and strategies related with in vitro haploid research. In: EUCARPIA X-th Meeting on Genetics and Breeding of Capsicum and Eggplant. Avignon, 1998: 96-97.
-
4. G e m e s n e J u h a s z A., S a g i Z.S., S a l a m o n P. e.a. Experiens and results of in vitro haploid methods application in pepper breeding programme. In: EUCARPIA X-th Meeting on Genetics and Breeding of Capsicum and Eggplant. Avignon, 1998: 201-203.
-
5. M i t y k o J., C h a m b o n n e r D., A d a m G. e.a. In vitro haploidy of spice and bell peppers: It's control for large-scale application. In: EUCARPIA IX-th Meeting on Genetics and Breeding of Capsicum and Eggplant. Budapest, 1995: 64-67.
-
6. Б а т ы г и н а Т.Б., В а с и л ь е в а В.Е. Размножение растений. СПб, 2002: 10-13, 15.
-
7. Т и м и н а О.О., О р л о в П.А., Ц ы к а л ю к Р.А. Регенерационная способность представителей
рода Capsicum L. В сб.: Биотехнология на рубеже двух тысячелетий. Саранск, 2001: 144-145.
-
8. B a r a l J.B., B o s l a n d P.W. An updated synthesis of the Capsicum genus. Capsicum and eggplant newsletter, 2002, 21: 11-21.
-
9. Ж у ч е н к о А.А., А н д р ю щ е н к о В.К., К о р о л ь М.М. и др. Изменчивость и наследование хозяйственно ценных признаков у томатов. Кишинев, 1973.
-
10. Ф е д и н М.А., С и л и с Д.Я., С м и р я е в А.В. Статистические методы генетического анализа. М., 1980.
-
11. Х л е б о д а р о в а Т.М. Как клетки защищаются от стресса? Генетика, 2002, 38, 4: 437-452.
-
12. D u m a s d e V a u l e x R., C h a m b o n n e t D., P o c h a r d E. Culture in vitro d'anth e res des piment
(Capsicum annuum L.): am e lioration des taux d'obtention de plantes chez diff e rents genotypes par des traite ments a +35 0C. Agronomic, 1981, 1: 859-864.
-
13. A h m a d i a n T e s t i 11 a n o P.S., G o n z a l e z - M e l e n d i P., F a d o n В. e.a. Cell biology of the pollen developmental program and the induction of microspore embryogenesis in Capsicum annuum L. In: EUCARPIA X-th Meeting on Genetics and Breeding of Capsicum and Eggplant. Avignon, 1998: 183-186.
Приднестровский государственный университет


