Натриевые химические источники тока с катодами на основе сульфидов меди
Автор: Линник Дмитрий Сергеевич, Полищук Татьяна Брониславовна, Глазунова Валентина Александровна, Жеребцов Дмитрий Анатольевич, Винник Денис Александрович, Могила Татьяна Николаевна, Алешкина Дарья Викторовна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 4 т.11, 2019 года.
Бесплатный доступ
В работе исследованы в качестве химических источников тока ячейки, состоящие из натрия и сульфидов меди с различным составом, структурой и морфологией катодного материала. Уменьшение характерного размера частиц СuS с 0,4-5 мкм до 10-50 нм привело к увеличению начального рабочего напряжения с 1,87 В до 2,55 В и емкости с 166 мАч·г-1 до 400 мАч·г-1. Сверхстехиометрическое внедрение серы в нанодисперсный сульфид меди CuS1+х приводит к снижению начального рабочего напряжения ячейки на 0,23 В, в то время как емкость увеличивается с 400 мАч·г-1 до 431 мАч·г-1. В случае сульфида состава Cu2S емкость ячейки с натриевым анодом составляет 121 мАч·г-1, кроме того, данный материал, как и микрокристаллический сульфид меди состава CuS, склонен к поверхностной пассивации сульфидами переменного состава. В работе проведен сравнительный анализ электрохимических показателей натриевых и литиевых источников тока с различными по составу и морфологии катодными материалами на основе сульфидов меди.
Химический источник тока, натриевый анод, нанодисперсный сульфид меди
Короткий адрес: https://sciup.org/147233151
IDR: 147233151 | УДК: 541.136 | DOI: 10.14529/chem190410
Текст научной статьи Натриевые химические источники тока с катодами на основе сульфидов меди
Несмотря на быстрые темпы внедрения литиевых первичных источников тока в бытовые устройства, львиную долю рынка занимают менее эффективные солевые и щелочные цинк-металлоксидные гальванические элементы. Существенным ограничением в распространении литиевых источников тока является высокая стоимость лития и его соединений [1]. В последние годы особое внимание исследователей ориентировано на замену литиевого анода в химических источника тока натриевым. Связано это не только с низкой стоимостью натрия, но и с высокими электрохимическими показателями (ЭХП) анодов на его основе [2].
В качестве катодных материалов для натриевых источников тока перспективны такие соединения, как сера [3, 4], оксиды кобальта и никеля [5, 6], дисульфиды железа и никеля [7, 8], сульфиды железа и меди [9–12]. Сульфиды меди являются перспективными катодными материалами для натриевых источников тока ввиду высоких ЭХП: E Na/Na+ 1,41 B и 1,58 В, Q 337 и 561 мАч·г–1, Q v 1960 и 2580 мАч·см–3 для ячеек с Cu 2 S и CuS соответственно.
Большинство работ ориентировано на синтез и исследование катодных материалов для перезаряжаемых источников тока – аккумуляторов, в то время как большую часть производимых источников тока представляют собой дешевые гальванические элементы [1]. Следует также отметить, что, несмотря на одни из самых высоких ЭХП у сульфидных катодных материалов, использование последних в качестве электродных материалов аккумуляторов имеет ряд недостатков, связанных с образованием дисульфидов и элементной серы в ходе циклования [12–15]. Более того, синтез наноструктур зачастую сложен и использование данных материалов в первичных источниках тока нецелесообразно. Данная работа посвящена одностадийному синтезу наностукту-рированных сульфидов меди и их апробации в качестве катодов в первичных источниках тока с натриевым анодом.
Экспериментальная часть
Исходные вещества и методическая часть
В качестве фоновых электролитов использовали перхлораты натрия и лития квалификации «ХЧ», которые перед использованием сушили при 200 °С под вакуумом в течении суток. Бутиро- лактон очищали путем фракционной перегонки над алюмогелем при пониженном давлении, а диметоксиэтан перегоняли над металлическим натрием. Электролиты готовили путем растворения солей в смеси бутиролактон:диметоксиэтан 1:1 по объему с концентрацией перхлората натрия или лития 1 моль·л–1. Растворы хранили над молекулярными ситами CaA 5Å.
Нанопорошки сульфидов меди получали из реактивов квалификации «ХЧ» следующим образом. Cu 2 S получали обменной реакцией суспензии CuI с избытком водного раствора Na 2 S в стеклянной ампуле. Аналогичным образом получали и CuS, однако в качестве источника меди использовали свежеосажденный гидроксид меди. Сульфид с избыточным содержанием серы CuS 1+x получали, используя смесь сульфида и дисульфида натрия с мольным соотношением 5:1. Запаянные ампулы с коллоидными растворами нагревали при температуре 80 °С в течение 14 суток. Далее растворы центрифугировали, осадки трижды промывали этанолом и сушили.
Микрокристаллический сульфид меди с развитой поверхностью синтезировали путем выдержки порошка меди квалификации М1Е в парах серы ОСЧ 14-4 при температуре 470–500 °С. Очистку сульфида меди от непрореагировавшей серы осуществляли ее отгонкой под вакуумом. Полученный сульфид меди измельчали в ступе. В качестве электропроводной добавки использовали беззольный тяжелый графит KS8 с общим его содержанием в катодном материале 7 масс. %. В качестве связующего использовали гидросиэтилцеллюлозу HEC CELLOSIZE QP-4400H с содержанием 12 масс. % с добавкой полиэтиленоксида в качестве пластификатора (5 масс. % от массы связующего). Навеску 0,12 г связующего вносили в 5 мл воды и диспергировали в течение трех часов с последующим вызреванием геля в течение трех суток при 40 °С. Далее катодную смесь, состоящую из сульфида меди и токопроводящей добавки, диспергировали в желатинизированном растворе связующего в течение часа. Полученной катодной пастой покрывали алюминиевую фольгу, выступающую в роли катодного токоотвода. Ячейки собирали в корпусе стандарта CR2032. В качестве сепаратора использовали полипропиленовую пленку фирмы Celgard толщиной 25 мкм и пористостью 48 %. Диаметр электродов составлял 15 мм, толщина натриевой фольги, использованной в качестве анода, была равна 250 мкм.
Исследование морфологии нанодисперсных сульфидов меди с помощью просвечивающей электронной микроскопии проводили на JEOL JEM-200A, а микрокристаллического сульфида меди – при помощи сканирующего электронного микроскопа JEOL JSM-6490LV, с применением рентгеновского энергодисперсионного спектрометра INCA Penta FETx3. Разрядные характеристики гальванических элементов изучали на потенциостат-гальваностате P-20X фирмы Elins. Для долгосрочных исследований разрядных характеристик систем при постоянной токовой нагрузке, а также для исследования саморазряда батарей использовали аналогово-цифровой конвертер Е14-140-М фирмы L-CARD.
Обсуждение результатов
Исследование морфологии сульфидов меди, полученных при двухнедельном синтезе частиц при температуре 80 °С, показало, что их можно отнести к наноматериалам. Так, в случае Cu 2 S формируются кубические и стержнеобразные агрегаты толщиной 150–200 нм и длиной до 800 мкм, характеризующиеся слоистой структурой (СС). Толщина слоев составляет менее 10 нм, а их ширина варьирует от 50 до 200 нм (рис. 1а). По данным дифракции электронов установлено, что кубические и стержнеобразные агрегаты характеризуются кристаллической структурой дигенита, в то время как отдельные слои аморфны. Увеличение времени вызревания коллоидного раствора приводит к усилению агрегации частиц с кристаллической структурой, поэтому время синтеза не превышало 14 дней.
Схожая морфология наблюдается и в случае СuS (рис. 1б), при этом формируются частицы в форме лепестков длиной до 300 нм. При этом толщина лепестков также не превышает 10 нм. Около половины массы материала представлена более крупными по размеру частицами с меньшей удельной поверхностью, которые, по-видимому, представляют собой агрегаты лепестков, размеры которых составляют 20–50 нм. Наличие крупных частиц может быть связано с их уплотнением со временем из агрегатов лепестков. Дифракцией электронов установлено, что лепестки характеризуются кристаллической структурой ковеллина, в то время как крупные агрегаты содержат и аморфную фазу.
Сул ьфид с из б ыт о ч н ым содержанием сер ы CuS 1+x менее склонен к формированию кристалли ч еск их образов ан и й и представ ляет собой сферические частицы размером 6 0 –140 нм (рис. 1в). В св о ю очередь сф ер и ч еск и е ча стицы представляют собой агрегаты наноч асти ц р а зме р о м 10 – 14 нм . Кром е ни х п р и с у тст ву ют стержнеобразные пористые частицы диамет р о м о коло 2 0 0 нм и длиной до 2 мк м. Размер по р в ни х составляет 2 0 –50 нм, а толщина стенок пор не превышает 20 нм.
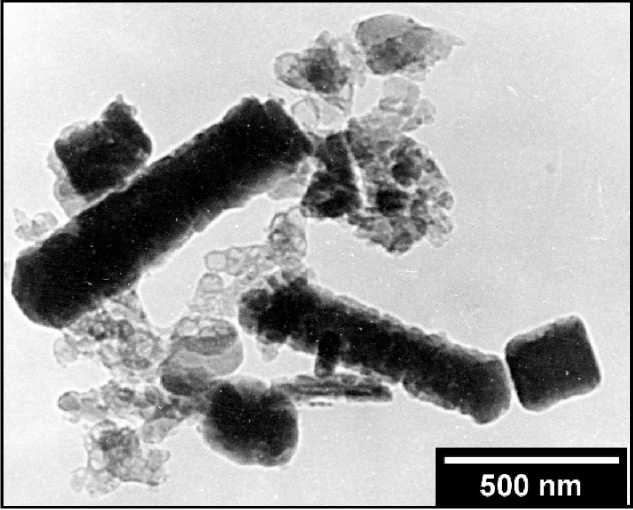
Сульфид CuS , полу ч ен н ый сжиганием порошка меди в парах серы, харак тер изуется поли- к ри с т ал ли че с кой морфо л ог и е й агрегатов игольчатых и пластинчатых кри сталлов мик ро нн ы х размеров 0,4–5 мкм (рис. 1г).
а)

б)

в)
Рис. 1. Морфология наночастиц Cu 2 S (а), CuS (б) и CuS 1+x (в), полученных в водной среде, а также сульфида меди, полученного сжиганием меди в парах серы (г)

г)
Таки м обр а зом, были с инте зированы нанодисперсные сульфиды меди с вы с о к ор а зви той п о ве р хностью и ра з личным с од ерж анием серы без применения сложных и мн о г ос тад и й ных м ет одик [16, 17]. Варьирование с о д е р жания серы позволяет контролировать емко с т ь к а т од н о г о мат е риала и н а пр я жен и е э ле ктрохи мической системы. Микрокристаллический су льфид м еди и с по л ь зов а ли как м одельн у ю с исте м у д ля сравнения ЭХП систем на основе катодов и з н а нодисперс н ы х сульфидов. Также с ра вн ен ие ЭХП проводили для систем с литиевым анодом.
Пр и нято с чи тать , что в осстановл е ни е сульфида мед и CuS в ячейках с литиевым и натриевым а н одами п ротекае т по с ледоват е л ьно в две стадии [18, 19] с соответствующим и с п ра воч ными значениями потенциалов:
2Cu S + 2Li+ + 2 ē → C u 2 S + Li 2 S
Cu 2 S + 2 Li+ + 2ē → 2C u + Li 2 S
E Li/Li+ =2,00 В; E Na/Na+ =1,58 В
E Li/Li+ =1,83 В; E Na/Na+ =1,41 В
Напряжение разряда батар еи может отклоняться в большие значения п о сравнению со спр а вочными при использовании н анодисперсных сульфидных материалов [20 ], так как увеличение удельной поверхности приводит к увеличению энергии Гиббса системы.
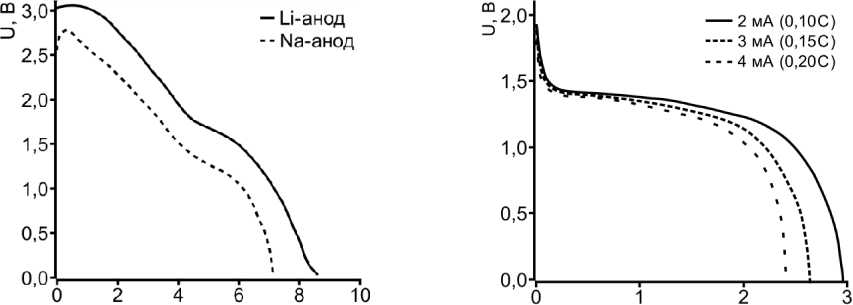
Так, в ходе разряда электр охимических ячеек с натриевым и литиевым анодом и катодом на основе нанодисперсного CuS (рис. 2а) наблюдается повышение напряжения относительно спра вочных данных примерно на 1 В. Это может быть связано не только с увеличением поверхности катодного материала, но и с на личием адсорбированной влаги и кислорода на поверхности нан о частиц. Разряд батарей проводили при плотности тока 0,1 С. Невысокая плотность нагрузки по зволила наблюдать два последовательных процесса восстановления сул ьфида меди. Наличие по логого участка снижения напр яжения в ходе разряда батарей во временном интервале 4 –6 часов говорит о конкурентных процессах восстановления CuS до Cu 2 S и металлической меди. Из пред ставленных данных также видно, что полная емкость катодного материала в ячейках с литиевым и натриевым анодами составляет 470 мАч·г–1 и 400 мАч·г–1, а емкости систем при конечном напряжении разряда в 0,9 В составляют 415 мАч·г–1 и 360 мАч·г–1 соответственно.
т, часы т, часы
а) б)
Рис. 2. Разрядные кривые электрохимических ячеек Li, Na│CuS с катодом на основе нано-CuS (а) и Na│CuS с катодом на основе микро-CuS (б)
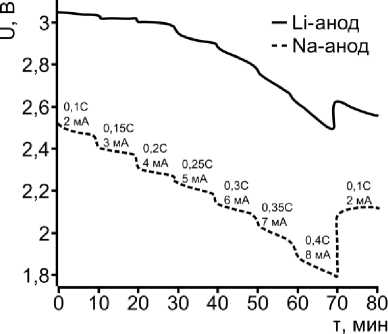
Значения емкости и напря жения разряда в системах с натриевым ано дом резко снижаются при замене нанодисперсного сульфида меди микрокристаллическим (рис. 2б). Так, при той же плотности разрядного тока пол ная емкость катодного материала составляе т лишь 166 мАч·г–1, а начальное напряжение разряда и напряжение при глубине разряда 50 % составляют 1,87 В и 1,44 В. На раз рядных кривых фактически отсутствуют потенциальные пе регибы, связанные со сменой процесса восстановлен ия катодного материала. Снижение емкости и отсутствие послед о вательных механизмов восстан овления катодов на основе микрокристаллич еского сульфида меди обу словлено поверхностной п ассивацией катодного материала сульфидом натрия и продуктами интеркалирования ионов натрия типа Na(CuS) 4 , Na 7 (Cu 6 S 5 ) 2 Na 3 (CuS) 4 , электронная и натрий- ионная проводимости которых во много раз ниже, чем у исходного матер иала. Незначительное увеличение плотности тока разряда приводит к существенному падению напряжения, что также подтверждает поверхностную пассивацию катодного материа ла и сопровождается снижением емкости до 149 мАч·г–1 и 130 мАч·г –1 при токах разряда 0,15 С и 0,20 С.
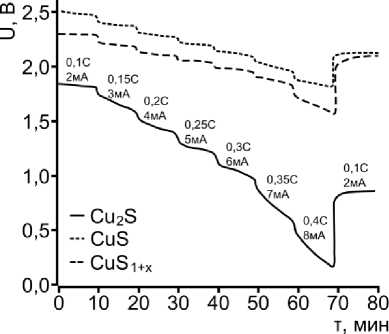
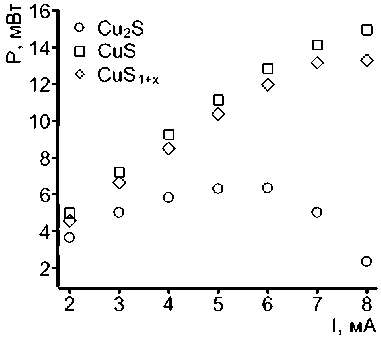
Данное явление пассиваци и не характерно для систем на основе нанод исперсных сульфидов меди CuS и CuS 1+x (рис. 3 а, б) даже при увеличении плотности разря дного тока до 0,4 С. Однако следует отметить, что напряже ние разряда снижается при использовании су льфида с избыточным содержанием серы, а емкость незначительно увеличивается. Из представл енных данных также видно, что отклонение от линейной зависимости P ( I) наблюдается только при плотностях разряда выше 0,35 С, что говорит о зна чительно большей активности катодных мате риалов по сравнению с сульфидом Cu 2 S . Более того, последний склонен к поверхностной пассива ции, что наблюдается в виде существенного падения напряжения с увеличением нагрузки. Образование сложных суль фидов переменного состава привод ит к увеличению внутреннего сопротивления ячейки, что под тверждается отклонением от линейной зависимости P(I) при нагрузках выше 0,25 С (рис. 3б).
а)
б)
Рис. 3. Разрядные характеристики натриевых систем с катодами на основе нанопорошков сульфидов меди под различными нагрузками: а – падение напряжения ячейки с увеличением токовой нагрузки;
б – изменение мощности ячейки с увеличением нагрузки
Таким образо м, дл я я ч ее к с натриевым анодом лучшими ЭХП характер и зует с я си ст ем а на осно ве на но диспер сно г о сул ь ф ида м еди CuS. Рабочее напряжение ячейки с натриевым анодом в среднем на 0,4 В н иж е по ср авне нию с л и т ие вой сист ем ой (рис. 4а). Несмотря на то, что ионы лит и я л ег ч е инт ер к алир ую т в кристаллические решетки оксидных и сул ь ф идны х м а териа ло в, в яч ейках с натриевы м анодом активность нанодисперсного су л ь ф ида м еди CuS не с ниж ает ся даж е пр и т о ках 0 ,4 С, как и в случае литиевых ячеек (рис. 4б). Связано это с тем, ч т о н е п рои с хо д и т фо рмирован ия толстого плотного пассивирующего слоя с в ыс ок и м омическим соп ротив л е н ием и з п ере ходн ых сульфидов и сульфида натрия на поверхност и н а н оча с ти ц ввиду и х р аз ви т о й по верхно сти. Таки м образом, показано, что рабочие характер ист ики натриевых яч еек л ишь не з нач и т е л ьно уступают литиевым. В частности, емкость катодно г о м атериала на-но-CuS в я ч ейке с л и т иевы м ан одо м со ст а вля ет 4 7 0 мАч·г–1, а с натриевым анодом – 400 мАч·г–1.
а)
m 25i
20-
15-
10-
о
□
о
5- □
Li-анод
Na-анод
о
□
о
О
О
□
□
о
о
D
D
О
2 3 4 5 6 7 8
I, мА
б)
Рис. 4. Разрядные характеристики систем на основе нанодисперсного сульфида меди CuS с натриевым и литиевым анодами при различных нагрузках: а – падение напряжения ячейки с увеличением токовой нагрузки; б – изменение мощности ячейки с увеличением нагрузки
В т абл ице о бо бщены р е зультаты обработки полученных данных: начал ьно е напря ж ение гал ь ванич еско й яч е йки, напр я ж ение ячейки по с л е вы р аб о т ки 5 0 % емкости, полная емкость яч ейки в р ас ч ет е на гр а м м с ул ьфида и величина степени конверсии катодно г о м ат ер иал а S. Наи вы сший по каз ат ел ь с т епени ко н вер си и S, представляющей собой отношение практической е м ко ст и кат о дно г о м а т ериал а к ее теоретическому значению, достигается в сис т ем е Na│нано-CuS.
Электрохимические показатели исследованных натриевых источников тока
|
Na│нано-Cu 2 S |
Na│нано-CuS |
Na│нано-CuS 1+х |
Na│микро-CuS |
|
|
U(100 %; 0,1C), B |
1,93 |
2,55 |
2,32 |
1,87 |
|
U(50 %; 0,1C), B |
1,49 |
1,55 |
1,58 |
1,44 |
|
C(0,1 C), мАч·г–1 |
121 |
400 |
431 |
166 |
|
S(0,1 C), % |
35,9 |
71,3 |
~70 |
29,6 |
Заключение
В работе предложены простые одностадийные способы синтеза наночастиц сульфидов меди различного состава и морфологии: Cu 2 S, CuS и CuS 1+x , которые, наряду с CuS с микронным размером частиц, были апробированы в качестве катодных материалов натриевых источников тока. В результате электрохимических исследований установлено, что наибольшее начальное напряжение достигается в натриевых системах на основе катодов из нанопорошка CuS, а емкость данного материала на 7 % ниже, чем сульфида с избыточным содержанием серы. Данные два сульфида могут рассматриваться как наиболее перспективные для практического применения.
Следует отметить, что использование нанодисперсного CuS по сравнению с системами на основе сульфида того же состава с микронным размером частиц приводит к увеличению ЭХП ячеек с натриевым анодом в первую очередь за счет снижения влияния образования пассивирующих слоев сульфидов переменного состава с высоким омическим сопротивлением.
Список литературы Натриевые химические источники тока с катодами на основе сульфидов меди
- Palomares V., Serras P., Villaluenga I., Hueso K.B., Carretero-González J., Rojo T. Na-ion Batteries, Recent Advances and Present Challenges to Become Low Cost Energy Storage Systems. Energy Environ. Sci., 2012, vol. 5, pp. 5884-5901. DOI: 10.1039/c2ee02781j
- Hwang J.Y., Myung S.T., Sun Y.K. Sun Sodium-Ion Batteries: Present and Future. Chem. Soc. Rev., 2017, vol 46, pp. 3529-3614. DOI: 10.1039/c6cs00776g
- Xu X., Zhou D., Qin X., Lin K., Kang F., Li B., Shanmukaraj D., Rojo T., Armand M., Wang G. A Room-Temperature Sodium-Sulfur Battery with High Capacity and Stable Cycling Performance Nat. Comm., 2018, vol. 9, no. 3870, pp. 1-12. DOI: 10.1038/s41467-018-06443-3
- Kumar D., Rajouria S.K., Kuhar S.B., Kanchan D.K. Progress and Prospects of Sodium-Sulfur Batteries: A Review. Solid State Ionics, 2017, vol. 312, pp. 8-16. DOI: 10.1016/j.ssi.2017.10.004
- Rami Reddy B.V., Ravikumar R., Nithya C., Gopukumar S. High Performance NaxCoO2 as a Cathode Material for Rechargeable Sodium Batteries. J. Mater. Chem. A, 2013, vol. 3, no. 35, pp. 18059-18063. DOI: 10.1039/x0xx00000x
- Zhou P., Liu X., Weng J., Wang L., Wu X., Miao, Z., Zhao J, Zhuo J., Zhuo, S. Synthesis, Structure, and Electrochemical Properties of O'3-Type Monoclinic NaNi0.8Co0.15Al0.05O2 Cathode Materials for Sodium-Ion Batteries. J. Mater. Chem. A, 2019, vol. 7, pp. 657-663.
- DOI: 10.1039/c8ta07842d
- Kitajou A., Yamaguchi J., Hara S., Okada S. Discharge/Charge Reaction Mechanism of a Pyrite-type FeS2 Cathode for Sodium Secondary Batteries. J. Power Sources, 2014, vol. 247, pp. 391-395.
- DOI: 10.1016/j.jpowsour.2013.08.123
- Zhao W., Ci S., Hu X., Chen J., Wen Z. Highly Dispersed Ultrasmall NiS2 Nanoparticles in Porous Carbon Nanofibers Anodes for Sodium Ion Batteries. Nanoscale, 2019, vol. 11, pp. 4688-4695.
- DOI: 10.1039/c9nr00160c
- Wei X., Li W., Shi J., Gu L., Yu Y. FeS@C on Carbon Cloth as Flexible Electrode for Both Lithium and Sodium Storage. ACS App. Mater. Interfaces, 2015, vol. 7, no. 50, pp. 27804-27809.
- DOI: 10.1021/acsami.5b09062
- Li H., Wang Y., Jiang J., Zhang Y., Peng Y., Zhao J. CuS Microspheres as High-Performance Anode Material for Na-ion Batteries. Electrochim. Acta, 2017, vol. 247, pp. 851-859.
- DOI: 10.1016/j.electacta.2017.07.018
- Kim N.R., Choi J., Yoon H.J., Lee M.E., Son S.U., Jin H.-J., Yun Y.S. (2017). Conversion Reaction of Copper Sulfide Based Nanohybrids for Sodium-Ion Batteries. ACS Sustainable Chem. Eng., 2017, vol. 5, no. 11, pp. 9802-9808.
- DOI: 10.1021/acssuschemeng.7b01692
- Kim J.S., Yu J.H., Ryu H.S., Kim K.W., Nam T.H., Ahn J.H., Wang G., Ahn H.J. The Electrochemical Properties of Sodium/Iron Sulfide Battery Using Iron Sulfide Powder Coated with Nickel. Rev. Adv. Mater. Sci., 2011, vol. 28, no. 1, pp. 107-110.
- Chen Y., Davoisne C., Tarascon J.-M., Guéry C. Growth of Single-Crystal Copper Sulfide Thin Films Via Electrodeposition in Ionic Liquid Media for Lithium Ion Batteries. J. Mater. Chem., 2012, vol. 22, no. 12, рр. 5295-5299.
- DOI: 10.1039/c2jm16692e
- Jache B., Mogwitz B., Klein F., Adelhelm P. Copper Sulfides for Rechargeable Lithium Batteries: Linking Cycling Stability to Electrolyte Composition. J. Power Sources, 2014, vol. 247, pp. 703-711.
- DOI: 10.1016/j.jpowsour.2013.08.136
- Kitajou A., Yamaguchi J., Hara S., Okada S. Discharge/Сharge Reaction Mechanism of a Pyrite-type FeS2 Cathode for Sodium Secondary Batteries. J. Power Sources, 2014, vol. 247, pp. 391-395.
- DOI: 10.1016/j.jpowsour.2013.08.123
- Lai C.H., Huang K.W., Cheng J.H., Lee C.Y., Hwang B.J., Chen L.J. Direct Growth of High-Rate Capability and High Capacity Copper Sulfide Nanowire Array Cathodes for Lithium-Ion Batteries. J. Mater. Chem., 2010, vol. 20, no. 32, pp. 6638-6645.
- DOI: 10.1039/c0jm00434k
- Zhao L., Tao F., Quan Z., Zhou X., Yuan Y., Hu J. Bubble Template Synthesis of Copper Sulfide Hollow Spheres and Their Applications in Lithium Ion Battery. Mater. Lett., 2012, vol. 68, pp. 28-31.
- DOI: 10.1016/j.matlet.2011.09.108
- Sun K., Su D., Zhang Q., Bock D.C., Tong X., Su D., Marschilok A.C., Takeuchi K.J., Takeuchi E.S., Gan H. Interaction of CuS and Sulfur in Li-S Battery System. J. Electrochem. Soc., 2015, vol. 162, no. 14, pp. A2834-A2839.
- DOI: 10.1149/2.1631706jes
- Park J.Y., Kim S.J., Yim K., Dae K.S., Lee Y., Dao K. P., Park J.S., Jeong H.B., Chang J.H., Seo H.K., Ahn C.W., Yuk J.M. Pulverization Tolerance and Capacity Recovery of Copper Sulfide for High Performance Sodium Storage. Adv. Sci., 2019, vol. 1900264, pp. 1-9.
- DOI: 10.1002/advs.201900264
- Zhang D., Tu J.P., Xiang J.Y., Qiao Y.Q., Xia X.H., Wang X.L., Gu C.D. Influence of Particle Size on Electrochemical Performances of Pyrite FeS2 for Li-Ion Batteries. Electrochim. Acta, 2011, vol. 56, no. 27, pp. 9980-9985.
- DOI: 10.1016/j.electacta.2011.08.119


