Наука о когнитивном мозге: глимфатическая (лимфатическая) система, циркадианный стресс и хронические инсомнии
Автор: Романчук Наталья Петровна, Волобуев Андрей Николаевич, Краснов Сергей Викторович
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 4 т.9, 2023 года.
Бесплатный доступ
Сон эволюционно сохраняется у всех видов, а нарушение сна является общим патогенезом нейродегенерации, циркадианного стресса и электромагнитной нагрузки/перегрузки. Качество сна у человека снижается с возрастом, а нарушение нормальной архитектуры сна часто предшествует возникновению нейродегенеративных заболеваний . Лимфатическая система, которая очищает мозг от белковых отходов, в основном активна во время сна. Хронический стресс ремоделирует и реструктурирует лимфатическую сосудистую сеть. Основополагающее исследования были сосредоточены на открытии глимфатической системы, сети мозга, которая очищает метаболиты и отходы жизнедеятельности через спинномозговую жидкость, пока мы спим. Глимфатическая система из-за ее зависимости от глиальных клеток - не нейрональных клеток в центральной нервной системе (ЦНС), которые не производят электрические импульсы, но поддерживают и защищают нейроны. Настоящая и функциональная лимфатическая сосудистая система находится в мозговых оболочках, которые покрывают ЦНС. Это неожиданное (повторное) открытие привело к переоценке механизмов дренажа жидкости и растворенных веществ в ЦНС, нейроиммунных взаимодействий и участия менингеальных лимфатических узлов в возникновении и прогрессировании неврологических расстройств. Различные факторы, влияющие на менингеальную лимфатическую функцию, такие как передача сигналов факторов роста и старения, и их влияние на непрерывный отток молекул, полученных из мозга, и менингеальных иммунных клеток в шейные лимфатические узлы. Открытие роли лимфатической сосудистой сети, дренирующей ЦНС, при различных патологиях, которые имеют сильный нейровоспалительный компонент, включая травмы головного мозга, опухоли и связанные со старением нейродегенеративные заболевания, такие как болезни Альцгеймера и Паркинсона. Нейросети, которые связывают сон, старение, клиренс лимфатической системы и агрегацию белков, пролили новый свет на патогенез широкого спектра нейродегенеративных заболеваний, для которых недостаточность лимфатической системы может представлять собой терапевтически целевой конечный общий путь.
Биофизика лимфообращения, лимфатическая сосудистая сеть, глимфатическая система, когнитивный мозг, нейровизуализация, нейрореабилитация, нейроэндокринология, новая ядерная медицина, когнитивное снижение, циркадианный стресс, хронические инсомнии
Короткий адрес: https://sciup.org/14127926
IDR: 14127926 | УДК: 616.83/.85:616.89 | DOI: 10.33619/2414-2948/89/24
Текст обзорной статьи Наука о когнитивном мозге: глимфатическая (лимфатическая) система, циркадианный стресс и хронические инсомнии
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.83/.85:616.89
Целью настоящей работы, является развитие науки об когнитивном мозге, исследование роли новой глимфатической системы, влияние хронического циркадианного стресса на процессы ремоделирования и реструктурирование лимфатической сосудистой сети, на нейровоспалительный компонент, взаимосвязь нарушения сна с возникновением нейродегенеративных заболеваний, внедрение технологий нейрореабилитации когнитивного мозга при когнитивном снижении.
Наука об когнитивном мозге (Cognitive brain science) — это новая, современная, молодая мультидисциплинарная и мультипарадигмальная научная платформа, включающая нейробиологию, нейрофизиологию, нейроэндокринологию, нейроиммунологию и др., через призму фундаментально-прикладных алгоритмов / инструментов / технологий на патогенез, диагностику, лечения и профилактику нейродегенеративных заболеваний.
Сформирована новая авторская мультидисциплинарная и мультипарадигмальная платформа, через призму фундаментально-прикладных алгоритмов / инструментов / технологий на патогенез, диагностику, лечения и профилактику данной нейродегенерации
(болезни Альцгеймера), которая позволяет стратегически моделировать и прогнозировать время (возраст) наступления когнитивного снижения [1].
Когнитивный мозг человека — это биологические, биофизические, нейрофизиологические и медико-социальные парадигмы обмена информацией. Достижением исследований Романчук Н. П. является установление многих генетических и эпигенетических факторов когнитивного снижения и нейродегенеративных заболеваний (Романчук Н. П., Когнитивный мозг. Избранные труды, 2023). Внедрение авторских разработок за последние 15 лет позволили сформировать систему алгоритмов и инструментов управления нейропластичностью. Модифицированные комбинированные методы ЭЭГ/ПЭТ и ПЭТ/фМРТ и гибридные технологии ПЭТ/КТ/МРТ — это, сочетающаяся функциональная и структурная нейровизуализация. Современные коммуникации — это, многоуровневые, мультипарадигмальные и междисциплинарные модели обмена информацией. Нейрогенетика является центром мультидисциплинарных и межведомственных исследований, использующих передовые методы, с участием 5П медицины и 5G технологий [1].
Рассматриваемая сложная более чем 115-летняя проблемная парадигма болезни Альцгеймера является авторским мультидисциплинарным ответом через призму фундаментально-прикладных алгоритмов/инструментов/технологий на патогенез, диагностику, лечения и профилактику данной нейродегенерации [2].
В исследованиях Н. П. Романчук показано, что для нового нейрогенеза и нейропластичности, для управления нейропластичностью и биологическим возрастом человека, для современной нейрофизиологии и нейрореабилитации когнитивных нарушений и когнитивных расстройств необходимо достаточное функциональное и энергетическое питание мозга с использованием современных нейротехнологий ядерной медицины. Функциональный продукт питания с помощью биомаркеров и технологий искусственного интеллекта является целевой питательной средой как для головного мозга, так и для организма в целом и биомикробиоты в частности [2].
Современные технологии искусственного интеллекта способны на многое, в том числе и прогнозировать когнитивные нарушения и когнитивные расстройства, с помощью комбинированной и гибридной нейровизуализации, секвенирования нового поколения и др., с целью начала своевременной и эффективной реабилитации мозга человека [2].
Мозг человека — это следующий рубеж для здравоохранения. Слияние комбинированных и гибридных методов нейровизуализации с технологиями искусственного интеллекта, позволяет понять и диагностировать неврологические расстройства и найти новые методы реабилитации и медико-социального сопровождения, которые приведут к улучшению психического здоровья [2]. Тяжесть когнитивных нарушений во многом зависит от времени начала ранней профилактики, тяжести депрессивного расстройства, возраста больного, нейроэндокринной, церебральной и цереброваскулярной патологии [2].
В исследовании [2], даны ответы на семь главных парадигмальных вопросов рассматриваемой нейродегенерации (болезни Альцгеймера):
-
1) Возраст наступления когнитивного снижения при болезни Альцгеймера, начинается в 30 лет, а после 45 лет резко отличается у мужчин и женщин, и в первую очередь связан гормональной вариабельностью. Заместительная гормональная терапия может помочь предотвратить болезнь Альцгеймера у миллионов женщин, подверженных риску развития этого заболевания.
-
2) Раннюю и ультрараннюю профилактику когнитивного снижения при болезни Альцгеймера, целесообразно структурировать с коморбидными и полиморбидными заболеваниями сопровождающиеся когнитивным снижением.
-
3) Раннее начало диспансерной вариабельности мужских и женских половых гормонов при здоровом старении организма человека, будет способствовать сохранению когнитивного мозга.
-
4) Новая роль персонизированной генетики и эпигенетики болезни Альцгеймера, состоит в синхронизации диагностических и лечебно-профилактических подходов.
-
5) Кратность диспансерных алгоритмов / инструментов / технологий нейровизуализации и нейропсихологического тестирования, зависит от комплексного участия 5П медицины и 5G технологий.
-
6) Классическое применение принципов ведения ЗОЖ, физической активности, лечебной физкультуры, диетического и лечебного питания, функционального и сбалансированного питания, нутрициологии и биоэлементологии мозга человека, неразрывно связано с пп.1–5.
-
7) Ранняя профилактика электромагнитной нагрузки и перегрузки, искусственного интеллекта, виртуальной и дополненной реальности — при прогрессировании индивидуального когнитивного снижения, является стратегическим выбором человека будущего активного и здорового долголетия.
Эмоции, если их не регулировать, приводят к аллостатической нагрузке / перегрузке, в конечном счете, к биологическому старению и ранним заболеваниям. Когнитивный мозг человека интегрирует и синхронизирует нейробиологические, нейрофизиологические и нейроэндокринологические эмоции, способствующие состраданию и межсубъективности, которые помогут уменьшить стресс и повысить сострадательное посредничество для разрешения конфликтов. Зависимость эмоциональных состояний от контекста также имеет решающее значение для исследований аффективной неврологии, в которых мы хотим экспериментально манипулировать эмоциональными состояниями. Эмоции — это, функциональные состояния, реализуемые в деятельности нейронных систем, которые регулируют сложное поведение [3].
Стратегическим является создание интегративной рабочей модели эмоций и стресса, в которой указаны временные рамки для измерения стресса — острого, событийного, ежедневного и хронического — и более точный язык для измерения стресса. Эмоции, если их не регулировать, приводят к аллостатической нагрузке / перегрузке и, в конечном счете, к биологическому старению и ранним заболеваниям [3].
Когнитивный мозг человека — это биологические, биофизические, нейрофизиологические и медико-социальные парадигмы обмена информацией. В 15-летних исследованиях Н. П. Романчук показано, что для нового нейрогенеза и нейропластичности, для управления нейропластичностью и биологическим возрастом человека, для современной нейрофизиологии и нейрореабилитации когнитивных нарушений и когнитивных расстройств необходимо достаточное функциональное и энергетическое питание мозга с использованием современных нейротехнологий ядерной медицины. Современные технологии искусственного интеллекта способны на многое, в том числе и прогнозировать когнитивные нарушения и когнитивные расстройства, с помощью комбинированной и гибридной нейровизуализации, секвенирования нового поколения и др., с целью начала своевременной и эффективной реабилитации мозга человека .
Социальные чувства имеют концептуальные и эмпирические связи с аффектом и эмоциями. Современная проблема аффективной неврологии — это детализировать причинно-следственные взаимодействия между эмоциональными состояниями, переживаниями эмоций и концепциями эмоций: у здоровых взрослых людей все три обычно происходят вместе. Эмоциональные состояния, наряду со многими другими признаками психического состояния, обеспечивают причинно-следственные объяснения поведения. Эмоции являются «целенаправленными», потому что они направлены на подготовку организма к реагированию на ситуации, которые неоднократно возникали на протяжении эволюции [3].
На концептуальных стадиях развития эмоции становятся более дифференцированными и разнообразными, поскольку когнитивный мозг человека (индивида / персоны / личности) откладывает воспоминания об эмоциональных событиях, часто вызванных социальными взаимодействиями, оценивает ситуации и развивает механизмы преодоления, включая ожидание, соответствующие уровни возбуждения и когнитивный контроль эмоционального поведения [3].
Исследована новая роль кортизола, эстрогена, тестостерона и окситоцина — в возрастных нейрокоммуникациях головного мозга — для работы нейроэкономического разума — способного к формированию и строительству предпочтений, решений в условиях риска и неопределенности, межвременного выбора, стратегических решений, требующих прогнозирования поведения других и роли доверия и сотрудничества в таких решениях.
Мозг человека работая в режиме гениальности (таланта, креативности) требует создания и поддержание современных нейрокоммуникаций между новой корой и гиппокампом (библиотекой памяти, винчестером памяти), формированием новых структурно-функциональных нейрокоммуникаций в мозге человека которые происходят непрерывно на протяжении всей жизнедеятельности от рождения до сверхдолголетия, и имеют творческие преимущества в эпоху современного нейробыта и нейромаркетинга. В исследовании [3], сделаны следующие выводы:
Интегративная рабочая модель эмоций и стресса, в которой указаны временные рамки для измерения стресса — острого, событийного, ежедневного и хронического — позволяет формировать более точный язык для измерения стресса.
Эмоции, если их не регулировать, приводят к аллостатической нагрузке / перегрузке и, в конечном счете, к биологическому старению и ранним заболеваниям.
Новая авторская мультидисциплинарная и мультипарадигмальная платформа, и современные фундаментально-прикладные алгоритмы / инструменты / технологии на патогенез, диагностику, лечения и профилактику данной нейродегенерации болезни Альцгеймера — позволяет стратегически моделировать и прогнозировать время (возраст) наступления когнитивного снижения при болезни Альцгеймера.
Мозг человека, работая в режиме гениальности (таланта, креативности) требует создания и поддержание современных нейрокоммуникаций между новой корой и гиппокампом (библиотекой памяти, винчестером памяти), формированием новых структурно-функциональных нейрокоммуникаций в мозге человека которые происходят непрерывно на протяжении всей жизнедеятельности от рождения до сверхдолголетия, и имеют творческие преимущества в эпоху современного нейробыта и нейромаркетинга.
Эмоциональные состояния, наряду со многими другими признаками психического состояния, обеспечивают причинно-следственные объяснения поведения. Эмоции являются «целенаправленными», потому что они направлены на подготовку организма к реагированию на ситуации, которые неоднократно возникали на протяжении эволюции. На концептуальных стадиях развития эмоции становятся более дифференцированными и разнообразными, поскольку когнитивный мозг человека (индивида / персоны / личности)
откладывает воспоминания об эмоциональных событиях, часто вызванных социальными взаимодействиями, оценивает ситуации и развивает механизмы преодоления, включая ожидание, соответствующие уровни возбуждения и когнитивный контроль эмоционального поведения. Когнитивный мозг человека интегрирует и синхронизирует нейробиологические, нейрофизиологические и нейроэндокринологические эмоции, способствующие состраданию и межсубъективности, которые помогут уменьшить стресс и повысить сострадательное посредничество для разрешения конфликтов.
Функционально-сбалансированные пищевые эмоции (хлеб и эмоции) — это комбинированное лечение с применением функциональных продуктов питания (персонифицированных по содержанию макро- и микроэлементов, витаминов и клетчатки) и лекарственных препаратов (с положительным влиянием на биомикробиоту) — способных к нормализации патологически измененных биологических ритмов — перспективное направление нейронутрициологии XXI века.
Ультрараннее и ранняя профилактика когнитивного снижения
Нормальный процесс старения приводит к незначительным изменениям в когнитивных способностях. Запоминание новой информации и запоминание имен и цифр может занять больше времени. Автобиографическая память о событиях жизни и накопленные знания об изученных фактах и информации — оба типа декларативной памяти — с возрастом ослабевают, в то время как процедурные воспоминания, такие как запоминание того, как ездить на велосипеде или завязывать шнурки, остаются в основном нетронутыми.
Рабочая память — способность удерживать в уме фрагмент информации, такой как номер телефона, пароль или местоположение припаркованного автомобиля, — также ухудшается с возрастом.
Когнитивное снижение: многочисленные исследования предполагают, что медленное когнитивное снижение начинается уже в возрасте 30 лет. Рабочая память зависит от быстрой обработки новой информации, а не от накопленных знаний. Другие аспекты такого рода подвижного интеллекта, такие как скорость обработки информации и решения проблем, также снижаются с возрастом. Некоторые аспекты внимания могут усложняться по мере старения нашего мозга. Возможно, нам будет труднее сосредоточиться на том, что говорят наши друзья, когда мы находимся в шумном ресторане. Наша способность отключаться от отвлекающих факторов и сосредотачиваться на определенном стимуле называется избирательным вниманием. Разделение нашего внимания между двумя задачами — например, ведение разговора во время вождения — также становится более сложным с возрастом. Этот тип внимания называется разделенным вниманием.
Но не все так плохо после 30 лет. Фактически, некоторые когнитивные способности улучшаются в среднем возрасте: лонгитюдное исследование в Сиэтле, в котором отслеживались когнитивные способности тысяч взрослых за последние 50 лет, показало, что люди на самом деле лучше справлялись с тестами вербальных способностей, пространственного мышления, математики и абстрактного мышления в среднем возрасте, чем в молодости взрослые.
Вопреки пословице о том, что вы не можете научить старую собаку новым трюкам, появляется все больше свидетельств того, что мы можем учиться и учимся на протяжении всей нашей жизни. Нейробиологи выясняют, что с возрастом наш мозг остается относительно «пластичным», что означает, что он способен перенаправлять нейронные связи, чтобы адаптироваться к новым вызовам и задачам.
Структурные изменения мозга: возрастные изменения в когнитивных способностях отражают изменения в структуре и химическом составе мозга. Когда мы вступаем в средний возраст, наш мозг меняется незаметным, но измеримым образом. Общий объем мозга начинает уменьшаться, когда нам за 30–40, причем скорость сокращения увеличивается примерно к 60 годам. Но потеря объема неравномерна по всему мозгу — некоторые области сокращаются сильнее и быстрее, чем другие. Наибольшие потери наблюдаются в префронтальной коре, мозжечке и гиппокампе, которые усугубляются в пожилом возрасте. Наша кора головного мозга, «морщинистый» внешний слой мозга, содержащий тела нейронов, также истончается с возрастом. Истончение коры происходит по схеме, сходной с потерей объема, и особенно выражено в лобных долях и частях височных долей. Области мозга, которые с возрастом претерпевают наиболее драматические изменения, также одними из последних созревают в подростковом возрасте. Теория старения мозга по принципу «входишь последним, выходишь первым» — те части мозга, которые развиваются последними, разрушаются первыми.
Исследования возрастных изменений белого вещества подтверждают эту гипотезу. Первыми из дальнодействующих волокон мозга, которые развиваются, являются проекционные волокна, соединяющие кору с нижними отделами головного и спинного мозга. Волокна, соединяющие диффузные области в пределах одного полушария, называемые ассоциативными волокнами, достигают зрелости последними и демонстрируют наиболее резкое функциональное снижение с возрастом.
Когнитивное здоровье и долголетие становится одной из величайших проблем и достижений качественной жизни человека в XXI веке. Достижением исследований Н. П. Романчук является установление многих генетических и эпигенетических факторов когнитивного снижения и нейродегенеративных заболеваний. Новая регуляция фундаментальных механизмов когнитивного здоровья и долголетия способствует ранней диагностике, лечению и профилактике когнитивного дефицита и когнитивных расстройств. Система природа-общество-человек: целостная, динамическая, волновая, открытая, устойчиво неравновесная система, с выделением не только внутренних связей, но и внешних — с космической средой. Внедрение авторских разработок за последние 15 лет позволили сформировать систему алгоритмов и инструментов управления нейропластичностью.
В исследованиях Н. П. Романчук показано, что для нового нейрогенеза и нейропластичности, для управления нейропластичностью и биологическим возрастом человека, для современной нейрофизиологии и нейрореабилитации когнитивных нарушений и когнитивных расстройств необходимо достаточное функциональное и энергетическое питание мозга с использованием современных нейротехнологий ядерной медицины [4].
В исследовании [4], установлено:
-
1. Глобальный доступ к медицинской визуализации и ядерной медицине, позволил разработке и внедрению радиопротекторной фармацевтике и диетологии.
-
2. Одной из областей интереса является то, что радиопротекторные агенты часто являются фитонутриентами, которые содержатся в хорошо сбалансированной диете, особенно в растительной диете [4]. Это наблюдение предполагает, что только модификация диеты может обеспечить радиопротекторные эффекты.
-
3. Учитывая насущную потребность в эффективных и безопасных лекарственных ресурсах и широкий спектр обстоятельств, в которых требуются радиопротекторы, будущие усилия по разработке природных радиопротекторов остаются чрезвычайно важными.
-
4. Современные принципы рационального проектирования наноматериалов, оптимизируют терапевтическую эффективность, поэтому систематическое обобщение достижений в этой области, позволяет разрабатывать новые высокоэффективные нанорадиопротекторы с максимизацией лекарственной эффективности.
-
5. В исследованиях Романчук Н. П. показано, что для нового нейрогенеза и нейропластичности, для управления нейропластичностью и биологическим возрастом человека, для современной нейрофизиологии и нейрореабилитации когнитивных нарушений и когнитивных расстройств необходимо достаточное функциональное и энергетическое питание мозга с использованием современных новых нейротехнологий ядерной медицины.
Идеальный радиопротектор должен быть легкодоступным, доступным по цене и не приводить к серьезной токсичности в широком диапазоне доз. Он также должен демонстрировать отсутствие кумулятивных эффектов от повторных обработок, быть способным к пероральному введению, оказывать защитное действие на широко распространенные системы органов и демонстрировать эффективность для различных типов излучения (X, гамма, электронное и нейтронное). Наконец, он должен обладать разумным фактором снижения дозы и способностью действовать через несколько механизмов. В настоящее время разрабатывается большое количество фармакологических средств для предотвращения, смягчения или лечения IR-индуцированной токсичности. Несмотря на то, что использование радиопротекторов является очень перспективным подходом как для случайного, так и для терапевтического воздействия, никакие доступные радиопротекторы не способны полностью предотвратить токсичность, связанную с IR. Поэтому использование природных соединений может быть хорошей стратегией в разработке идеальных радиопротекторов [4].
Современные технологии и инструменты реабилитации больных с когнитивными нарушениями и когнитивными расстройствами имеют множество потенциальных применений для лечения болезни Альцгеймера: оказания медикаментозной и немедикаментозной медицинской помощи, медико-социального и экономического сопровождения — от здорового старения, до ускоренного и патологического старения Homo sapiens [5].
Нейрофизиология и нейрореабилитация когнитивных нарушений и когнитивных расстройств, предусматривает следующие диагностические, лечебные и профилактические направления [5]:
-
– Генетика (геномные исследования, секвенирование РНК и ДНК нового поколения).
-
– Эпигенетика (эпигеном и старение, фенотипические исследования и др.).
-
– Нейропсихологическое тестирование (MOCA, MMSE, Mini-Cog, FAB, TMT, GDS и др.).
-
– Комбинированная и гибридная нейровизуализация, секвенирование нового поколения.
-
– Метаболомика, метагеномика, микробиота.
-
– Сбалансированное, функциональное и безопасное питание.
-
– Искусственный интеллект, искусственные нейронные сети.
-
– Биочипирование, нейронные и мозговые чипы.
-
– Комбинированная и гибридная нейрореабилитация.
-
– Персонифицированное управление возрастом.
-
– Медико-социальное и экономическое сопровождение при болезни Альцгеймера с помощью бытовых роботов и медицинских биороботов.
Системное нейрокогнитивное и нейроэкономическое принятие решений становится одной из величайших проблем качественной жизни человека в XXI веке. Исследован процесс принятия решений человеком на нейрокогнитивном, нейросоциальном и нейроэкономическом уровнях [6]. Методы управления нейропластичностью позволяют провести своевременную профилактику факторов, снижающих нейропластичность, сохранить факторы положительного влияния на нейропластичность, а главное — своевременно применить в практическом здравоохранении комбинированные методы сохранения и развития нейропластичности головного мозга человека. Современная наука рассматривает человека, человечество и биосферу как единую систему, с растущими демографическими, продовольственными и медицинскими проблемами. Главный двигатель долголетия человека — это, когда микробиологическая память микробиоты остается стабильной, а рацион функционального (здорового) диетического питания и структура здоровой биомикробиоты — функционируют почти неизменными. Здоровая биомикробиота обеспечивает стабильность функционирования и своевременного перепрограммирования в гипоталамо-гипофизарно-надпочечниковой оси, в работе двунаправленных кишечномозговых связей когнитивного и висцерального мозга. Установлена роль кортизола, эстрогена, тестостерона и окситоцина — в возрастных изменениях функций головного мозга, и в процессе когнитивного и социально-эмоционального старения [6].
Мозг человека — это биологические, биофизические, нейрофизиологические и медикосоциальные парадигмы обмена информацией. Современные коммуникации — это многоуровневые, мультипарадигмальные и междисциплинарные модели обмена информацией. Внедрение авторских разработок в последнее пятнадцатилетие позволило сформировать систему алгоритмов и инструментов управления нейропластичностью. Новые компетенции психонейроиммуноэндокринология и психонейроиммунология играют стратегическую роль в междисциплинарной науке и межведомственном планировании и принятии решений. Квалифицированный разум — создает и совершенствует когнитивный потенциал мозга. «Нейроинтерфейсный камень» самооценки человека для самоактуализации и самореализации личности — это, самооткрытие, саморазвитие, самообладание, самореализация.
Мозг человека работая в режиме гениальности (таланта, креативности) требует создания и поддержание современных нейрокоммуникаций между новой корой и гиппокампом (библиотекой памяти, винчестером памяти), формированием новых структурно-функциональных нейрокоммуникаций в мозге человека, которые происходят непрерывно на протяжении всей жизнедеятельности от рождения до сверхдолголетия, и имеют творческие преимущества в эпоху современного нейробыта и нейромаркетинга [6].
Стресс может влиять на здоровье на протяжении всей жизни, однако нет единого мнения о том, какие виды и аспекты стресса имеют наибольшее значение для здоровья и болезней человека. Отчасти это связано с тем, что «стресс» — это не монолитное понятие, а скорее возникающий процесс, который включает взаимодействие между индивидуальными факторами и факторами окружающей среды, историческими и текущими событиями, аллостатическими состояниями и психологической и физиологической реактивностью. Многие из этих процессов сами по себе были установлены как «стресс». Наука о стрессе получила бы дальнейшее развитие, если бы исследователи приняли общую концептуальную модель, которая включает эпидемиологические, аффективные и психофизиологические перспективы, с более точным языком для описания мер стресса [1–7].
Факторы стресса возникают в контексте жизни человека, представленные контекстуальными факторами в синем треугольнике [6]. Эти контекстуальные факторы включают индивидуальные характеристики, такие как личностные и демографические факторы, окружающая среда, в которой человек живет, текущее и прошлое воздействие стрессоров и защитные факторы; все это в совокупности определяет базовое аллостатическое состояние физиологической регуляции и нейросетевую парадигму и призму, через которую стрессоры воспринимаются и получают значение. Контекстуальные факторы и привычные процессы вместе влияют на психологические и физиологические реакции на острые и повседневные стрессоры. Исследовано, что эти реакции, если их не регулировать, приводят к аллостатической нагрузке и, в конечном счете, к биологическому старению и ранним заболеваниям. Мы формулируем интегративную рабочую модель, подчеркивающую, как воздействие стрессоров на протяжении всей жизни влияет на привычное реагирование и стрессовую реактивность, а также на то, как поведение в отношении здоровья взаимодействует со стрессом. Мы предлагаем типологию стресса, в которой указаны временные рамки для измерения стресса — острого, событийного, ежедневного и хронического – и более точный язык для измерения стресса [1–7].
Несмотря на широко распространенное мнение о том, что стресс важен при изучении здоровья и старения, существуют критические барьеры, препятствующие научному прогрессу. Одним из основных препятствий, на котором мы здесь остановимся, является отсутствие последовательности и тщательности в измерении стресса. Измерение стресса по своей сути является сложным, поскольку стресс проявляется на нескольких уровнях — социальном, психологическом и физиологическом. Таким образом, существует мало согласованных мер «золотого стандарта». Во всех исследованиях измерения противоречивы и часто поверхностны, а разнородные конструкции смешиваются. Чтобы улучшить измерение стресса, нам необходимо лучше сформулировать наши подходы к измерению, используя общий язык стресса, а также более сложные и точные модели стресса, которые учитывают многоуровневый характер стресса. Мультипарадигмальная таксономия стресса как шаг к обеспечению общего языка для измерения, включая измерения воздействия, реакции и временные рамки. Мы также представляем междисциплинарную модель стресса, которая объединяет знания как эпидемиологического, так и экспериментального подходов [1–7].
Биофизика кровообращения при болезни Альцгеймера характеризуется нарушениям ламинарного тока крови и церебральной гипоперфузией. Как результат, страдает внутриклеточный метаболизм, возникает целый каскад изменений в нейронах, связанный с процессами эксайтотоксичности и оксидантного стресса, что, в свою очередь, стимулирует амилоидогенез. Экспериментально и 25-летними наблюдениями было показано, что длительно существующее состояние гипоперфузии приводит к гиппокампальным нарушениям. Этот процесс сопровождается нарушениями памяти, структурным изменением капилляров в области гиппокампа, нарушением обмена глюкозы и белков, отложением β-амилоида, активацией глиальной ткани, гибелью нейронов гиппокампа [7].
Биоэлектромагнитические характеристики светового воздействия на зрительный анализатор, являются самыми сильными синхронизирующим сигналами для циркадианной системы и оптимальной работы мозга человека. Оптимизация нейробиологических и хрономедицинских процессов, возможна при циркадианной выработке мелатонина и обеспечении его длительной концентрации в организме человека [1, 3, 5, 6].
Циркадные часы управляют функциями иммунной системы как в установившемся режиме, так и в ответ на инфекционные угрозы. Зависимые от времени суток переменные обнаруживаются в физиологии иммунных клеток, взаимодействии хозяина и паразита, воспалительных процессах или адаптивных иммунных реакциях. Иммунные клетки не являются исключением, поскольку они также представляют собой функциональные часы, диктующие транскрипционные ритмы. Молекулярные часы и регуляторы хроматина, контролирующие ритмичность, представляют собой уникальный каркас, опосредующий перекрестные помехи между циркадной и иммунной системами.
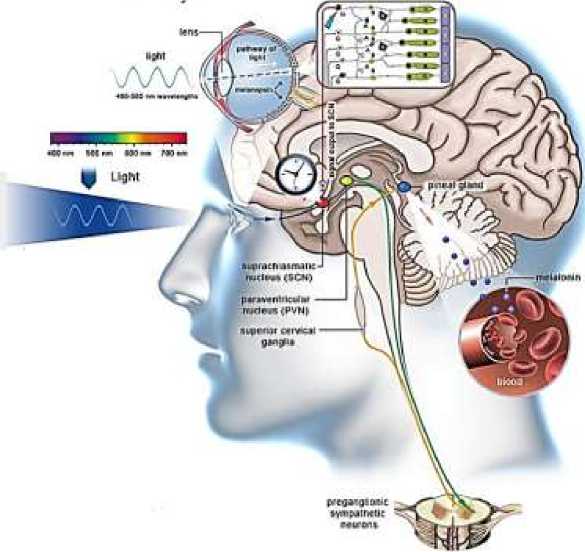
Рисунок 1. Циркадианная система человека [1]
В исследовании [8] установлены основные современные инструменты и методики эпигенетической защиты здорового старения и долголетия человека разумного. Центральное место в интегративной модели стресса занимает проблема, требующая от человека принятия решения. Понятие такой проблемы определяют как проявление, воздействие на человека стимулов или условий, требующих от него превышения либо ограничения обычного уровня деятельности. Возникновение проблемы (трудностей с ее решением) сопровождается напряжением функций организма, — если проблема не решается, напряжение сохраняется или даже нарастает — развивается стресс. Критическая потеря гармоничного временного порядка на разных организационных уровнях может повлиять на фундаментальные свойства нейроэндокринной, иммунной и вегетативной систем, приводя к нарушению биоуправляемых адаптационных механизмов с повышенной стрессоустойчивостью и уязвимостью. Циркадианная дисрегуляция после воздействия травматического стресса может представлять собой основную особенность связанных с травмой нарушений, опосредующих устойчивые нейробиологические корреляты травмы через дезадаптивную регуляцию стресса. Понимание механизмов, подверженных циркадианной дисрегуляции, и их роли в развитии связанных со стрессом расстройств могло бы обеспечить новое понимание механизмов заболевания, расширение возможностей психохронобиологического лечения и профилактических стратегий в подверженных стрессу группах населения исследовании [9].
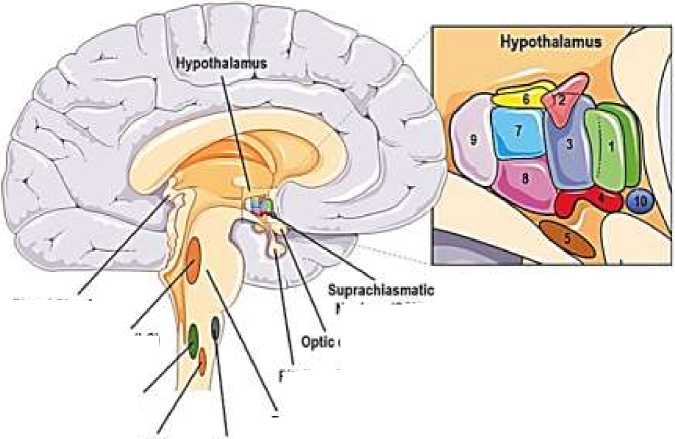
Нейроанатомические локусы взаимодействуют друг с другом, влияя на свою собственную активность, и взаимодействуют с несколькими другими подсистемами мозга, такими как мезокортикальная / мезолимбическая дофаминергическая система (Рисунок 2).
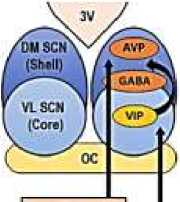
Центральная и периферическая циркадианные системы представляет собой обширную сеть темпоральных механизмов, которые создают и поддерживают клеточную и системную ритмичность посредством временной организации и координации многих физиологических и транскрипционных колебательных процессов на нескольких структурных уровнях организма (Рисунок 3).
Pineal Gland
Nucleus (SON)
Pituitary Gland
Brain stem
Nel. Tracks Solitarius(NTS]
Dorsal motor Nd Ventrolateral of the vagus (DMNX) medulla (VLM)
1. Preoptlc Nel.
Z Para ventricular Nel. |PVN>
3. Anterior hypothalamic area
4. Supraoptic Nel.
5. Arcuate Nel.
6. Dorsal hypothalamic area
7. Dorsomedial Nel. (DMH>
8. Ventromedial Nel.
9. Posterior hypothalamic area
10. SuprachlasmatlcNcl. (SCN)
Рисунок 2. Анатомия стресса и связанных с циркадной системой структур головного мозга [9]
Locus coeruleus (LC)
Suprachlasmatic Nucleus (SCN)
Hypothalamus Brainstem
Photic Input RHT Raphe Nel.
№L LC
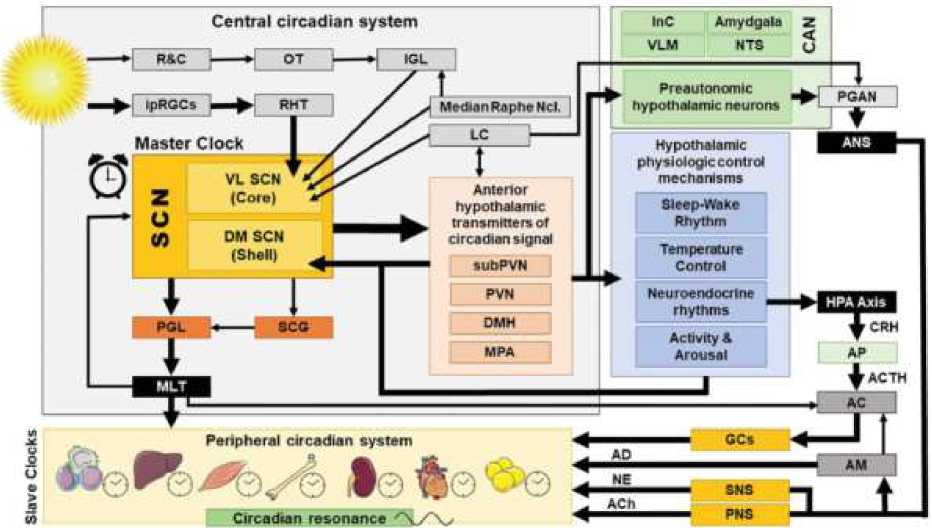
Рисунок 3. Центральная и периферическая циркадианные системы и их взаимосвязи [9]
Циркадная активность и реактивность гипоталамо-гипофизарно-надпочечниковой оси реализуются, как через гормональные, так и через нейрональные пути (Рисунок 4).
Ритмическое связывание с электронными блоками на хроматине тактовых компонентов положительной петли, CLOCK: BMAL1, индуцируют экспрессию генов, контролируемых часами, и тактовых отрицательных регуляторов PER и CRY. Ядерные рецепторы REV-ERB и ROR накладывают транскрипционные ритмы на гены через регуляторные элементы RORE, в то время как транскрипционные факторы DBP и репрессор NFIL3 взаимодействуют, чтобы управлять транскрипционными ритмами в наборе генов через связывание с D-боксами. Стресс — это состояние угрожающего гомеостаза, вызванное внутренними или внешними неблагоприятными силами (стрессорами) и противодействуемое сложным репертуаром физиологических и поведенческих реакций, направленных на поддержание/ восстановление оптимального равновесия организма (эустаза).
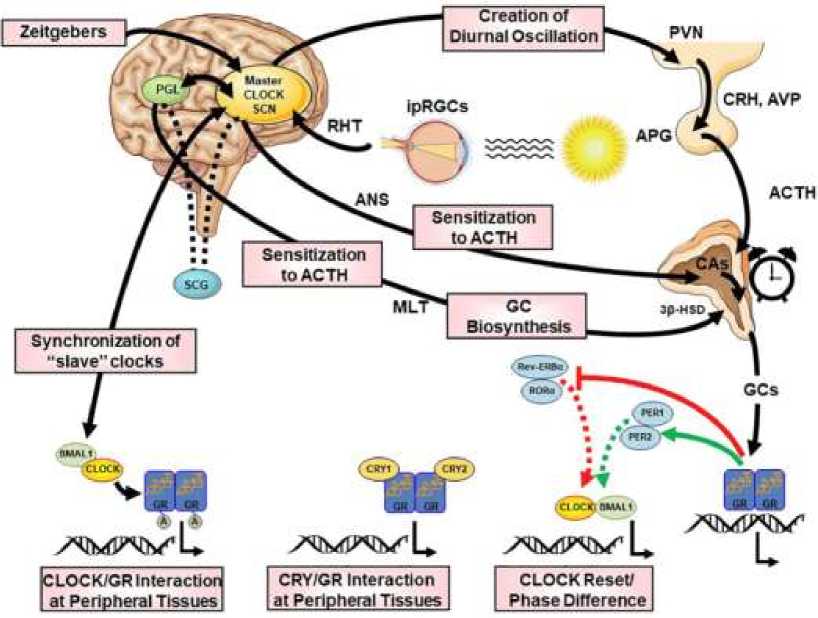
Рисунок 4. Многоуровневые взаимодействия между циркадной системой и гипоталамо-гипофизарно-надпочечниковой осью [9]
Адаптивный стресс-ответ зависит от высоко взаимосвязанной нейроэндокринной, клеточной и молекулярной инфраструктуры-системы стресса. Ключевыми компонентами стресс-системы являются гипоталамо-гипофизарно-надпочечниковая ось (ГПА) и вегетативная нервная система (ВНС), которые взаимодействуют с другими жизненно важными центрами в центральной нервной системе (ЦНС) и тканями/органами на периферии для мобилизации успешной адаптивной реакции против навязанного стрессора(ов). Дисрегуляция стрессовой системы (гипер- или гипоактивация) в сочетании с мощным и / или хроническим стрессом может заметно нарушать гомеостаз организма, приводя к состоянию какостаза или аллостаза, со спектром клинических проявлений.
CRH: кортикотропин-рилизинг гормон; LC/NE симпатическая система: локус coeruleus / норэпинефрин-симпатическая система; POMC: проопиомеланокортин; AVP: аргинин вазопрессин; ГАМК: γ-аминомасляная кислота; BZD: бензодиазепин; АКТГ: адренокортикотропный гормон (кортикотрофин); NPY: нейропептид Y; SP: вещество P. Активация представлена сплошными зелеными линиями, а торможение-пунктирными красными линиями [10].
Центральный нейрохимический контур, ответственный за активацию стресс-системы, формирует физиологическую систему внутри ЦНС, состоящую как из стимулирующих, так и из тормозных сетей с множеством участков взаимодействия, которые модулируют и тонко настраивают адаптивный стресс-ответ. Ключевыми компонентами этих сетей являются гипоталамические CRH и AVP нейроны в сочетании с центральными катехоламинергическими (LC/NE) нейронами (Рисунок 5) [10].
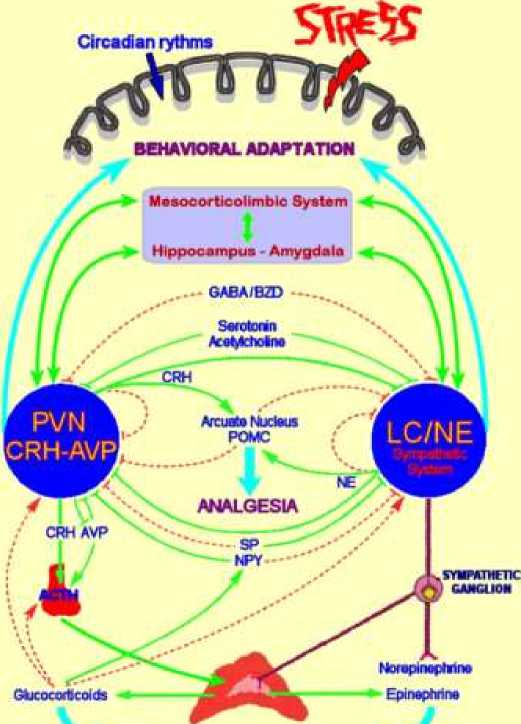
PfRIFHHUL ADAPTATION
Рисунок 5. Упрощенное представление о центральных и периферических компонентах стресс-системы, их функциональных взаимосвязях и отношениях с другими проводящими ЦНС, участвующими в стрессовой реакции [10]
Активация центральной стресс-системы основана на реципрокных ревербераторных нейронных связях между PVN CRH и катехоламинергическими LC/NE нейронами, причем CRH и NE стимулируют секрецию друг друга через CRH-рецептор-1 (CRH-R1) и α1-норадренергические рецепторы соответственно. Следует отметить, что ауторегуляторные сверхкороткие петли отрицательной обратной связи существуют как в ПВН CRH, так и в катехоламинергических нейронах ствола головного мозга, причем коллатеральные волокна ингибируют секрецию CRH и катехоламина соответственно через ингибирование соответствующих пресинаптических CRH- и α2-норадренергических рецепторов [10].
Экспериментальные, клинические и эпидемиологические данные показали, что хроническая активация стрессового ответа может участвовать в развитии различных соматических, а также нейропсихиатрических заболеваний. Накопленные данные этиопатогенеза болезни Альцгеймера показали, что нейроэндокринные и поведенческие изменения, сопровождающие реакцию на стресс, влияют на нейрональный гомеостаз и ставят под угрозу несколько ключевых нейронных процессов. Медиаторы нейроэндокринного стрессового ответа, при многократном или хроническом повышении, оказывают прямое пагубное воздействие на головной мозг, нарушая нейрональный метаболизм, пластичность и выживание (Рисунок 6) [11].
stressors
«solation
crowding
chrome disease
biological stressors
infection
social stressors
locus coeruleus
sleep deprivation psychological stressors catecholamine autotoxicity, reduced norepinephrine In !he brain
emotional stress tau phosporylation
CRF neurons
HPA exaggerated , glucocorticoids release
* major depression
gfuiamatergic neurons
glutamate excitotoxicity
Inflammation
axis
toxins
immune system
heat
reactivation of latent
organs and neurons affected by stressors
the effect of allostatic overload of neurons and organs
Alzheimer s disease-related neuropathology
Alzheimer's ‘ disease phenotype
amyloid 0 clearance hypoxia ke>
chemical stressors
phosporylation impairment of energy
atherosclerosis hypertension stroke
cardiovascular.** hypoxia system /
peipherat and central insulinoresistance (diabetes type 3)
peripheral inflammatory mediators
metabolism
gastrointestinal system
noise
cold
head
physical stressors
Рисунок 6. Фенотипические нейрональные механизмы при болезни Альцгеймера [11]
Множество доказательств указывает на тесную связь между сахарным диабетом 2 типа и нейродегенеративными заболеваниями, такими как болезнь Альцгеймера (Рисунок 7). Хотя точный механизм остается неясным, сахарный диабет 2 типа может усугублять нейродегенеративные процессы. Атрофия головного мозга, снижение метаболизма глюкозы в мозге и резистентность к инсулину центральной нервной системы являются признаками как болезни Альцгеймера, так и сахарного диабета 2 типа. Фенотип сахарного диабета 2 типа (дисгемеостаз глюкозы, резистентность к инсулину, нарушение передачи сигналов инсулина) также способствует патологии болезнь Альцгеймера, а именно накоплению β-амилоида (Aβ) и гиперфосфорилированного tau, и может индуцировать другие аспекты дегенерации нейронов, включая воспалительные и окислительные процессы.
Aβ и гиперфосфорилированный тау-белок могут также играть роль в дисфункции β-клеток поджелудочной железы и снижении чувствительности к инсулину и поглощения глюкозы периферическими тканями, такими как печень, скелетные мышцы и жировая ткань. Это предполагает роль этих белков, связанных с болезнью Альцгеймера, в развитии сахарного диабета 2 типа. Накопление островкового амилоидного полипептида (IAPP, или амилина) в β-клетках островков является основной патологической особенностью поджелудочной железы у пациентов с хроническим сахарным диабетом 2 типа. Совместно секретируемый с инсулином, амилин накапливается с течением времени и способствует токсичности β-клеток, что в конечном итоге приводит к снижению секреции инсулина и возникновению открытого (инсулинозависимого) диабета.
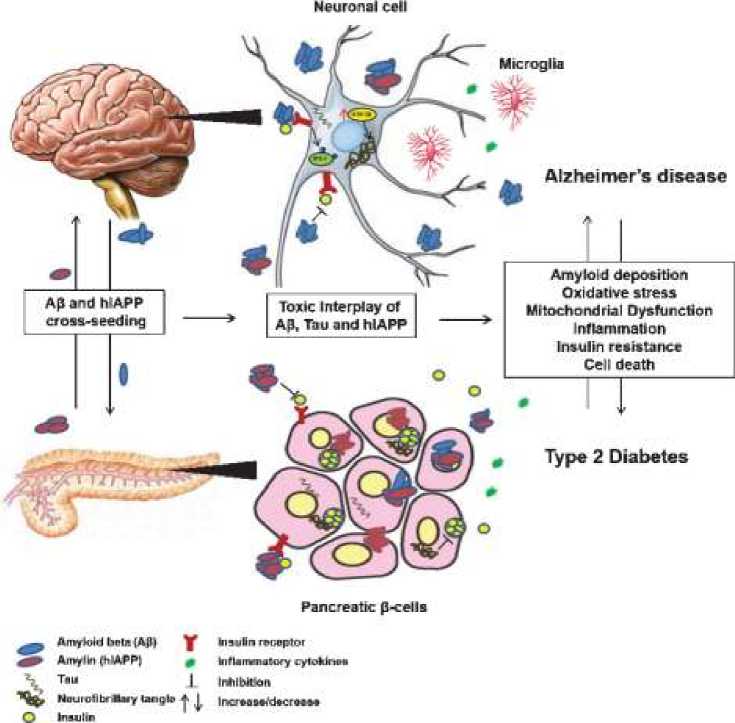
Рисунок 7. Патогенетические механизмы между сахарным диабетом 2 типа и нейродегенеративными заболеваниями — болезнь Альцгеймера
В процессе старения и при заболеваниях центральной нервной системы (ЦНС) нарушаются функции менингеальных лимфатических сосудов (MLV). Изменения в MLV наблюдались при связанных со старением нейродегенеративных заболеваниях, опухолях головного мозга и даже цереброваскулярных заболеваниях. Эти результаты открывают новый взгляд на старение и нарушения ЦНС и обеспечивают многообещающую терапевтическую мишень. Кроме того, недавние нейропатологические исследования показали, что MLV обмениваются растворимыми компонентами между спинномозговой жидкостью (CSF) и интерстициальной жидкостью (ISF) и выводят метаболиты, клеточный мусор, неправильно свернутые белки и иммунные клетки из CSF в глубокие шейные лимфатические узлы (DCLN), напрямую связывая мозг с периферическим кровообращением. Нарушение и дисфункция менингеальных лимфатических сосудов могут привести к накоплению токсичных белков в головном мозге, усугубляя прогрессирование неврологических расстройств [12].
Старение является важной причиной заболеваний ЦНС и даже влияет на прогноз этих заболеваний, включая цереброваскулярные заболевания, нейродегенеративные заболевания, травмы, опухоли головного мозга и так далее. Долгое время считалось, что патогенным эффектом старения является прямое старение нейронов, а прогресс иммунологии подчеркнул иммунные взаимодействия между ЦНС и периферией. ЦНС считается относительно иммунно-привилегированным участком. Хотя нейроиммунные взаимодействия играют важную роль в различных неврологических расстройствах, иммунный надзор за ЦНС остается неясным. ЦНС содержит микроглию, но эти клетки ограничены паренхимой головного мозга и не могут взаимодействовать с периферической иммунной системой в здоровых условиях. В отличие от паренхимы головного мозга, менингеальная лимфатическая сеть обеспечивает эффективный иммунный надзор за мозгом. Открытие MLV в ЦНС разрушило традиционное представление о том, что ЦНС обладает иммунными привилегиями. Старение сопровождается функциональным снижением MLV, которые способствуют нескольким возрастным нейродегенеративным заболеваниям, таким как болезнь Альцгеймера (AD), болезнь Паркинсона (PD), опухоли головного мозга, черепномозговая травма (ЧМТ), рассеянный склероз (MS) и инсульт.
Лимфатические узлы состоят из высокопроницаемых начальных лимфатических сосудов и более крупных собирающих лимфатических узлов. Исходные лимфатические сосуды представляют собой тонкостенные сосуды, образованные одним слоем LECs, которые реагируют на VEGF-C для активации лимфангиогенеза. Кроме того, начальные лимфатические сосуды соединены в виде небольших пуговичных соединений с наличием прерывистых базальных мембран и отсутствием гладкомышечных клеток (SMC). Кнопочные соединения и якорные нити образуют первичные лимфатические клапаны, которые обеспечивают доступ ISF, макромолекул и иммунных клеток. Впоследствии начальные лимфатические сосуды постепенно сливаются в предварительно собирающие и собирающие лимфатические сосуды, которые больше по калибру и окружены SMC. Собирающие лимфатические узлы состоят из плотно прилегающих молниеобразных соединений и вторичных внутрипросветных клапанов, которые практически непроницаемы для предотвращения обратного лимфотока и облегчения однонаправленного дренажа [12].
При физиологических и патологических состояниях структура и функция MLV перестраиваются микроокружением, в котором цитокины играют ключевую регуляторную роль. Исследовано, что некоторые растворимые медиаторы, такие как интерлейкин и VEGF-C, опосредуют ремоделирование структуры и функции лимфатических сосудов. При заболеваниях ЦНС астроциты, эндотелиальные клетки сосудов и иммунные клетки, могут секретировать вышеуказанные факторы и участвовать в патологическом ремоделировании MLV [12].
В условиях гомеостаза дуральные мозговые оболочки инфильтрируются многочисленными иммунными клетками (кроме микроглии), которые осуществляют иммунный надзор и влияют на функцию мозга.
Установлено [12], что менингеальные LEC являются важными типами стромальных клеток в ЦНС, которые регулируются микроокружением MLVs и также участвуют в ремоделировании микроокружения. Поэтому изучение соответствующих регуляторных взаимосвязей между менингеальными LEC и другими менингеальными клетками представляет собой новую перспективу для понимания патологических процессов многих заболеваний ЦНС.
Недавно признанное присутствие функциональных MLV в ЦНС пролило новый свет на этиологию различных неврологических расстройств. В последние годы сообщалось, что MLV оказывают важное влияние на сложную циркуляцию и обмен растворимым содержимым между CSF и ISF.
Менингеальные лимфатические сосуды — «хранитель» гомеостаза CSF / ISF. Общий объем ликвора обновляется примерно 11 раз в день у крыс и примерно 4 раза в день у здоровых людей [12].
Жидкость в ЦНС вытекает главным образом по трем путям: арахноидальные грануляции и ворсинки в дуральном венозном синусе, периферические лимфатические сосуды вблизи решетчатой пластинки и MLVs.
Параваскулярный приток / отток ликвора и ISF был предложен в качестве пути обмена метаболитов, неправильно свернутых белков и продуктов жизнедеятельности. Вкратце, субарахноидальная ликворная жидкость втекает в паренхиму головного мозга по периартериальному пространству Вирхова-Робина (приток), обменивается с ISF, а затем переносит метаболиты, неправильно свернутые белки и другие отходы, чтобы вытекать по перивенозному пространству обратно в ликвор (отток). Кроме того, эти молекулы могут проникать в паренхиму мозга или покидать ее через концевые ножки глиальных лимитов. Наконец, ликвор поступает в твердую мозговую оболочку, и отходы выводятся MLV в DCLN.
Одним из основных факторов, подтверждающих идею о том, что ЦНС является органом, обладающим иммунными привилегиями, является отсутствие лимфодренажа в паренхиме головного мозга. Однако экспериментальные данные свидетельствуют о том, что иммунные клетки (Т-клетки, В-клетки и DC) накапливаются в менингеальных пространствах в гомеостатических условиях; хотя эти иммунные клетки (за исключением микроглии) не могут проникнуть в паренхиму мозга, MLV несут многочисленные иммунные клетки и выводят их из ЦНС, чтобы играть роль в иммунном надзоре. При патологических состояниях DC распознают соответствующие антигены и мигрируют в DCLN, способствуя пролиферации и активации антиген-специфических Т-клеток. Во время этого процесса DC или Т-клетки попадают в MLV в основном через путь CCL21-CCR7. Миграция Т-клеток в DCLN, зависящая от CCR7, по-видимому, имеет центральное значение для поддержания менингеального иммунитета, как показано наблюдением, что отток CCR7-KO Т-клеток в DCLN был значительно меньше, чем у CCR7-WT Т-клеток, когда два типа клеток были удалены и вводится в ликвор. Считается, что легкое является «лицензированным» местом для специфичных к ЦНС Т-клеток, которые приобретают миграционные свойства, позволяющие им получать доступ к ЦНС. Однако исследования показывают, что DCLN являются еще одним «лицензированным сайтом» для реактивации Т-клеток [12].
Ключом к возникновению и развитию болезни Альцгеймера является дисбаланс между выработкой и выведением белковых молекул: бета-амилоид Aβ и тау Tau. MLV и дренаж Aβ. Aβ происходит из белка-предшественника β-амилоида (APP) посредством протеолитических функций β-секретазы и γ-секретазы, в то время как α-секретаза предотвращает его образование, расщепляя его в середине амилоидного домена. Ключом к возникновению и развитию болезни Альцгеймера является дисбаланс между выработкой и выведением Aβ. Внеклеточный Aβ в ISF выводится в просвет сосудов или транспортируется в ликвор по циркуляции глимфатическим путем. Следовательно, восстановление функции очистки Aβ является многообещающей стратегией лечения болезни Альцгеймера [12].
Поскольку скорость текучести ликвора у здоровых пожилых людей вдвое меньше, чем у молодых людей, считается, что скорость текучести ликвора может быть связана с возникновением деменции у пожилых людей. Снижение потока ликвора может повлиять на состав ликвора, так что способность ликвора выводить растворенные вещества снижается, что влияет на клиренс Aβ и приводит к болезни Альцгеймера у пожилых людей [12].
Стоит отметить, что MLV способствуют выведению внеклеточного Aβ из головного мозга, поскольку исследования показали, что Aβ может накапливаться в этих менингеальных лимфатических сосудах и далее стекать в DCLN. Тем не менее, нарушение лимфодренажа ликвора может повлиять на клиренс Aβ и, таким образом, увеличить нагрузку Aβ в головном мозге [12].
MLV и дренаж тау. Молекулы Tau принадлежат к семейству белков, связанных с микротрубочками, которые преимущественно встречаются в нейронах. Внутриклеточное накопление агрегированных гиперфосфорилированных форм тау в структурах приводит к болезни Альцгеймера, поэтому важно знать, что регулирует выведение внеклеточного тау из ЦНС. Было продемонстрировано, что тау в ликворе может транспортироваться в шейные лимфатические узлы через дренаж MLV в твердой мозговой оболочке. Из-за их патофизиологической роли в очистке молекул Aβ и Tau, MLV могут быть многообещающей терапевтической мишенью для профилактики болезни Альцгеймера.
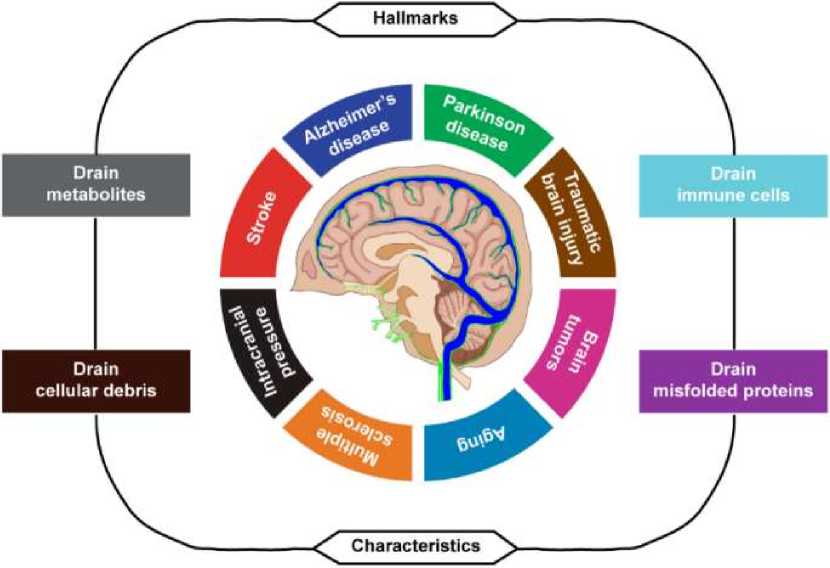
Рисунок 8. Патофизиологические признаки MLVs [12]
На Рисунке 8 продемонстрировано восемь отличительных возможностей MLV. Это значительный прогресс наших знаний о MLV. Старение связано с периферической лимфатической дисфункцией, но о взаимосвязи между менингеальной лимфатией и старением сообщалось редко. Недавние исследования показали, что старение связано как с дисфункцией MLV, так и со снижением дренажной способности менингеальных иммунных клеток.
С момента повторного открытия MLV в 2015 году многие исследования подтвердили важность MLV при неврологических расстройствах и старении (Рисунок 8) [12]. Менингеальные лимфатические сосуды взаимодействуют с другими механизмами очистки для поддержания гомеостаза мозга путем удаления метаболитов, клеточного мусора, неправильно свернутых белков и переноса иммунных клеток между мозгом и периферией. Наконец, понимание функции MLV в регулировании лимфодренажа может обеспечить терапевтические цели для лечения неврологических заболеваний и даже замедлить процесс старения мозга у людей.
Общая система разделена на дорсальную и вентральную системы (Рисунок 9) [13]. Дорсальная система включает ISF-лимфатическую жидкость, присутствующую вдоль дуральных венозных синусов, которая стекает вдоль яремных вен и большого отверстия. Самое густое из этих жидких пространств находится на средне-сагиттальном уровне. Уменьшение размера этого пространства, присутствующего на уровне заднего сагиттального синуса, скорее всего, связано с действием силы тяжести в положении лежа на спине во время сканирования.
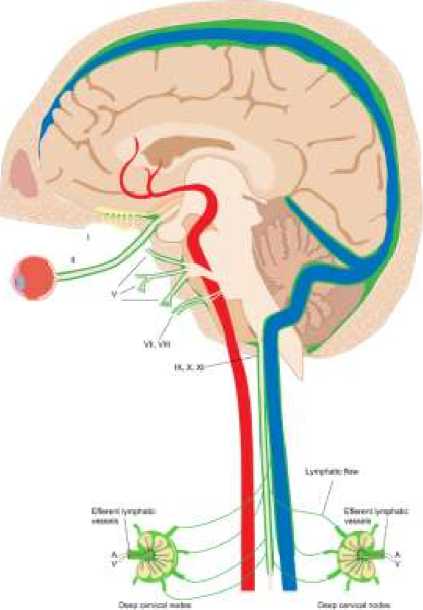
Рисунок 9. Схема прямых связей между менингеальной ISF-лимфатической жидкостью с глубокими шейными узлами через множественные нервные отверстия [13]
Вентральная система включает ISF-лимфатическую жидкость вдоль обонятельных нервов в передней черепной ямке, зрительной бороздке, твердой мозговой оболочке у отверстия пещер Меккеля, твердой мозговой оболочке у отверстия внутренних слуховых каналов и твердой мозговой оболочке на уровне отверстий яремного отверстия. Зеленый сигнал в отверстиях нервных отверстий представляет лимфатическую жидкость. Эти пути направляют ISF-лимфатическую жидкость за пределы внутричерепного по пространственным эпидуральным поверхностям черепных нервов. ISF-лимфатические сигналы вдоль черепных нервов, яремных вен и каменистых и шейных ВСА на шее показывают связи между собой и шейными лимфатическими узлами [13].
Настоящая и функциональная лимфатическая сосудистая система находится в мозговых оболочках, которые покрывают центральную нервную систему (ЦНС). Это неожиданное (повторное) открытие привело к переоценке механизмов дренажа жидкости и растворенных веществ в ЦНС, нейроиммунных взаимодействий и участия менингеальных лимфатических узлов в возникновении и прогрессировании неврологических расстройств [14]. Исследовано, влияния на менингеальную лимфатическую функцию, таких как передача сигналов факторов роста и старение, и их влияние на непрерывный отток молекул, полученных из мозга, и менингеальных иммунных клеток в шейные лимфатические узлы. Развитие открытия роли лимфатической сосудистой сети, дренирующей ЦНС, при различных патологиях, которые имеют сильный нейровоспалительный компонент, включая травмы головного мозга, опухоли и связанные со старением нейродегенеративные заболевания, такие как болезни Альцгеймера и Паркинсона. Предоставлена [14], критическая оценка загадок, проблем и захватывающих вопросов, связанных с менингеальной лимфатической системой, которые должны быть исследованы в ближайшие годы.
Сон эволюционно сохраняется у всех видов, и нарушение сна является общей чертой больного мозга. Качество сна снижается с возрастом, а нарушение нормальной архитектуры сна часто предшествует возникновению деменции при нейродегенеративных заболеваниях [15]. Лимфатическая система, которая очищает мозг от белковых отходов, в основном активна во время сна. Тем не менее, лимфатическая система с возрастом ухудшается, что указывает на причинно-следственную связь между нарушением сна и прогрессированием симптомов при нейродегенеративных деменциях. Связи, которые связывают сон, старение, клиренс лимфатической системы и агрегацию белков, пролили новый свет на патогенез широкого спектра нейродегенеративных заболеваний, для которых недостаточность лимфатической системы может представлять собой терапевтически целевой конечный общий путь [15].
Схематическое изображение мозговых оболочек, состоящих из твердой мозговой оболочки, арахноидального и мягкого слоев (Рисунок 10) [16].
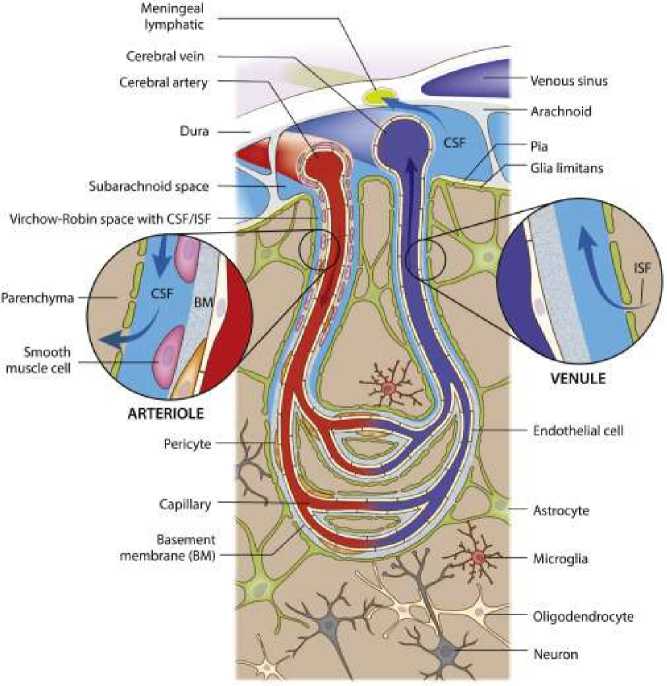
Рисунок 10. Цитоархитектура мозговых оболочек, сосудистой сети головного мозга и путей параваскулярной рециркуляции [16]
Лимфатические сосуды, которые присутствуют в твердой мозговой оболочке, выводят компоненты спинномозговой жидкости (ликвора), которая заполняе т субарахноидальное пространство. Проникая с поверхности мозга, мозговые артерии переходят в пиальные, а затем субпиальные артерии. Пиальные артерии большего калибра переходят в артериолы меньшего калибра (обе окружены гладкомышечными клетками), которые погружаются в паренхиму мозга. Четко очерченные параваскулярные пространства размером около 50–100
нм, пространства Вирхова-Робина, заполнены ликворо м, который поступает в более глубокие области мозга, вдоль артериол и капилляров, и диффундирует через г лиальные лимит ы в паренхиму. Отток (ISF) происходит через паравенозные пространства обратно в субарахноидальный ликвор [16].
Мы также ожидаем разработки более совершенных методов нейровизуализации, которые позволят использовать менингеальный лимфодренаж и измерения притока/оттока лимфы у людей в качестве диагностических и / или прогностических инструментов у пациентов с нейровоспалительными и нейродегенеративными расстройствами. Функционально-сбалансированная нутрициология и новая глимфатическая система очищает метаболиты и отходы жизнедеятельности через спинномозговую жидкость, пока мы спим.
Хронический стресс ремоделирует и реструктурирует лимфатическую сосудистую сеть. Основополагающее исследования были сосредоточены на открытии глимфатической системы, сети мозга, которая очищает метаболиты и отходы жизнедеятельности через спинномозговую жидкость, пока мы спим. Глимфатическая система из-за ее зависимости от глиальных клеток — не нейрональных клеток в центральной нервной системе (ЦНС), которые не производят электрические импульсы, но поддерживают и защищают нейроны. Настоящая и функциональная лимфатическая сосудистая система находится в мозговых оболочках, которые покрывают центральную ЦНС. Это неожиданное (повторное) открытие привело к переоценке механизмов дренажа жидкости и растворенных веществ в ЦНС, нейроиммунных взаимодействий и участия менингеальных лимфатических узлов в возникновении и прогрессировании неврологических расстройств. Сон эволюционно сохраняется у всех видов, а нарушение сна является общим патогенезом нейродегенерации, циркадианного стресса и электромагнитной нагрузки / перегрузки. Качество сна у человека снижается с возрастом, а нарушение нормальной архитектуры сна часто предшествует возникновению нейродегенеративных заболеваний.
Функционально-сбалансированные пищевые эмоции (хлеб и эмоции) — это комбинированное лечение с применением функциональных продуктов питания (персонифицированных по содержанию макро- и микроэлементов, витаминов и клетчатки) и лекарственных препаратов (с положительным влиянием на биомикробиоту) — способных к нормализации патологически измененных биологических ритмов — перспективное направление нейронутрициологии XXI века [17].
Одной из областей интереса является то, что радиопротекторные агенты часто являются фитонутриентами, которые содержатся в хорошо сбалансированной диете, особенно в растительной диете [17]. Это наблюдение предполагает, что только модификация диеты может обеспечить радиопротекторные эффекты.
Нейровизуализация в нейрофармакологии позволяет сформировать доказательную фармакологию, умения грамотного подбора наиболее эффективных и безопасных лекарственных средств по их фармакодинамическим и фармакокинетическим характеристикам, взаимодействию лекарственных средств; настороженности к нежелательным лекарственным реакциям при заданной патологии и устранению последствий этих реакций. Категория функциональной визуализации головного мозга используется для диагностики расстройств обмена веществ на самых ранних стадиях развития заболевания [18].
Наиболее развитыми являются диагностические технологии и методики — функциональная и структурная визуализация, биохимическое и генетическое тестирование [18]. Все этапы, связанные с медико-биологическим направлением нейронаук и технологий — диагностика, терапия, реабилитация и профилактика неврологических и психических расстройств — имеют свои сложности, что ведет к недостаточно эффективной помощи больным. Поэтому критически важной задачей является дальнейшее развитие технологий и методик в этих областях, наряду с прорывами в накоплении фундаментальных знаний о возникновении и развитии данных заболеваний. Современное использование в лечебно-диагностическом процессе наряду с гибридными и комбинированными методами управления «когнитивным мозгом», IT-технологий и автоматического анализа полногеномного секвенирования нового поколения повышают качество оказания медицинской помощи [18].
Современные многочисленные исследования посвящены путям управления нейропластичностью мозга, которые помогут разрабатывать более эффективные стратегии вмешательства для выздоровления (реабилитации), улучшения функций мозга и управления возрастными особенностями мозговой деятельности [18].
Эпигенетические механизмы могут регулировать экспрессию родственных генов на ранней стадии заболевания, и, таким образом, изменение факторов, связанных с развитием заболевания у пациентов с болезнью Альцгеймера, может быть использовано для профилактики и лечения данной нейродегенерации. Человеческий мозг — это главный инструмент и самый ценный ресурс на нашей планете. Новая эпигенетика человека и мозг человека управляет взаимодействием генетических и эпигенетических программ старения и здорового долголетия. Эпигенетические часы — это математические модели и искусственный интеллект, которые предсказывают биологический возраст человека с помощью данных метилирования ДНК и являются наиболее точными биомаркерами процесса старения [19].
Генетические и эпигенетические факторы, ограничивающие продолжительность жизни человека, являются актуальными в биогеронтологических, биофизических и нейрофизиологических исследованиях, особенно с точки зрения медицинской экономики [19].
Цереброваскулярное старение можно рассматривать с нескольких точек зрения, включая изменения в плотности сосудов (количество капилляров и артериол), пластичности сосудов (динамическая регуляция плотности или структуры сосудов) и реактивности сосудов (приспособление сосудов к острым метаболическим изменениям, происходящим в тканях). Основные механизмы контроля в мозговом кровообращении уникальны по сравнению с другими сосудистыми руслами и включают, но не ограничиваются такими особенностями, как гематоэнцефалический барьер, периваскулярная иннервация, внутриклеточная связь между нейронами, периваскулярные глиальные клетки и гладкомышечные клетки, высокая скорость метаболизма тканей, отсутствие аноксической толерантности и наличие коллатеральных артерий [19].
Хрономедицинские технологии — это математические модели и искусственный интеллект, которые предсказывают биологический возраст человека с помощью данных метилирования ДНК, модификации гистонов, ремоделирование нуклеосом и микроРНК, и являются наиболее точными биомаркерами процесса старения. Эпигенетические механизмы (метилирование ДНК, модификации гистонов, нкРНК) взаимосвязаны и образуют «эпигенетическую сеть». Факторы образа жизни и воздействия окружающей среды оставляют эпигенетические следы на нашей ДНК, которые влияют на экспрессию генов, некоторые из них оказывают защитное действие, а другие — вредное. Генетические и эпигенетические факторы обеспечивающие долголетие и сверхдолголетие, требуют от человека разумного нового взаимодействия с природой и обществом, и ответственности за будущие здоровые поколения [20].
Современное и своевременное внедрение эпигенетических постулатов питания от «Здоровое питание матери — лучшее начало жизни» до «Здоровое питание человека — обеспеченное здоровое старение» позволит эффективной реализации программ долголетия и сверхдолголетия человека и мозга человека [20].
В исследовании [20] доказано что, продолжительность жизни человека в значительной степени определяется эпигенетически. Эпигенетическая информация — обратима, наши исследования дают возможность терапевтического вмешательства при здоровом старении и связанных с возрастом заболеваниях [20].
Современные нейротехнологии ядерной медицины, новая 5П медицина и 5G технологии сделали открытие в решении проблемы болезни Альцгеймера [21]. Пятнадцатилетний авторский опыт внедрения результатов исследований (алгоритмы / инструменты / изобретения) позволили проведению успешной медицинской реабилитации когнитивных нарушений и увеличению (здоровой / качественной / культурной / религиозной) продолжительности жизнедеятельности [21]. Исследования Н. П. Романчук по смягчению влияния циркадианного стресса на здоровое долголетие человека открыли мультидисциплинарные адресные возможности психиатрам, неврологам, кардиологам, эндокринологам и гериатрам. Генетическая и эпигенетическая терапия возрастозависимой эндотелиальной дисфункции при сосудистом старении, является стратегической, в мероприятиях активного долголетия.
В исследованиях Н. П. Романчук показано, что для нового нейрогенеза и нейропластичности, для управления нейропластичностью и биологическим возрастом человека, для современной нейрофизиологии и нейрореабилитации когнитивных нарушений и когнитивных расстройств необходимо достаточное функциональное и энергетическое питание мозга с использованием современных нейротехнологий ядерной медицины [21]. В исследовании установлено:
Геном — это «оборудование», с которым мы рождаемся. Наш эпигеном — химические модификации ДНК и связанных с ними белков — является «программным обеспечением», влияющим на экспрессию генов. Оба важны. Эпигеном податлив, и на его состав могут влиять факторы окружающей среды.
Практически ничего нельзя сделать, чтобы благоприятно изменить наш геном, существует большой интерес к пониманию факторов, таких как пищевые компоненты, которые способны модифицировать наш эпигеном, чтобы установить «здоровый» транскриптом.
Новый нейрогенез и нейропластичность зависят от достаточного функционального и энергетического питания мозга с использованием современных нейротехнологий ядерной медицины: радиопротекторной фармацевтики и нутрициологии, радиомодуляторов и радиомитигаторов.
Циркадные изменения при болезни Альцгеймера связаны с нарушением сна и включают фрагментацию ночного сна, повышенное бодрствование и снижение уровня дневной активности при дневной дремоте. Специфические изменения сна включают потерю медленного сна и быстрого сна.
Положительная корреляция с оценками Mini Mental State Examination (MMSE) свидетельствует, что нарушение сна совпадает с тяжестью деменции.
Сон выполняет восстановительную функцию в мозге и связан с сохранением памяти. Медленный сон — особенно значим для сохранения памяти. Медленные волны, обнаруженные в ЭЭГ, имеют более низкую энергию нейронов, которая более устойчива и благоприятна для синаптической пластичности и консолидации памяти.
Циркадианный стресс вызывает нарушение сна и нейропсихиатрические расстройства с предполагаемой высокой распространенностью циркадной дисрегуляции. Внеклеточные везикулы рассматриваются как многофункциональные молекулярные комплексы, контролирующие фундаментальные и гомеостатические функции клеток. В головном мозге внеклеточные везикулы секретируют различные молекулы, связанные с функцией нейронов и нейротрансмиссией, тем самым способствуя реципрокной коммуникации между нервными клетками (например, взаимодействие нейрон-глия), синаптической пластичности и нейрональной активности. В исследовании [21] были сделаны следующие выводы:
Нейропластичность, нейрокоммуникации и инструменты нейрореабилитации взаимосвязаны с религиозностью человека .
Наноматериалы и новые высокоэффективные нанорадиопротекторы с максимизацией лекарственной эффективности воздействия на мозг человека, работа гиппокампа с «винчестерами» памяти и состояние духовного мира человека, синхронизированы.
Пятнадцатилетний авторский опыт внедрения результатов исследований (алгоритмы / инструменты / изобретения) позволили проведению успешной медицинской реабилитации когнитивных нарушений и увеличению (здоровой / качественной / культурной / религиозной) продолжительности жизнедеятельности.
Культурная парадигма здоровья мозга человека в десятилетнем исследовании «Активное долголетие: биофизика генома, нутригеномика, нутригенетика, ревитализация» активизирует проникновение эволюционных и социально-когнитивных нейрокоммуникаций мозга человека в современные нейротехнологии ядерной медицины, новую 5П медицину и 5G технологии.
Комбинированная медикаментозная платформа и обогащенная биоэлементология и нутрициология (мозга / микробиоты и генома / эпигенома), гибридная нейровизуализация и нейротехнологии ядерной медицины работают как превентивно, так и в долгосрочных программах медицинской реабилитации.
Новые компетенции психонейроиммуноэндокринология и психонейроиммунология играют стратегическую роль в междисциплинарной науке и межведомственном планировании и принятии решений.
Стратегической задачей является профилактика комбинированного суммарного риска воздействия на мозг человека: патологического ускоренного старения мозга, церебрального COVID-19 воздействия, технологий ядерной медицины.
Циркадная система синхронизации представляет собой эволюционный программный продукт мозг человека, который необходим, для выживания и подготовки организма к ожидаемым циклическим вызовам, различной эпигенетической направленности.
Продолжающемся исследовании [22] следующих стратегических научно-практических направлений, установлено следующее: программа лечения и профилактики когнитивных нарушений и когнитивных расстройств «Болезнь Альцгеймера и ядерная медицина (БАЯМ-365 / 22 / 77)» обеспечивает работу квалифицированного разума, сопровождает создание и совершенствование не только когнитивного потенциала мозга, но и управление когнитивной реабилитацией при болезни Альцгеймера. Эффективность стратегических мероприятий когнитивной реабилитации напрямую зависит от биоплатформы здоровой микробиоты и синхронизации работы «висцерального и когнитивного мозга». Нейросоциологическое и нейроэкономическое сопровождение новой когнитивной реабилитации при болезни Альцгеймера потребует реинкарнации информационного взаимодействия современного человека в процессе всей жизнедеятельности [22].
Структурно-функциональное и когнитивное развитие нового мозга человека потребует количественного и качественного обеспечения технологий и инструментов в «адресной» доставке к нейрокоммуникативным «винчестерам» памяти наноматериалов биоэлементологии и нутрициологии мозга, фармакологии и радиобиологии [22]. В исследованиях Н. П. Романчук показано, что для нового нейрогенеза и нейропластичности, для управления нейропластичностью и биологическим возрастом человека, для современной нейрофизиологии и нейрореабилитации когнитивных нарушений и когнитивных расстройств необходимо достаточное функциональное и энергетическое питание мозга с использованием современных нейротехнологий ядерной медицины. Нейрогенетика, комбинированные и гибридные нейросетевые технологии нейровизуализации, 5П медицина и 5G технологии, нанорадиопротекторы с максимизацией лекарственной эффективности на биоплатформе здоровой микробиоты обеспечат синхронизацию работы «висцерального и когнитивного мозга» в стратегических мероприятиях когнитивной реабилитации [22].
Биоэлектромагнитические характеристики светового воздействия на зрительный анализатор, являются самыми сильными синхронизирующим сигналами для циркадианной системы и оптимальной работы мозга технологий. Оптимизация нейробиологических и хрономедицинских процессов, возможна при циркадианной выработке мелатонина и обеспечении его длительной концентрации в организме человека. Половые гормоны оказывают многочисленные защитные и антиоксидантные действия во взрослом мозге, увеличивая нервную функцию и устойчивость и способствуя выживанию нейронов [23].
По мере старения организма происходит относительно быстрая потеря гормонов яичников у женщин после менопаузы и постепенное, но действительно значительное снижение тестостерона у мужчин. Репродуктивное старение как у мужчин, так и у женщин оказывает негативное влияние на нервную функцию и представляет собой значительный возрастной фактор риска нейродегенеративных заболеваний, в первую очередь болезни Альцгеймера [23].
Ключевым положительным фактором всех исследований является возраст начала менопаузальной гормонотерапии, раннее начало гормонотерапии в период менопаузы является защитным от болезни Альцгеймера. Нейроэндокринологические мультимодальные методы позволяют существенно увеличить продолжительность активной и качественной здоровой жизни человека [23].
Время начала терапии экзогенными эстрогенами также высоко достоверно ассоциировалось с риском деменции: если заместительная гормональная терапия начиналась в первые 5 лет после наступления менопаузы, риск развития болезни Альцгеймера был существенно ниже. Комбинация эстрогенов, IGF-1 или других нейротрофических факторов в определенные временные интервалы, например, в период легких и умеренных когнитивных нарушений, предшествующей тяжелой нейродегенерации, может обеспечить терапевтическую стратегию у пациентов с болезнью Альцгеймера в постменопаузе.
Кроме того, эстрогены действуют в головном мозге, регулируя широкий спектр поведения и физиологических функций у обоих полов. По мере старения организма происходит относительно быстрая потеря гормонов яичников у женщин после менопаузы и постепенное, но действительно значительное снижение тестостерона у мужчин. Репродуктивное старение как у мужчин, так и у женщин оказывает негативное влияние на нервную функцию и представляет собой значительный возрастной фактор риска нейродегенеративных заболеваний, в первую очередь болезни Альцгеймера [23].
Согласно современной концепции [24], расстройства пробуждения из медленного сна имеют общие диагностические критерии, демонстрируя сходные патофизиологические изменения. Согласно современным нейрофизиологическим данным, парасомнии, связанные с нарушением пробуждения из медленного сна, занимают промежуточное положение между сном и бодрствованием. Причиной этому является дисфункция активации в поясной, префронтальной и лобной коре. Несмотря на достаточно активное продвижение в понимании физиологических основ возникновения данных парасомний, остаются открытыми вопросы терапии их отдельных клинических проявлений [24].
Нарушения сна и бодрствования при таких заболеваниях [25], как болезнь Паркинсона, деменция с тельцами Леви и болезнь Альцгеймера, встречаются у большей части пациентов. Сон выполняет множество функций, обеспечивающих нормальную работу мозга, и его нарушения могут являться одним из факторов, способствующих развитию нейродегенеративных заболеваний. Нарушения сна и бодрствования могут ухудшать течение нейродегенеративного процесса и приводить к нарастанию симптомов, в том числе когнитивных нарушений. Одним из препаратов мелатонина, доступным в России, является меларитм (ФП «Оболенское»). Препарат содержит 3 мг мелатонина и назначается в качестве снотворного средства, а также адаптогена для нормализации биологических ритмов. Принимать меларитм при нарушениях сна рекомендуется в дозе 0,5–1 табл. перед сном за 30–40 мин 1 раз в день. Коррекция дневной сонливости при нейродегенеративных заболеваниях является непростой задачей, учитывая то, что ее генез преимущественно объясняется поражением центров бодрствования. Помимо соблюдения гигиены ночного сна, пациентам должен быть рекомендован короткий дневной сон продолжительностью не более 20–30 мин. Необходимо провести дифференциально-диагностический поиск возможных факторов, способствующих развитию дневной сонливости, и при их выявлении проводить соответствующее лечение. В качестве дополнительного лечения применяются стимулирующие препараты, в том числе модафинил и метилфенидат однако в настоящее время они не зарегистрированы в РФ. Неоднозначные результаты были получены при исследовании кофеина, который показал статистически значимое, но небольшое уменьшение дневной сонливости в сравнении с плацебо [25]. Другое направление коррекции дневной сонливости — это усиление циркадианных ритмов: использование препаратов мелатонина, фототерапия и регулярные физические упражнения. Коррекция нарушений сна и бодрствования может быть фактором, улучшающим течение нейродегенеративных заболеваний, особенно при проведении ее на ранних стадиях, однако этот вопрос требует дальнейшего изучения [25].
Сон выполняет множество функций, среди которых синхронизация организма с окружающей средой и сохранение энергии, синтез и накопление белков и гликогена, настройка нейромедиаторных систем, терморегуляция, консолидация памяти, а также удаление накопленных в течения дня в межклеточном пространстве головного мозга метаболитов [26]. Однако старение неотвратимо ассоциировано с изменениями в структуре сна и цикле «сон-бодрствование». Характерными изменениями сна у пожилых являются удлинение времени засыпания, снижение общего времени сна, уменьшение продолжительности глубоких стадий и увеличение поверхностных стадий сна [27]. С возрастом также происходит смещение пика секреции мелатонина на более ранние часы, что приводит к раннему укладыванию в постель с более ранним пробуждением утром. У пожилых также отмечается снижение порога пробуждения, что приводит к фрагментации сна и частым ночным пробуждениям. В то время как в общей популяции клинически значимые нарушения сна у пожилых старше 65 лет встречаются в 38% случаев, при нейродегенеративных заболеваниях их частота выше в 1,5–2 раза и более [28]. Связь между нарушениями сна и нейродегенеративными заболеваниями является двусторонней. С одной стороны, нарушения сна могут повышать риск развития нейродегенеративного процесса, а с другой — они могут быть первыми проявлениями развивающейся синуклеино- или таупатии [29].
Нарушения сна при БА могут предшествовать развитию когнитивных нарушений. Так, при исследовании сна у пациентов со сниженным уровнем β-амилоида-42 в цереброспинальной жидкости (ЦСЖ) было выявлено, что уже на преклинической стадии БА происходит снижение эффективности сна вследствие его фрагментации [29]. Существует тенденция к усилению нарушений сна и бодрствования по мере прогрессирования заболевания. Так, J. Yesavage и соавт. [30] при наблюдении пациентов с БА в течение 1,5 года отмечали ухудшение качества ночного сна по результатам актиграфии. Соответственно, наиболее выраженные нарушения сна были связаны с более тяжелой деменцией.
Поддержание состояния бодрствования осуществляется путем сочетанной работы нескольких центров, в том числе медиального парабрахиального ядра дорсальной покрышки мозга (глутаматергические нейроны), педункулопонтинного ядра (холинергические нейроны), вентральной покрышки (дофаминергические нейроны), дорсальных и медиальных ядер шва (серотонинергические нейроны), голубоватого пятна (норадренергические нейроны). Эти ядра участвуют в активации таламуса, гипоталамуса, базальной области переднего мозга и мотонейронов спинного мозга и тормозят главный «центр сна», локализованный в вентролатеральной преоптической области. Основные роли в поддержании бодрствования принадлежат орексинергической и гистаминергической системам, работа которых приводит к «включению» вышеперечисленных «центров бодрствования» и активации коры [31]. Хроническая депривация сна ведет к тому, что система поддержания бодрствования находится в активном состоянии в течение большего времени, чем это предусмотрено в норме. Нейроны, входящие в эту систему, имеют длинные аксоны с большим числом синапсов, и их работа связана с высоким уровнем энергозатрат и образованием продуктов метаболизма. Достаточный физиологический сон требуется для восстановления «центров бодрствования», а его хроническое ограничение может приводить к нарушению структуры и функции нейронов [32]. Так, J. Zhang и соавт. [33] обнаружили, что депривация сна приводит к нарушению гомеостаза нейронов голубоватого пятна, которые участвуют в поддержании бодрствования и процессах, регулирующих память и внимание. Ограничение сна у мышей в течение 8 ч приводило к дезактивации протеина сиртуина 3-го типа, необходимого для нормальной жизнедеятельность клетки, и, вследствие этого, к развитию окислительного стресса. Во время сна происходит множество физиологических процессов, регулирующих работу головного мозга, один из них — удаление метаболитов, накопленных в межклеточном пространстве в течение дня. Липиды, крупные белки (β-амилоид, τ-протеин, α-синуклеин) и другие молекулы не могут пройти через гематоэнцефалический барьер, поэтому их удаление происходит альтернативным путем — через глимфатическую систему. Основной частью глимфатической системы являются периваскулярные пространства Вирхова—Робена, которые ограничены лептоменингеальным клеточным слоем как на внутренней стенке, обращенной к сосуду, так и на внешней, обращенной к периваскулярному отростку астроцита. Глимфатическая система позволяет осуществлять обмен между цереброспинальной (ЦСЖ) и интерстициальной жидкостями, доставку питательных веществ в паренхиму головного мозга и удаление «отходов» из интерстициального пространства [34]. L. Xie и соавт. [26] установили, что глимфатическая система активнее всего функционирует во время сна, когда скорость движения ЦСЖ в периваскулярных пространствах повышается на 90% вследствие их расширения из-за снижения активности симпатической системы.
Основным компонентом терапии является соблюдение гигиены сна. Для этого следует рекомендовать пациенту избегать дневного сна, не ложиться спать в возбужденном состоянии или слишком рано, выработать определенный ритуал отхода ко сну и засыпания, ложиться спать и вставать всегда в одно и то же время, создать спокойные условия в комнате для ночного сна. Коррекция нарушений циркадианного ритма должна включать в себя строгое соблюдение режима труда и отдыха, укладывание в постель и пробуждение в одно и то же время, регулярную физическую нагрузку в первую половину дня, прогулки на свежем воздухе для обеспечения достаточного уровня инсоляции. Мелатонин является основным гормоном-регулятором циркадианных ритмов, а также обладает антиоксидантными и нейропротективными свойствами, согласно данным, полученным на экспериментальных моделях [35]. Мелатонин хорошо переносится больными, среди побочных эффектов редко могут наблюдаться сонливость и головные боли в первой половине дня.
Мы также ожидаем разработки более совершенных методов нейровизуализации, которые позволят использовать менингеальный лимфодренаж и измерения притока / оттока лимфы у людей в качестве диагностических и / или прогностических инструментов у пациентов с нейровоспалительными и нейродегенеративными расстройствами. Циркадианный стресс вызывает дисрегуляцию «программного обеспечения» мозга человека, с последующим нарушением работы «когнитивного» и «висцерального» мозга. Циркадные ритмы организма запрограммированы системой циркадных генов. Циркадианные часы и циркадная система — являются биофизическим и биохимическим регулятор иммунной защиты. Циркадная система синхронизации представляет собой эволюционный программный продукт «биокомпьютера» для выживания и подготовки организма к ожидаемым циклическим вызовам, различной эпигенетической направленности [36]. Понимание временной связи между стрессорами и стрессовыми реакциями имеет решающее значение для понимания молекулярных основ физиологии и патогенеза заболевания. Хронический стресс и циркадианное рассогласование запускают каскад сбоев в функционировании нейрофизиологических, нейроэндокринных и психонейроиммунных механизмов [36].
Эпигенетическая нагрузка и аллостатическая перегрузка снижает как общую работоспособность организма, так и его физическую, профессиональную и когнитивную составляющие. Циркадианный стресс оказывает патологическое влияние на человека, во все его возрастные периоды жизнедеятельности. Стратегические экспериментальные фундаментально-прикладные исследования биофизических принципов регуляции артериального кровотока положили основу для нейросетевой нейрофизиологической / нейроиммунологической / нейроэндокринологической регуляции — взаимодействия с новой глимфатической системой, которая позволяет установить защиту от влияния хронического циркадианного стресса на процессы ремоделирования и реструктурирование лимфатической сосудистой сети, на своевременное внедрение технологий нейрореабилитации когнитивного мозга при когнитивном снижении.
В исследовании экспериментально, установлены новые физиологические аспекты регуляции артериального кровотока [37]. Рассмотрен обзор существующих подходов к расчетам потока крови в эластичных кровеносных сосудах. Показано, что доступные методы расчета тока жидкости в эластичных трубопроводах, основанные на стандартных гидродинамических уравнениях, не могут адекватно описать движение крови в эластичных кровеносных сосудах. Представлены также способы моделирования пульсовых волн, как по существу нелинейных эффектов [37].
Иммунология придерживается общебиологического принципа соотношения структуры и функции: иммунная система — система лимфоидных клеток, органов и тканей. Единственные специфические клетки иммунной системы — лимфоциты. Как и все другие системы в целом организме, иммунная взаимодействует со всеми остальными: с нервной, эндокринной, сердечно-сосудистой, всеми клетками крови, включая миелоидные клетки-исполнители воспалительных реакций в тканях (innate immunity). Миелоциты (нейтрофилы, макрофаги, эозинофилы, базофилы, тучные клетки), будучи активированными, развивают неспецифические воспалительные реакции в тканях, описанные много веков назад rubor, tumor, calor, dolor et functio lease, а в последние 15 лет — innate immunity. Основные функции иммунной системы [38]:
Активное поддержание иммунной толерантности (доминантной, транстолерантности) ко множеству веществ, происходящих как из собственных тканей организма, так из внешней среды. Цитотоксичность в отношении собственных стареющих или поврежденных какой-либо травмой (в том числе инфекцией, но не только) клеток. Клиренс внутренней среды организма от продуктов распада собственных клеток и тканей, заодно и от каких-то веществ, проникающих из внешней среды. Иммунитет — совокупная функция иммунной системы, описываемая «по периметру» четырьмя составляющими [38]:
-
- Доминантная иммунная толерантность к здоровым тканям своего организма и множеству экзогенных веществ.
-
- Цитотоксичность к устаревающим клеткам своего организма (освобождает место для физиологической регенерации тканей) и поврежденным теми или иными воздействиями (в том числе инфекциями) внешней среды.
-
- Прорегенеративная функция в формате физиологической регенерации и заживления травм.
-
- Клиренс внутренней среды от продуктов распада клеток и тканей.
Дальнейшее развитие науки об когнитивном мозге, продолжение исследований роли новой глимфатической системы и биофизических принципов регуляции артериального кровотока, влияние хронического циркадианного стресса на процессы ремоделирования и реструктурирование лимфатической сосудистой сети, на нейровоспалительный компонент, установление глубокой взаимосвязи нарушения сна с возникновением нейродегенеративных заболеваний, позволит науке и практическому здравоохранению внедрение новых технологий нейрореабилитации когнитивного мозга при когнитивном снижении.
Золотые правила долголетия:
-
– код иммунитета — защищает и усиливает иммунитет, который в свою очередь является проводником увеличения продолжительности жизни.
– здоровый иммунитет достигается / обеспечивается / сопровождается здоровой микробиотой.
– эмоции управляют и упреждают от развития тяжелого хронического циркадианного стресса и хронических инсомний. Эмоции — это, функциональные состояния, реализуемые в деятельности нейронных систем, которые регулируют сложное поведение.
Стратегическим является создание интегративной рабочей модели эмоций и стресса, в которой указаны временные рамки для измерения стресса — острого, событийного, ежедневного и хронического — и более точный язык для измерения стресса. Эмоции, если их не регулировать, приводят к аллостатической нагрузке / перегрузке и, в конечном счете, к биологическому старению и ранним заболеваниям. Социальные чувства имеют концептуальные и эмпирические связи с аффектом и эмоциями. Современная проблема аффективной неврологии — это детализировать причинно-следственные взаимодействия между эмоциональными состояниями, переживаниями эмоций и концепциями эмоций: у здоровых взрослых людей все три обычно происходят вместе. Эмоциональные состояния, наряду со многими другими признаками психического состояния, обеспечивают причинноследственные объяснения поведения. Эмоции являются «целенаправленными», потому что они направлены на подготовку организма к реагированию на ситуации, которые неоднократно возникали на протяжении эволюции.
Наука об когнитивном мозге (Cognitive brain science) — это новая, современная, молодая мультидисциплинарная и мультипарадигмальная научная платформа, включающая нейробиологию, нейрофизиологию, нейроэндокринологию, нейроиммунологию и др., через призму фундаментально-прикладных алгоритмов / инструментов / технологий на патогенез, диагностику, лечения и профилактику нейродегенеративных заболеваний.
Сформирована новая авторская мультидисциплинарная и мультипарадигмальная платформа, через призму фундаментально-прикладных алгоритмов / инструментов/ технологий на патогенез, диагностику, лечения и профилактику данной нейродегенерации (болезни Альцгеймера), которая позволяет стратегически моделировать и прогнозировать время (возраст) наступления когнитивного снижения при болезни Альцгеймера.
Когнитивный мозг человека — это биологические, биофизические, нейрофизиологические и медико-социальные парадигмы обмена информацией. Достижением исследований Романчук Н. П. является установление многих генетических и эпигенетических факторов когнитивного снижения и нейродегенеративных заболеваний [1]. Внедрение авторских разработок за последние 15 лет позволили сформировать систему алгоритмов и инструментов управления нейропластичностью. Модифицированные комбинированные методы ЭЭГ/ПЭТ и ПЭТ/фМРТ и гибридные технологии ПЭТ/КТ/МРТ — это, сочетающаяся функциональная и структурная нейровизуализация. Современные коммуникации — это, многоуровневые, мультипарадигмальные и междисциплинарные модели обмена информацией. Нейрогенетика является центром мультидисциплинарных и межведомственных исследований, использующих передовые методы, с участием 5П медицины и 5G технологий. Выводы:
Когнитивный мозг человека — открытие новых биофизических принципов регуляции артериального кровотока и нейросетевой нейрофизиологической / нейроиммунологической / нейроэндокринологической регуляции — взаимодействие с новой глимфатической системой, которая позволяет установить защиту от влияния хронического циркадианного стресса на процессы ремоделирования и реструктурирование лимфатической сосудистой сети, на своевременное внедрение технологий нейрореабилитации когнитивного мозга при когнитивном снижении.
Сон эволюционно сохраняется у всех видов, а нарушение сна является общим патогенезом нейродегенерации, с влиянием циркадианного стресса и электромагнитной нагрузки / перегрузки. Качество сна у человека снижается с возрастом, а нарушение нормальной архитектуры сна часто предшествует возникновению нейродегенеративных заболеваний. Менингеальные лимфатические сосуды (MLV) — «хранители» гомеостаза спинномозговой жидкости / интерстициальной жидкости (CSF / ISF).
Исследования показали, что MLV обмениваются растворимыми компонентами между спинномозговой жидкостью (CSF) и интерстициальной жидкостью (ISF) и выводят метаболиты, клеточный мусор, неправильно свернутые белки и иммунные клетки из CSF в глубокие шейные лимфатические узлы (DCLN), напрямую связывая мозг с периферическим кровообращением.
Лимфатическая система, которая очищает мозг от белковых отходов, в основном активна во время сна. Общий объем ликвора обновляется примерно 4 раза в день у здоровых людей. MLV и лимфатическая система являются основными путями удаления отходов из мозга. В отличие от паренхимы головного мозга, менингеальная лимфатическая сеть обеспечивает эффективный нейроиммунный надзор за головным мозгом. Открытие глимфатической системы — многофункциональной менингеальной лимфатики, которая регулирует механизмы дренажа жидкости и растворенных веществ в ЦНС, координирует работу нейроиммунных взаимодействий и участия менингеальных лимфатических узлов в нейропротекции возникновения и прогрессирования неврологических расстройств — важное достижение / внедрение для практического здравоохранения.
Хронический стресс ремоделирует и реструктурирует лимфатическую сосудистую сеть. Нейросети, которые связывают сон, старение, клиренс лимфатической системы и агрегацию белков, пролили новый свет на патогенез широкого спектра нейродегенеративных заболеваний, для которых недостаточность лимфатической системы может представлять собой терапевтически целевой конечный общий путь. Ключом к возникновению и развитию болезни Альцгеймера является дисбаланс между выработкой и выведением белковых молекул: бета-амилоид Aβ и тау (Tau). Следовательно, восстановление функции очистки Aβ и Tau является многообещающей стратегией лечения болезни Альцгеймера. Болезнь Альцгеймера и сахарный диабет 2 типа взаимодействуют и усугубляют нейродегенеративный процесс. Сахарный диабет 2 типа участвует в стимулировании нейродегенерации, опосредованной Aβ и Tau, и потенциальный вклад Aβ и Tau в развитие диабетического фенотипа, который в свою очередь — еще больше усугубляет нейродегенерацию.
Список литературы Наука о когнитивном мозге: глимфатическая (лимфатическая) система, циркадианный стресс и хронические инсомнии
- Романчук Н. П. Когнитивный мозг. Избранные труды. Самара-Москва. 2023.
- Романчук Н. П., Булгакова С. В., Волобуев А. Н., Краснов С. В., Середина Г. И., Зиганшина В. М., Сивакова Е. В., Маслова О. А., Пятин В. Ф. Альцгеймера болезнь: биофизика, генетика, эпигенетика, нейровизуализация, биоэлементология, нутрициология, лечение, профилактика и нейротренинги // Бюллетень науки и практики. 2023. Т. 9. №2. С. 131-170. https://doi.org/10.33619/2414-2948/87/18
- Романчук Н. П. Когнитивный мозг: нейробиология, нейрофизиология и нейроэндокринология эмоций // Бюллетень науки и практики. 2023. Т. 9. №3. С. 158-193. https://doi.org/10.33619/2414-2948/88/21
- Романчук Н. П., Булгакова С. В., Тренева Е. В., Волобуев А. Н., Кузнецов П. К. Нейрофизиология, нейроэндокринология и ядерная медицина: маршрутизация долголетия homo sapiens // Бюллетень науки и практики. 2022. Т. 8. №4. С. 251-299. https://doi.org/10.33619/2414-2948/77/31
- Романчук Н. П., Романчук П. И. Нейрофизиология и нейрореабилитация когнитивных нарушений и расстройств // Бюллетень науки и практики. 2019. Т. 5. №11. С. 176-196. https://doi.org/10.33619/2414-2948/48/19
- Романчук Н. П. Мозг Homo sapiens XXI века: нейрофизиологические, нейроэкономические и нейросоциальные механизмы принятия решений // Бюллетень науки и практики. 2021. Т. 7. №9. С. 228-270. https://doi.org/10.33619/2414-2948/70/23
- Волобуев А. Н., Романчук П. И. Биофизика кровообращения при сосудистой деменции и болезни Альцгеймера // Бюллетень науки и практики. 2019. Т. 5. №4. С. 76-102. https://doi.org/10.33619/2414-2948/41/08.
- Agorastos A., Nicolaides N. C., Bozikas V. P., Chrousos G. P., Pervanidou P. Multilevel interactions of stress and circadian system: implications for traumatic stress // Frontiers in Psychiatry. 2020. V. 10. P. 1003. https://doi.org/10.3389/fpsyt.2019.01003
- Orozco-Solis R., Aguilar-Arnal L. Circadian regulation of immunity through epigenetic mechanisms // Frontiers in Cellular and Infection Microbiology. 2020. P. 96. https://doi.org/10.3389/fcimb.2020.00096
- Yan J., Goldbeter A. Robust synchronization of the cell cycle and the circadian clock through bidirectional coupling // Journal of the Royal Society Interface. 2019. V. 16. №158. P. 20190376. https://doi.org/10.1098/rsif.2019.0376
- Mravec B., Horvathova L., Padova A. Brain under stress and Alzheimer's disease // Cellular and Molecular Neurobiology. 2018. V. 38. P. 73-84. https://doi.org/10.1007/s10571-017-0521-1
- Jiang H., Wei H., Zhou Y., Xiao X., Zhou C., Ji X. Overview of the meningeal lymphatic vessels in aging and central nervous system disorders // Cell & Bioscience. 2022. V. 12. №1. P. 202. https://doi.org/10.1186/s13578-022-00942-z
- Albayram M. S., Smith G., Tufan F., Tuna I. S., Bostanciklioglu M., Zile M., Albayram O. Non-invasive MR imaging of human brain lymphatic networks with connections to cervical lymph nodes // Nature Communications. 2022. V. 13. №1. P. 203. https://doi.org/10.1038/s41467-021-27887-0
- Das Neves S. P., Delivanoglou N., Da Mesquita S. CNS-draining meningeal lymphatic vasculature: roles, conundrums and future challenges // Frontiers in Pharmacology. 2021. V. 12. P. 655052. https://doi.org/10.3389/fphar.2021.655052
- Nedergaard M., Goldman S. A. Glymphatic failure as a final common pathway to dementia // Science. 2020. V. 370. №6512. P. 50-56. https://doi.org/10.1126/science.abb8739
- Da Mesquita S., Fu Z., Kipnis J. The meningeal lymphatic system: a new player in neurophysiology // Neuron. 2018. V. 100. №2. P. 375-388. https://doi.org/10.1016/j.neuron.2018.09.022
- Романчук Н.П. Биоэлементология и нутрициология мозга // Бюллетень науки и практики. 2021. Т. 7. №9. C. 189-227. https://doi.org/10.33619/2414-2948/70/22
- Романчук Н. П. Здоровая микробиота и натуральное функциональное питание: гуморальный и клеточный иммунитет // Бюллетень науки и практики. 2020. Т. 6. №9. С. 127166. https://doi.org/10.33619/2414-2948/58/14
- Романчук П. И., Волобуев А. Н. Современные инструменты и методики эпигенетической защиты здорового старения и долголетия Homo sapiens // Бюллетень науки и практики. 2020. Т. 6. №1. С. 43-70. https://doi.org/10.33619/2414-2948/50/06
- Романчук П. И. Возраст и микробиота: эпигенетическая и диетическая защита, эндотелиальная и сосудистая реабилитация, новая управляемая здоровая биомикробиота // Бюллетень науки и практики. 2020. Т. 6. №2. С. 67-110. https://doi.org/10.33619/2414-2948/51/07
- Романов Д. В., Романчук Н. П. Болезнь Альцгеймера и ядерная медицина: циркадианный стресс и нейровоспаление, нейрокоммуникации и нейрореабилитация // Бюллетень науки и практики. 2022. Т. 8. №5. С. 256-312. https://doi.org/10.33619/2414-2948/78/35
- Волобуев А. Н., Романчук Н. П., Маслова О. А., Пятин В. Ф., Романов Д. В. Проблемы ядерной медицины и когнитивной реабилитации // Бюллетень науки и практики. 2022. Т. 8. №6. С. 308-350. https://doi.org/10.33619/2414-2948/79/33
- Пятин В. Ф., Маслова О. А., Романчук Н. П. Нейронауки и ядерная медицина: моделирование и прогнозирование нейрореабилитации болезни Альцгеймера // Бюллетень науки и практики. 2022. Т. 8. №9. С. 211-275. https://doi.org/10.33619/2414-2948/82/30
- Захаров А. В., Повереннова И. Е., Калинин В. А., Хивинцева Е. В. Парасомнии, связанные с нарушением пробуждения из медленного сна: механизм возникновения, нейрофизиологические особенности // Журнал неврологии и психиатрии. 2019. Т. 119. №4. Вып. 2. С. 50-55. https://doi.org/10.17116/jnevro201911904250
- Яковлева О. В., Полуэктов М. Г., Ляшенко Е. А., Левин О. С. Сон и когнитивные нарушения при нейродегенеративных заболеваниях // Журнал неврологии и психиатрии. 2019. Т. 119. №4. С. 89-98. https://doi.org/10.17116/jnevro201911904289
- Xie L., Kang H., Xu Q., Chen M. J., Liao Y., Thiyagarajan M., Nedergaard M. Sleep drives metabolite clearance from the adult brain // Science. 2013. V. 342. №6156. P. 373-377. https://doi .org/10.1126/science.1241224
- Bombois S., Derambure P., Pasquier F., Monaca C. Sleep disorders in aging and dementia // The journal of nutrition, health & aging. 2010. V. 14. P. 212-217. https://doi.org/10.1007/s12603-010-0052-7
- Foley D. J., Monjan A. A., Brown S. L., Simonsick E. M., Wallace R. B., Blazer D. G. Sleep complaints among elderly persons: an epidemiologic study of three communities // Sleep. 1995. V. 18. №6. P. 425-432. https://doi.org/10.1093/sleep/18.6.425
- Ju Y. E. S., McLeland J. S., Toedebusch C. D., Xiong C., Fagan A. M., Duntley S. P., Holtzman D. M. Sleep quality and preclinical Alzheimer disease // JAMA neurology. 2013. V. 70. №5. P. 587-593. https://doi.org/10.1001/jamaneurol.2013.2334
- Yesavage J. A., Friedman L., Kraemer H. C., Noda A., Wicks D., Bliwise D. L., Zarcone V. A follow-up study of actigraphic measures in home-residing Alzheimer's disease patients // Journal of geriatric psychiatry and neurology. 1998. V. 11. №1. P. 7-10. https://doi.org/10.1177/0891988798011001
- Бабкина О. В., Полуэктов М. Г., Левин О. С. Гетерогенность дневной сонливости при болезни Паркинсона // Журнал неврологии и психиатрии. 2016. Т. 116. №6-2. C. 60-70.
- Tononi G., Cirelli C. Sleep and the price of plasticity: from synaptic and cellular homeostasis to memory consolidation and integration // Neuron. 2014. V. 81. №1. P. 12-34. https://doi.org/10.1016/j.neuron.2013.12.025
- Zhang J., Zhu Y., Zhan G., Fenik P., Panossian L., Wang M. M., Veasey S. Extended wakefulness: compromised metabolics in and degeneration of locus ceruleus neurons // Journal of Neuroscience. 2014. V. 34. №12. P. 4418-4431. https://doi.org/10.1523/JNEUR0SCI.5025-12.2014
- Matsumae M., Sato O., Hirayama A., Hayashi N., Takizawa K., Atsumi H., Sorimachi T. Research into the physiology of cerebrospinal fluid reaches a new horizon: intimate exchange between cerebrospinal fluid and interstitial fluid may contribute to maintenance of homeostasis in the central nervous system // Neurologia medico-chirurgica. 2016. V. 56. №7. P. 416-441. https://doi.org/10.2176/nmc.ra.2016-0020
- Hood S., Amir S. Neurodegeneration and the circadian clock // Frontiers in aging neuroscience. 2017. V. 9. P. 170.
- Пятин В. Ф., Романчук Н. П., Булгакова С. В., Романов Д. В., Сиротко И. И., Давыдкин И. Л., Волобуев А. Н. Циркадианный стресс Homo sapiens: новые нейрофизиологические, нейроэндокринные и психонейроиммунные механизмы // Бюллетень науки и практики. 2020. Т. 6. №6. С. 115-135. https://doi.org/10.33619/2414-2948/55/16
- Volobuev A. N., Koshev V. I., Petrov E. S. Biophysical principles of hemodynamics // Biophysical Principles of Hemodynamics. 2010. P. 1-215.
- Хаитов Р. М., Игнатьева Г. А. Наука об иммунитете - современные тренды. М.: ГЭОТАР-Медиа, 2023. 784 с.


