Неалкогольная жировая болезнь печени: коморбидность, клиническое значение и методы диагностики фиброза печени
Автор: Маршалко Д.В., Пчелин И.Ю., Шишкин А.Н.
Журнал: Juvenis scientia @jscientia
Рубрика: Медицинские науки
Статья в выпуске: 2, 2018 года.
Бесплатный доступ
В статье проанализированы современные научные данные о патогенетических и клинико-эпидемиологических аспектах неалкогольной жировой болезни печени (НАЖБП), которая за последнее десятилетие вышла на первое место по распространенности среди заболеваний печени в России. Рассмотрены наиболее актуальные проблемы коморбидности при НАЖБП. Дана сравнительная характеристика различных методов диагностики фиброза печени с описанием их преимуществ и недостатков. Суммированы данные последних лет о прогностическом значении индексов, используемых для неинвазивной оценки фиброза печени при НАЖБП.
Неалкогольная жировая болезнь печени, фиброз печени, стеатогепатит, цирроз печени, транзиторная эластография, шкала nfs, шкала fib-4, биопсия печени, метаболический синдром, инсулинорезистентность
Короткий адрес: https://sciup.org/14110472
IDR: 14110472 | УДК: 616.36-003.826
Текст научной статьи Неалкогольная жировая болезнь печени: коморбидность, клиническое значение и методы диагностики фиброза печени
Неалкогольная жировая болезнь печени (НАЖБП, NAFLD) и ее взаимоотношения с избыточной массой тела и метаболическим синдромом в настоящее время являются предметом многочисленных исследований. Распространенность НАЖБП среди взрослого населения составляет 1746% [1]. Повышенный риск развития у пациентов с НАЖБП цирроза печени и гепатоцеллюлярной карциномы в значительной степени определяет прогноз у этой категории больных [2, 3].
В Российской Федерации частота выявления НАЖБП стремительно растёт: в 2007 г. она оценивалась в 27%, а в 2014 г. – уже в 37,1%, что выводит ее на первое место по распространенности среди заболеваний печени. Чаще всего НАЖБП выявляется в следующих возрастных группах: 50–59 лет (31,1%), 40–49 лет (23,6%), 60–69 лет (18,1%) [4]. По данным последних исследований, имеется взаимосвязь между потреблением каннабиса и заболеваемостью НАЖБП. Показано, что у лиц, потребляющих каннабис, распространенность НАЖБП существенно ниже, что, возможно, является предпосылкой для создания нового вектора в лечении НАЖБП [5].
В настоящее время в качестве основного патогенетического фактора развития НАЖБП рассматривается инсулино-резистентность. Нарушения углеводного обмена и другие компоненты метаболического синдрома встречаются у пациентов с НАЖБП значительно чаще, чем в общей популяции, и ассоциированы с повышенным риском развития сердечно-сосудистой патологии. Заболевания сердечно- сосудистой системы являются основной причиной смерти этих пациентов, причем кардиоваскулярный риск значительно возрастает при наличии фиброза печени [6-8].
Одним из современных научных направлений является поиск связи между НАЖБП и хронической болезнью почек (ХБП). По данным международного мета-анализа, НАЖБП является независимым фактором риска ХБП. Далеко зашедшие стадии НАЖБП ассоциированы с высоким риском развития ХБП прогрессирующего течения. Из этого следует, что всем пациентам с НАЖБП, особенно при наличии стеатоге-патита и фиброза, необходима регулярная оценка функции почек для своевременного начала лечения ХБП [9, 10].
НАЖБП является фактором риска развития гепатоцеллюлярной карциномы (ГЦК), которую регистрируют, в том числе, и на предцирротической стадии. По результатам Корейского популяционного исследования с участием 25947 человек, злокачественные новообразования в группе пациентов с НАЖБП встречались на 32% чаще, чем у участников исследования без данной патологии [11]. Относительный риск возникновения отдельных видов опухолей у больных НАЖБП представлен на рисунке 1. Причины повышения риска онкологических заболеваний у пациентов с НАЖБП до конца не изучены. Обсуждается роль изменений гормонального фона, инсулинорезистентности, нарушения стабильности клеточного цикла гепатоцитов и других факторов. Также не вполне ясны особенности течения опухолевого процесса у больных данной группы, что требует дальнейших исследований на основе клинических наблюдений [11, 12].
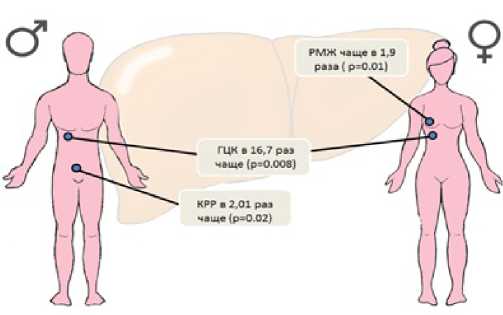
Рисунок 1. Относительный риск развития онкологических заболеваний у больных НАЖБП в сравнении с общей популяцией. РМЖ – рак молочной железы, ГЦК – гепатоцеллюлярная карцинома, КРР – колоректальный рак. Адаптировано из G.-A. Kim et al. [11]
НАЖБП – это медленно прогрессирующее заболевание [13]. Общая схема прогрессирования НАЖБП представлена на рисунке 2. На риск развития и характер течения НАЖБП оказывают влияние возраст, пол, коморбидность, генетические факторы, а также, по современным представлениям, микробиоценоз желудочно-кишечного тракта [14, 15]. По данным мета-анализа исследований парных биопсий печени, проведенного S. Singh et al., у пациентов с неалкогольным жировым гепатозом (НАЖГ) развитие стадии 1 фиброза печени наблюдается в среднем через 14,3 лет, а у пациентов с неалкогольным стеатогепатитом (НАСГ) – через 7,1 лет [16].
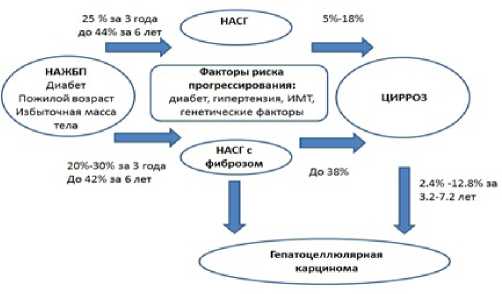
Рисунок 2. Схема прогрессирования неалкогольной жировой болезни печени (НАЖБП). НАСГ – неалкогольный стеатогепатит, ИМТ – избыточная масса тела. Адаптировано из L. Calzadilla Bertot, L. A.
Adams [13]
Степень фиброза – наиболее важный прогностический фактор при НАЖБП [17, 18]. В крупном когортном исследовании было показано, что наличие стадий 3 и 4 фиброза при НАЖБП ассоциировано с повышением риска смерти от всех причин в 3,3 раза [6]. По данным G. Sesti et al., риск гипертрофии левого желудочка у больных НАЖБП с умеренным или выраженным фиброзом в 3,5 раза выше, а риск утолщения комплекса интима-медиа сонных артерий – в 3,9 раза выше, чем у пациентов с незначительно выраженным фиброзом [19].
Для оценки фиброза печени у пациентов с НАЖБП разработаны различные инвазивные и неинвазивные методы. Несмотря на многообразие неинвазивных методов, золотым стандартом диагностики НАЖБП и стадирования фиброза во всем мире до сих пор остается биопсия печени.
Преимущества и недостатки этой методики, широко обсуждаемые в научной литературе [20-24], суммированы в таблице 1.
Таблица 1 Преимущества и недостатки биопсии печени как метода диагностики фиброза
|
Преимущества |
Недостатки |
|
Эталонный метод для оценки фиброза |
Инвазивная процедура с возможными осложнениями в 0,57% случаев |
|
Подробная информация о гистопатологии печени |
Болевой синдром в 20% случаев |
|
Разработаны точные критерии для оценки тяжести фиброза |
Летальность от 0,009% до 0,12% |
|
Оценивается ограниченный участок органа (1/50000 ткани печени) |
|
|
Патоморфологическое заключение зависит от квалификации специалиста |
|
|
Высокая стоимость |
С учётом приведенных в таблице данных, выполнение биопсии каждому пациенту с НАЖБП нецелесообразно. В связи с этим неинвазивные методы должны использоваться в качестве первой линии диагностики, и их результаты следует принимать во внимание при определении показаний к биопсии печени. Золотого стандарта неинвазивной диагностики в настоящее время не существует. Большое количество неинвазивных методов стадирования фиброза печени предполагает применение различных подходов в зависимости от клинической ситуации и материальной оснащенности клиники [22-26]. Данные о возможностях и ограничениях этих методов суммированы в таблице 2.
Таблица 2 Преимущества и недостатки неинвазивных методов диагностики фиброза печени при НАЖБП
|
Преимущества |
Недостатки |
|
Отсутствие противопоказаний (для применения расчётных индексов) |
Некоторые маркеры не специфичны для печени (гиалуроновая кислота) |
|
Отсутствие опасных осложнений |
Используемые параметры могут изменяться под действием других факторов (билирубин, гаптоглобин, альфа-2 макроглобулин) |
|
Оценка фиброза происходит во всей печени, а не в отдельной его части |
В 14-58% случаев пациенты попадают в зону неопределенности («серую зону») |
|
Простые и удобные шкалы, некоторые основаны на рутинных лабораторных показателях |
Высокая стоимость отдельных методов |
|
Высокая специфичность и чувствительность при наличии выраженного фиброза и цирроза |
Снижение информативности при наличии асцита, выраженного ожирения (для эластографии) |
Наиболее достоверными неинвазивными методами для оценки фиброза печени у пациентов с НАЖБП являются: транзиторная эластография (TE), шкала фиброза при НАЖБП (NAFLD fibrosis score; NFS) и индекс фиброза-4 (FIB-4) со значением площади под ROC-кривой (area under the receiver operating characteristic curve; AUROC) 0.84-1.00, 0.82 и 0.86, соответственно [27, 28].
Транзиторная эластография – это быстрый, простой и безопасный метод, имеющий, однако, определенные ограничения. У пациентов с ожирением, асцитом, при венозном застое в печени, при портальной гипертензии точность метода падает. Кроме того, даже постпрандиальное увеличение давления в воротной вене может приводить к ложному повышению жесткости печени [22, 29]. Для пациентов с ожирением (индекс массы тела≥30) рекомендуется использование датчика размера XL, что позволяет повысить достоверность результатов [27, 30]. Транзиторная эластогра-фия является достаточно точным методом для исключения выраженного фиброза и цирроза печени. Чувствительность метода возрастает по мере увеличения стадии фиброза. Однако частота ложноположительных результатов сравнительно высока. Широкое применение эластографии также ограничено высокой стоимостью оборудования [31, 32].
Шкала фиброза при НАЖБП (NAFLD fibrosis score; NFS) – простой и дешевый метод, который включает такие параметры, как возраст, индекс массы тела, уровни АЛТ и АСТ, количество тромбоцитов, содержание альбумина в сыворотке крови и наличие нарушений углеводного обмена (сахарный диабет или нарушение гликемии натощак) [27, 33]. Данная шкала адаптирована для применения у широкого круга лиц и рекомендована для оценки фиброза у пациентов с НАЖБП в качестве первой линии диагностики [34]. Недостатком метода является то, что от 20 до 58% пациентов по результатам попадают в «серую зону», что требует проведения дополнительных диагностических мероприятий [35].
Еще одной шкалой, для которой характерна высокая чувствительность диагностики тяжелого фиброза и цирроза печени, является индекс FIB-4. Индекс фиброза FIB-4 рассчитывается на основании возраста, сывороточных уровней АЛТ и АСТ, а также количества тромбоцитов, что не представляет сложности для врача любой специальности [36].
Почти все неинвазивные шкалы включают уровень АЛТ, но изолированно показатель АЛТ нельзя использовать для оценки фиброза, так как он не коррелирует напрямую с тяжестью поражения печени. Напротив, у пациентов с выраженным фиброзом отмечается снижение сывороточной концентрации АЛТ [36].
Неинвазивные шкалы хорошо подходят для исключения тяжелого фиброза и цирроза печени, что даёт возможность реже прибегать к биопсии для подтверждения диагноза и оценки прогноза [37]. Последовательное применение различных неинвазивных методов позволяет повысить точность диагностики и уменьшить количество пациентов, которые попадают в «серую зону». В качестве первого метода рационально использовать NFS или FIB-4. В случае если пациент попадает в «серую зону», целесообразно дополнить обследование транзиторной эластографией [38].
Cуществуют и другие неинвазивные шкалы оценки фиброза печени, такие как BARD score, APRI, отношение АСТ к АЛТ и т. д. Однако их изучение на большом клиническом материале показало, что они значительно уступают вышеперечисленным методам по чувствительности и специфичности [38].
Следует особо отметить, что к настоящему моменту получены данные, подтверждающие самостоятельное прогностическое значение расчетных индексов фиброза печени. В крупном когортном исследовании было показано, что риск развития сахарного диабета у пациентов с НАЖБП, не имеющих исходных нарушений углеводного обмена, напрямую связан с исходным значением NFS [39]. По данным A. Gentili et al., значение NFS коррелирует с показателями поток-зависимой вазодилатации и толщины комплекса интима-медиа как доклиническими маркерами поражения сердечно-сосудистой системы [40], что потенциально открывает перспективы использования этого простого расчетного индекса в стратификации кардиоваскулярного риска. По данным американского мета-анализа 2017 года, шкала NFS является надежной альтернативой биопсии печени для прогнозирования риска смерти пациентов с НАЖБП [41]. Аналогичные результаты были получены и в исследованиях, включавших отдельные клинические группы. В частности, в работе А. Yoshihisa et al. было продемонстрировано, что шкала NFS обладает прогностическим значением в отношении риска смерти пациентов с хронической сердечной недостаточностью, имеющих сохраненную фракцию выброса [42]. Исследования прогностического потенциала индекса фиброза FIB-4 показали, что его высокие значения являются предиктором повышенного риска развития ХБП [43, 44].
Таким образом, с учетом высокой распространенности НАЖБП, возрастной структуры пациентов, характерной ко-морбидности и прогноза можно утверждать, что данное заболевание является социально значимым и требует комплексного подхода к диагностике и лечению. Большое количество исследований направлено на поиск методов оценки фиброза печени с высокой чувствительностью и специфичностью. Современные неинвазивные методы сочетают в себе информативность и безопасность, что позволяет рекомендовать их в качестве первой линии диагностики фиброза при НАЖБП. Нам представляется перспективным дальнейшее изучение взаимосвязи индексов фиброза печени с субклиническими нарушениями обмена веществ у пациентов с избыточной массой тела.
Список литературы Неалкогольная жировая болезнь печени: коморбидность, клиническое значение и методы диагностики фиброза печени
- EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease//J. Hepatol. 2016. Vol. 64. P. 1388-1402.
- Rinella M.E. Nonalcoholic fatty liver disease: a systematic review/JAMA. 2015. Vol. 313. P. 2263-2273.
- Vernon G., Baranova A., Younossi Z.M. Systematic review: the epidemiology and natural history of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis in adults//Aliment. Pharmacol. Ther. 2011. Vol. 34. P. 274-285.
- Диагностика и лечение неалкогольной жировой болезни печени: методические рекомендации для врачей/под ред. акад. В.Т. Ивашкина . URL: https://rsls.ru/files/Guidelines-RSLS-NASH-2016-01-03.pdf.
- Adejumo A., Alliu S., Ajayi T. O. et al. Cannabis use is associated with reduced prevalence of non-alcoholic fatty liver disease: A cross-sectional study//PLoS One. 2017. Vol. 12. e0176416.
- Ekstedt M., Hagström H., Nasr P. et al. Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up/Hepatology. 2015. Vol. 61. P. 1547-1554.
- Targher G., Day C. P., Bonora E. Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease/N. Engl. J. Med. 2010. Vol. 363. P. 1341-1350.
- Lee S.B., Park G.M., Lee J Y et al. Association between nonalcoholic fatty liver disease and subclinical coronary atherosclerosis: An observational cohort study/J. Hepatol. 2017. In press.
- Musso G., Gambino R., Tabibian J. H. et al. Association of Non-alcoholic Fatty Liver Disease with Chronic Kidney Disease: A Systematic Review and Meta-analysis/PLoS Med. 2014. Vol. 11. e1001680.
- Mikolasevic I., Racki S., Bubic I. et al. Chronic kidney disease and nonalcoholic Fatty liver disease proven by transient elastography//Kidney Blood Press. Res. 2013. Vol. 37. P. 305-310.
- Kim G.A., Lee H.C., Choe J. et al. Association between non-alcoholic fatty liver disease and cancer incidence rate//J. Hepatol. 2018. Vol. 68. P. 140-146.
- Pár A., Pár G. Non-alcoholic fatty liver disease and hepatocellular carcinoma //Orv. Hetil. 2016. Vol. 157. P. 987-994.
- Calzadilla Bertot L., Adams L. A. The Natural Course of Non-Alcoholic Fatty Liver Disease//Int. J. Mol. Sci. 2016. Vol. 17. E774.
- Lim H.-W., Bernstein D.E. Risk Factors for the Development of Nonalcoholic Fatty Liver Disease/Nonalcoholic Steatohepatitis, Including Genetics//Clin. Liv. Dis. 2018. Vol. 22. P. 39-57.
- Borrelli A., Bonelli P., Tuccillo F. M. Role of gut microbiota and oxidative stress in the propression of non-alcoholic fatty liver disease to hepatocarcinoma: Current and innovative therapeutic approaches//Redox Biol. 2018. Vol. 15. P. 467-479.
- Singh S., Allen A. M., Wang Z. et al. Fibrosis Progression in Nonalcoholic Fatty Liver vs Nonalcoholic Steatohepatitis: A Systematic Review and Meta-analysis of Paired-Biopsy Studies//Clin. Gastroenterol. Hepatol. 2015. Vol. 13. P. 643-654.
- Dulai P. S., Singh S., Patel J. et al. Increased risk of mortality by fibrosis stage in nonalcoholic fatty liver disease: Systematic review and meta-analysis//Hepatology. 2017. Vol. 65. P. 1557-1565.
- Hagström H., Nasr P., Ekstedt M. et al. Fibrosis stage but not NASH predicts mortality and time to development of severe liver disease in biopsy-proven NAFLD//J. Hepatol. 2017. Vol. 67. P. 1265-1273.
- Sesti G., Sciacqua A., Fiorentino T.V. et al. Association between noninvasive fibrosis markers and cardio-vascular organ damage among adults with hepatic steatosis//PLoS One. 2014. Vol. 9. e104941.
- Spengler E.K., Loomba R. Recommendations for Diagnosis, Referral for Liver Biopsy, and Treatment of Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis//Mayo Clin. Proc. 2015. Vol. 90. P. 1233-1246.
- Scott R., Guha I. N. Non-invasive monitoring of liver fibrosis//Br. Med. Bull. 2014. Vol. 112. P. 97-106.
- Almpanis Z. Evaluation of liver fibrosis: "Something old, something new…"//Ann. Gastroenterol. 2016. Vol. 29. 445-453.
- Sumida Y., Nakajima A., Itoh Y. Limitations of liver biopsy and non-invasive diagnostic tests for the diagnosis of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis//World J. Gastroenterol. 2014. Vol. 20. P. 475-485.
- Bedossa P., Patel K. Biopsy and Noninvasive Methods to Assess Progression of Nonalcoholic Fatty Liver Disease//Gastroenterology. 2016. Vol. 150. P. 1811-1822.
- Papastergiou V., Tsochatzis E., Burroughs A. K. Non-invasive assessment of liver fibrosis//Ann. Gastroenterol. 2012. Vol. 25. P. 218.
- Karim M. F, Al-Mahtab M, Rahman S. et al. Non-alcoholic Fatty Liver Disease (NAFLD) -A Review//Mymensingh Med. J. 2015. Vol. 24. P. 873-880.
- Festi D., Schiumerini R., Marzi L. et al. Review article: the diagnosis of non-alcoholic fatty liver disease -availability and accuracy of non-invasive methods//Alim. Pharmacol. Ther. 2013. Vol. 37. P. 392-400.
- Kim D., Kim W. R., Talwalkar J. A. et al. Advanced fibrosis in nonalcoholic fatty liver disease: noninvasive assessment with MR elastography//Radiology. 2013. Vol. 268. P. 411-419.
- Myers R. P., Pomier-Layrargues G., Kirsch R. et al. Discordance in fibrosis staging between liver biopsy and transient elastography using the FibroScan XL probe//J. Hepatol. 2012. Vol. 56. P. 564-570.
- Mikolasevic I., Orlic L., Franjic N. et al. Transient elastography (FibroScan(®)) with controlled attenuation parameter in the assessment of liver steatosis and fibrosis in patients with nonalcoholic fatty liver disease -Where do we stand//World J. of Gastroenterol. 2016. Vol. 22. P. 7236-7251.
- Hashemi S.-A., Alavian S.-M., Gholami-Fesharaki M. Assessment of transient elastography (FibroScan) for diagnosis of fibrosis in non-alcoholic fatty liver disease: A systematic review and meta-analysis//Casp. J. Intern. Med. 2016. Vol. 7. P. 242-252.
- Abenavoli L., Beaugrand M. Transient elastography in non-alcoholic fatty liver disease//Ann. Hepatol. 2012. Vol. 11. P. 172-178.
- Angulo P., Hui J. M., Marchesini G. et al. The NAFLD fibrosis score: A noninvasive system that identifies liver fibrosis in patients with NAFLD//Hepatology. 2007. Vol. 45. P. 846-854.
- Angulo P., Bugianesi E., Bjornsson E. S. et al. Simple noninvasive systems predict long-term outcomes of patients with nonalcoholic fatty liver disease//Gastroenterology. 2013. Vol. 145. P. 782-789.
- Musso G., Gambino R., Cassader M. et al. Meta-analysis: Natural history of non-alcoholic fatty liver disease (NAFLD) and diagnostic accuracy of non-invasive tests for liver disease severity/Ann. Med. 2011. Vol. 43. P. 617-649.
- McPherson S., Stewart S. F., Henderson E. et al. Simple non-invasive fibrosis scoring systems can reliably exclude advanced fibrosis in patients with non-alcoholic fatty liver disease//Gut. 2010. Vol. 59. P. 1265-1269.
- Castera L. Noninvasive Evaluation of Nonalcoholic Fatty Liver Disease//Semin. Liver Dis. 2015. Vol. 35. P. 291-303.
- Petta S., Wong V.W., Cammà C. et al. Serial combination of non-invasive tools improves the diagnostic accuracy of severe liver fibrosis in patients with NAFLD//Alim. Pharmacol. Ther. 2017. Vol. 46. P. 617-627.
- Chang Y., Jung H. S., Yun K. E. et al. Cohort study of non-alcoholic fatty liver disease, NAFLD fibrosis score, and the risk of incident diabetes in a Korean population//Am. J. Gastroenterol. 2013. Vol. 108. P. 1861-1868.
- Gentili A., Daviddi G., De Vuono S. et al. Non-alcoholic fatty liver disease fibrosis score and preclinical vascular damage in morbidly obese patients//Dig. Liver Dis. 2016. Vol. 48. P. 904-908.
- Jaruvongvanich V., Wijarnpreecha К., Ungprasert P. The utility of NAFLD fibrosis score for prediction of mortality among patients with nonalcoholic fatty liver disease: A systematic review and meta-analysis of cohort study//Clin. Res. Hepatol. Gastroenterol. 2017. Vol. 41. P. 629-634.
- Yoshihisa A., Sato Y., Yokokawa T. et al. Liver fibrosis score predicts mortality in heart failure patients with preserved ejection fraction//ESC Heart Fail. 2017. In press DOI: 10.1002/ehf2.12222
- Wijarnpreecha K., Thongprayoon C., Scribani M. et al. Noninvasive fibrosis markers and chronic kidney disease among adults with nonalcoholic fatty liver in USA//Eur. J. Gastroenterol. Hepatol. 2017. In press DOI: 10.1097/MEG.0000000000001045
- Xu H. W, Hsu Y. C, Chang C. H. et al. High FIB-4 index as an independent risk factor of prevalent chronic kidney disease in patients with nonalcoholic fatty liver disease//Hepatol. Int. 2016. Vol. 10. P. 340-34.


