Нефронсберегающие операции в хирургическом лечении ретроперитонеальных сарком
Автор: Рябов А.Б., Чайка А.В., Хомяков В.М., Александров О.А., Кострыгин А.К., Соболев Д.Д., Погосян Г.С., Арзуманов С.В., Воробьев Н.В., Черемисов В.В., Уткина А.Б., Аксенов С.А., Макурина М.П., Салимзянов К.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.23, 2024 года.
Бесплатный доступ
Цель исследования - уточнение показаний к применению нефронсберегающих технологий при хирургическом лечении больных с ретроперитонеальными саркомами. Материал и методы. В исследование включены 64 пациента с первичными ретроперитонеальными саркомами с вовлечением почки и структур почечной ножки, проходивших хирургическое лечение в торакоабдоминальном отделении МНИОИ им. П.А. Герцена (2010-2021). Нефрэктомии выполнены у 21 больного, у 43 больных применены нефронсберегающие технологии. Изучен морфологический профиль сарком, половозрастной состав, возможности нефронсберегающих технологий, частота послеоперационных осложнений в обеих группах, а также отдаленные результаты лечения, в том числе в зависимости от различных факторов. С этой целью проведен многофакторный анализ.
Неорганные забрюшинные опухоли, ретроперитонеальные саркомы, нефронсберегающие операции, липосаркома
Короткий адрес: https://sciup.org/140307087
IDR: 140307087 | УДК: 617.553+616-006.3.04+616.61]-089 | DOI: 10.21294/1814-4861-2024-23-4-32-44
Текст научной статьи Нефронсберегающие операции в хирургическом лечении ретроперитонеальных сарком
В настоящее время хирургическое лечение ретроперитонеальных сарком (РПС) является активно изучаемой темой. Неорганные забрюшинные опухоли (НЗО) являются достаточно редкой патологией и составляют менее 1 % всех злокачественных опухолей [1, 2]. Из-за относительно медленного роста и длительного отсутствия симптомов чаще всего выявляются РПС больших размеров. Данные новообразования представляют собой гистологически гетерогенную группу опухолей, включающую около 140 гистологических подтипов [1, 3], частота местных рецидивов и метастазирования РПС после хирургического лечения зависит от морфологического строения опухоли. Липосаркомы составляют около 60 % всех РПС, могут возникать везде, где присутствует жировая ткань, 12–40 % липосарком исходит из забрюшинного пространства и 35 % приходится на паранефральную жировую клетчатку. Второй по распространенности гистологический вариант – лейомиосаркомы (16 %), они подразделяются на опухоли, исходящие из тканей нижней полой вены (НПВ), и опухоли, не исходящие из НПВ, характеризуются как выраженным местнораспространенным ростом, в том числе с истинной инвазией в стенку органов и сосудов [4], так и высокой частотой отдаленного метастазирования. Плеоморфная саркома (ранее известная как злокачественная фиброзная гистиоцитома) составляет 5 % всех РПС. Образования, исходящие из клеток нервной ткани (невриномы, ганглионевромы, параганглиомы различной степени злокачественности и другие), составляют примерно 4 % всех (НЗО) [1, 3].
Хирургическое удаление НЗО в настоящее время является безальтернативным методом лечения больных с РПС как радикального характера, так и циторедуктивного, при отсутствии возможности радикально удалить опухоль. В литературе идет дискуссия по поводу необходимости компартмен-тального удаления РПС, с обязательным удалением органов (почка, отдел ободочной кишки и т.д.), входящих в определенные компартменты, из которых исходит опухоль, даже если эти органы непосредственно не вовлечены в опухолевый процесс [5, 6]. Циторедуктивное удаление РПС применяется в основном при большой распространенности опухоли и невозможности удаления без существенного анатомического дефекта, не совместимого с приемлемым функционированием организма. Массивные РПС с вовлечением более одного компартмента зачастую возможно удалить только путем фрагментирования.
Ряд авторов убежден в необходимости сбалансированного подхода к хирургическому лечению резектабельных РПС, заключающегося в одновременном моноблочном удалении опухоли, но с сохранением органов и структур, не вовлеченных непосредственно в опухолевый процесс, посредством прецизионного их выделения. В нашем исследовании применяется именно этот сбалансированный подход, заключающийся в одновременном стремлении к моноблочному удалению опухоли с максимально возможным сохранением органов и структур. В частности, нефронсберегающие операции подразумевают полное удаление опухоли с паранефральной клетчаткой с прецизионным выделением и сохранением почки, элементов ворот почки и мочеточника. При необходимости возможно выполнение резекции структур почечной ножки с последующим их вос- становлением, а также проведение аутотрансплантации почки с удалением остаточной опухолевой ткани ex vivo и последующей реплантацией органа и ангиопластикой [7–9].
Цель исследования – уточнение показаний к применению нефронсберегающих технологий при хирургическом лечении больных с ретроперитонеальными саркомами.
Материал и методы
В торакоабдоминальном отделении МНИОИ им. П.А. Герцена в 2010–2021 гг. по поводу НЗО хирургическое лечение получили 196 больных; в общей сложности им проведено 224 операции, включая повторные вмешательства при рецидивах заболевания. С резекцией (или удалением) одного и более органов выполнено 143 операции. Всего при первичных РПС (n=110) вовлечение в том или ином виде паренхимы почки и структур почечной ножки, мочеточника отмечалось у 64 (58,18 %) пациентов. Нефрэктомии выполнены у 21 больного, у 43 применены нефронсберегающие технологии.
При представлении материалов, методов и результатов исследования количественные показатели даны в виде средних арифметических величин (M) ± стандартное отклонение (SD). При сравнении средних величин в нормально распределенных совокупностях количественных данных применялся t-критерий Стьюдента. Для сравнения независимых совокупностей в случаях отсутствия признаков нормального распределения данных использовался U-критерий Манна–Уитни. Сравнение номинальных данных проводилось при помощи критерия χ2 Пирсона. Различия показателей считались статистически значимыми при p<0,05. Оценка функции выживаемости пациентов проводилась по методу Каплана–Мейера. Прогностическая модель, характеризующая зависимость количественной переменной от факторов, разрабатывалась с помощью метода линейной регрессии. Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Microsoft Office Excel 2016. Статистический анализ проводился с использованием программы IBM SPSS Statistics v.26 (разработчик – IBM Corporation).
В группе пациентов с вовлечением почки или ее структур половозрастной состав не имел существенных различий, средний возраст составил 63,14 года. Морфологические типы удаленных опухолей составляли традиционную картину: большинство (около 60 %) – различные варианты липосарком, меньшая доля (около 17,2 %) – лейо-
Таблица 1/Table 1
Клинико-морфологические характеристики пациентов с первичными РПС с вовлечением почки либо почечных структур
Clinical and morphological characteristics of patients in the group with primary retroperitoneal sarcomas with invasion of renal structures
|
Параметры/Parameteres |
Вся группа/ Whole group (n=64) |
Нефрэктомии/ Nephrectomy (n=21) |
Нефронсберегающие операции/ Nepfron-sparing (n=43) |
|
Муж/Жен/Male/Female |
26/38 |
7/14 |
19/24 |
|
Средний возраст (min-max), лет/ Median age (min-max), years |
57,56 ± 12,6 (31–80) |
61,14 ± 9,38 (48–80) |
55,32 ± 13,45 (31–77) |
|
Гистологический тип/Histology type |
|||
|
Липосаркомы/Liposarcoma |
38 (~60 %) |
16 (76 %) |
22 (51,1 %) |
|
Лейомиосаркома/Leiomyosarcoma |
11 (17,2 %) |
2 (9,5 %) |
9 (20,9 %) |
|
Опухоли периферических нервов, оболочек нервов, нейрогенного происхождения/ Malignant peripheral nerve sheath tumor |
9 (14,0 %) |
2 (9,5 %) |
7 (16,3 %) |
|
Десмоидные фибромы/Desmoid tumors |
1 (1,5 %) |
0 (0 %) |
1 (2,3 %) |
|
Плеоморфная саркома (Злокачественная фиброзная гистиоцитома)/ Malignant fibrous histiocytoma |
4 (6,2 %) |
0 (0 %) |
4 (9,3 %) |
|
Гемангиоперицитома/Hemangiopericytoma |
1 (1,5 %) |
1 (4,7 %) |
0 (0 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
миосаркомы, 14,0 % – опухоли периферической нервной системы и др. (табл. 1).
Следует отметить, что в нашем исследовании нефрэктомия выполнялась не по принципиальным показаниям, когда почка удаляется в составе компартмента, независимо от того, вовлечен орган, его структуры или сосуды в опухолевый процесс или нет, в чем, собственно, и заключается максимально радикальный подход хирургии ретроперитонеальных сарком. Мы придерживаемся органосохраняющей тактики, и нефрэктомия выполнялась только при вовлечении в опухолевый процесс почки либо ее структур (мочеточника, сосудов ворот почки), когда их невозможно было сохранить либо отсутствовала функция почки, и ее атрофии при длительно существующем блоке мочеточника и/или сосудистых структур. В ряде случаев на предоперационном этапе отмечалось резкое нарушение функции вовлеченной почки из-за обструкции мочевых путей, но освобождение этих структур из опухолевых масс позволило восстановить выделительную функцию почки при условии отсутствия ее атрофии. Кроме того, у 1 пациента с нефрэктомией в анамнезе по поводу рака почки применение нефронсберегающей технологии оказалось жизненной необходимостью в связи с тем, что другая почка была удалена ранее по поводу другой патологии. По нашему мнению, применение нефронсберегающих технологий оправдано, так как риск развития рецидива заболевания высокий, как правило, независимо от радикальности операции, и в дальнейшем пациенту, возможно, будет необходимо проводить и повторные операции, и системную химиотерапию, а в случае выполнения циторедуктивной операции (R2) выполнение нефрэктомии нецелесообразно.
В группе нефронсберегающих технологий (n=43) у 29 больных проводилось прецизионное выделение почки, мочеточника и сосудистых структур почки из опухолевых узлов, не нарушая при этом целостности капсулы опухоли. Стентирование мочеточника на дооперационном этапе или во время операции выполнено в 10 наблюдениях. Стентирование на дооперационном этапе выполнялось при цистоскопии, его целью была лучшая визуализация мочеточника в опухолевом или спаечном процессе, однако в ряде случаев при выраженном стенозе и извитости хода мочеточника в плотных опухолевых массах стентирование мочеточника на дооперационном этапе может быть опасным из-за риска перфорации. Интраоперационное стентирование производилось, как правило, при необходимости резекции мочеточника и формировании анастомозов органов мочевыделительной системы. В других случаях катетеризация имела целью не только визуализировать, но и создать каркас для мочеточника, поскольку зачастую по мере роста опухоли мочеточник растягивается и удлиняется, стенки его становятся тонкими и более подверженными микроциркуляторным нарушениям с возможным очаговым некрозом стенки. Стентирование мочеточника предупреждает обструкцию мочевых путей вследствие его перегиба в послеоперационном периоде.
Резекция почки при инвазии в паренхиму выполнена 3 больным, у 2 пациентов в виде частичной
Òàблицà 2/Table 2
Пðимåнåниå нåфðîнñбåðåгàющиõ тåõнîлîгиé Nephron-sparing technologies
Варианты нефронсберегающих технологий/ Nephron-sparing technologies
Количество выполненных хирургических приемов/ Number of surgical procedures
Прецизионное выделение почки, мочеточника и сосудистых структур почки из опухолевых узлов/
Precision mobilization of the kidney, ureter and vascular structures of the kidney from tumor tissue
Резекция почки/Partial Nephrectomy
Резекция НПВ и/или устьев почечных вен с ангиопластикой/ Resection of V. cava inferior and/or renal veins’ resection with angioplasty
Аутотрансплантация почки/Kidney autotransplantation
Варианты с резекцией мочеточника/ов с формированием уретеро-уретероанастомозов, уретеро-пиелоанастомоза, уретеро-цистоанастомоза, уретерокутанеостомия/ Options with resection of the ureter with the uretero-ureteroanastomosis, uretero-pyeloanasto-mosis, uretero-cystoanastomosis, ureterocutaneostomy
Примечание: таблица составлена авторами.
Note: created by the authors.
Всего/Total
или полной декапсуляции, у одного – в виде резекции паренхимы. При плановом морфологическом исследовании операционного препарата отмечалось истинное врастание опухоли в капсулу почки, опухоль имела строение лейомиосаркомы.
При вовлечении мочеточников на разных уровнях, не позволяющем выделить их из опухолевых масс, применялись различные варианты резекции мочеточников с формированием уретеро-уретероанастомозов, уретеро-пиелоанастомоза, уретеро-цистоанастомоза, уретерокутанеостомии. Операции этого типа выполнены у 7 больных. При формировании анастомозов стентирование мочеточника проводится в обязательном порядке для предотвращения стриктуры соустья. Резекция нижней полой вены и устьев почечных вен с последующей ангиопластикой проведена у 2 больных; еще 2 пациентам выполнено удаление РПС больших размеров с последующим экстракорпоральным удалением опухолевых масс и жировой клетчатки, окружающей орган, и аутотрансплантацией почки (табл. 2).
Результаты
Частота послеоперационных осложнений в группе нефрэктомий и нефронсберегающих операций – 17 (26,5 %): в группе нефрэктомий – 19,0 % (4 пациента, типы II, IIIB, IV и V по Clavien–Dindo), в группе нефронсберегающих операций – 30,2 % (13 пациентов: типы II – 8, IIIA – 1, IIIB – 3, IV – 1); летальных исходов не было (табл. 3).
На момент исследования прослеженность отдаленных результатов составила 97 %. Средняя продолжительность безрецидивного периода во всей группе из 64 пациентов с РПС с вовлечением почки и ее структур составила 31,2 мес (медиана –
24 мес). При последующем наблюдении в сроки от 3 до 84 мес диагностирован 31 (48,4 %) рецидив у 64 больных. Одногодичная безрецидивная выживаемость составила 70,0 %, 3-летняя – 50 %, 5-летняя – 40 %. При статистическом анализе подгрупп с нефрэктомией и нефронсберегающих операций разница в безрецидивной выживаемости статистически недостоверна (рис. 1). Таким образом, применение нефронсберегающих технологий не влияет на безрецидивный период после хирургического лечения пациентов с вовлечением в опухолевый процесс почки и ее структур.
Многие исследования показали, что частота рецидивов РПС зависит, прежде всего, от морфологического строения опухоли и ее биологической
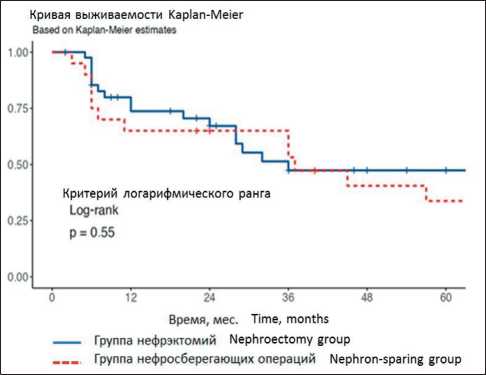
Рис. 1. Сравнительная безрецидивная выживаемость в группах нефрэктомий и нефронсберегающих технологий (р=0,55). Примечание: график выполнен авторами
Fig. 1. Comparative disease-free survival in the groups of nephrectomy and nephron-sparing surgery (р=0.55). Note: created by the authors
Таблица 3/Table 3
Послеоперационные осложнения
Postoperative complications
Категория послеоперационных осложнений по Clavien–Dindo/ Clavien–Dindo’s grades
Нефрэктомии/
Nephrectomy (n=21)
Нефронсберегающие операции/ Nepfron-sparing (n=43)
II
IIIA
IIIB
IV
V
8 (пневмонии, послеоперационные гематома, купировавшиеся
консервативно, неврологические нарушения терапевтического
спектра)/
8 (pneumonia, postsurgical hematoma, relieved by conservative treat-
ment, neurological disorders of the therapeutic spectrum associated)
1 (послеоперационный панкреатит, очаговый панкреонекроз, дренирование под местной анестезией под УЗИ-навигацией)/
1 (postoperative pancreatitis, focal pancreatic necrosis, minimally invasive drainage with ultrasound navigation under local anesthesia)
1 (двухсторонняя
пневмония)/
1 (bilateral pneumonia)
3 (2 – деструктивный панкреатит, очаговый панкреонекроз:
1 – осложнившийся кишечным свищем, 1 – аррозивным кровоте чением; 1 – тромбоз артериального анастомоза бедренной артерии, 1 (внутрибрюшное кровотечение, релапарото-
потребовавший ампутации нижней конечности)/
3 (2 – destructive pancreatitis; focal pancreatic necrosis: 1 – with intestinal fistula complication, 1 - with arrosive bleeding; 1 - arterial anastomosis’ thrombosis of femoral artery, requiring lower extremity
мия)/
1 (intra-abdominal bleeding, relaparotomy)
amputation)
1 (острое нарушение мозгового кровообращения, сопровождавшееся эпилептиформным приступом)/
1 (acute cerebrovascular accident accompanied by an epileptiform attack)
1 (острый инфаркт миокарда, переведена в кардиологический стационар)/ 1 (acute myocardial infarction, transported to a cardiology hospital)
1 (несостоятельность желудочного анастомоза, перфорация кишки, перитонит, полиорганная недостаточность)/
1 (gastric anastomosis leakage, intestinal perforation, peritonitis, multiple organ failure syndrome)
Примечание: таблица составлена авторами.
Note: created by the authors.
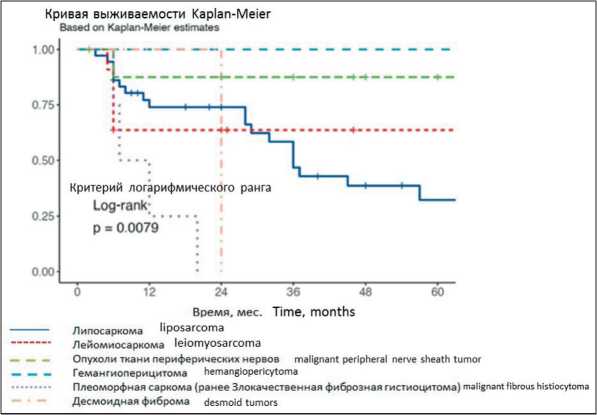
Рис. 2. Безрецидивная выживаемость в зависимости от гистологического строения опухоли. Примечание: график выполнен авторами Fig. 2. Recurrence-free survival depending on the tumor histology.
Note: created by the authors
агрессивности. В нашем исследовании при анализе влияния гистологического типа опухоли на безре-цидивную выживаемость выявлены значимые различия (р=0,0079): самый короткий безрецидивный период наблюдался у больных с плеоморфными саркомами (ранее известна как злокачественная фиброзная гистиоцитома) и липосаркомами (ввиду небольшой численности групп выявление зависимости от степени дифференцировки не представляется статистически достоверным) (рис. 2).
Ряд авторов выявил, что частота рецидивов достоверно выше при непосредственном вовлечении в опухолевый процесс одного или нескольких органов [3, 7, 8]. Наша выборка сравнительно
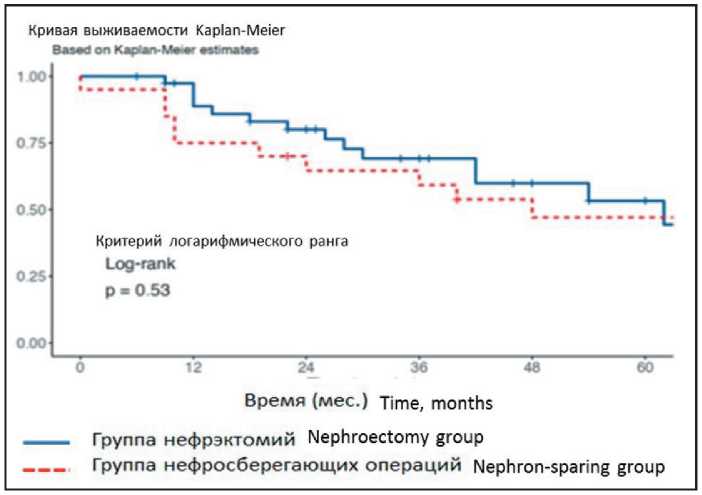
Рис. 3. Сравнительная общая выживаемость в группах нефрэктомий и нефронсберегающих технологий (р=0,53). Примечание: график выполнен авторами
Fig. 3. Comparative overall survival in the groups of nephrectomy and nephron-sparing surgery (р=0.53). Note: created by the authors небольшая, и достоверно оценить зависимость частоты рецидивов от тех или иных причин объективно не представляется возможным, поскольку РПС достаточно разнородны по морфологическим характеристикам, распространенности процесса, объему хирургического вмешательства и т.д.
Общая средняя продолжительность жизни после лечения во всей группе (n=64) составила 39,1 мес, медиана – 32 мес. На момент исследования живы 36 пациентов (из 62 прослеженных), умерло 23 (36 %) больных в сроки от 0 до 96 мес. Одногодичная выживаемость во всей группе составила 84,1 %, 3-летняя – 65,9 %, 5-летняя – 51,4 %. При статистическом анализе подгрупп нефрэктомий и нефронсберегающих операций разница в общей выживаемости статистически недостоверна (рис. 3). При анализе влияния гистологического типа опухоли на безрецидивную выживаемость выявлены значимые различия (р=0,0083): самая большая продолжительность выявлена у больных с липосаркомами и опухолями из оболочек периферических нервов, а наиболее неблагоприятный прогноз имели больные с лейомиосаркомами и плеоморфными саркомами (рис. 4). Опухоль, имеющая строение гемангиоперицитомы, наблюдалась у 1 больного, пациент жив в настоящее время без признаков рецидива опухоли.
При анализе факторов риска неблагоприятного исхода выявлена достоверная связь с возрастом (HR 1,05, 95 % CI [1,01, 1,08], p=0,009). Пороговое значение составило 64 года. У больных старше этого возраста значимо повышается смертность в ходе динамического наблюдения после хирургического лечения первичной РПС, связанная как с рецидивом процесса, так и наличием сопутствующей патологии. При мультифакторном анализе факторов, влияющих на общую выживаемость, также выявлена связь между показателями возраста (р=0,026), гистологическим строением (плеоморфная саркома (злокачественная фиброзная гистиоцитома), р=0,005). Также отмечена тенденция к уменьшению выживаемости у больных с лейомиосаркомой (р=0,066) (табл. 4).
Нефронсберегающие операции при рецидивах (n=23) выполнялись при следующих ситуациях: как органосохраняющие операции при радикальном удалении рецидивной опухоли (n=5); в случае, если одна почка была уже удалена при предыдущих вмешательствах (у 16 из 23 пациентов – нефрэктомия во время первой операции, еще у 10 – при последующих рецидивах); при операциях циторедуктивного характера с целью улучшения качества жизни после заведомо нерадикальной операции, в том числе с возможным последующим проведением системной химиотерапии (n=2). Нефрэктомия при рецидивах НЗО выполнялась в общей сложности у 26 больных с рецидивами НЗО (вне зависимости от того, какой по счету был рецидив).
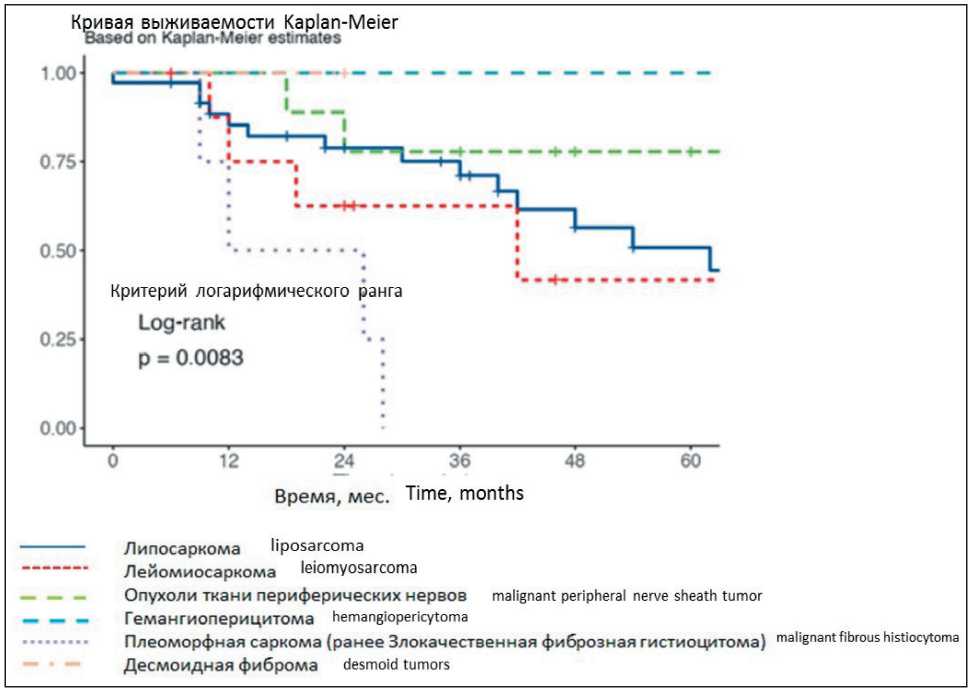
Рис. 4. Общая выживаемость в зависимости от гистологического строения опухоли. Примечание: график выполнен авторами
Fig. 4. Overall survival depending on the tumor histology.
Note: created by the authors
Таблица 4/Table 4
Мультифакторный анализ предикторов неблагоприятного прогноза хирургического лечения РПС с вовлечением почки и ее структур
Multifactor analysis of poor prognosis predictors in surgical treatment of retroperitoneal sarcomas involving the kidney and its structures
|
Число больных/ |
HR (монофакторный)/ |
HR (мультифакторный)/ |
|
|
Показатель/Categories |
Number of patients |
HR (monofactor analysis) |
HR (multifactor analysis) |
|
Осложнения/ |
Нет/No |
47 (75,8 %) |
– |
– |
|
Complications |
Да/Yes |
15 (24,2 %) |
1,05 (0,42–2,65, p=0,909) |
1,63 (0,57–4,69, p=0,363) |
|
Нефронсберега-ющая операция/ Nephron-sparing surgery |
Да/Yes |
42 (67,7 %) |
– |
– |
|
Нет (нефрэктомии)/ No (total nephrectomies) |
20 (32,3 %) |
1,28 (0,59–2,81, p=0,534) |
2,07 (0,76–5,60, p=0,154) |
|
|
Пол/Gender |
Жен/Female |
36 (58,1 %) |
– |
– |
|
Муж/Male |
26 (41,9 %) |
1,16 (0,54–2,53, p=0,700) |
1,45 (0,62–3,43, p=0,394) |
|
|
Липосаркома/Liposarcoma, |
36 (58,1 %) |
– |
– |
|
|
Лейомиосаркома/ Leiomyosarcoma |
11 (17,7 %) |
1,35 (0,45–4,08, p=0,595) |
3,46 (0,92–12,98, p=0,066 ) |
|
|
Гистология/ Histology |
Периферические нервы/ Malignant peripheral nerve sheath tumor |
9 (14,5 %) |
0,33 (0,08–1,45, p=0,142) |
0,63 (0,13–2,99, p=0,563) |
|
Гемангиоперицитома/ Gemangiopericytoma |
1 (1,6 %) |
0,00 (0,00–Inf, p=0,998) |
0,00 (0,00–Inf, p=0,998) |
|
|
Злокачественная гистоцитома/ Malignant fibrous histiocytoma |
4 (6,5 %) |
5,16 (1,60–16,60, p=0,006) |
7,58 (1,86–31,00, p=0,005 ) |
|
|
Десмоид/Desmoid tumors |
1 (1,6 %) |
0,00 (0,00–Inf, p=0,999) |
0,00 (0,00–Inf, p=0,999) |
Возраст/Age Среднее (SD)/Average 57,5 (12,7) 1,05 (1,01–1,08, p=0,009) 1,04 (1,00–1,08, p=0,026 )
Примечание: таблица составлена авторами.
Note: created by the authors.
Обсуждение
В современной литературе нет единого мнения относительно целесообразности применения не-фронсберегающих технологий. Ряд авторов обосновывает нефронсберегающий подход тем, что у большинства пациентов нефрэктомия выполняется без истинной инвазии опухоли в почку. P. Russo et al. (1997) [7] на материале 75 пациентов из 371 с РПС, которым была произведена нефрэктомия при удалении основной опухоли, продемонстрировали, что инвазия почечной капсулы была у 15 % пациентов, инвазия в почечную паренхиму – у 9 %, инвазия в почечную вену – у 3 %. У большинства пациентов (73 %) прямая почечная инвазия отсутствовала.
По данным N. Ikoma et al. (2018) [8], из 83 пациентов, включенных в исследование, 76 (92 %) больных подверглись радикальному удалению опухоли (R0/R1), резекции смежных органов выполнены в 38 (46 %) случаях, при этом инвазия резецированного органа/органов наблюдалась у 6 (7 %) пациентов. Расчетная общая выживаемость составила 11,3 года (5-летняя выживаемость – 86 %), безрецидивная выживаемость – 5,4 года (5-летняя безрецидивная выживаемость – 51 %).
При многофакторном анализе установлено, что резекция смежного органа не связана с улучшением общей выживаемости (ОВ) (р=0,428) или безрецидивной выживаемости (БВ) (р=0,946), а ее отсутствие связано с меньшим риском послеоперационных осложнений (р=0,01). Исследование показало отсутствие преимущества по безрецидивной и общей выживаемости при мультиорганных резекциях у больных с высокодифференцированными липосаркомами при отсутствии истинной инвазии опухоли. В этом случае авторы рекомендуют проведение органосохраняющих операций.
Ряд авторов выступает против нефрэктомии из-за потенциального долгосрочного риска хронического заболевания почек (ХБП), требующего в дальнейшем диализа и ограничений при назначении системной химиотерапии. Имеются сообщения об изменениях функции почек после нефрэктомии, выполненной по разным причинам, в том числе при РПС. C. Cho et al. (2017) [9] в сравнительном исследовании, включавшем 114 пациентов, одновременно анализировали онкологические результаты и функцию оставшейся почки после нефрэктомии единым блоком по поводу РПС (n=65) по сравнению с резекцией без нефрэктомии
(n=49). Авторы при исследовании скорости клубочковой фильтрации (СКФ) в различные сроки до и после операции оценивали степень компенсации функции оставшейся почки. В течение периода наблюдения, равного 29 мес, медиана послеоперационной СКФ в группе нефрэктомии снизилась до 73,5 % относительно дооперационной СКФ. У 38 (58 %) пациентов наблюдалось прогрессирование стадии ХБП после нефрэктомии, но ни у одного пациента она не перешла в терминальную стадию почечной недостаточности. В то же время у пациентов после нефрэктомии отмечались значимые преимущества локального контроля по сравнению с группой без нефрэктомии (р=0,048).
W.W. Tseng et al. (2014) [10] на материале 247 пациентов с первичными или рецидивирующими ретроперитонеальными липосаркомами показали, что у 34 % пациентов заболевание носило мультифокальный характер роста. Среди пациентов с первичным монофокальным ростом опухоли у 57 % заболевание прогрессировало до многоочагового локорегионарного заболевания с последующим рецидивом после хирургического лечения, в том числе у 11 % – с новыми опухолями вне исходного поля резекции. Мультифакторный анализ показал, что никакая клинико-патологическая или связанная с лечением переменная, включая гистотип опухоли и объем операции, не являлась предиктором дальнейшего мультифокального или «внепольного» прогрессирования.
Напротив, другие исследователи демонстрируют лучшие результаты хирургического лечения РПС с удалением почки. J. Phu et al. [11] изучили эффективность хирургического лечения больных с РПС, исходящими преимущественно из околопочечной клетчатки. Авторы утверждают, что резекция смежных органов безопасна и улучшает локорегионарный контроль. Исследование включало 79 пациентов, у 68 – операция выполнялась с нефрэктомией, из них 33 больным проведено сочетанное удаление или резекция другого органа помимо почки. У 11 больных удаление РПС проведено без нефрэктомии, при этом 2 больным операция выполнена с резекцией другого органа. При инвазии опухоли в другие органы, кроме почки, безрецидивная выживаемость была значимо ниже, чем при отсутствии таковой, вне зависимости от того, выполнялась нефрэктомия или нет. Удаление забрюшинной опухоли с нефрэктомией значимо улучшало локальный контроль по сравнению с группой без нефрэктомии, независимо от того, выявлялась ли инвазия в почку и ее структуры или нет, в тех случаях, когда не было инвазии в другие соседние органы и структуры [11]. Авторы также делают вывод, что нефрэктомия при НЗО, которые зачастую исходят из периренальной клетчатки, является положительным прогностическим фактором даже в том случае, если истинной инвазии почки нет.
По данным K. Karadayi et al. [12], 5-летняя выживаемость для высокодифференцированных подтипов составляет 90 %, для дедифференци-рованных – 75 %, для миксоидных/круглоклеточ-ных липосарком – 60–90 %, для плеоморфных – 30–50 %. Очевидно также, что смертность от ретроперитонеальных липосарком является результатом локального рецидива вследствие неполной резекции опухолевой массы из-за сложности дифференциации липосаркомы от прилегающей нормальной жировой ткани и отсутствия анатомически выраженной сосудисто-лимфатической ножки опухоли. Это затрудняет радикальное удаление опухоли в пределах здоровых тканей без резекции органов и структур, прилегающих к опухоли [13], и липосаркомы, наиболее склонные к инвазивному характеру роста, более требовательны к моноблочной (компартментальной) хирургии [12, 14].
В 2003 г. S. Singer et al. [14] показали, что наличие среди липосарком низкодифференцированного и дедифференцированного вариантов, а также вовлечение смежных с опухолью органов связаны с повышенным риском местного рецидива и ухудшением отдаленных результатов. У 68 (38 %) из 177 больных с ретроперитонеальными липосаркомами была выполнена нефрэктомия. Липосаркомы, особенно высокодифференцированные, как правило, не имели истинной инвазии в почечную паренхиму, в этих случаях подход заключался в удалении наружной капсулы почки для достижения «чистого» хирургического края. В случаях циркулярного вовлечения ворот почки в опухолевый процесс обычно выполнялась нефрэктомия. Опираясь на данные многофакторного анализа, авторы делают вывод, что для достижения радикализма операции может потребоваться выполнение нефрэктомии, но она не оказывает заметного влияния на общую выживаемость [14].
Данная тема исследовании получила продолжение в работе S. Bonvalot et al. (2009) [15]. Авторы изучили прогностические факторы, влияющие на безрецидивную и общую выживаемость при РПС всех гистотипов в группе, состоявшей из 382 пациентов. Мультифакторный анализ показателей, ассоциированных с локальным контролем после удаления РПС, продемонстрировал положительное влияние низкой степени злокачественности, отсутствия разрыва опухоли, «чистого» хирургического края, а также компартментальной хирургии по сравнению со стандартным объемом операции. Агрессивный рост с инвазией прилежащих органов, высокая степень злокачественности опухоли, нарушение целостности капсулы, макроскопически остаточная ткань опухоли и положительный край резекции являются негативными прогностическими факторами.
Таким образом, нет единого мнения относительно целесообразности компартментального подхода к хирургическому лечению РПС, многие исследователи рекомендуют дифференцированный подход, обосновывая необходимость сохранения не вовлеченного в опухолевый процесс органа. Нефронсберегающая тактика представляется важной, если принимать во внимание, что развитие в последующем острого повреждения почек и/или наличие хронической болезни почек увеличивает риск смертности у онкологических пациентов от неонкологических причин. Сохранение массы функционирующих нефронов позволяет увеличить ожидаемую продолжительность жизни пациентов, а также не иметь ограничений при адъювантной терапии. Все вышеперечисленные факты побуждают выработать показания к применению нефронсбе-регающих технологий, используя индивидуальный подход. Благодаря совершенствованию хирургической техники, внедрению в практику различных современных инструментов и технологий и применению физических факторов воздействия на биологические ткани возможно также удаление опухолей с безопасной резекцией почечной паренхимы. При вовлечении в опухолевый процесс области ворот почки, чашечно-лоханочной системы, сосудистой ножки почки разработаны методики прецизионного удаления опухолевых масс с сохранением органа и его структур.
Список литературы Нефронсберегающие операции в хирургическом лечении ретроперитонеальных сарком
- Toulmonde M., Bonvalot S., Ray-Coquard I., Stoeckle E., Riou O., Isambert N., Bompas E., Penel N., Delcambre-Lair C., Saada E., Lecesne A., Le Péchoux C., Blay J.Y., Piperno-Neumann S., Chevreau C., Bay J.O., Brouste V., Terrier P., Ranchère-Vince D., Neuville A., Italiano A.; French Sarcoma Group. Retroperitoneal sarcomas: patterns of care in advanced stages, prognostic factors and focus on main histological subtypes: a multicenter analysis of the French Sarcoma Group. Ann Oncol. 2014; 25(3): 730-4. https://doi.org/10.1093/annonc/mdt576.
- Fairweather M., Gonzalez R.J., Strauss D., Raut C.P. Current principles of surgery for retroperitoneal sarcomas. J Surg Oncol. 2018; 117(1): 33-41. https://doi.org/10.1002/jso.24919.
- Sassa N., Yokoyama Y., Nishida Y., Yamada S., Uchida H., Kajiyama H., Nagino M., Kodera Y., Gotoh M. Clinical characteristics and surgical outcomes of retroperitoneal tumors: a comprehensive data collection from multiple departments. Int J Clin Oncol. 2020; 25(5): 929-36. https://doi.org/10.1007/s10147-020-01620-1.
- Cooley C.L., Jagannathan J.P., Kurra V., Tirumani S.H., Saboo S.S., Ramaiya N.H., Shinagare A.B. Imaging features and metastatic pattern of non-IVC retroperitoneal leiomyosarcomas: are they different from IVC leiomyosarcomas? J Comput Assist Tomogr. 2014; 38(5): 687-92. https://doi.org/10.1097/RCT.0000000000000097.
- Faron M., Cavalcanti A., Honore C. Compartmental resection of a retroperitoneal sarcoma. Journal of Visceral Surgery. 2019; 156(3): 245-51. https://doi.org/10.1016/j.jviscsurg.2019.02.002.
- Willis F., Schneider M. Retroperitoneale Weichteilsarkome: Chirurgische Therapie [Retroperitoneal soft tissue sarcoma: surgical management]. Chirurg. 2022; 93(1): 16-26. German. https://doi.org/10.1007/s00104-021-01506-6.
- Russo P., Kim Y., Ravindran S., Huang W., Brennan M.F. Nephrectomy during operative management of retroperitoneal sarcoma. Ann Surg Oncol. 1997; 4(5): 421-4. https://doi.org/10.1007/BF02305556.
- Ikoma N., Roland C.L., Torres K.E., Chiang Y.J., Wang W.L., Somaiah N., Mann G.N., Hunt K.K., Cormier J.N., Feig B.W. Concomitant organ resection does not improve outcomes in primary retroperitoneal welldifferentiated liposarcoma: A retrospective cohort study at a major sarcoma center. J Surg Oncol. 2018; 117(6): 1188-94. https://doi.org/10.1002/jso.24951.
- Cho C.W., Lee K.W., Park H., Kim H.J., Park J.B., Choi Y.L., Yu J.I., Lee S.J., Choi D.I., Kim S.J. Clinical benefit and residual kidney function of en bloc nephrectomy for perirenal retroperitoneal sarcoma. Asia Pac J Clin Oncol. 2018; 14(5): 465-71. https://doi.org/10.1111/ajco.12769.
- Tseng W.W., Madewell J.E., Wei W., Somaiah N., Lazar A.J., Ghadimi M.P., Hoffman A., Pisters P.W., Lev D.C., Pollock R.E. Locoregional disease patterns in well-differentiated and dedifferentiated retroperitoneal liposarcoma: implications for the extent of resection? Ann Surg Oncol. 2014; 21(7): 2136-43. https://doi.org/10.1245/s10434-014-3643-4.
- Rhu J., Cho C.W., Lee K.W., Park H., Park J.B., Choi Y.L., Kim S.J. Radical Nephrectomy for Primary Retroperitoneal Liposarcoma Near the Kidney has a Beneficial Effect on Disease-Free Survival. World J Surg. 2018; 42(1): 254-62. https://doi.org/10.1007/s00268-017-4157-6.
- Karadayi K., Yildiz C., Karakus S., Kurt A., Bozkurt B., Soylu S., Cicekli A.A., Egilmez R., Cetin A. Well-differentiated abdominal liposarcoma: experience of a tertiary care center. World J Surg Oncol. 2015; 13: 166. https://doi.org/10.1186/s12957-015-0580-z.
- Nijhuis P.H., Sars P.R., Plaat B.E., Molenaar W.M., Sluiter W.J., Hoekstra H.J. Clinico-pathological data and prognostic factors in completely resected AJCC stage I-III liposarcomas. Ann Surg Oncol. 2000; 7(7): 535-43. https://doi.org/10.1007/s10434-000-0535-6.
- Singer S., Antonescu C.R., Riedel E., Brennan M.F. Histologic subtype and margin of resection predict pattern of recurrence and survival for retroperitoneal liposarcoma. Ann Surg. 2003; 238(3): 358-70; discussion 370-1. https://doi.org/10.1097/01.sla.0000086542.11899.38.
- Bonvalot S., Rivoire M., Castaing M., Stoeckle E., Le Cesne A., Blay J.Y., Laplanche A. Primary retroperitoneal sarcomas: a multivariate analysis of surgical factors associated with local control. J Clin Oncol. 2009; 27(1): 31-7. https://doi.org/10.1200/JCO.2008.18.0802.


