Неинвазивная диагностика злокачественных новообразований верхних дыхательных путей на основе анализа маркеров в выдыхаемом воздухе
Автор: Кульбакин Д.Е., Чойнзонов Е.Л., Федорова И.К., Обходская Е.В., Обходский А.В., Родионов Е.О., Сачков В.И., Чернов В.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.22, 2023 года.
Бесплатный доступ
Цель исследования - изучение диагностической возможности сенсорного газоаналитического аппарата при исследовании образцов выдыхаемого газа, полученных у больных раком орофарингеальной области и гортани. Материал и методы. Объектом исследования были пробы выдыхаемого газа от 31 больного раком орофарингеальной области и гортани, а также 31 здорового добровольца. Предлагаемый метод основан на анализе проб выдыхаемого газа исследуемых лиц при помощи разработанного авторами диагностического прибора, созданный на детекции летучих соединений в вдыхаемом воздухе посредством набора полупроводниковых сенсоров с последующим нейросетевым анализом.
Рак орофарингеальной области, рак гортани, маркеры, неинвазивная диагностика, выдыхаемый воздух, сенсорная газоаналитическая система, нейронная сеть
Короткий адрес: https://sciup.org/140303561
IDR: 140303561 | УДК: 616.211/.232-006.04-07:616.24-008.4 | DOI: 10.21294/1814-4861-2023-22-6-7-15
Текст научной статьи Неинвазивная диагностика злокачественных новообразований верхних дыхательных путей на основе анализа маркеров в выдыхаемом воздухе
Первые два десятилетия XXI века характеризуются ростом заболеваемости злокачественными новообразованиями (ЗНО) населения мира и России. Так, на территории РФ в 2021 г. впервые выявлено 580 415 случаев злокачественных новообразований, что на 41 % больше, чем в 2011 г. (240 107 случаев). Среди причин смертности населения РФ в 2020 г. (всего 2 138 600 случаев) ЗНО занимают 2-е место (295 900 случаев) после болезней системы кровообращения (938 500 случаев). В структуре заболеваемости злокачественными новообразованиями плоскоклеточный рак головы и шеи (ПРГШ) находится на 6-м месте. В РФ в 2021 г. выявлено 1 472 случая рака губы, 3 376 – полости рта, 1 194 – глотки, 2 630 – гортани [1]. За период с 2011 по 2021 г. прирост заболеваемости среди населения РФ для рака полости рта составил 36,5 %, для рака ротоглотки – 25,8 %. Злокачественные опухоли полости рта отличаются высоким уровнем заболеваемости и смертности. Летальность больных на первом году после установления диагноза в 2021 г. составила 27,8 % у больных раком полости рта и 35,8 % – у больных раком ротоглотки. Основной причиной этого является стабильно высокий уровень доли больных с IV стадией – от 28,8 до
37,6 % среди впервые выявленных больных в РФ за период с 2011 по 2021 г. [1].
Неудовлетворительные показатели онкологической смертности связаны с тем, что у большинства больных (до 50–60 %) ЗНО выявляются в запущенных стадиях (T3–Т4). Подобная тенденция, с одной стороны, связана с несвоевременным обращением пациентов за медицинской помощью, с другой стороны, несовершенством современных методов ранней диагностики ЗНО. Зачастую методики ранней диагностики носят инвазивный характер, являются оператор-зависимыми и дорогостоящими. Таким образом, в некоторых случаях методы ранней диагностики не всегда доступны широким слоям населения и не могут обеспечить адекватный скрининг ЗНО [2].
В настоящее время среди методов обследования пациентов с опухолями головы и шеи можно выделить эндоскопические, рентгенологические и морфологические [3]. Эффективность каждого из них зависит как от его доступности, так и от навыков диагностов, выполняющих тот или иной метод. Используемые методы обследования направлены на раннее выявление опухолевой патологии с целью дальнейшего лечения и достижения приемлемых онкологических результатов, что не всегда воз- можно. Лечение пациентов с распространенными ЗНО полости рта, ротоглотки и гортани нередко сопряжено с рядом негативных последствий в виде тяжелых функциональных и косметических нарушений, которые часто приводят к инвалидизации пациентов и их социальной изоляции [4].
Требования, предъявляемые к скрининговым методам диагностики опухолевой патологии органов головы и шеи, побуждают онкологов и врачей диагностического звена к разработке и внедрению более эффективных методик раннего выявления ЗНО. Среди современных требований, предъявляемых к диагностическим методам, можно выделить воспроизводимость, низкую стоимость, максимальную независимость от человеческого фактора, а также возможность их применения в общей лечебной сети врачами первичного звена (терапевты, ЛОР-врачи, стоматологи).
В последнее время с целью улучшения ранней диагностики ЗНО изучаются разнообразные методики, включающие в себя определение потенциальных маркеров, которые могут свидетельствовать о наличии злокачественной опухоли. Есть данные о том, что злокачественное новообразование способно вносить изменения в метаболические процессы человека, с выделением полученных метаболитов различными путями. С диагностической точки зрения наибольший интерес представляют летучие и полулетучие метаболиты, способные выделятся при дыхании. Вследствие этого в выдыхаемом газе могут присутствовать специфичные метаболиты, по количественным и качественным характеристикам которых можно предположить присутствие ЗНО в организме человека. Подобная теория подкрепляется данными мировой литературы, где за последние 5–7 лет отмечается рост сообщений, посвященных неинвазивной диагностике злокачественных опухолей по данным анализа газов, составляющих выдыхаемую воздушную смесь. Имеются публикации по изучению эффективности такого метода у больных со злокачественными опухолями легких, молочной железы, кишечника, предстательной железы [5].
Опубликована экспериментальная работа по использованию летучих органических веществ в выдыхаемом из полости рта воздухе в качестве биомаркеров плоскоклеточного рака полости рта. Результаты исследования показали, что такие соединения, как ундекан, додекан, деканаль, бензальдегид, 3,7-диметилундекан, 4,5-диметилнонан, 1-октен и гексадекан, могут быть потенциальными биомаркерами для диагностики плоскоклеточного рака полости рта [6].
Опубликовано пилотное исследование по изучению возможностей устройства «электронный нос» в диагностике опухолей головы и шеи. В исследование включено 36 больных раком головы и шеи (рото-, гортаноглотка и гортань), у которых проводился отбор воздуха при выдыхании в
5-литровый пакет Тедлара натощак при 8-часовом воздержании от приема пищи (DiagNose, C-it BV, Zutphen, Нидерланды). Исследование показало значимую разницу в составе летучих органических метаболитов у больных со ЗНО верхних дыхательных путей по сравнению с контрольной группой, состоящей из здоровых лиц, с высокой уровнем чувствительности и специфичности (от 80 до 90 %). Авторы резюмируют, что разработанный ими метод неинвазивной диагностики является многообещающим и эффективным в диагностике ЗНО головы и шеи [7].
Основываясь на литературных данных и особенностях обмена веществ при злокачественных опухолях, можно выделить несколько возможных источников биомаркеров для диагностики опухолей орофарингеальной области и гортани: углеводороды (3,7-диметилдекан, 3-метилнонан и 1-октен), альдегиды (нонаналь, деканаль и бензальдегид), сложные эфиры и спирты (2-этил-1-гексанол, гексанол и бензиловый спирт, бутил-, октил- и изоборнилацетаты) [8]. На основании проведенного обзора возможных биомаркеров ЗНО гортани и орофарингеальной области, количество которых велико, можно сделать вывод, что проводимые исследования однозначно не решают проблему определения биомаркеров, указывающих с высокой точностью на наличие злокачественного новообразования. Поиск отдельных биомаркеров злокачественных новообразований является комплексным и длительным процессом. Решение этой проблемы возможно за счет применения сенсорной газоаналитической системы в совокупности с методами нейросетевого анализа данных.
Целью исследования стало изучение образцов выдыхаемого газа, полученных у больных раком орофарингеальной области и гортани, а также поиск характерных для них биомаркеров, выявляемых с помощью искусственной нейронной сети и сенсорного газоаналитического аппарата.
Материал и методы
В работе проведено исследование проб выдыхаемого воздуха у 62 человек в возрасте от 22 до 95 лет. Все включенные в исследование лица были разделены на основную и контрольную группы. При составлении групп исследования, а также в последующем анализе полученных результатов не учитывались возраст, пол, стаж курения и употребления спиртных напитков, наличие сопутствующей соматической патологии, а также длительного приема лекарственных средств по поводу возможных хронических патологий. Основная и контрольная группы были сопоставимы.
В основную группу вошел 31 больной с гистологически подтвержденным плоскоклеточным раком орофарингеальной области и гортани Т1–4N0–3М0 стадии, ранее не получавших специального противоопухолевого лечения (таблица). В основной
Таблица/table
Характеристика групп пациентов
Characteristics of the study group of patients
|
Параметры/Parameteres |
Больные со злокачественными опухолями/ Patients with malignant tumors (n=31) |
Контрольная группа (здоровые добровольцы)/ Control group (healthy volunteers) (n=31) |
|
Средний возраст, лет /Average age, years |
60 ± 7 |
50 ±5 |
|
Пол/Gender |
||
|
Мужской/Male |
25 (80,6 %) |
14 (45,2 %) |
|
Женский/Female |
61 (9,4 %) |
17 (54,8 %) |
|
TNM стадия/TNM stage |
||
|
I |
5 (16,1 %) |
- |
|
II |
13 (41,9 %) |
- |
|
III |
9 (29,1 %) |
- |
|
IV |
4 (12,9 %) |
- |
|
Локализация/Localization |
||
|
Гортань/Larynx |
9 (29,1 %) |
- |
|
Полость рта/Oral cavity |
5 (16,1 %) |
- |
|
Ротоглотка/Oropharynx |
7 (22,6 %) |
- |
|
Гортаноглотка/Hypopharynx |
1 (3,2 %) |
- |
|
Язык/Tongue |
6 (19,4 %) |
- |
|
Слизистая альвеолярного отростка нижней челюсти/ Mucous of the alveolar process of the mandible |
3 (9,6 %) |
- |
|
Данные о курении/smoking |
||
|
Да/Yes |
17 (54,8 %) |
- |
|
Нет/No |
14 (45,2 %) |
- |
Примечание: таблица составлена авторами.
Note: created by the authors.
группе преобладали мужчины (n=43; 82,7 %). У большей части больных (n=9) диагностирован рак гортани. Средний возраст составил 60 лет.
В контрольную группу включен 31 человек на момент проведения исследования без злокачественной патологии (анамнестически и на основании ранее проведенного обследования). В контрольной группе – 17 (54,8 %) женщин и 14 (45,2 %) мужчин. Средний возраст – 50 лет. Критериями исключения из контрольной группы являлись наличие злокачественного новообразования в анамнезе, возраст до 18 лет, острый инфекционный процесс, проведение антибактериальной терапии, беременность или кормление грудью.
Всем пациентам основной группы, согласно клиническим рекомендациям по лечению и диагностике злокачественных опухолей головы и шеи, выполнено обследование для определения распространенности и стадии опухоли. Применялись эндоскопические методы (фиброларингоскопия), СКТ и/или МРТ, УЗИ лимфатических узлов шеи, а также биопсия опухоли с последующим морфологическим исследованием.
Перед исследованием лица, включенные в основную и контрольную группы, воздерживались от еды и любых напитков, не курили и не чистили зубы не менее чем за 6 ч до забора образцов воз- духа. Таким образом, наиболее подходящим временем для проведения исследования было утро. У пациентов основной группы образцы выдыхаемого газа забирались после завершения всего комплекса диагностического обследования.
Исследование осуществлялось в отдельном помещении, где была установлена сенсорная газоаналитическая система и поддерживались нормальные условия окружающей среды. На каждого исследуемого заполнялось информированное согласие, а также фиксировались основные исходные данные: возраст, пол, локализация опухоли, стадия, курение и употребление спиртных напитков, возможные сопутствующие заболевания, а также длительный прием медикаментов в связи с возможной имеющейся хронической патологией. После этого исследуемые в положении сидя делали максимальные выдохи в специальный пластиковый стерильный мешок объемом 5 л.
Результаты, получаемые при оцифровке сигналов с газоаналитических сенсоров, фиксировались в базу для дальнейшего автоматизированного анализа и обработки. После этапа забора проб выдыхаемого воздуха исследуемые наблюдались в течение 30 мин с целью оценки их общего состояния. Для диагностики ЗНО нами использовалась разработанная сенсорная газоаналитическая система, включающая набор полупроводниковых сенсоров и использующая методики нейросетевого анализа полученных данных [9].
На каждого пациента в газоаналитической системе создавался подкаталог, где сохранялись все данные, включающие метаданные и массивы значений сенсорных сигналов, создавая, таким образом, дерево каталогов исследования. Взаимосвязь программы оператора газоаналитической системы с архивом данных осуществляется за счет стандартизированных SQL запросов. Для формирования диагностического результата по каждому пациенту поступающие сигналы с 14 газоаналитических сенсоров проходили предварительную обработку, что позволяло использовать их для последующего статистического анализа.
Исходя из сформированной задачи, оптимальным типом архитектуры нейронной сети для стратификации исследуемых лиц являлась нейронная сеть прямого распространения типа персептрон. Количество элементов входного S-слоя нейронной сети соответствует количеству дискретных значений сигнала с каждого отдельного датчика, и это количество одинаково для всех датчиков, выходной R-слой нейронной сети при этом определяет количество классификационных признаков. В про- водимом эксперименте выходной слой содержал только один нейрон, принимающий значение «1», при наличии злокачественного новообразования и «-1», если исследуемый здоров.
На вход нейронной сети поступали соотношения 4 и 1 периодов термоциклирования всех 14 газоаналитических сенсоров от точки остывание-нагрев до точки нагрев-остывание (3,5 сек×50 Гц=175 значений). При выполнении данной работы экспериментально установлено: если использовать каждое 10-е значение, то погрешность не возрастает, ввиду чего был значительно сокращен объем входного потока данных ‒ со 175 значений для каждого сенсора до 17. Следует сказать, что на вход нейронной сети подавалось 17×14 значений, поступающих с газоаналитических сенсоров. Итоговая размерность входного S-слоя нейронной сети включает 238 элементов. Размерность внутреннего А-слоя составила 476 элементов. При обработке данных не учитывалась информация о гендерной принадлежности, возрасте и другие характеристики.
Результаты
При выявлении подходящих характеристик обучения нейронной сети в ходе эксперимента установлено, что наилучшие показатели для до-
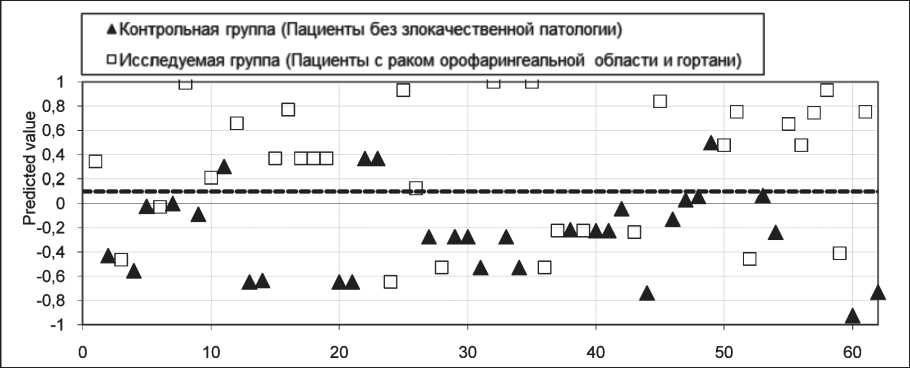
Рис. 1. Диаграмма распределения проб для всех здоровых лиц и пациентов со злокачественной патологией орофарингеальной области и гортани. По оси абсцисс представлен порядковый номер исследуемого лица, участвующего в перекрестной проверке. Примечание: рисунок выполнен авторами
Fig. 1. Sample distribution diagram for all healthy subjects and patients with oropharyngeal and laryngeal cancers. The x-axis represents the serial number of the person under study participating in the cross-validation. Note: created by the authors
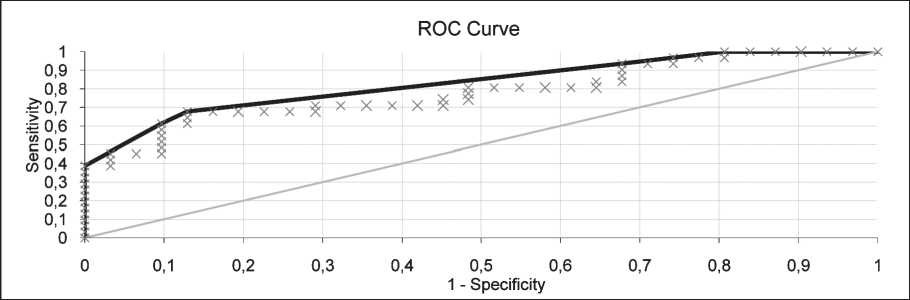
Рис. 2. ROC-кривые для всех здоровых лиц и больных раком орофарингеальной области и гортани.
Примечание: рисунок выполнен авторами
Fig. 2. ROC-curve for all healthy individuals and patients with oropharyngeal and laryngeal cancers. Note: created by the authors
стижения наименьшей ошибки обучения соответствуют большому количеству эпох обучения и при достижении низкой скорости обучения. Оптимальные настройки нейронной сети составляют: 1 000 000 эпох обучения, скорость обучения 0,01, скрытый слой 1 с размерностью в 2 раза больше, чем количество входов, функция активации для слоя нейронов th(x). Индикатором для поиска оптимальных параметров служила площадь под кривой ошибок.
Была проведена серия экспериментов. При проведении экспериментов применялся алгоритм стандартной перекрестной проверки, предполагающий случайное деление общего набора пациентов на 5 групп. Одна из групп назначалась контрольной и не участвовала в обучении, а на оставшихся 4 группах пациентов проводилось обучение нейронной сети. Таким образом, в качестве контрольной группы за серию экспериментов выступала каждая из 5 групп. При количественном делении одна из групп отличалась от остальных числом пациентов в силу невозможности целого деления общего числа пациентов на 5 групп. Случайное деление и последующая проверка производились 5 раз, в общей сложности было проведено 5 перекрестных проверок, каждая из которых включает 5 экспериментов для трех различных вариантов наборов данных. Результаты основаны на 25 экспериментах. Полученные данные перекрестной проверки для параметров, состоящих из 31 больного раком орофарингеальной области и гортани и 31 здорового исследуемого, представлены на рис. 1 и 2.
Уровень разделения положительных и отрицательных проб определен методом оценки площади под кривой ошибок (рис. 2) и составил 0,1. Величина AUC-ROC составила 0,783 (доверительный интервал, Р (0,66; 0,9)=0,99), что говорит о высоком качестве классификатора. Параметры точности, чувствительности и специфичности для полученного набора данных от 62 лиц проверялись согласно методикам [10, 11]. Точность определения составила 77,41 %, чувствительность – 67,74 %, специфичность – 87,1 %.
Обсуждение
Анализ дыхания с целью скрининга опухолей верхних дыхательных путей является быстро развивающейся областью. Ускорение темпов разработки надежной панели маркеров, которые могут быть применены для клинического использования, потребует стандартизированного подхода в трех ключевых сферах: создание стандартизированных и гибких протоколов забора проб выдыхаемого воздуха, рандомизированные клинические исследования
Список литературы Неинвазивная диагностика злокачественных новообразований верхних дыхательных путей на основе анализа маркеров в выдыхаемом воздухе
- Sostoyanie onkologicheskoi pomoshchi naseleniyu Rossii v 2021 godu. Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2022. 239 s.
- Panferova O.I., Nikolenko V.N., Kochurova E.V., Kudasova E.O. Etiologiya, patogenez, osnovnye printsipy lecheniya ploskokletochnogo raka slizistoi obolochki polosti rta. Golova i sheya. 2022; 10(2): 69-77. https://doi.org/10.25792/HN.2022.10.2.69-77.
- The National Comprehensive Cancer Network [Internet]. Clinical Practice Guidelines in Oncology. [cited 2023 May 15]. URL: https://www.nccn.org/professionals/physician_gls/default.aspx.
- Harris A., Lyu L., Wasserman-Winko T., George S., Johnson J.T., Nilsen M.L. Neck Disability and Swallowing Function in Posttreatment Head and Neck Cancer Patients. Otolaryngol Head Neck Surg. 2020; 163(4): 763-70. https://doi.org/10.1177/0194599820923630.
- Krilaviciute A., Stock C., Leja M., Brenner H. Potential of noninvasive breath tests for preselecting individuals for invasive gastric cancer screening endoscopy. J. Breath Res. 2018; 12. https://doi.org/10.1088/1752-7163/aab5be.
- Bouza M., Gonzalez-Soto J., Pereiro R., de Vicente J.C., SanzMedel A. Exhaled breath and oral cavity VOCs as potential biomarkers in oral cancer patients. J Breath Res. 2017; 11(1). https://doi.org/10.1088/1752-7163/aa5e76.
- Leunis N., Boumans M.L., Kremer B., Din S., Stobberingh E., Kessels A.G., Kross K.W. Application of an electronic nose in the diagnosis of head and neck cancer. Laryngoscope. 2014; 124(6): 1377-81. https://doi.org/10.1002/lary.24463.
- Opitz P., Herbarth O. The volatilome - investigation of volatile organic metabolites (VOM) as potential tumor markers in patients with head and neck squamous cell carcinoma (HNSCC). J Otolaryngol Head Neck Surg. 2018; 47(1): 42. https://doi.org/10.1186/s40463-018-0288-5.
- Chernov V.I., ChoynzonovE.L., KulbakinD.E., Obkhodskaya E.V., Obkhodskiy A.V., Popov A.S., Sachkov V.I., Sachkova A.S. Cancer Diagnosis by Neural Network Analysis of Data from Semiconductor Sensors. Diagnostics. 2020; 10(9). https://doi.org/10.3390/diagnostics10090677.
- Horváth I., Barnes P.J., Loukides S., Sterk P.J., Högman M., Olin A.C., Amann A., Antus B., Baraldi E., Bikov A., Boots A.W., Bos L.D., Brinkman P., Bucca C., Carpagnano G.E., Corradi M., Cristescu S., de Jongste J.C., Dinh-Xuan A.T., Dompeling E., Fens N., Fowler S., Hohlfeld J.M., Holz O., Jöbsis Q., Van De Kant K., Knobel H.H., Kostikas K., Lehtimäki L., Lundberg J., Montuschi P., Van Muylem A., Pennazza G., Reinhold P., Ricciardolo F.L.M., Rosias P., Santonico M., van der Schee M.P., van Schooten F.J., Spanevello A., Tonia T., Vink T.J. A European Respiratory Society technical standard: exhaled biomarkers in lung disease. Eur Respir J. 2017; 49(4). https://doi.org/10.1183/13993003.00965-2016.
- Shakeel P.M., Tolba A., Al-Makhadmeh Z., Jaber M.M. Automatic detection of lung cancer from biomedical data set using discrete AdaBoost optimized ensemble learning generalized neural networks. Neural Computing and Applications. 2020; 32: 777-90.
- Becker M., Zaidi H. Imaging in head and neck squamous cell carcinoma: the potential role of PET/MRI. Br J Radiol. 2014; 87(1036). https://doi.org/10.1259/bjr.20130677.


