Нейроамины - регуляторы местных процессов при аутопересадке костного мозга
Автор: Воробьева О.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Физиология и патофизиология
Статья в выпуске: 4 т.11, 2015 года.
Бесплатный доступ
Цель: определить содержание нейроаминов (гистамина, серотонина, катехоламинов) в биоаминсодержащих структурах костного мозга после аутогенной трансплантации костного мозга. Материал и методы. Животным в хвостовую вену вводили суспензию костного мозга, полученную из бедренной кости этой же мыши. Взятый из бедренной кости 1 мл костного мозга помещали в 2 мл физиологического раствора и тщательно размешивали. 1 мл суспензии костного мозга вводили в хвостовую вену. Криостатные срезы обрабатывали люминесцентно-ги-стохимическими методами. Результаты. После аутотрансплантации костного мозга отмечаются выраженные изменения в нейромедиаторах костного мозга —увеличивается число гранулярных люминесцирующих клеток с уменьшением количества гранул в них и уменьшением числа тучных клеток вследствие их дегрануляции. Отмечается слабая люминесценция ядер у нейтрофилов. Возможно, это свидетельствует об активации иммунной реакции. Заключение. Аутотрансплантация костного мозга приводит к перераспределению в структурах костного мозга гистамина, катехоламинов и серотонина, что изменяет направление цитодифференци-ровки клеток, изменяет содержание нейроаминов в гранулярных люминесцирующих клетках и тучных клетках (клетках автономной регуляции органов).
Аутотрансплантация костного мозга, гистамин, гранулярные люминесцирующие клетки, катехоламины, серотонин, тучные клетки
Короткий адрес: https://sciup.org/14918189
IDR: 14918189
Текст научной статьи Нейроамины - регуляторы местных процессов при аутопересадке костного мозга
га, однако причина такого сдвига в обмене биогенных аминов не известна. В последнее время в патогенезе онкологических заболеваний все большее значение придается морфологическим структурам, участвующим в местной регуляции тканевых процессов, а также биологически активным веществам, которые вырабатываются ими [3]. Известно, что в костном мозге имеются гранулярные люминесцирующие клетки, которые совместно с тучными клетками участвуют в автономной регуляции органов, выполняют функции нейроэндокринных и паракринных менеджеров [4, 5].
Цель: определить содержание нейроаминов (гистамина, серотонина, катехоламинов) в биоаминсодержащих структурах костного мозга после аутогенной трансплантации костного мозга во временном аспекте.
Материал и методы. Работа выполнена на 45 мышах, которые были разделены на три группы:
-
1-я группа — интактные мыши без проведения трансплантации костного мозга (n=15);
2-я группа — контрольная группа мышей (n=15), у которых нейроаминные сдвиги в гранулярных и тучных клетках костного мозга происходят в первые 30 минут после введения физиологического раствора в дозе 1 мл, далее их количество в клетках стабилизируется. Вследствие этого материал для изучения брали начиная с 40 мин после введения костного мозга;
3-я группа — группа мышей, которым производили аутотрансплантацию костного мозга (n=15). Для этого в хвостовую вену вводили суспензию костного мозга. Для получения суспензии производили забор 1 мл костного мозга из бедренной кости этой же мыши. Взятый материал помещали в 2 мл физиологического раствора и тщательно размешивали. Полученный 1 мл суспензии костного мозга и вводили в хвостовую вену. Другая часть объема полученной суспензии шла на подсчет числа клеток в полученной гетерогенной популяции клеток костного мозга с помощью проточного спектрофотометра «Ф-2000» с применением флуоресцеина изотиоцианата (FITC). Число клеток в 1 мл суспензии было равно 2,1*108.
Все процедуры по уходу осуществлялись по нормам и правилам обращения с лабораторными животными [6], в соответствии с «Международными рекомендациями по проведению медико-биологических исследований с использованием животных» (1985), правилами лабораторной практики в Российской Федерации (приказ МЗ РФ от 19.06.2003 №267).
В процессе решения поставленных задач использовали люминесцентно-гистохимический метод Кросса, Евена, Роста [7] для выявления гистамина; для избирательного выявления катехоламинов и серотонина использовали метод Фалька — Хилларпа. Количественный уровень катехоламинов, серотонина и гистамина в структурах оценивался с помощью цитоспектрофлу-ориметрии. Окраска по А. Унна применялась для определения сульфатированности гепарина и состояния тучных клеток. Ортохромную (голубую) окраску дает моно- и дисульфатированный, незрелый гепарин. Бе-та-метахроматическую (чернильно-фиолетовую) дает трехсульфатированный, созревающий гепарин, и гам-ма-метахроматическая (пурпурная) окраска присуща зрелому, пятисульфатированному гепарину.
Полученные цифровые данные обрабатывали в программе «Statistica», версия 6 (Copyright@StatSoft, 19842001, ИПЧИ 31415926535897). Статистическую значимость различий определяли по критерию Стьюдента.
Результаты. В данном исследовании на моноамины через 40 мин после аутопересадки выявляются гранулярные люминесцирующие клетки двух разновидностей: мелкие, с компактными гранулами (макрофаги) и крупные, с разнокалиберными гранулами, в которых люминесцируют 2–3 гранулы. Остальные гранулы не люминесцируют, поскольку моноамины выходят из гранул в межклеточные пространства. Число гранулярных клеток остается повышенным до 5–7 вместо 3–4 в одном поле зрения. Число тучных клеток снижено до 16 на весь препарат по сравнению с интактными мышами. Содержание катехоламинов и серотонина в них повысилось в два раза. У юных и палочко-ядерных нейтрофилов начинают слабо
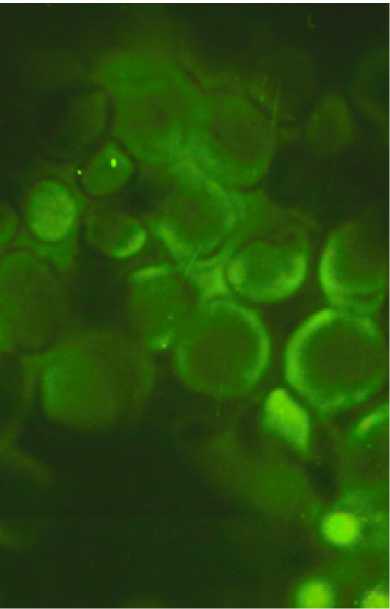
Люминесценция цитоплазмы бластных форм клеток и ядер нормобластов. Метод Кросса. Микроскоп МЛ-6. Ув. имм.
люминесцировать ядра. Остальные гемопоэтические клетки практически не люминесцируют.
Наблюдается диффузное свечение гистамина во всех видах клеток. В гемопоэтических клетках светятся в основном ядра, за исключением бластных форм, и межклеточное вещество (рисунок). Много гистамина в цитоплазме базофильных мегакариоцитов.
Отмечается увеличение содержания несвободного серотонина в гранулах эозинофилов, в ядрах эритробластов и лимфоцитов, и снижается его содержание в гранулах нейтрофильного ряда и тучных клетках. Наблюдается увеличение числа митозов практически во всех видах клеток.
При окраске препаратов по Унна гемопоэтические клетки окрашены ортохромно, за исключением эозинофильного ряда, где в цитоплазме выявляется легкая метахромазия. Чем моложе клетка, тем слабее окрашено ее ядро. Различают 3 вида тучных клеток, которые окрашены В-метахроматично: одни мелкие с голубыми ядрами, другие с центрально расположенным ядром, третьи дегранулированные вплоть до тотального распада. Такие клетки окрашиваются гамма-метахроматично,
При исследовании препаратов по Паппенгейму определяются митотически делящиеся лимфоциты.
В гемопоэтических клетках костного мозга происходит увеличение моноаминооксидазы (МАО), за исключением некоторых лимфоцитов, которые образуют шаровидные скопления. В большом количестве МАО распределяется по ходу нервных волокон, в гранулярных и тучных клетках, число которых также увеличилось по сравнению с интактными животными. Кислая фосфатаза в мазках костного мозга мышей выявляется в цитоплазме клеток нейтрофильного, эозинофильного, моноцитарного рядов, а также в лимфоцитах. Кислая фосфатаза выявляется в увеличенном количестве в макрофагах.
Увеличивается содержание нейроспецифической енолазы в тучных клетках, число которых возросло более чем в 1,5 раза. Причем увеличилось процентное содержание молодых компактных клеток.
Обсуждение. В костном мозге через 40 мин после аутогенной пересадки костного мозга увеличивается число гранулярных люминесцирующих клеток и снижается число тучных клеток с увеличением в них биоаминов. Повышается дегрануляция тучных клеток, увеличивается выход нейроаминов из гранул люми-несцирующих клеток в межклеточное пространство. У экспериментальных животных ярко люминесцируют ядра нейтрофилов. Возможно, все это говорит об активации иммунной реакции.
По данным Гордон (1982) [8], гамма-метахромазия свидетельствует о старении тучных клеток и об их усиленной сульфатации.
Увеличивается число митозов, образуются шаровидные скопления морфологически одинаковых клеток, по периферии которых располагаются гранулярные люми-несцирующие клетки. В тканях происходит дифференцировка и пролиферация предшественников тучных клеток. Как известно, накопление катехоламинов, серотонина в цитоплазме клеток костного мозга способствует дифференцировке зрелых форм клеток, а накопление гистамина снижает дифференцировку и увеличивает число бластов. По сравнению с данными других авторов [3], мы предполагаем, что нейроамины регулируют гемопоэз, активируют ангиогенез посредством перераспределения нейроаминов в структурах костного мозга. Увеличенная активность ферментов приводит к усилению окислительно-восстановительных процессов.
Выводы:
-
1. Аутотрансплантация приводит к увеличению числа ГЛК и ТК, а в них повышается содержание нейроаминов, это приводит к изменению цитодифференцировки клеток.
-
2. Аутопересадка костного мозга стимулирует иммунные процессы.
-
2. Увеличивается активность ферментов, что активирует окислительно-восстановительные процессы.
Список литературы Нейроамины - регуляторы местных процессов при аутопересадке костного мозга
- Семенова E.B., Станчева H.B., Бондаренко С.Н. Качество жизни больных лимфомами в разные сроки после высокодозной химиотерапии с аутологичной трансплантацией гемопоэтических стволовых клеток. Клиническая онкогематология: фундаментальные исследования и клиническая практика 2014; 7 (4): 577-582
- Abedi М, Foster ВМ, Wood KD, et al. Haematopoietic stem cells participate in muscle regeneration. Br J Haematol. 2007; 138 (6): 792-801
- Любовцева E.B., Любовцева Л.А. Биоаминсодержащие структуры костного мозга при системных заболеваниях крови. Морфология 2012; 3: 95-96
- Макаренкова В.П., Кост Н.В., Щурин М.Р Система дендритных клеток: роль в индукции иммунитета и в патогенезе инфекционных, аутоиммунных и онкологических заболеваний. Иммунология 2002; 2: 68-76
- Ставинская О.А. Роль гистамина и серотонина в поддержании иммунного гомеостаза. В кн.: Национальная конференция «Аллергология и клиническая иммунология: междисциплинарные проблемы». Российский аллергологический журнал 2008; 1: 283-284
- Каркищенко H.H., Грачева С.В. Руководство по лабораторным животным и альтернативным моделям в биомедицинских технологиях. М.: Медицина, 2010; 344 с.
- Cross SAM, Ewen SWB, Rost EWDA. Stindi of the methods available for the cytochhem: cal localization of histamine by fluorescence induced with o-phthalaldehyde or acetadehude. J. Histochem 1971; 6: 471-476
- Гордон Б.М. Математическое обоснование специфичности люминесцентно-гистохимических реакций на аутолюминесцентных структурах. Морфология и гистохимия тканей в норме, патологии и эксперименте!982; 2: 71-76.


