Нейрогенная дифференцировка мезенхимальных стволовых клеток
Автор: Кудрова Ю.Н., Глушкова Т.Г., Маркова В.И.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Методы исследования
Статья в выпуске: 1 т.19, 2011 года.
Бесплатный доступ
Количество опубликованных работ по био- логии и пластичности мезенхимальных стволовых клеток за последние годы достигло огромных размеров. Однако многие данные по-прежнему остаются противоречивыми. Мезенхимальные стволовые клетки - весьма многообещающее средство клеточной терапии. Получены данные о их нейрогенной дифференцировки.
Мезенхимальные стволовые клетки, нейрогенная дифференцировка
Короткий адрес: https://sciup.org/143176975
IDR: 143176975
Текст научной статьи Нейрогенная дифференцировка мезенхимальных стволовых клеток
Введение. Мезенхимальные стволовые дифференцируются в клетки эктодермального и энтодермального генеза [1], уподобляясь эмбриональным стволовым клеткам.
Такой многолинейный потенциал стволовых клеток позволяет разграничить обычные стромальные клетки – предшественники костного мозга и мезенхимальные стволовые клетки, которые обычно редко присутствуют в костном мозге взрослого человека (1/105) [2, 3]. Обычным источником мезенхимальных стволовых клеток является взвесь клеток, полученная из костного мозга или из других тканей [4, 5]. Циркулирующие мезенхимальные стволовые клетки обнаруживаются и периферической крови [6].
Стволовые клетки способны в своей дифференцировке преодолевать линейные и тканевые барьеры и приобретать профиль экспрессии и функциональный сренотип, уникальные для клеток другой ткани. Это свойство стволовых клеток получило название пластичности [7]. Гипотеза о существовании в постнатальном онтогенеза тотипотентной стволовой клетки, способной дифференцироваться в клетки любой ткани организма, представляется наиболее заманчивой при осмыслении феномена пластичности. Реальными кандидатами на роль таких клеток являются эмбриональные [8] и мезенхиальные стволовые клетки [9]. Однако до сих пор неизвестно, является ли мезенхимальные стволовые клетки популяцией клеток, существующих у человека в норме, либо их потенциал, проявляющихся при введение in vivo, возникает только искусственно в культуральных условиях ex vivo [10].
Цель работы – отработать методику получения и культивирования мезенхиальных стволовых клеток мышей.
Материал и методы работы. Мезенхимальные стволовые клетки костного мозга получали от мышей С57В1/6. Самцов 8—10 недельного возраста (n = 19) после анестезии умертвляли с помощью цервикальной дислокации. Бедренные и большие берцовые кости выделялись и освобождались от мягких тканей. Эпифизы костей отделялись, а их диафизы промывались средой ДМЕМ (Gibco). Среда содержит 10 % фетальной сыворотки крови плодов коров (ES-grabe, Gibco), 100ЕД/мл пенициллина (Gibco), 100мкг/мл стрептомицина (Gibco), 12мм α-глютамина (Gibco) (ростовая среда).
Выделенное из костномозговых каналов содержимое помещали в конические пробирки, содержащие 5,0 мл ростовой среды, и центрифугировали в течение 10 мин при 400g. Осадок из каждой пробирки ресуспензировали в ростовой среде до концентрации 1х106 клеток в 1,0 мл и высаживали в культуральные флаконы площадью 75 см2. Через 48 часов не прикрепившиеся клетки удаляли, а во флаконы добавляли по 20 мл свежий ростовой среды. Прикрепившиеся клетки культивировали в течение 2-х недель, меняя ростовую среду каждые 3-4 дня.
При формировании монослоя клетки снимали с подложки путём промывания 0,25 % рас- твором трипсина (Gibco) в смеси с раствором Версена (Gibco) в соотношении 1:1. затем во флаконы добавляли по 2,0 мл вышеуказанной смеси и инкубировали при t — 37 °C 5-10 мин. Затем клетки переводили в суспензию и осаждали центрифугированием в течение 5 мин при 400g. Осадок ресуспензи-ровали в ростовой среде с концентрацией 104 кл/мл. Культивирование проводили в CO2 – инкубаторе при 5 % CO2 и t — 37 °C. После 4-го пассажа к ростовой среде добавляли базальный фактор роста фибробластов (bFGF, Sigma) до концентрации 10 нг/мл для введения использовали клетки 5-8 пассажей.
Результаты работы и их обсуждение. Для подтверждения состоявшейся дифференцировки мезенхимальных стволовых клеток использовались специфические методы гистохимии и иммуногистохимии, специфические для выбранных типов диффе-
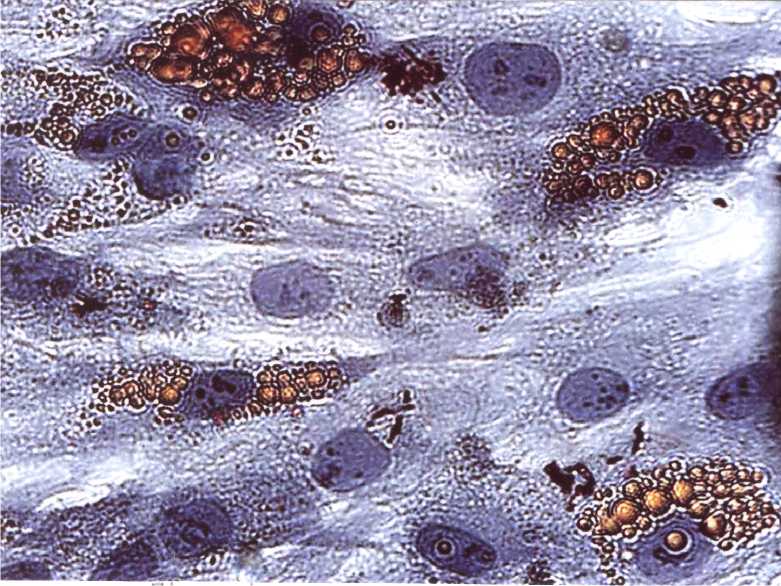
Рис. 1. Адиногенная дифференцировка мезенхимальных стволовых клеток. 28-е сутки индукции. Окраска жировым красным. Ув. 700.
они были единичными, к 28-м суткам занимали большую часть цитоплазмы. При индуцировании остеогенной дифференцировки положительная проба на костный сиалопротеин определялась ренцированных клеток. Для адипоцитов – окраска жировым красным (oil red), для остеобластов – обработка моноклональными антителами на остеонек-тин и сиолопротеин, для хондроцитов – обработка моноклональными антителами на хондроитин и коллаген I и II типов, для клеток нервной ткани – окраска на β-III тубулин и глиальный фибриллярный кислый белок (GFAP).
При индукции дифференцировки по жировому типу на 4-е сутки культивирования в индукционной среде определялись клетки с липидными капель в цитоплазме (рис. 1). Количество липидных капель увеличивалось в процессе дифференцировки клеток: в начале процесса
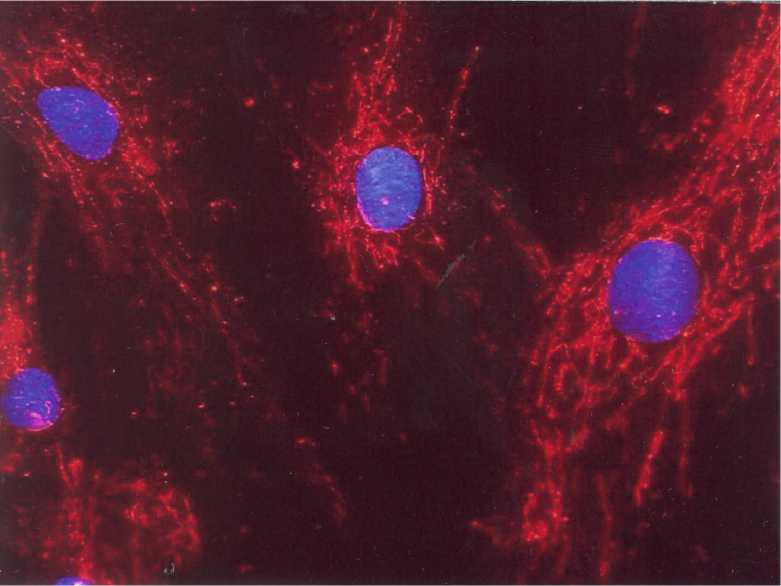
Рис. 2. Остеогенная дифференцировка мезенхимальных стволовых клеток. Обработка моноклональными антителами на костный сиалопротеин. Ядра докрашены красителем DAPi. Ув. 700.
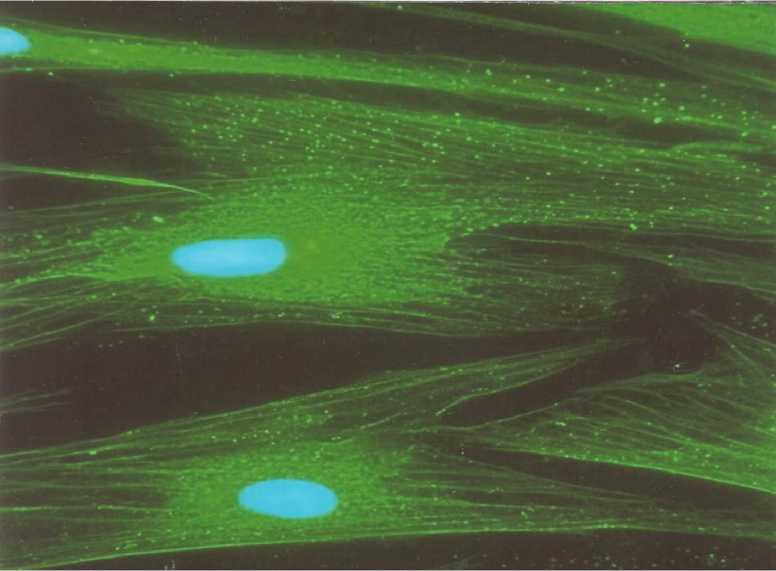
Рис. 3. Остеогенная дифференцировка мезенхимальных стволовых клеток. Обработка моноклональными антителами на остеонектин. Ядра докрашены красителем DAPi. Ув. 700.
ференцировки мезенхимальных стволовых клеток были использованы 3-и маркера (хондроитин, коллаген I и II типа), которые эксперсируются хондроцитами. Использование их связана с тем, что ни один из них не является строго специфичным только для хондроцитов. Все пробы дали положительные результаты (рис. 4). Наиболее удивительной оказалась нейрогенная дифференцировка мезенхимальных стволовых клеток, поскольку в биологии длительное время считалось, что мезенхимальные стволовые клетки способны давать дифференцированных потомков исключительно мезенхимального происхождения. Признаки нейрогенной дифференцировки клеток уже через 24 часа после начала культивирования (рис. 2), а проба на остеонектин- к 21-м суткам (рис. 3). Для подтверждения хоидрогенной диф- отчётливо определялись уже к концу 7-х суток индуцирования (рис. 5).
Способность мезенхимальных стволовых
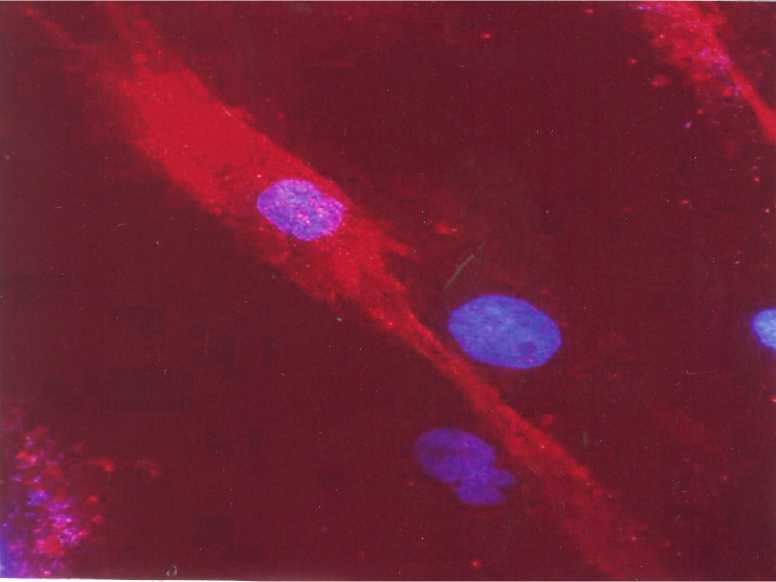
Рис. 4. Хондрогенная дифференцировка мезенхимальных стволовых клеток. Обработка моноклональными антителами к хондроитину. Ядра докрашены красителем DAPi. Ув. 700.
клеток in vitro дифференцироваться в остеобласты, адипоциты и хондроциты является на сегодняшний день единственным достоверным способом их индентификации [11]. Однако по данным [12], в пределах отдельной популяции мезенхимальных стволовых клеток могут присутствовать клетки, способные к трехпотенциальной, бипотенциальной и даже монопотенциаль-ной дифференцировке. Мультипотентность утрачивается при пассаже в культуре, химальных стволовых клеток демонстрируют различные склонности к старению. Так, человеческие мезенхи-
мальные стволовые клетки стареют после 40 удвоений популяций, а крысиные и мышиные популяции ме-
зенхимальных стволовых клеток не стареют и после 100 делении [13]. Результаты проведённой работы подтвердили это положение: признаки старения клеток отсутствовали, а достаточное их количество для проведения дальнейших экспериментов было получено от небольшого числа животных, кроме того, проверка мульти-потентности полученных культур мезенхимальных стволовых клеток дала стабильный повторяющийся результат: более 90 % клеток подвергалось дифференцировке.
Список литературы Нейрогенная дифференцировка мезенхимальных стволовых клеток
- Petersen B. E. Bone mar row as a potent ial source of hepatic oval cells / B. E. Petersen et al // Scince, 1999, v. 284, p. 1168 - 1170.
- Pittenger M. F. Multilineage potential of adult human mesenchymal stem cells / M. F. Pittenger et al // Scince, 1999, v. 284, p. 143 - 147.
- Jing Y. Pluripotency of mesenchymal Stem cells derived from adult marrow / Y. Jing et al // Nature, 2002, v. 418, p. 41 - 49.
- Lee R. H. Characterization and expression analys of mesenchymal Stem cells from human bone marrow and adipose tissue / R. H. Lee, B. Kim et al // Cell Physiol. Biochem., 2004, v. 14, p. 311 - 314.
- Frices A. Mesenchymal progenitor cells in human umbilical cord blood / A. Frices, P. Conget // Brit. J. Haematol., 200, v. 109, p. 235 - 242.
- Roufosse C. A. Circulating mesenchymal Stem cells / C. A. Roufosse, W. R. Otto // Jnt. JBiochem. Cell. Biol., 2004, v. 36, p. 585 - 597.
- Daley G. Realistic prospects for Stem cell therapeutics / G. Daley, M. Goodel // Hematology, 2003, v. 17, p. 398 - 418.
- Blau H. M. The evolving concept of a Stem Cell: entity or function? / H. M. Blau, J. M. Weimann // Cell, 2001, v. 105, p. 829 - 841.
- Deans R. J. Mesenchymal stem cells: biology and potential clinical uses / R. J. Moseley / Exp. Haematol., 2000, v. 28, p. 875 - 884.
- Kadiyala S. Culture expanded canine mesenchymal stem cells possess osteo chondrogenic potential in vivo and in vitro / S. Kadiyala, S. P. Bruder // Cell Transplant., 1997, № 6, p. 125 - 134.
- Glennic S. Bone marrow mescnchymal Stem cell induce division arrest anergy of activated / S. Glenniec, F. Dazzi // Blood, 2005, v. 105, p. 2821 - 2827.
- Digirolamo C. M. Propadation and Senescence of human marrow stronral cells in culture: a simple colonyforming assay identifies samples With the greatest potential to propagate and differentiate / C. M. Digirolamo, D. Colter // Brit. J. Haemafol., 1999, v. 107, p. 275 - 287.
- Baddoo M. Characterization of mesenchymal Stem cell isolated from murine bone marrow by negative selection / M. Baddoo, R. Hill // J. Cell Biochem, 2003, v.89, p. 1235 - 1249.


